Remodelado cardíaco: de lo macroscópico a la estructura molecular
Anuncio

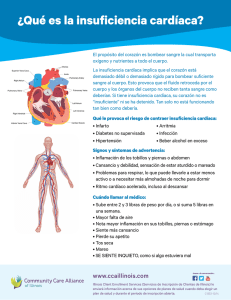
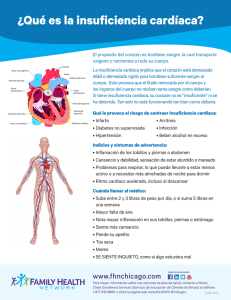
SILVA M REVISIÓN CONTEMPORÁNEA Avances Cardiol 2013;33(1):45-52 Remodelado cardíaco: de lo macroscópico a la estructura molecular Cardiac remodeling: from macroscopic aspects to molecular structure Dra. Martha M. Silva-Falcón1 MSc. Médico Cirujano. Magister Scientarum en Fisiología. Magister Scientarum en Educación Superior. Docente Agregado de la sección de Fisiología. Departamento de Ciencias Funcionales. Universidad Centroccidental Lisandro Alvarado. Barquisimeto-RB de Venezuela. 1 RESUMEN El remodelado cardíaco ha sido definido como un proceso resultante de cambios en la geometría y la estructura del miocardio con aparición de tejido fibrótico acompañado de alteraciones en la contractilidad miocárdica. La importancia clínica del remodelado ventricular izquierdo se ha extendido gradualmente en la comunidad médica y hoy en día es considerado un predictor de la progresión de enfermedades cardiovasculares; ha sido utilizado como un marcador subrogado en condiciones tales como infarto miocárdico, enfermedades cardíacas valvulares, miocardiopatía dilatada e insuficiencia cardíaca. Tradicionalmente, las alteraciones neurohormonales e inflamatorias relacionadas con el eje renina–angiotensina–aldosterona, la endotelina, el factor de necrosis tumoral alfa, las catecolaminas y las citocinas, han sido las protagonistas principales en la inducción de remodelado cardíaco. Sin embargo, actualmente el interés está focalizado en el entendimiento de los cambios génicos, moleculares, CORRESPONDENCIA Dra. Martha Milagros Silva Falcón Av. Libertador con Av. Andrés Bello. Decanato de Ciencias de La Salud. UCLA. Sección de Fisiología. BarquisimetoRB de Venezuela. Tel: +58-251-259.18.40 / +58-414-556.16.32 E-mail: smartha@ucla.edu.ve DECLARACIÓN DE CONFLICTO DE INTERÉS DE LOS AUTORES No aplica Recibido en: junio 04, 2012 Aceptado en: febrero 16, 2013 Avances Cardiol celulares e intersticiales que se producen en el miocardio alterando el tamaño, forma y función ventricular. Estos modelos lejos de ser excluyentes son complementarios y nos dan una concepción más integral y dinámica del remodelado cardíaco. Las investigaciones clínicas y experimentales indican que el remodelado celular se inicia tempranamente precediendo la aparición de los signos y síntomas de insuficiencia cardíaca. Una mejor comprensión de la fisiopatología molecular subyacente en el remodelado cardíaco permitirá el desarrollo de biomarcadores de daño miocárdico tales como el Péptido Procolágeno tipo I, así como nuevas opciones terapéuticas (moléculas anticaspasas) dirigidas a la prevención y tratamiento del remodelado cardíaco. Palabras clave: Remodelado cardíaco, sistema reninaangiotensina-aldosterona, inflamación, fibrosis. ABSTRACT Cardiac remodeling has been defined as a process resulting from changes in the geometry and structure of the myocardium, with appearance of fibrotic tissue accompanied by alterations in myocardial contractility. The clinical importance of left ventricular remodeling has gradually gained hold in the medical community, nowadays it is regarded as a predictor of progressive cardiovascular diseases; It has been used as a surrogate marker in conditions such as myocardial infarction, valvular heart disease, dilated cardiomyopathy and heart failure. Traditionally, the neurohormonal alterations and inflammatory related with the Renin-angiotensin-aldosterone axis, endothelin, Tumoral Necrosis Factor alpha, catecholamines and cytokines have been the main protagonists in the induction of cardiac remodeling. However, current interest is focused on understanding the genetic, molecular, cellular and interstitial changes that occur in the myocardium that lead to alterations in the size, form and 45 REMODELADO CARDÍACO function of the ventricle; these models far from being mutually exclusive are complementary and they give us a more holistic and dynamic conception of cardiac remodeling. Clinical and experimental researches indicate that cellular remodeling starts early in the onset of the disease, preceding the appearance of signs and symptoms of heart failure. A better understanding of the molecular pathophysiology underlying the origin of cardiac remodeling will allow us to develop biomarkers of myocardial damage such as Peptide Procollagen type I, as well as new therapeutic options (anticaspasas molecules) aimed at preventing and treating cardiac remodeling. Key words: Cardiac remodeling, system renin-angiotensinaldosterone, inflammation, fibrosis. Aspectos fisiopatológicos del remodelado cardíaco El remodelado cardíaco (RC) se define como el conjunto de cambios anatómicos, geométricos, histológicos y moleculares del miocardio que se observan secundariamente a una sobrecarga o daño miocárdico (1). Fue descrito por primera vez a partir de observaciones macroscópicas de los procesos de expansión de un área infartada (dilatación parcial del ventrículo) y una disminución en la contractilidad en el área no infartada (2). El RC es consecuencia de cualquier patología que curse con sobrecarga de presión o de volumen aunque de forma aguda la principal causa es el infarto miocárdico. Entre las respuestas adaptativas del miocardio al estrés mecánico en un intento para adaptarse a la elevación en la tensión de la pared y mantener el gasto se encuentran: la hipertrofia de los cardiomiocitos, la liberación de citocinas proinflamatorias (IL-6, TNF-α, IL 1-β) y los cambios en la composición y distribución de los componentes de la matriz extracelular (MEC): colágeno, metaloproteinasas matriciales (MMP) y péptidos inhibidores del recambio matricial (3). Cabe recordar que dos tercios de la población de células que forman el corazón lo constituyen células no musculares, principalmente fibroblastos y que estas células responden muy sensiblemente a señales intercelulares modificando su fenotipo y liberando proteínas de la MEC, factores de crecimiento y citocinas proinflamatorias. Todos estos fenómenos, principalmente la fibrosis, conducen a la disfunción diastólica y sistólica ventricular propias de la remodelación que en último término llevan a la insuficiencia cardíaca. De esta manera el proceso de remodelación iniciado como una respuesta compensatoria al daño y al estrés mecánico, se convierte lentamente en un proceso que conduce a la insuficiencia cardíaca (Figura 1). Figura 1. Esquema sobre las distintas fases de la insuficiencia cardíaca. MEC: matriz extracelular; VI: ventrículo izquierdo. Tomado de: Jiménez Navarro MF, Díez Martínez J, Delgado Jiménez JF, Crespo Leiro MG. La insuficiencia cardíaca en el año 2005. Rev Esp Cardiol. 2006;59(Supl):55-65. 46 Vol. 33, Nº 1, marzo 2013 SILVA M Así por ejemplo, una sobrecarga de presión (factor desencadenante) produce la activación de vías de señalización (una de ellas la vía de activación de proteínas asociadas a mitogénesis -MAPKinasas-) con la consecuente hipertrofia del miocito (respuesta celular) acompañada de eventos como la disfunción mitocondrial relacionada con la disminución del metabolismo energético y alteración en el mecanismo de acoplamiento de las proteínas contráctiles (cambios moleculares), alteración de los componentes de la matriz extracelular y a un estado de insuficiencia contráctil expresada clínicamente por signos de falla cardíaca. Este mecanismo es capaz de autoperpetuarse con la activación de mediadores proinflamatorios y neurohormonales que inicialmente tratan de preservar la hemodinamia pero que en el tiempo resultan altamente nocivas. Remodelado e inflamación Durante el remodelado ocurre un incremento en la producción de reactantes de fase aguda como la proteína C reactiva (pCR) y varias citocinas, entre ellas el factor de necrosis tumoral alfa (TNF-α), la Interleucina-6 (IL-6), la interleucina-1β (IL1β) y el factor de crecimiento transformante-β1 (TFG-β1). Estas citocinas son las más estudiadas con relación al proceso de remodelación ventricular posterior a injuria cardíaca y no se encuentran constitutivamente expresadas en el corazón en condiciones normales; sin embargo, ante un daño al miocardio, se produce un gran aumento en sus niveles plasmáticos. En modelos experimentales de infarto miocárdico se ha reportado un aumento de hasta 50 veces en los niveles de RNA mensajero para TNF-α, IL-6 e IL-1 β dentro de las primeras horas después de la isquemia en el área infartada y un aumento de hasta 15 veces en la zona del miocardio no infartado. Aunque la inflamación pos infarto es necesaria para el inicio del proceso de reparación, la excesiva inflamación juega un importante rol en el desarrollo del remodelado ventricular (4). En miocardiopatías dilatadas pos-infecciosas tales como la miocardiopatía chagásica crónica, la respuesta inflamatoria es particularmente intensa. La elevación en la expresión de citocinas ocurre antes del incremento de la actividad de las MMPs Avances Cardiol (MMP-2 y MMP-9) en el área lesionada, las cuales están relacionadas directamente con el remodelado cardíaco (5). De igual manera esta elevación ocurre previa al cambio en la distribución del colágeno en el miocardio no infartado, por lo que se cree que estas citocinas ajustan de manera aguda las respuestas adaptativas al daño regulando la sobrevivencia de los miocitos, al regular el proceso de apoptosis (5). Además generan respuestas inflamatorias celulares adicionales que a largo plazo pueden mediar la reparación y remodelación del tejido a través de activar mediadores como las MMPs y la consecuente formación de colágena, así como el proceso de angiogénesis (6). Las citocinas proinflamatorias particularmente el TNF-α regula algunas MMPs (como las gelatinasas MMP-2 y la MMP-9) así como la alteración de la expresión de los Inhibidores de las MMPs (TIMPs), permitiendo una desviación de la relación MMP/TIMP hacia una mayor actividad proteolítica con degradación del colágeno y la reestructuración de la MEC, contribuyendo a la progresión de la dilatación cardíaca. De hecho, en ratones transgénicos que sobreexpresan TNF-α específicamente en el miocardio, se presenta una elevada actividad de las MMPs y se desarrolla dilatación cardíaca (7). Ha sido evidenciado que el TNF-α es capaz de inducir miocardiopatía dilatada en animales y humanos (8), así como se ha demostrado el efecto positivo sobre el remodelado cuando se disminuye la bioactividad de este factor (9) . El papel de este factor es diferente de acuerdo con la miocardiopatía. Un ejemplo lo constituye los niveles elevados demostrados en la fase previa al desarrollo de IC en la miocardiopatía chagásica lo que podría constituir un factor etiopatogénico que favorece la progresión hacia IC en comparación con otras miocardiopatías en donde esta Interleucina solo se eleva en etapas avanzadas (10). La IL-6 es producida durante la fase aguda de la respuesta inmune por diversos tipos celulares. De manera particular, la IL-6 produce un incremento en la producción de anticuerpos por linfocitos B, en la hematopoyesis, en la trombocitopoyesis y en la síntesis de proteínas de fase aguda. La IL-6 aumenta su síntesis en el miocardio ante el daño por isquemia/reperfusión, al igual que el TNF-α. En pacientes se ha reportado que la IL-6 se encuentra 47 REMODELADO CARDÍACO elevada en diversas patologías cardiovasculares como la falla cardíaca crónica, la miocarditis, el IM, la endotoxemia y el daño asociado a la isquemia/ reperfusión (11). En miocardiopatías crónicas tales como miocardiopatía chagásica se ha encontrado una correlación positiva entre los niveles de IL-6 y la pCR y el grado de deterioro de la función cardíaca por lo cual han sido señalados como marcadores pronósticos en la progresión de la enfermedad (12). Los mecanismos de acción de la IL-6 se han relacionado con la producción de NO y con la afectación de la función del retículo sarcoplásmico (RS) al reducir la fosforilación del fosfolamban, una proteína reguladora de la bomba de calcio del RS. Se ha demostrado que el proceso de remodelación aguda mediado por citocinas y células inflamatorias también inicia el proceso de reparación del tejido dañado. Interesantemente, se ha reportado un aumento en la producción de colágeno tipos I y III por los fibroblastos del miocardio sin lesión posterior a un infarto miocárdico, lo que sugiere que durante la fase aguda de la injuria cardíaca, la IL-1β al igual que el TNF-α parecen tener un papel protector y regulan la recuperación del tejido (13,14). Bajo esta perspectiva, el efecto más importante de la IL-1β sería su efecto mitogénico sobre los fibroblastos de la región no infartada que llevaría, en primera instancia, a la reparación del daño y a la adaptación mecánica de la cámara ventricular, pero también este proceso sería responsable a largo plazo, de alterar la distensibilidad del miocardio propia de la remodelación. El esquema general de participación de las diferentes citocinas en la remodelación es complejo y esta condición aumenta al considerar la respuesta antiinflamatoria desencadenada también por el propio daño al miocardio. En este sentido, la citocina más estudiada es la interleucina 10 (IL-10), la cual se caracteriza por disminuir la síntesis de citocinas proinflamatorias, particularmente la producción de TNF-α y óxido nítrico (15). Remodelado y fibrosis La función fisiológica principal de la matriz 48 extracelular (MEC) es mantener la integridad del tejido miocárdico y, en consecuencia, preservar la función de la bomba cardíaca. La deposición del colágeno se modula por factores hormonales, factores de crecimiento, citocinas, proteínas reguladoras y/o factores hemodinámicos. Se precisa un balance apropiado en la síntesis de la matriz extracelular y su degradación para la morfogénesis normal y el mantenimiento de la arquitectura del tejido (16). La acumulación excesiva de colágeno conduce a la disfunción diastólica y sistólica ventricular y en último término contribuye a la insuficiencia cardíaca. Por consiguiente, aunque el remodelado inicialmente sea una respuesta de adaptación, se convierte gradualmente en mala adaptación y conduce a la descompensación progresiva. La síntesis de precursores tales como el propéptido aminoterminal del procolágeno tipo I (PINP) y el propéptido aminoterminal del procolágeno tipo III (PIIINP) se regula en las células, mientras que la deposición de estas proteínas depende de un equilibrio entre las metaloproteinasas matriciales (MMP) y los inhibidores de tejido de las MMP (TIMPs) (16,17). IL-6 y el TNF de manera autocrina o paracrina induce incremento en la producción de su expresión y síntesis por las células del miocardio lo cual conduce a un desequilibrio y resultar en una arquitectura alterada de la matriz extracelular del miocardio. Por lo tanto, la medición del recambio del colágeno cardíaco mediante la utilización de marcadores serológicos es una herramienta útil para controlar la reparación del tejido cardíaco. En este contexto, puede medirse la concentración sérica del PIIINP, como marcador del recambio del colágeno en la insuficiencia cardíaca (18). Desde el punto de vista histomorfológico, las alteraciones del colágeno adoptan dos patrones: fibrosis difusa o focal (Figura 2). La fibrosis difusa se observa en miocardiopatías hipertrofiantes, como la cardiopatía hipertensiva, la miocardiopatía diabética, la miocardiopatía hipertrófica y la cardiopatía de la estenosis aórtica. La fibrosis focal se asocia con la cardiopatía isquémica, sobre todo la que cursa con infarto de miocardio. La alteración de la red de colágeno se Vol. 33, Nº 1, marzo 2013 SILVA M Figura 2. Patrones histomorfológicos resultantes de la alteración del equilibrio síntesis/degradación de colágeno fibrilar en distintos tipos de cardiopatías. (Biopsias endomiocárdicas humanas tratadas con rojo de Picrosirio que tiñe de rojo las fibras de colágeno; magnificación× 100). Tomado de: Jiménez Navarro MF, Díez Martínez J, Delgado Jiménez JF, Crespo Leiro MG. La insuficiencia cardíaca en el año 2005. Rev Esp Cardiol. 2006;59(Sup):55-65. da en la miocardiopatía dilatada idiopática y en las cardiopatías crónicas que han evolucionado hasta la fase de dilatación. Las relaciones entre las alteraciones del colágeno miocárdico y las alteraciones de la función cardíaca todavía no están claras y no pueden contemplarse aisladas de posibles alteraciones de otros componentes de la MEC que también influyen en la rigidez de la cámara ventricular durante la diástole (como la fibronectina) o la contractilidad sistólica del miocardio (como las integrinas) (18). En los últimos años se ha suscitado un notable interés por el desarrollo de marcadores no invasivos de las alteraciones del colágeno cardíaco, así como por la exploración de medidas terapéuticas dirigidas a restablecer el equilibrio entre su síntesis y su degradación. En el ámbito diagnóstico y junto con el empleo de métodos de imagen como la resonancia Avances Cardiol magnética (RM) cabe destacar la determinación sanguínea de un péptido (PICP) producido en los tejidos cuando una molécula de colágeno tipo I se forma a partir de su precursor. Existe evidencia sobre la utilidad de la determinación sérica de PICP como marcador de la cuantía del depósito miocárdico de fibras de colágeno tipo I en pacientes hipertensos con IC (18,19). De tal manera que el desequilibrio de la síntesis/degradación de la matriz extracelular (MEC) altera críticamente la estructura del miocardio, compromete la función y la geometría del ventrículo produciendo la activación de mecanismos regulatorios neurohormonales e inmunoinflamatorios lo cual a su vez perpetúan y magnifican las respuestas celulares y los cambios moleculares que mantendrán la cadena de eventos en progresión hacia la insuficiencia cardíaca. 49 REMODELADO CARDÍACO Remodelado y el sistema renina-angiotensinaaldosterona (SRAA) El sistema renina-angiotensina-aldosterona (RAA) constituye un mecanismo hormonal altamente involucrado en el remodelado ventricular, con evidencia experimental que avala la existencia de una alteración de los sistemas genéticos que codifican a los componentes de las vías neurohormonales que participan en el eje SRAA, tales como la Enzima Convertidora de Angiotensina (ECA) y una expresión hacia la baja de otros genes que regulan la expresión de receptores parasimpáticos (β-1 adrenérgicos, muscarínicos y aumento en la relación de los subtipos de receptores de angiotensina II:AT2/AT1) (20). De igual manera se ha demostrado el incremento en la producción de los componentes del SRA local a través de la liberación de quimasa y renina local por mastocitos en miocardio, lo cual activa la vía alterna en la producción de angiotensina II a partir de angiotensina I (21). La angiotensina II produce un incremento de citocinas proinflamatorias (IL-6) a partir de fibroblastos cardíacos la cual a su vez induce remodelado cardíaco estimulando la producción de TFN β1 (22). La activación de citocinas desencadena una mayor expresión de la enzima convertidora de angiotensina y una mayor producción local de ATII y Aldosterona, lo que contribuye finalmente a la fibrosis miocárdica conectando de este modo el SRAA con los mecanismos reguladores inmunológicos (23). La sobreactivación del SRAA se ha demostrado especialmente en pacientes con IC de grado avanzado donde existe una profunda activación de este sistema (24,25). En este contexto los inhibidores de la enzima convertidora de angiotensina y los antagonistas del receptor de aldosterona son una familia de drogas que han demostrado en múltiples estudios modificar la condición de daño mecánico, reduciendo el fenómeno del remodelado de las células cardíacas e inhibiendo la proliferación resultante de las células inflamatorias. Existe evidencia in vivo e in vitro de que la pCR es capaz de inducir fibrosis cardíaca e inflamación en fibroblastos cardíacos y promueve el remodelado mediado por angiotensina II a través de 50 la sobreexpresión del receptor AT1 y la activación de NF-KB. De tal manera que la pCR parece no solo ser un marcador de inflamación sino que también es un mediador en el remodelado cardíaco de etiología hipertensiva (25). Remodelado auricular En el remodelado auricular recientemente se ha establecido la conexión entre la activación del SRAA y la vía mitogénica MAP Kinasa en el remodelado estructural relacionado con la Fibrilación Auricular así como la activación de factores de transcripción (STAT3). Esta activación ha sido inhibida con el uso de y un antagonista de los receptores de angiotensina II (Losartán) y un inhibidor de la 3-hidroxi-3-metilglutaril – coenzima A (HMG-CoA) reductasa (Simvastatina). Esto ha sido demostrado en tejido de aurícula humana proveniente de pacientes con Fibrilación auricular en los cuales los niveles de Ang II se encuentran elevados. Por tanto la vía Ang II- Rac1-STAT3 es una importante vía de señalización en miocardio auricular que media remodelado estructural siendo este efecto revertido con el uso de antagonista de los receptores de angiotensina II y estatina (26,27). El remodelado cardíaco resulta en alteraciones del metabolismo cardíaco, compromiso de la perfusión miocárdica, deterioro de la función sistólica y diastólica y generación de arritmias. Por tanto es la llave que determina el curso clínico de una gran cantidad de enfermedades cardíacas. El concepto de la heterogeneidad del remodelado cardíaco en las diferentes enfermedades cardíacas nos ofrece un ejemplo de la integración de conceptos como: la inflamación, la fibrosis reactiva y/o reparativa y la apoptosis con cada una de las entidades clínicas (cardiopatía hipertensiva, isquémica, dilatada, diabética, valvular). En este sentido el conocimiento de las bases moleculares que sustentan el RC permitirá el desarrollo de nuevas terapias dirigidas a la prevención o la regresión de este fenómeno altamente complejo. Vol. 33, Nº 1, marzo 2013 SILVA M REFERENCIAS 1. Rivera M, Taléns-Visconti R, Jordán A, Sirera R, Sevilla B, Climent V, et al. Remodelado miocardico y activación inmunitaria en pacientes con insuficiencia cardíaca. Rev Esp Cardiol. 2006;59:911-918. 2. McKay RG, Pfeffer MA, Pasternak RC, Markis JE, Come PC, Nakao S, et al. Left ventricular remodeling after myocardial infarction: A corollary to infarct expansion. Circulation. 1986;74:693-702. 3. Okada M, Yamawaki H, Hara Y. Angiotensin II enhances interleukin-1 beta-induced MMP-9 secretion in adult rat cardiac fibroblasts. J Vet Med Sci. 2010;72:735-9. 4. Anzai T. Post-infarction inflammation and Left Ventricular Remodeling. Circ J. 2013. [Epub ahead of print] 5. Martinez Rosas, M. Remodelación cardíaca e inflamación. Arch Cardiol Mex. 2006;76:58-66. 6. Zornoff L, Paiva S, Duarte D, Spadaro J. Remodelación ventricular postinfarto de miocardio: conceptos e implicaciones clínicas. Arq Bras Cardiol. 2009;92:15764. 7. Feldman AM, Combes A, Wagner D, Kadakomi T, Kubota T, Li YY, et al. The role of tumor necrosis factor in the pathophysiology of heart failure. J Am Coll Cardiol. 2000;35:537-544. 8. Deswal A, Bozkurt B, Seta Y, Parilti-Eiswirth S, Hayes FA, Blosch C, et al. Safety and efficacy of a soluble P75 tumor necrosis factor receptor (Enbrel, etanercept) in patients with advanced heart failure. Circulation. 1999;99:3224-3226. 9. Kroll-Palhares K, Silvério JC, Silva AA, Michailowsky V, Marino AP, Silva NM, et al. TNF/TNFR1 signaling up-regulates CCR5 expression by CD8+ T lymphocytes and promotes heart tissue damage during Trypanosoma cruzi infection: Beneficial effects of TNF-alpha blockade. Mem Inst Oswaldo Cruz. 2008;103:375-385. 10. Rodríguez-Bonfante C. Chiurillo M. Polimorfismo de genes de citocinas pro inflamatorias asociados al desarrollo de la cardiopatía crónica chagásica Boletín Médico de Posgrado. Vol. XXVI, Edición Especial. UCLA. Decanato de Ciencias de la Salud. Barquisimeto – Venezuela; 2010. 11. López L, Arai K, Giménez E, Jiménez M, Pascuzo C, Rodríguez-Bonfante C, et al. Las concentraciones séricas de interleucina-6 y proteína C reactiva se incrementan a medida que la enfermedad de Chagas evoluciona hacia el deterioro de la función cardíaca la proteína C reactiva y la interleucina-6 en la enfermedad de Chagas. Rev Esp Cardiol. 2006;59:50-56. 12. Yu XW, Chen Q, Kennedy RH, Liu SJ. Inhibition of sarcoplasmic reticular function by chronic interleukin-6 Avances Cardiol exposure via iNOS in adult ventricular myocytes. J Physiol. 2005;566:327-340. 13. Dobaczewski M, Gonzalez-Quesada C, Frangogiannis NG. The extracellular matrix as a modulator of the inflammatory and reparative response following myocardial infarction. J Mol Cell Cardiol. 2010;48:504-511. 14. Stumpf C, Lehner C, Yilmaz A, Daniel WG, Garlichs CD. Decrease of serum levels of the anti-inflammatory cytokine interleukin-10 in patients with advanced chronic heart failure. Clin Sci (Lond). 2003;105:45-50. 15. Crespo MG, Jiménez M, Pulpón LA, Cuenca JJ, Muñoz R, Fernández-Avilés F. La insuficiencia cardíaca en el año 2004. Rev Esp Cardiol Supl. 2005;5:35A-44. 16. Westermann D, Lindner D, Kasner M, Zietsch C, Savvatis K, Escher F, et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction. Circ Heart Fail. 2011;4:44-52. 17. Roselló-Lletí E, Rivera M, Bertomeu V, Cortés R, Jordán A, González-Molina A. Interleucina-4 y fibrosis miocárdica en pacientes con insuficiencia cardíaca. Rev Esp Cardiol. 2007;60:777-80 18. Jiménez-Navarro MF, Gómez-Doblas JJ, Cabrera-Bueno F, Cruz-Ocaña E, Rodríguez-Bailon I, Ruiz-Galdón M, et al. Síntesis de colágeno e insuficiencia cardíaca. Rev Esp Cardiol. 2005;58:975-978. 19. López-Salazar B, Ravassa-Albéniz S, Arias-Guedón T, González-Miqueo A, Querejeta R, Díez-Martínez J. Alteraciones del metabolismo del colágeno fibrilar en la cardiopatía hipertensiva. Situación actual y perspectivas. Rev Esp Cardiol. 2006;59:1047-1057. 20. Lorell BH. Role of angiotensin AT1, and AT2 receptors in cardiac hypertrophy and disease. Am J Cardiol. 1999;83:48H-52H. 21. Peters H, Unger T. Mast cells and the power of local RAS activation. Nephrol Dial Transplant. 2007;22:40-42. 22. Mackins CJ, Kano S, Seyedi N, Schäfer U, Reid AC, Machida T, et al. Cardiac mast cell-derived renin promotes local angiotensin formation, norepinephrine release, and arrhythmias in ischemia/reperfusion. J Clin Invest. 2006;116:1063-1070. 23. Cunha-Neto E, Nogueira LG, Teixeira PC, Ramasawmy R, Drigo SA, Goldberg AC, et al. Immunological and nonimmunological effects of cytokines and chemokines in the pathogenesis of chronic Chagas disease cardiomyopathy. Mem Inst Oswaldo Cruz. 2009;104(Suppl):252-258. 24. Dávila Spinetti D, Donis J, González M, Sánchez F. Fisiopatología, diagnóstico y tratamiento médico de la 51 REMODELADO CARDÍACO activators of transcription 3 via Rac1 in atrial myocytes and fibroblasts: Implication for the therapeutic effect of statin in atrial structural remodeling. Circulation. 2008;117:344-355. insuficiencia cardíaca congestiva. Rev Venez Endocrinol Metab. 2010;8:88-98. 25. Zhang R, Zhang YY, Huang XR, Wu Y, Chung AC, Wu EX, et al. C-reactive protein promotes cardiac fibrosis and inflammation in angiotensin II-induced hypertensive cardiac disease. Hypertension. 2010;55:953-960. 26. Tsai CT, Lai LP, Kuo KT, Hwang JJ, Hsieh CS, Hsu KL, et al. Angiotensin II activates signal transducer and 52 27. Kehat I, Molkentin JD. Molecular pathways underlying cardiac remodeling during pathophysiological stimulation. Circulation. 2010;122:2727-2735. Vol. 33, Nº 1, marzo 2013