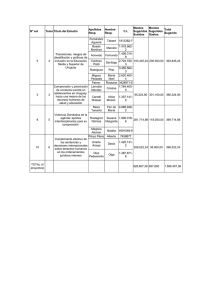
Química Inorgánica
Anuncio

A MORALES B. - T. MERUANE C. PROBLEMAS Y EJERCICIOS DE QUIMICAINORGANICA Departamento Central de Ciencias Matemáticas y Naturales Facultad de Filosofía y Educación Universidad de Chile 1964 PREFACIO Se ha demostrado que el conocimiento científico, juzgado por el volumen de las publicaciones y revistas, ha experimentado un crecimiento exponencial. Este gigantesco desarrollo ha determinado profundos cambios en la Educación y en la enseñanza de las disciplinas científicas. En los últimos veinte año la Química Inorgánica, ha dejado de ser la masa de hechos y fenómenos inconexos que, destinada a los cursos elementales de química, servía a los fines de una Educación memorística. El cambio ha sido tan violento que representa un verdadero desafío para los investigadores, profesores y estudiantes. La aparición de un extenso campo de teorías ha permitido la integración y comprensión de numerosos fenómenos y datos experimentales, a la vez que ha permitido prever el compartimiento químico de sistemas actualmente en estudio. Baste citar al respecto, las notables contribuciones de Paulina, R.T. Sanderson, Huggins, Busch. Orgel, Basolo, Pearson, R. Daudel, etc. La aplicación de nuevos métodos de preparación y separación y la incorporación de nuevos métodos físicos han proporcionado valiosos datos cuantitativos sobre las propiedades de elementos y compuestos. Las mayores exigencias de la industria, en su búsqueda incesante de nuevos materiales, ha contribuido por otra parte, al desarrollo de una ciencia y una técnica altamente especializadas. Unánimemente se reconoce que, ante el abrumador volumen de hechos y datos, no queda otro camino que el conocimiento de los grandes principios generales que permiten una adecuada compresión de los hechos fundamentales y elementales. El ideal es presentar las propiedades de los elementos como un todo unificado y dar una visión general unificada del vasto conocimiento acumulado. Este texto destinado a los profesores y estudiantes de química, contiene sólo algunas de las materias que hemos considerado previas y fundamentales para iniciar posteriormente el estudio de la Química Inorgánica. Las anomalías, imperfecciones y vacíos aparentes no deben buscarse en una supuesta irregularidad del comportamiento de la naturaleza sino en las limitaciones de los autores. Si con él logramos proporcionar una mejor comprensión de los fenómenos y reducir las exigencias de memorización de los hechos de la Química Inorgánica nos sentiremos compensados por nuestros desvelos. No podríamos terminar estas breves líneas sin expresar nuestro agradecimiento a nuestros colegas y alumnos por estimulo recibido, y en forma especial y destacadísima al Prof. D. Germán Mena R. Quien colaboró entusiastamente con los esquemas y dibujos que acompañan este texto. Alfonso Morales B. Profesor titular Cát. Química Inorgánica, Director del Laboratorio de Instrumentación. Teodoro Meruane C. Profesor auxiliar Cát. Química Inorgánica. Profesor Investigador del Laboratorio de Instrumentación Departamento Central de Ciencias Matemáticas y Naturales, Facultad de Filosofía y Educación Universidad de Chile Santiago de Chile, Marzo de 1964 C a p í t u l o I EL ESPECTRO DE RAYAS Y EL ATOMO DE BOHR El estudio del espectro de rayas del hidrógeno, el más sencillo de los elementos, constituyó el punto de partida en la determinación de la configuración electrónica de los elementos. Este espectro está formado por varias series o grupos de líneas, a saber: Serie de Lyman: Serie de Balmer: Serie de Paschen: Serie de Brackett: Serie de Pfund: ultravioleta visible infrarrojo próximo infrarrojo lejano infrarrojo lejano − Las longitudes de onda, λ, así como el número de ondas υ , de cualquiera de estas rayas, quedan determinados por la relación de Balmer: ⎛ − = V = RH ⎜ 1 ⎜ n2 λ ⎝ 1 1 − ⎞ ⎟ 2 n ⎟ 2⎠ 1 en que RH es una constante, igual a 109.737 cm-1 (constante de Rydberg). n1 y n2 son números enteros, siendo n2 mayor que n1. Para cada serie, n1 y n2 valen: Lyman Balmer Paschen Brachett Pfund n1 = 1 =2 =3 =4 =5 n2 = 2,3,4,........ = 3,4,5,…… = 4,5,6,……. = 5,6,7,……. = 6,7,……… Bohr propuso una interpretación del espectro de rayas del H, basada en los siguientes postulados: I) El electrón gira en órbitas circulares alrededor del núcleo, y mientras permanece en una órbita determinada, no hay absorción ni emisión de energía por parte de éste. II) El paso del electrón de una órbita cualquiera a otra más externa, precisa de cierta cantidad de energía, que es igual a la energía emitida cuando el electrón vuelve de una órbita externa a su nivel original. La energía absorbida o emitida, aparece en forma de una radiación, cuya frecuencia se encuentra en directa dependencia con las energías del electrón en ambas órbitas de acuerdo a la ecuación de Planck: E 2 − E1 = h ⋅ υ en que v es la frecuencia de la radiación y h es la constante de Planck, igual a: 6,62 . 10-27 erg.seg. III) El electrón sólo puede poseer aquellas órbitas en las que el momento angular sea un múltiplo entero de la cantidad h/2 π, es decir: m.v.r. = n.h/2 π en que m: masa del electrón (9,11.10-28 g) v: velocidad del electrón en cm/seg. r: radio de la órbita, en cm. h: constante de Planck. Aplicando las relaciones encontradas, y suponiendo que la fuerza centrífuga del electrón (m.v 2 /r) es igual a la atracción coulombiana entre el electrón y el núcleo (e 2 /r 2 ), Bohr logró deducir una fórmula, análoga a la de Balmer: − v= 2 π2 e4 m 1 1 ( 2 − 2) 3 h c n1 n 2 en que, e = carga elemental de electricidad: 4,8 . 1010 u.e.s. c = velocidad de la luz : 3 . 1010 cm/seg. El primer factor del segundo miembro de la ecuación , es constante, y numéricamente igual a la constante de Rydberg. La velocidad del electrón en cualquier órbita, queda determinada por: v= 2 π e2 nh y el radio de las órbitas por: r= n2 h2 4 π2 m e2 Por otra parte, la energía en cualquier nivel viene dada por: En = − 2π 2 e 4 m h2 n2 La energía necesaria para promover el electrón desde el nivel n = 1, a cualquier otro nivel , se llama potencial de resonancia. Según el nivel al que se transfiere el electrón, se habla de un primer (de n = 1 a n = 2), segundo (de n = 1 n = 3), tercer, etc., potencial de resonancia. El potencial de ionización, por su parte, es la energía necesaria para expulsar totalmente el electrón del átomo ( de n = 1 a n = ∞). Estos potenciales se expresan por lo general, en electrón- volts (ev). 1 ev = 1,6 . 10-12 erg. Ejemplo a) Calcular la longitud de onda correspondiente a las rayas de mayor y menor longitud de onda de cada serie. Resp. De acuerdo a la relación: 1 = RH ( λ 1 n12 − 1 n 22 ) , la menor longitud de onda corresponderá al valor de n2 = ∞, y l mayor para n2 = n1 + 1. Serie de Lyman: 1 λ min 1 λ máx = R H, de donde λ = = R H( 1 = 9.10 - 6 cm = 900 Å RH 1 1 3 RH 4 ; λ máx = − 2 )= = 1210 Å 2 4 3 RH 1 2 Serie de Balmer: 1 λ min y = 1 λmáx RH de donde λ 4 1 4 1 9 = RH ( - ) = min = 3,63 . 10 −5 cm = 3630 Å 5 RH 36 ; γ máx = = 6560 Å 36 5 RH Serie de Paschen: 1 λ min y = 1 λmáx RH 9 ; λ min = = 8,2 .10 -5 cm = 8200 Å 9 RH 7 RH 144 1 1 )= ;λ = = 18700 Å 9 16 144 máx 7 RH = RH ( - Serie de Brackett: 1 λ min y = 1 λ máx RH 16 ; λ min = = 14500 Å 16 RH = RH ( 1 1 9 RH 400 - )= ; λ máx = = 40400 Å 16 25 400 9 RH Serie de Pfund: 1 λ min y = 1 λ máx RH 25 ; λ min = = 22700 Å 25 RH = RH ( 9 RH 100 1 1 - )= ;λ = = 90900 Å máx 25 36 900 RH Ejemplo b) Calcular el potencial de ionización del hidrógeno, en ev. Resp. El potencial de ionización es, según se ha dicho, la energía necesaria para promover el electrón de n = 1 a n = ∞. La longitud de onda de la radiación correspondiente a esta promoción es 9.10-6 cm (ver Ej. a). c Como: ∆ Ε = h . v y v = ; luego : E = hc λ λ Reemplazando los datos por su valores numéricos: ∆E= 6,62 .10 -27. 3 . 1010 9 .10 -6 = 22,1 . 1012 erg Como 1 ev = 1,6 . 10-12 erg. tenemos: ∆ E = 22,1 = 13,8 ev 1,6 Probl. 1.- El potencial de ionización del Na y K es, respectivamente, 5,14 y 4,1 ev. ¿Cuál será la longitud de onda de la radiación emitida al reintegrar el electrón de valencia a los iones Na+ y K + ? Resp. Na+ = 2,41 . 10-5 cm K+ = 3,03 . 10-5 cm Probl. 2.- Demostrar el valor de la constante de Rydberg, a partir de la expresión: E 2 - E1 = 2π 2 e 4 m h 2 ( 1 n 12 - 1 n 22 ) Resp. RH = 109670 cm-1 Probl. 3. Las conocidas rayas amarillas del Na, de 5890 Å, y la ultravioleta del Hg, de 2537 Å , son ejemplos típicos de rayas de primera resonancia. Calcular los potenciales de primera resonancia del Na y del Hg, en ev. Resp. Na = 2,1 ev Hg = 4,9 ev. Probl. 4.- Calcular el radio de las órbitas correspondientes a los niveles n = 1, n = 2, y n = 3, del átomo de H. ¿Cuál será la velocidad del electrón en cada una de ellas?. Resp. r1 = 0,53 A° r2 = 2,12 A° r3 = 4,77 A° v1 = 2,2 . 108 cm/seg v2 = 1,1 . 108 “ v3 = 0,73 108 “ Capítulo II RELACIONES DE TAMAÑO Volúmenes atómicos y moleculares. El volumen atómico viene dado por la relación entre el peso atómico, expresado en gramos y la densidad. Análogamente, el volumen molecular es la razón del peso molecular a la densidad. Los resultados quedan dados en cm3 y sólo son comparables si las densidades se han determinado en condiciones análogas. Para elementos que presentan un mismo tipo de empaquetamiento u ordenación atómica, los volúmenes son directamente proporcionales a los cubos de los radios: 3 V1 R 1 = V2 R 3 2 Esta relación no es válida para elementos de diferente red cristalina. En todos estos casos nos estamos refiriendo al radio metálico de los elementos, es decir, el que presenta el átomo dentro del elemento libre. Diferente es el radio covalente, que es el radio presentado por el átomo combinado, formando parte de un enlace covalente simple y normal. Ejemplo a) Las densidades de los metales alcalinos son : Li; 0,507, Na: 0,971, K: 0,86, Rb: 1,53 y Cs: 1,873 gr/cm3. Calcular los volúmenes atómicos de estos elementos. R : Siendo V = m/d, tenemos: Li KKK V = 6,94/0,507 = 13,6 cm 3 /át.gr. Na KKK V = 23,0 /0,971 = 23,7 " " K KKK V = 39,1 /0,86 = 45,5 " " Rb KKK V = 85,5 /1,53 = 55,9 " " Cs KKK V = 132,9/1,873 = 70,9 " " Problema 1. La densidades del Cu, Ag y Au son: 8,92, respectivamente. Calcular los volúmenes atónicos. 10,50 y 19,30 gr/cm3, Resp. Cu: 7,10, Ag: 10,3, Au: 10,1 cm3 / át. Gr. Ejemplo b) A partir del radio metálico del Li = 1,55 Å, y de los volúmenes obtenidos en el . ejemplo a) calcular el radio metálico de los otros metales alcalinos. R: Na L VNa R 3Na 23,7 R3 = K K K K = VLi 13,6 (1,55) 3 R 3Li R = 1,55 3 1,74 = 1,89 Å 45,5 R3 = 13,6 (1,55) 3 R = 1,55 3 3,42 = 2,34 Å Rb L 55,9 R3 = 13,6 (1,55) 3 R = 1,55 Cs L 70,9 R3 = 13,6 (1,55) 3 R = 1,55 KL 4,11 = 2,49 Å 3 5,22 = 2,697 A° 3 Ejemplo c). A partir de los volúmenes atómicos y utilizando el valor 6,02 . 1023 para el N° de Avogadro, calcular los volúmenes atómicos reales en Å3. R. : El volumen por átomo real, viene dado por: v = V , en que V es el volumen del N átomo – gr y N el número de Avogadro. Li K 13,6/6,02 . 10 23 = 2,25 . 10 -23 cm 3 = 22,5 Å Na L 23,7/6,02 . 10 23 = 3,93 . 10 -23 cm 3 = 39,3 Å K L 45,5/6,02 . 10 23 = 7,56 . 10 -23 cm 3 = 75,6 Å Rb K 55,9/6,02 . 10 23 = 9,28 . 10 -23 cm 3 = 92,8 Å Cs L 70,9/6,02 . 10 23 = 11,77 . 10 -23 cm 3 = 117,7 Å Ejemplo d) A partir de los volúmenes atómicos reales, y suponiendo a los átomos como esferas rígidas perfectas, calcular los radios metálicos de los alcalinos. 4 3 R.: El volumen de una esfera es: v = π R 3 , de donde R= 3 3 v = 4π 3 0,24 v = 1,75 Å Na L Rb K 3 22,27 = 2,79 Å Cs L Li K 3 5,4 KL 3 3 3 9,43 = 2,11 Å 28,25 = 3,04 Å 18,1 = 2,62 Å Todos los valores obtenidos se hallan por encima del valor real. Los átomos del metal, debido a la naturaleza del empaquetamiento sólido, no se pueden homologar a perfectas esferas aisladas. Problema 2. Las densidades del Mg, Ca, Sr y Ba, son respectivamente: 1,74, 1,55, 2,6 y 3,75 gr/cm3. Calcular sus volúmenes atómicos. Resp. : Mg.: 13,79, Ca: 25,80, Sr: 33,68, Ba: 39,20 cm3/át. gr. Problema 3. Calcular los volúmenes atómicos reales de los alcalinos-térreos, a partir de los resultados del problema 2. Resp.: Mg: 22,9, Ca: 42,8, Sr: 55,9, Ba: 65,1 Å3. Problema 4. Los volúmenes atómicos de los halógenos son: Cl: 18,8, Br: 23,6, I: 26 cm3 por át. gr. Calcular los volúmenes de los átomos reales. Resp.: Cl: 31,2, Br: 39,2, I: 43,1. Å3. Problema 5. Las densidades del Sc, Y y La son, respectivamente: 3,02, 4,47 y 6,15 gr/cm3. El radio metálico del Sc es 1,62 Å. Calcular los radios metálicos del Y y La. Resp.: Y = 1,79, La = 1,89 Å. Observaciones. De acuerdo a los problemas y ejercicios realizados, es posible concluir lo siguiente: 1º. Los volúmenes atómicos aumentan en cada grupo, con el aumento del N° atómico. 2º. En un mismo período, los volúmenes atómicos disminuyen, desde los alcalinos (valor máximo), hasta los metales de transición, aumentando luego gradualmente, hasta el gas noble correspondiente. 3º. Dentro de un grupo, el aumento de volúmen es más marcado en los metales que en los no metales. 4º. Los elevados volúmenes atómicos de los alcalinos explican su baja densidad, bajo punto de fusión y escasa dureza (metales blandos). En cambio, los metales del grupo Ib (Cu, Ag, Au) que presentan volúmenes atómicos más pequeños, son más densos, con mayor punto de fusión y más duros que los alcalinos. Radios covalentes ẹ iónicos. El estudio de los radios covalentes ẹ iónicos es de extraordinaria importancia, por cuanto todas las propiedades químicas de los elementos pueden relacionarse, en última instancia, con su tamaño. Se ha visto ya cómo es posible calcular, en forma aproximada, el radio metálico a partir de la densidad y el peso atómico. La evaluación de los radios atómicos a partir de las energías de enlace y electronegatividades será tratada en los próximos capítulos (Caps. IV y V). La relación de radios permite establecer el número máximo de átomos, o iones, que pueden estar en contacto con un átomo, o ión central, antes de que se produzca el contacto y la consiguiente repulsión entre los ligandos. Así, según el número de átomos, o iones, unidos a un átomo, o ión, central, y de acuerdo a la disposición espacial adoptada, se puede establecer la siguiente relación de radios: N° de Coordinación 8 6 4 4 3 2 Disposición Espacial Relación de Radios Cúbica centrada en el cuerpo Mayor que 0,73 Entre 0,414 y 0,73 Octaédrica “ 0,414 y 0,73 Cuadrado plano “ 0,225 y 0,414 Tetraédrica “ 0,15 y 0,225 Triangular menor que 0,15 Lineal Ejemplo e) Demostrar, geométricamente, los valores de la relación de radios permitidas para cada índice de coordinación. Resp. 1) I. de coord.. 8. Cuando se produce el contacto entre los ligandos, tenemos: Quím.2 A C B BD = 2 Ra AB = Ra + Rc AC = Ra AC = Ra 2 Siendo ABC triángulo rectángulo: 2 AB = BC 2 + AC 2 o sea : (Ra + Rc) 2 = 2 Ra 2 + Ra 2 Ra + Rc = Ra Rc = Ra ( de donde : Rc/ Ra = 3 3 - 1) 3 - 1 = 0,73 2) 1. de coord.. 6 En el triángulo rectángulo ABC: A, B = AC = Ra + Rc BC = 2 Ra BC 2 = AC 2 + AB 2 B A C o sea : (2 Ra) 2 = 2 (Ra + Rc) 2 2 Ra = (Ra + Rc) Ra 2 2 = Ra + Rc de donde : Rc = Ra ( 2 − 1) y : Rc/ Ra = 2 - 1 = 0,414 3) 1. de coord.. 4 (disposición cuadrada plana). A B C AB = AC = Ra + Rc BC = 2 Ra Como : BC 2 = AB 2 + AC 2 Se demuestra, igual que en el caso anterior: Rc/Ra = 0.414 4) I. de coord.. 4 (disposición tetraédrica). Recordemos que un tetraedro puede inscribirse en un cubo regular (ver esquema). A E B C AC = Ra + Rc EC = 2 Ra BC = Ra DC = Ra 2 AB = 1/2 DC = 1/2 Ra 2 En triángulo ABC : AC 2 = AB 2 + BC 2 (Ra + Rc) 2 = (1/2 Ra Ra + Rc = Ra 2 2) + Ra 2 3/2 Rc = Ra ( 3/2 - 1) Rc / Ra = 3/2 - 1 = 0,225 5) I. de coord.. 3. En triángulo ABC: (*) cos 30° = BC / AB = 0,866 BC = Ra AB = Ra + Rc por lo tanto: Ra / Ra + Rc = 0,866 de donde : Rc / Ra = 0.15. El cálculo de los radios iónicos puede efectuarse : a) A partir de las cargas nucleares efectivas b) A partir de la densidad y del tipo de red de algún compuesto iónico que presente al ión en cuestión, y c) a partir de la energía reticular de los cristales iónicos. . A 30° B D C Los procedimientos b) y c) nos permiten evaluar la distancia ínteriónica. Si se conoce el radio de uno de los iones, el del otro se obtiene por simple diferencia. - Cálculo de radios iónicos a partir de las cargas nucleares efectivas. El método sólo es aplicable para iones isoelectrónicos, es decir, que poseen la configuración del mismo gas noble; por ejemplo, los iones: Na+, Mg++, Al+++, 0-2 y F-, son iso-electrónicos y poseen la configuración del Ne. En estos tipos de iones, sus radios son inversamente proporcionales a las cargas nucleares efectivas. Estas últimas se obtienen restando a la carga nuclear Z, el efecto pantalla S, de los electrones. Una ecuación simple que relaciona el efecto pantalla con el número de electrones, es la ecuación de Slater: S = 0,35 Nn + 0,85 Nn-1 + N en que: Nn = Nn-1 = N = número de electrones del nivel cuántico superior número de electrones del nivel cuántico inmediatamente inferior. número de electrones restantes. Ejemplo f). Calcular el efecto pantalla correspondiente a los iones tipo Ne. R : La configuración electrónica general de estos iones es 1s2 2s2 2p6. de donde : S = 0,35 . 8 + 0,85 . 2 + 0 = 4,5 Problema 6. Calcular el efecto pantalla para las iones tipo: Ar, Kr y Xe. Resp.: Ar = 11,6 Kr = 28,1 Xe = 46,1. Problema 7. Calcular la carga nuclear efectiva de los siguientes elementos: Ca (Z = 20), T1 (Z = 81), Zn (Z = 30) y As (Z = 33). Resp.: Ca = 2,5, Tl = 4,65, Zn = 4,00, As = 5,95. Los radios de iones isoelectrónicos son inversamente proporcionales a la cargas nucleares efectivas, es decir, R1/R2 = Z2 – S / Z1 – S. Esta fórmula sólo es aplicable para iones que, además de ser isoelectrónicos, posean la misma carga, con independencia del signo de ésta. Cuando se calcula el radio de un ión plurivalente, en comparación con el de un ión isoelectrónico monovalente de radio conocido, el valor obtenido se denomina radio cristalino monovalente, y se define como el radio que tendría el ión, si manteniendo su configuración electrónica y su carga nuclear efectiva, poseyera la unidad de carga eléctrica. El radio real se obtiene multiplicando el radio monovalente por un factor de corrección igual a: Q -2 / n '−1 en que Q es la carga del ión y n’ una constante llamada exponente de Born que posee valores característicos para cada configuración de gas noble o de pseudo gas inerte. Los valores del exponente de Born son: Iones tipo “ “ “ “ “ “ “ “ He = 5 Ne = 7 Ar = 9 Kr = 10 Xe = 11 tipo Cu+ = 9 “ Ag+ = 10 “ Au+ = 10 Ejemplo g) Las distancias interiónicas en los siguientes compuestos: MgO, KCl, CaS y SrSe, son, respectivamente, 2,10, 3,14, 2,84 y 3,18 Å. Calcular los radios de cada ión. R: En cada compueto, los iones constituyentes son iso-electrónicos y poseen la misma carga, de modo que: - R1/R2 = Z2-S / Z1-S - MgO, iones tipo Ne, S = 4,5 +2 R Mg +2 2,10 - R Mg = (ej. F): 8 − 4,5 12 − 4,5 +2 de donde: R Mg = 0,66 Å y R0 –2 = 2,1 – 0,66 = 1,44 Å - - KCl, iones tipo Ar. S = 11,6 (Problema 6): R +K 3.14 − R +K = 17 − 11,6 19 − 11,6 − K+ =1,33 Å y RCl =3,14 – 1,33=1,81Å - CaS, iones tipo Ar. S=11,6: +2 R Ca +2 2,84 − R Ca = 16 − 11,6 20 - 11,6 +2 RCa = 0,97 Å y RS−2 = 2,84 - 0,97 = 1,87Å - Sr y Se, iones tipo Kr. S = 28,1 (Problema 6): +2 R Sr +2 3,18 − R Sr = 34 - 28,1 38 - 28,1 +2 −2 R Sr = 1,12Å y RSe = 3,18 - 1,12 = 2.01Å Ejemplo h). El radio del ión F- es 1,36 Å y el del ión Cl- es 1,81 Å. Calcular el de los iones Mg+2 y Sc+3. R : El F- es isoelectrónico con el Mg+2 (iones tipo Ne, S = 4,5); luego: R +Mg2 1,36 = 9 - 4,5 +2 R Mg = 0,82 Å (radio monovalente) 12 − 4,5 El radio real es: 0,82 . Q-2 / n’ – 1 Q = 2 y n’ = 7 (ión tipo Ne) Luego, R +Mg2 = 0,82 . 2 -1/3 = 0,65 Å El Cl- es isoelectrónico con el Sc+3 (iones tipo Ar, S = 11,6); luego: +3 R Sc 17 - 11,6 +3 = R Sc = 1,04 Å (radio monovalente) 1,81 21 - 11,6 El radio real, correspondiente a ión trivalente, es: 1,04 . 3-1/4 = 0,80 Å Problema 8. La distancia interiónica en el NaF es 2,29 Å. Calcular el radio de cada ión. Nº Atóm. = Na: 11, F: 9. Resp.: Na+ = 0,945 Å F- = 1,345 Å. Problema 9. La distancia interiónica en el RbBr es 3,37 Å. Calcular el radio de cada ión Nº Atóm. : Rb = 37, Br = 35. Resp. : Rb+ = 1,47 Å, Br - = 1,90 Å. Problema 10. Radio del ión Cs+ es 1,74 Å. Calcular la distancia interiónica en el yoduro de cesio. Nº Atóm.: Cs = 55, I = 53. Rep.: R = 3,97 Å. Problema 11. A partir del radio del ión I- = 2,16 Å, calcular el de los iones: Cs+, Ba+2 y La . Nº Atóm.: I = 53, Cs = 55, Ba = 56, La = 57. Resp.: Cs+ = 1,68 Å, Ba+2 = 1,30 Å, La+3 = 1,10. +3 Problema 12. El radio del ión F- es 1,35 Å. Calcular el del ión Al+3 . Nº Atóm.: F = 9, Al = 13. Resp.: Al+3 = 0,495 Å. Problema 13. A partir del valor 1,95 Å para el radio del ión Br-, calcular el de los iones Sr e Y+3 . Nº Atóm.: Br = 35, Sr = 38, Y = 39. Resp.: Sr+2 = 1,16 Å , Y+3 = 0,97 Å. +2 Problema 14. A partir del valor 0,95 Å para el radio del ión Na+, calcular el de los iones Mg+2 y Al+3 . Nº Atóm.: Na = 11, Mg = 12, Al = 13. Resp.: Mg+2 = 0,66 Å, Al+3 = 0,51 Å. Problema 15. El radio del ión F- es 1,35 Å. Calcular el del ión óxido. Nº Atóm.: F = 9,0 = 8. Resp.: 0-2 = 1,37 Å. - Cálculo de radios iónicos a partir de las energías reticulares de los cristales. La energía reticular de un cristal iónico es la energía que queda en libertad, cuando se juntan, para formar una red cristalina definida, un mol de iones positivos y negativos, que estaban separados inicialmente por distancias infinitas. Esta energía reticular depende de: a) b) c) d) la distancia interiónica en el cristal, el tipo de red cristalina, el estado de oxidación de los iones y la configuración electrónica de los iones. La expresión que relaciona la energía reticular con cada uno de estos factores es: Uo = 329,7 A z 2 ( 1 - 1/n' ) R0 en que: U0 = energía reticular del cristal, en Kcal/peso fórmula A = constante de Madelung, cuyo valor depende del tipo de red del cristal R0 = distancia interiónica en Å z = máximo común divisor entre los valores absolutos de los estados de oxidación de los iones n’ = exponente de Born. Cuando un cristal está constituido por iones de distinta configuración electrónica, se toma un valor de n’ igual al promedio de los valores correspondientes a cada ión. Como veremos más adelante (Cap. III), la energía reticular se puede calcular a partir del ciclo termoquímico de Born – Haber. Ejemplo i). Calcular el radio del ión Na+, a partir del radio del ión Br- = 1,96 Å, y de la energía reticular del NaBr = 171 Kcal/ p. fórmula. La constante de Madelung para los cristales tipo NaCl es 1,75. R.: De la expresión : U 0 = R0 = 329,7 A z 2 (1 - 1/n' ). se despeja R o y : Ro 329,7 A z 2 (1 - 1/n' ) U0 U 0 = 171 Kcal A = 1,75 z =1 valor promedio de n’, entre 7 para iones tipo Ne y 10 para los del tipo Kr, es = 8,5. Luego : R0 = 329,7 . 12 . 1,75 (1 - 1 /8,5) 171 de donde : R0 = 2,92 Å y por lo tanto, R +Na = 2,92 - 1,96 = 0,96 Å. Problema 16. La energía reticular del KBr es 161 Kcal/p. fórm. La constante de Madelung vale 1,75. Calcular la distancia interiónica en el cristal de KBr. Resp.: R 0 = 3,23 Å . Problema 17. El radio del ión Cl- es 1,81 Å. Calcular la energía reticular del CaCl2 si este compuesto cristaliza en la forma de la fluorita (constante de Madelung es 5,04). Resp.: U o = 533,5 Kcal / p.fórm. Problema 18. La energía reticular del MgO (estructura tipo NaCl, constante de Madelung vale 1,75), es 940,3 Kcal/p. fórm. Calcular el radio de los iones Mg +2 y O -2 . Resp.: Mg +2 = 0,67 Å, O -2 = 1,43 Å . Problema 19. Calcular las energías reticulares del NaF y del KCl, dados: constante de Madelung: 1,75, radios iónicos: Na+ = 0,96 Å y Cl- = 1,81 Å . Resp.: NaF = 215, y KCl = 164 Kcal / p. fórm. - Cálculo de radios iónicos a partir de las densidades y geometría de los cristales. La densidad del cristal nos permite calcular el volumen de la celda unitaria y de allí, por simples consideraciones geométricas, obtener la distancia entre los iones. En nuestros ejercicios y problemas nos referiremos a las tres redes iónicas fundamentales: a) b) c) Estructura tipo NaCl: cúbica simple. Los cationes y aniones ocupan alternadamente los vértices del cubo. Es la configuración general de los compuestos iónicos de fórmula MX (haluros alcalinos, excepto RbF, RbCl y los de Cs, óxidos alcalinos térreos). El número de coordinación del catión y del anión es 6. Estructura tipo CsCl: cúbica centrada en el cuerpo. El catión central está en contacto con 8 aniones que ocupan los vértices del cubo, en cuyo centro se halla el catión. Es la estructura general de los haluros de Cs. El índice de coordinación es 8, tanto para el catión como para el anión. Estructura tipo fluorita (CaF2): cúbica centrada en las caras. Los cationes se hallan en los vértices y en el centro de cada cara del cubo, en tanto que en su interior se hallan 8 aniones. La disposición es tal que cada anión se encuentra constituyendo el centro de gravedad de un tetraedro cuyos vértices lo forman los cationes vecinos. Por su parte, cada catión está rodeados por 8 aniones en disposición cúbica. Es la estructura general para los compuestos iónicos de fórmula MX2 o M2X. En las siguientes figuras se puede apreciar, con cierta claridad, lo expuesto: Red tipo cloruro sódico: cada ión presenta 6 vecinos inmediatos, y se comparte simultáneamente con 8 cubos (ver ión central). Red tipo cloruro de cesio: el catión presenta 8 aniones vecinos, y a su vez, cada anión está en contacto con 8 aniones pertenecientes a 8 cubos vecinos. Red tipo fluorita: Cada anión constituye el centro de gravedad de un tetraedro cuyos vértices son los cationes. A su vez cada catión está rodeado por un cubo de aniones, como se puede apreciar en el esquema, al incluir cuatro aniones del cubo vecino. Detalle de la celda de la fluorita, a fin de mostrar uno de los tetraedros. Ejemplo j). La densidad del NaCl es 2,16 gr/cc. Calcular la distancia interiónica en el cristal de NaCl. Pesos Atóm.: Na = 23, Cl = 35,5 gr/át. gr. Cada cubo posee 4 cationes y 4 aniones. A su vez, cada ión se comparte simultáneamente con 8 cubos, lo que da ½ ión para cada celdilla. El peso de la celda es : o sea: 4,85 . 10-23gr. El volumen es: V = 58,5 2.602.10 23 M 4,85 . 10 -23 = d 2,16 o sea: 22,4 . 1024 cc = 22,4 Å 3. La arista x, o sea la distancia interiónica es: x= 3 22,4 = 2,82 Å X Ejemplo: k) La distancia interiónica en el CsF es 3,12 Å . Calcular la densidad, en gr/cc del CsF sólido. Pesos Atóm.: Cs = 133, F = 19. Cálculo de la arista x: ( (3,12) 2 = (x/2) 2 + x 9,73 = 3/4 x 2 x 2 = 12,94 . x = 3,60 2 2 ) 2 x 2 3,02 x 2 2 volumen de la celda: (3,60)3 = 45,6 Å 3 . A cada celda le corresponde un catión y un anión. El peso de la celda es: M= y la densidad: d = 152 = 25,2 . 10 -23 gr. 6,02 .10 23 M 25,2 . 10 -23 gr = = 5,5 gr/cc. V 45,6 . 10 -24 cc Ejemplo 1). La densidad de la fluorita es 3,18 gr/cc. Calcular la distancia interiónica en el cristal de CaF2. (Pesos Atóm. : Ca = 40, F = 19). R: Cada catión del vértice del cubo se comparte con 8 cubos vecinos, en tanto que los de las caras se comparten entre dos cubos. A cada cubo le corresponde, por lo tanto, cuatro cationes (8/8 + 6/2) y 8 aniones (que se hallan en el interior y, por lo tanto, no se comparten con los cubos vecinos). 4.(40 + 38) La masa del cubo es : M = = 51,8 . 10 -23 gr 23 6,02 . 10 M 51,8 . 10 -23 el volumen : V = = = 162,8 Å 3 d 3,18 . 10 -24 artista: 3 162,8 = 5,48 Å. La distancia catión – catión (AB)) es la mitad de la diagonal de una de las caras, o sea: AB = 1/2 . 5,48 2 = 3,86 Å. Aplicando el teorema general de Pitágoras al triángulo ABC, y sabiendo que el ángulo tetraédrico vale 109º 28’, tenemos: C A B AB = AC + BC - 2 (AC) (BC) cos 109º 28' AC = BC = X, como: cos (90º + x) = - sen x tenemos: (3,86)2 = 2 X2 (1 + sen 19º 28’) sen 19º 28’ = 0,333 por lo tanto: 14,89 = 2,666 X2. y de aquí: X = 2,36 Å.. 2 2 2 Problema 20. Dadas las distancias interiónicas, calcular las densidades de los siguientes cristales iónicos: NaF (R = 2,34 Å. ), KBr (R = 3,29 Å. ) y RbI (R = 3,65 Å. ). Pesos atóm.; Na = 23, F = 19, K = 39, Br = 80, Rb = 85,5, I = 127. Resp.: NaF = 2,72, KBr = 2,79, RbI = 3,64 gr/cc. Problema 21. El ThO2 cristaliza en la red de la fluorita y tiene una densidad de 10,03 gr/cc. Calcular: a) la distancia catión – catión, y b) la distancia catión – anión, en el cristal de ThO2. Pesos Atóm.: Th = 232,0 = 16. Resp.: a) 3,86 Å , b) 2,36 Å . Problema 22. A temperatura inferiores a - 190ºC, el RbCl cristaliza en la estructura del CsCl ¿Cuál es su densidad, en estas condiciones, sabiendo que la densidad de la forma estable (tipo NaCl) es de 2,82 gr/cc? Pesos Atóm.: Rb = 85,5 Cl = 35,5 Resp.: 3,68 gr/cc. Problema 23. Las densidades de los óxidos de Ca, Sr y Ba son, respectivamente: 3,42, 4,70 y 5,72 gr/cc. El radio del ión óxido es 1,43 Å . Calcular los radios de los cationes. Pesos Atóm.: 0 = 16, Ca = 40, Sr = 88, Ba = 138. Resp.: Ca+2 = 0,94, Sr+2 = 1,18, Ba+2 = 1,35 Å . Problema 24. La densidasd del LiI es 4 gr/cc. Calcular: a) b) c) d) El volumen de la celda unitaria, La distancia interiónica (artista), La distancia anión-anión, y Dado que los aniones se hallan en contacto, calcular el radio del ión I . Pesos Atóm.: Li = 7,0, I = 127. Resp.: a) 28 Å 3, b) 3,05 Å , c) 4,32 Å , d) 2,16 Å . Observaciones. Es conveniente recalcar las siguientes generalizaciones: a) Para iones isoelectrónicos, el radio iónico decrece con el aumento de la carga positiva, Ejemplo: 0-2 = 1,43 Å , F− = 1,36 Å , Na+ = 0,96 Å , Mg+2 = 0,65 , Å , Al+3 = 0,50. Lo mismo se puede apreciar claramente en el esquema de la pág. Siguiente. b) Dentro de un período la carga nuclear efectiva aumenta regularmente en la misma cantidad, al igual que el número atómico, alcanzando un valor máximo en el halógeno: Ej. Z Zef F 9 4,5 Na 11 1,85 Mg 12 2,5 Al 13 3,15 Si 14 3,80 P 15 4,45 S 16 5,10 Cl 17 5,75 K 19 2,85 Un valor elevado de la carga nuclear efectiva, indica inmediatamente el carácter no metálico de un elemento (comparar F con Na, K con Cl). En el Cap. IV veremos como esta propiedad se relaciona en forma directa con la electronegatividad de un elemento. c) Para una compuesto iónico binario, la distancia interiónica, no siempre es igual a la suma de los radios iónicos, sino que está en directa dependencia con el tipo de red cristalina que presenta el compuesto. d) Dentro de una serie de compuestos isoelectrónicos, el aumento de la carga iónica se traduce en una disminución. 0 1 2 3 4 5 º A 2O Li + FNa - Cl B C Al 3+ + Cu Ca Zn 2 Br- + + Ti 4 V5 Rb+ + Ga3 + Ge 4+ As5 Sr + Cl7 + Zr 4 + + + Cr 6 Mn 7 + Cd 2 Cs + Hg 2 Sc 6 + + Br 7 Nb 5 + Mo 6 + Tc 7+ + 2+ Ba Au + + 2+ In 3 I- + S6 + + Ag 2- + P5 2+ Y3 Te 4+ Si Sc 3 Se N5+ K 2- 4+ + + Mg 2 S2 3+ Be2+ + + La 3 Tl + 3+ Sn 4 + + Sb 5 Tc 6 + I7 + + Ce4 Pb 4+ Bi5 + Fig. 4.1 Ionic crystal radii. (Redrawn from PAULING, The Nature of the Chemical. Bond, Cornell University Press, Ithaca, N.Y. 1940, Fig. 44-2). de la distancia interiónica, aumento de la dureza, del punto de fusión y de la energía reticular. Ej. KF CaO Dist. Inter.. Enero. Retic. Pto. Fusión 2,69 Å 190,4 41ºC 2,46 Å 842,3 Kcal/p. fórm. 2570ºC Capítulo III EL CICLO TERMOQUIMICO DE BORN-HABER Y SUS APLICACIONES El cálculo de ciertas magnitudes termoquímica puede efectuarse descomponiendo la reacción en estudio en una serie de pasos, cada uno de los cuales involucra una absorción o liberación de energía conocida; la suma de estas energías nos da la energía buscada, de acuerdo a la ley de la aditividad (ley de Hess). Así, por ejemplo, el cálculo de la energía reticular de un haluro MX puede efectuarse de acuerdo al siguiente ciclo + Uo MX (s) M(g) + -I _ Q 1/2 X2 (g) M(s) En que: Uo EA I S D Q X - 1/2 D -S M (g) + (g) + EA X (g) = energía reticular del cristal MX(s) = electroafinidad del halógeno X = primer potencial de ionización del metal M. = energía de sublimación del metal M. = energía de disociación (energía de enlace) de la molécula X2. = calor de formación del sólido MX. El signo + corresponde a una absorción de energía, y el – a una liberación. Siendo un ciclo, el cambio energético total debe ser nulo. Luego: de donde Uo + EA – I – ½ D – S - Q = O Uo = Q + S + ½ D + I – EA Ejemplo a) Calcular la electroafinidad del Cl, en función de: Calor de formación del NaCl : 98,2 Kcal Energía reticular del NaCl : 180,4 Kcal Energía sublimación del Na: 26 Kcal Primer PI del Na: 118 Kcal. Energía de enlace Cl-Cl: 57,8 Kcal. R.: EA = S + I + ½ D + Q - Uo EA = 26 + 118 + 28,9 + 98,2 – 180,4 = 90,7 Kcal. Ejemplo b) Calcular la electroafinidad del S. de acuerdo al ciclo de Born – Haber, dados: Calor de formación del SrS: 667,4 Kcal. Energía reticular del SrS: 113 Kcal. Calor de sublimación del Sr: 39,7 Kcal. Primer PI del Sr: 5,69 ev Segundo PI del Sr: 10,98 ev Energía de enlace S-S en la molécula S2: 133,2 Kcal. 1 ev = 23,06 Kcal/mol. R : De acuerdo al ciclo de Born – Haber: EA = S + I + ½ D + Q - Uo Reemplanzando: EA = 39,7 + (5,69 + 10,98) . 23,06 + 66,6 + 113 - 667,4 EA = − 84,7 Kcal Nota. El proceso ½ X2 + ē → X - , va acompañado por una liberación de energía denominada electrofinidad del átomo X. La entrada de un segundo electrón, implica una absorción de energía, por cuanto significa captar una nueva carga negativa de parte de un ión negativo. De aquí entonces, la diferencia de signo observada para las electroafinidades del Cl y del S. Mientras la captación de un electrón por parte un átomo de Cl va acompañada por la liberación de 90,7 Kcal, la captación de dos electrones por parte del átomo de S, con el fin de formar el ión S-2, precisa la absorción de 84,7 kcal. Problema 1. Calcular el primer potencial de ionización del K, en ev, dados: Calor de formación del Kbr: Energía reticular del KBr Calor de sublimación del K: Electroafinidad del Br: Energía de enlace Br- Br: 94,2 Kcal. 157,8 “ 21,7 “ 84,6 “ 46,1 “ R.: 4,31 ev. Observaciones.- La electroafinidad depende del tamaño del átomo, de su carga nuclear efectiva y de su configuración electrónica: a) La EA decrece con el aumento del radio atómico. Ejemplo: Cl: 3,78 ev, Br: 3,54 ev I: 2,24 ev. b) La EA aumenta con el aumento de la carga nuclear efectiva. Ejemplo: EA Zef Na Cl 0,74 ev 1,85 3,78 ev 5,75 c) La EA es mayor, mientras menos electrones debe captar el átomo para alcanzar la configuración de gas inerte. Así en la secuencia C, N, O y F, la EA va aumentando hacia el F. El potencial de ionización es la energía absorbida por un átomo gaseoso, en el proceso de entrega de un electrón de valencia. M (g) → M + (g) + e Según el número de electrones entregados se habla de un primer, segundo, tercer, etc., potencial de ionización. El valor del potencial de ionización depende de: a) Tamaño del átomo: el PI disminuye con el aumento de tamaño, ya que los electrones de valencia se encuentran más alejados del núcleo. Ejemplo: Li = 5,39, Na = 5,14, K = 4,34, Rb = 4,17, Cs = 3,89 b) Carga nuclear efectiva: PI aumenta con el aumento de ésta. Ejemplo : primer PI Zef Na 5,14 1,85 Mg 7,64 2,50 Al 5,98 3,15 Si 8,15 3,80 P S Cl 10,55 10,34 13,01 4,45 5,10 5,75 c) El tipo de electrón cedido por el átomo. Así el valor “anormalmente” bajo del primer PI del Al se explica porque el electrón entregado correspóndela electrón 3p, el único existente en el sub nivel p (configuración electrónica del Al es: 1 s2 2 s2 2 p6 3 p1) el que es cedido con más facilidad que uno de los electrones 3s del Mg, por cuanto este último proceso significa alterar la estabilidad de un orbital completo. d) Los potenciales de ionización superiores (2º, 3º, 4º, etc.), tienen, en cada caso, valores más elevados que los inferiores, lo que se explica por la dificultad de separar un 2º ó 3.er electrón de un ión positivo. Ej.: K Ca Al primer PI 4,34 6,11 5,98 segundo PI 31,81 11,87 18,83 tercer PI 46,0 51,21 28,44 cuarto PI 60,9 67,0 119,96 e) El potencial de ionización necesario para retirar un electrón, de un ión con configuración de gas noble, es notoriamente más elevado que los otros PI. Ej.: comparar el “salto” en los valores correspondientes al 2º y 3er PI del Ca, 1º y 2º del K, y 3º y 4º del Al. Otra de las aplicaciones del ciclo de Born. Haber la tenemos en el cálculo de los potenciales de oxidación de los metales. +S M M(g) (s) - H +I M+ M+ (aq) en que (g) -H M+ S = energía de sublimación del metal I = primer PI del metal. HM+ = energía de hidratación del catión ∆ H = calor de reacción (variación de entalpía) para la reducción del catión hidratado. La suma de las energías deber ser nula: S + I - H M+ - ∆ H = O y ∆ H = S + I - H M+ Si se conoce la temperatura y la variación de entropía (∆ S) de la reacción considerada, es posible calcular la variación de energía libre (∆ F) del proceso : ∆ F = ∆ H - T ∆ S y ∆F de aquí la constante: ∆ F = - RT ln K, o el potencial de oxidación : E = nF F = constante de Faraday = 23,066 cal/volt. Análogamente, el potencial de oxidación de un haluro se calcula por el ciclo: X- - + Hx- H 1/2 + EA X (g) X2 - 1/2 D EA + H - X(g) (aq) X - - 1/2 D - ∆ H = O ∆ H = EA + Hx - - 1/2 D Nota. - Los potenciales de oxidación son valores relativos, es decir, relacionados a + + e a1 un valor tipo, que es generalmente el valor 0,00 volts, para el par ½ H2(g) → H (aq) atm. de presión y a una concentración de H + = IM. En consecuencia, es conveniente, para el cálculo del potencial de oxidación de un par, calcular primeramente, mediante el ciclo termoquímico, el potencial final de alguna reacción que implique el par problema y otro de potencial ya conocido. Por simple diferencia entre el valor del potencial final y el del par conocido, se obtiene el potencial del problema. Ejemplo c) Basándose en la reacción: + + M (g) + H (aq → M (aq) + ½ H 2 (g ) evaluar los potenciales de oxidación de los metales alcalinos, a 27ºC, dados: Energías de sublimación ( en Kcal): Li 38,3, Na: 26, K: 21,7, Rb: 19,9, Cs: 19,1. Potenciales de ionización (en Kcal): Li: 124, Na: 118, K: 100, Rb: 96, Cs: 90, H: 315. Entropías (en cal /át. ºK): Li: 6,9, Na: 12,4, K: 15,4, Rb: 16,6, Cs: 18,4 H2: 31,2, Li+ : 4,7, Na+ : 13,8, K+ : 24,0, Rb+ : 28,6, Cs+ : 33,2, H+ : 0,00. Energías de hidratación: H+ : 260, Li+ : 123, Na+ : 97, K+ : 77, Rb+ : 70, Cs+ : 63 Kcal. R: De acuerdo al ciclo de Born - Haber: M (s) + S ⎯⎯⎯→ M (g) + IM ⎯⎯ ⎯⎯→ − HM+ + M + (g) ⎯⎯ ⎯⎯ ⎯→ M (aq) + + + H H+ + H (aq) ⎯⎯ ⎯ ⎯ ⎯→ + H (g) ∆H = S + I H - H + M H ⎯-⎯I⎯ → H (g) + H H+ - I H - 12 D ⎯⎯ ⎯ ⎯→ - 1 2 En todos los casos es constante la suma: H H+ - I H - 1 2 D = 260 - 315 - 52 = - 107 Kcal. Li KKKK ∆ H = 38,3 + 124 - 123 - 107 = - 67,7 Kcal Na LLLL ∆ H = 26 + 118 - 97 - 107 = - 60,0 " K LLLL ∆ H = 21,7 + 100 - 77 - 107 = - 62,3 Rb LLLL ∆ H = 19,9 + 96 - 70 - 107 = - 61,1 Cs LLLL ∆ H = 19,1 + 90 - 63 - 107 = - 60,9 " " " D 1 2 H2 Variación de entropía para cada caso: Li KKKK ∆ S = 15,6 + 4,7 - 6,9 = 13,4 cal/at º K Na LLLL ∆ S = 15,6 + 13,8 - 12,4 = 17,0 " K LLLL ∆ S = 15,6 + 24 - 15,4 = 24,2 Rb LLLL ∆ S = 15,6 + 28,6 - 16,6 = 27,6 Cs LLLL ∆ S = 1 5,6 + 24 - 15,4 = 24,2 " " " y la variación de energía libre, ∆ F, para cada reacción: Li KKKK ∆ F = - 67.700 − 13,4 - 300 = - 71,020 cal Na LLLL ∆ F = - 60.000 - 17 - 300 = - 65,100 " K LLLL ∆ F = - 62.300 - 24,2 - 300 = - 69,560 " Rb LLLL ∆ F = - 61.100 - 27,6 - 300 = - 69,380 " Cs LLLL ∆ F = - 60.900 - 30,4 - 300 = - 70,020 " La diferencia de potencial con que se desplaza la reacción estudiada, es igual al potencial de oxidación del metal, ya que el Eº del H+ es 0,00 v. Para cada metal tenemos un Eº de: Li KKKK Eº = 71.020 / 23.066 = 3,07 v Na LLLL Eº = 65.100 / 23.066 = 2,82 v K LLLL Eº = 69.560 / 23.066 = 3,01 v Rb LLLL Eº = 69.380 / 23.066 = 3,00 v Cs LLLL Eº = 70.020 / 23.066 = 3,03 v Ejemplo d) Basándose en la reacción: + K (s) + 1/2 X 2 (g) ⎯ ⎯→ K (aq) + X -(aq) calcular el potencial de reducción de los halógenos, a 27ºC, dados: Energías de enlace (en Kcal) : F2 = 36,6, Cl2 = 58, Br2 = 46,1, I2 = 36,1. Electroafinidades (en Kcal) : F = 82, Cl = 87,3, Br = 82, I = 75,7 Energía de hidratación (en Kcal) : F = 122, Cl- = 89, Br- = 81, I- = 72, K+ = 77. Potencial de oxidación del K es 2,92 volts. Entropías (en cal / át. ºK): F = 24,3 Cl = 26,7 Br = 29,3 I = 31,2 K = 15,4 F = 2,3 Cl = 13,5 Br = 19,7 I = 25,3 K = 24,0 R : El ciclo termoquímico para la reacción estudiada es : K (s) + 21,7 ⎯⎯ ⎯⎯→ K (g) + 100 + ⎯-⎯77 + ⎯⎯ ⎯⎯→ K (g) ⎯→ K (aq) + 1/2 D - EA - Hx 1/2 X 2 (g ) ⎯⎯ ⎯ ⎯→ X (g) ⎯⎯ ⎯⎯→ X (g) ⎯⎯ ⎯⎯→ X - (aq) ∆ H = 44,7 + 1/2 D - EA - Hx El calor de reacción es, en cada caso: F L ∆ H = 44,7 + 18,3 - 82 - 122 = - 141 Kcal Cl L ∆ H = 44,7 + 29 - 87,3 - 89 = - 102,6 " Br L ∆ H = 44,7 + 23,05 - 82 - 81 = - 95,25 " I L ∆ H = 44,7 + 18,05 - 75,7 - 72 = - 84,95 " La variación de entropía para cada reacción es : F L ∆ S = (- 23 + 24) - (24,3 + 15,4) = - 18 Cl L ∆ S = ( 13,5 + 24) - (26,7 + 15,4) = - 4,6 Br L ∆ S = ( 19,7 + 24) - (29,3 + 15,4) = - 1,0 I L ∆ S = ( 25,3 + 24) - (31,2 + 15,4) = - 2,7 cal/át. º K " " " " " " y el ∆ F correspondiente: F L ∆ F = - 141,000 + 18 . 300 = - 135,600 cal Cl L ∆ F = - 102,600 + 4,6 . 300 = - 100,220 " Br L ∆ F = - 95,250 + 1,0 . 300 = - 94,950 " I L ∆ F = - 84,950 + 2,7 . 300 = - 85,760 " El potencial de cada reacción vale: F L Eº = 135,600 / 23.066 = 5,88 v Cl L Eº = 100,220 / 23,066 = 4,34 v Br L Eº = I L Eº = 94,950 / 23,066 = 4,11 v 85,760 / 23,066 = 3,71 v Como el potencial de oxidación del potasio es de 2,92 v, el potencial de reducción de cada halógeno será: F LL Eº = 5,88 - 2,92 = 2,96 v Cl LL Eº = 4,34 - 2,92 = 1,42 v Br L L Eº = 4,11 - 2,92 = 1,19 v I LL Eº = 3,71 - 2,92 = 0,79 v Los valores experimentales, citados en la bibliografía, son: F = 2,85 v, Cl = 1,36 v Br = 1,06 v, I = 0,54 v. El cálculo se puede repetir para cualquiera de los metales alcalinos y los resultados, aunque no coinciden, se pueden homologar perfectamente. Problema 2. Empleado los datos de los ejercicios c) y d), calcular los potenciales de reducción los de los halógenos, a 27ºC, en función de la reacción: M (s) + 1 2 X 2 → M + (aq) + X - (aq) empleando como M: a) Li (Eº = 3,02 v), b) Na (Eº = 2,71 v) y c) Rb (Eº 2,99 v). R: a b c F LL 2,95 3,17 2,89 Cl LL 1,46 1,57 1,39 Br LL 1,19 I LL 0,76 1,21 0,81 1,12 0,72 Observaciones. En el grupo de los metales alcalinos, los valores del potencial de oxidación dependen directamente de los valores correspondientes a las energías de sublimación, primer potencial de ionización y energías de hidratación del ión gaseoso. Así tenemos que el poder reductor de estos metales aumenta con la disminución del PI y de la energía de sublimación, y con el aumento de la energía de hidratación. Dentro de esta familia, los tres factores considerados decrecen con el aumento del tamaño. La energía de sublimación y los PI lo hacen en forma más bien gradual, en cambio es notorio el brusco descenso de la energía de hidratación al pasar del Li+ al Na+, y de éste al K+. En otras palabras, la energía de hidratación del Li+ gaseoso es “anormalmente” elevada, debido a su pequeño radio, lo que determina que, en solución acuosa, el Li metálico sea tanto o más reductor que el Cs. En otros grupos de metales, que no sean alcalinos o alcalino-térreos, las energías de hidratación son pequeñas en comparación con los altos valores de los potenciales de ionización y de los calores de sublimación. El carácter noble de la Ag, en comparación con el K, se puede deducir claramente del siguiente cuadro: K Calor de sublimación LLLL L Primer PI LLLLLLLLL Energ. Hidrat. del M + LLLL ∆H para M (s) → M+ + e (aq) 21,7 100,0 Ag 67 175 Kcal " - 77,0 - 113,0 " 44,3 128,0 " Como las energías de sublimación dependen, en parte del punto de ebullición, los metales con temperaturas de ebullición elevadas, presentan un alto carácter noble: Ej.: Au = 2660 º C Pt = 3825 º C Pd = 3125 º C Ir = 4200 º C en cambio : Mg = 1117 º C = 757 º C Cd = 766 º C K En lo que se refiere a los halógenos, sus potenciales de reducción dependen de la electroafinidad, de la energía de enlace y de la energía de hidratación del haluro gaseoso. El poder oxidante de un halógeno aumenta cuando aumenta su electroafinidad, y la energía de hidratación del ión X - , y cuando disminuye su energía de enlace. La baja energía de disociación de la molécula de flúor, así como la elevada energía de hidratación del F- , consecuencia directa de su pequeño tamaño, son factores más que suficientes para explicar el gran carácter oxidante de este halógeno. Del mismo modo, la baja energía de hidratación del ión I- unido al bajo valor de la elelctroafinidad del yodo, son factores que explican el escaso poder exidante del I2, en relación con sus congéneres. El calor de disolución de una sal binaria, corresponde a la variación en entalpía para la reacción: + aq → M (aq) + MX (S) + X -(aq) Esta magnitud termoquímica puede calcularse a partir del ciclo + Uo MX(s) + M(g) + X(g) HM+ H + M(aq) + Hx X(aq) ∆ H = U o - H +M - H -X Como se desprende del ciclo, la solubilidad en agua de una sal binaria, implica: a) Ruptura de la red cristalina, con formación de los iones gaseosos correspondientes. Este proceso requiere la absorción de una cantidad de energía igual a la energía reticular del cristal. b) Hidratación de los iones gaseosos. Proceso exotérmico que implica la liberación de una cantidad de energía igual a las energías de hidratación de estos iones. Ejemplo e) Comparte la solubilidad de los fluoruros alcalinos, en agua, dados: Energías de hidratación ( en Kcal): Li + = 123, Na + = 97, K + = 77, R b + = 70, Cs + = 63 F − = 122 Radios iónicos (en Å): F − = 1,36 Li + = 0,68, Na + = 0,98, K + = 1,33, Rb + = 1,49, Cs + = 1,65. Constantes de Madelung: cristales tipo NaCl = 1,75 cristales tipo CsCl = 1,76 Exponentes de Born = iones tipo: He = 5, Ne = 7, Ar = 9, Kr = 10, Xe = 11. Entropías (cal/át ºK): LiF = 18,57, NaF = 14, RbF = 19,4, KF = 15,9, CsF = 23,5 Li+ = 4,7, Na+ = 14, K+ = 24,2, Rb+ = 28,7, Cs+ = 33,2, F- = - 2,3 R.: La solubilidad viene expresada por la constate de la reacción: MF(s) + + aq → M (aq) + F(aq) y de acuerdo al ciclo de Born – Haber : ∆ H = U º - H M + - H F- Previamente se debe calcular las energías reticulares: U0 = LiF L U 0 = NaF L U 0 = KF L U o = RbF L U o = CsF L U o = 329,7 A z 2 (1 - 1/n' ) R0 329,7 . 1,75 (1 - 1/6) = 240,1 Kcal 2,04 329,7 . 1,75 (1 - 1/7) = 215 Kcal 2,34 329,7 . 1,75 (1 - 1/8) = 190,4 Kcal 2,69 329,7 . 1,75 (1 - 1/8,5) = 181,8 Kcal 2,85 329,7 . 1,75 (1 - 1/9 ) = 172,8 Kcal 3,01 El calor de disolución es, en cada caso: LiF LL ∆ H = 240,1 NaF LL ∆ H = 215 KF LL ∆ H = 190,4 RbF LL ∆ H = 181,8 CsF LL ∆ H = 172,8 - 123 - 122 97 - 122 77 - 122 70 - 122 63 - 122 = = = = = - 4,9 Kcal 4,0 " 8,6 " 10,2 " 12,2 " La variación de entropía: LiF LL ∆ S = ( 4,7 - 2,3 ) - 18,37 = - 16,17 cal = - 2,30 " NaF LL ∆ S = ( 14 - 2,3 ) - 14 KF LL ∆ S = (14,2 - 2,3) - 15,9 RbF LL ∆ S = (28,7 - 2,3) - 19,4 CsF LL ∆ S = (33,2 - 2,3) - 23,5 = + 6,00 " = + 6,00 " = + 7,40 " La variación de energía libre ( a 27ºC) es: LiF LL ∆ F = - 4,990 NaF LL ∆ F = - 4,000 KF LL ∆ F = - 8,600 RbF LL ∆ F = - 10,200 CsF LL ∆ F = - 12,000 + 16,17 . 300 = - 2,3 . 300 = - 6 . 300 = - 6 . 300 = - 7,4 . 300 = 90 cal - 3,310 " - 10,400 " - 12,000 " - 14,420 " La constante K, para cada caso: log K = - LiF LL ∆ F 2,3 . 2 . 300 = - ∆ F 1.380 98 / 1380 = 0,0710, de donde K = 1,18 . NaF LL 3,310 / 1380 = 2,39, de donde K = 2,5 . 10 2 KF LL 10,400 / 1380 = 7,53, de donde K = 3,4 . 10 7 RbF LL 12,000 / 1380 = 8,68, de donde K = 4,8 . 10 8 CsF LL 14,420 / 1380 = 10,47, de donde K = 3,0 . 1010 La solubilidad aumenta con el tamaño del catión. Observaciones.- La energía reticular y el calor de hidratación decrecen con el aumento del radio iónico, pero la energía reticular lo hace más rápidamente, lo que determina que la diferencia Uo - H se haga más negativa, lo cual se traduce en un aumento de la solubilidad. Así, por ejemplo, la solubilidad en agua de los fluoruros alcalinos crece en el orden : LiF < NaF < KF < RbF < CsF. La energía reticular y las energías de hidratación aumentan con el aumento de la carga iónica, pero la Uo lo hace más rápidamente lo que determina una disminución de la solubilidad. Se puede apreciar que las sales alcalino-terreas son, generalmente, menos solubles que las alcalinas correspondientes (comparar KF con CaF2). Es de hacer notar, eso si, la elevada solubilidad del BeF2 comparada con el LiF. Esto se debe a la elevada energía de hidratación del ión Be+2, consecuencia de su pequeño radio, que es mucho mayor que el aumento de Uo al pasar del LiF al BeF2: Radio del ión M+ ………………………… Uo del MF ……………………………… Energ. de hidrat. del catión gaseoso…….. Li Be 0,68 0,31 Å 240,1 875,0 Kcal 123,0 aprox. 950 Probl. 3. Calcular la constante para la reacción: + AgCl (s) → Ag (aq) + Cl -(aq) ¿Cuál es la solución del AgCl, en grs/lt, a 27 ºC? Datos: Uo del AgCl = 211 Kcal. Energías de hidratación. Ag+ = 106 Kcal Cl- = 89 “ Entropías (en cal/mol ºK) : AgCl: 23, Ag+ : 17,5, Cl- : 13,5 Resp. : a) K = 10-10 b) 1,43 . 10-3 gr/lt. Probl. 4. La solubilidad del AgI en agua, a 27ºC, es 2,35 . 16-6 gr/lt. Calcular la energía reticular del AgI. Datos: Energías de hidratación: Ag+ = 106 Kcal, I- = 72 Kcal Entropías (en cal/mol ºK) : AgI = 27,6, Ag+ = 17,5. I- = 25,3. Resp. Uo = 201,6 Kcal. Nota a los problemas 3 y 4. A pesar de que la Uo del AgI (201,6 Kcal) es menor que la del AgCl (211 Kcal), este último presenta una mayor solubilidad, debido precisamente a la mayor energía de hidratación del ión Cl- con respecto al I- (89 por 72 Kcal). En todos los casos contemplados, los valores de las energías libres, y por lo tanto, de las constantes, dependen también de los valores de entropías correspondientes, pero esta dependencia es, en realidad, bastante pequeña, comparado con los factores que hemos analizado. El ciclo de Born – Haber permite, además, establecer el carácter ácido de un haluro de hidrógeno, el que viene dado por la constante para la reacción: HX (aq) + H 2 O → H 3 O + + X -(aq) la que se puede calcular por el ciclo: HX(g) + D H(g) + X (g) + I - EA X(g) + H (g) + Q - Hx - H+ H HX(aq) H H3O+ + X - (aq) en que Q = energía de hidratación del HX(g) D = energía de enlace de HX ∆ H = D + I - EA - H + - H - + Q H x Ej. f). Determinar la fuerza relativa de los haluros de H, como ácidos, en función de los valores de sus constantes de acidez. Datos: Energías de enlace (en Kcal/mol): HF = 134,6, HCl = 103,2, HBr = 87,5 HI = 71,4 Potencial de ionización del H : 315 Kcal. Electroafinidades ( en Kcal/át): F = 82, Cl = 87,3, Br = 82, I = 75,7 Energía de hidratación (en Kcal): H+ = 260, F- = 122, Cl- = 89, Br- = 81, I- = 72 HF = 11,5, HCl = 4,2, HBr = 5,0, HI = 5,5 Variaciones de entropías: ⎯→ HX (aq) para HX (g) ⎯⎯ ⎯ ⎯ (∆ S ) 1 HF = - 23 cal/mol º K HCl = - 18 " " HBr = - 19 " " HI = - 20 " " para HX (g) ⎯⎯ ⎯⎯→ H (g) + X (g) HF = 23,8 cal/ mol º K (∆ S 2 ) HCl = 22,3 " " HBr = 21,8 " " HI = 21,2 " " para H para X (g) ⎯ ⎯→ H O + ; - 27,4 cal/át. º K 3 (g) ⎯⎯ ⎯ ⎯→ X (aq) (∆ S3 ) F = I = - 40,2, Cl = - 26,3, Br = - 22,5 - 17,0 cal/át. Resp. Del ciclo se desprende: ∆ H = Q + D + I - EA - H H + - H x - En los 4 casos es constante la diferencia: I - H H + = 315 - 260 = 55 Kcal. El calor de reacción es, para cada hidrácido: HF ∆H = 55 + 11,5 + 134,6 - 82 - 122 = - 2,9 Kcal HCl ∆H = 55 + 4,2 + 103,2 - 87,3 - 89 = - 13,9 " HBr ∆H = 55 + 5,0 + 87,5 - 82 - 81 = - 15,5 " HI ∆H = 55 + 5,5 + 71,4 - 75,7 - 72 = - 15,8 " La variación de entropía para la reacción: HX (aq) + H 2 O ⎯ ⎯→ H 3 O + + X -(aq) es : ∆ S = ∆ S1 + ∆ S 2 + (- 27,4) + ∆ S 3 ya para cada haluro, tenemos: HF HCl HBr HI ∆S = 23 + ∆S = 18 + ∆S = 19 + ∆S = 20 + 23,8 − 27,4 - 40,2 = 22,3 − 27,4 - 26,3 = 21,8 - 27,4 - 22,5 = 21,2 - 27,4 - 17,0 = - 20,8 cal/mol - 13,4 " " - 9,1 " " - 3,2 " " Cálculo de las energías libres, a 27ºC: HF HCl HBr HI ∆F = ∆F = ∆F = ∆F = − 2900 − 13900 - 15500 - 15800 + 300 + 300 + 300 + 300 . 20,8 = + 3340 . 13,4 = - 9880 . 9,1 = - 12770 . 3,2 = - 14840 cal " " " Cálculos de las constantes: − In K = ∆F R .T R = 2 cal T = 300 º K reduciendo a logaritmos decimales y reemplazando los valores de R y T: log K = ∆ F 1380 HF log K = − 3340 / 1380 = − 2,49 K = 32 . 10 -3 HCl log K = 9880 / 1 380 = 7,16 K = 1,4 . 10 7 HBr log K = 13770 / 1380 = 9,25 K = 1,8 . 10 9 log K = - 15800 / 1380 = 10,75 K = 5,6 . 1010 HI La acidez aumenta desde el HF hasta el HI. Observaciones. Se puede apreciar el efecto preponderante que ejerce en la fuerza de estos hidrácidos, el valor de las energías de enlace H – X. Así, la alta energía de enlace del HF, en relación a sus homólogos, se traduce finalmente en el bajo carácter ácido de este haluro, a pesar de que el ión F- y el HF poseen las más altas energías de hidratación de la serie. Es conveniente observar, que ese ejemplo, la influencia de los valores de entropía . Así, para HF, el valor de – 20,8 cal / mol ºK, da por resultado una variación de energía libre positiva y por lo tanto, un bajo valor de la constante de acidez. La variación de las entalpías en la serie HF….. HI, también proporciona una idea de la variación de la acidez en los haluros de H, pero, el valor negativo del ∆H, para el HF, puede interpretarse erróneamente como una medida de la fuerza de este ácido en circunstancias de que esta viene dada por los valores ∆F, consideradas, en esta última la temperatura y la variación de entropía del proceso. Capítulo IV ELECTRONEGATIVIDADES La electronegatividad (EN) se puede definir como la tendencia de un átomo, ión o molécula, a atraer los electrones. Es una expresión más o menos general, que incluye al potencial de ionización, la electroafinidad, y por lo tanto, es función también del tamaño y la configuración electrónica del elemento. Se ha elaborado una serie de escalas para evaluar las electronegatividades de los elementos. Cada una de éstas parte de una base diferente, pero los resultados se pueden homologar perfectamente, observándose, en todos los casos, las mismas tendencias y variaciones. Algunas expresiones empíricas se han deducido que permiten la conversión de los valores de EN de una escala en otra. En forma más bien general, la EN es función del tamaño de un átomo, y si se trata de un ión, también de su carga. Las mayores EN las encontramos en los elementos más pequeños y en los iones positivos. ELECTRONEGATIVIDADES A PARTIR DE LAS ENERGIAS DE ENLACE (ESCALA DE PAULING) Pauling postula que la energía de un enlace covalente simple normal, entre dos átomos diferentes, A – B, debe corresponder al promedio aritmético de las energías de los enlaces normales A-A y B-B . Así, por ejemplo, la energía del enlace C – H debería ser igual al promedio de las energías de los enlaces simples C – C y H – H, es decir: 1 2 [ ( 83,1 + 104,2 ) ]= 93,65 Kcal / enlace En forma general: D(A-B) = ½ [D (A − A + D (B − B) ] en que : D(A-A) = energía del enlace A-B D(A-A) = “ “ “ A-A D(B-B) = “ “ “ B-B Sin embargo, experimentalmente se ha demostrado que la energía del enlace A – B es siempre mayor que el promedio de las energías de los enlaces A – A y B – B. Así, para el enlace C – H el calor real es de 98,8 Kcal/enl., habiendo una diferencia, ∆, de 5,15 Kcal con respecto al valor calculado. Esta energía extra queda definida por: ∆ = D (A – B) - ½ [D (A – A) + D(B – B)] de acuerdo con esto ∆, no puede ser nunca negativa. El siguiente esquema, de los valores de las energías de enlace para los halógenos y sus compuestos, ilustra lo dicho: F-F Energías de enlace Cl - Cl Br - Br I-I H-H 104 36,6 58 46,1 36,1 H-F H - Cl H - Br H-I 134,6 103,2 87,5 71,4 64,3 22,2 12,45 F - Cl F - Br Cl - Br Cl - I Br - I 60,6 61 52,3 50,3 42,5 13,3 20,65 0,25 ∆ ∆ 1,35 3,25 1,4 Se puede apreciar que la energía adicional, ∆, decrece desde el HF hasta el HI, lo que indica que el carácter de enlace covalente normal aumenta en el mismo sentido. Del mismo modo, se puede observar el alto valor de ∆ , para el enlace Cl – F en comparación con el Cl – Br y el Cl – I. Pauling ha explicado esta energía extra como producto de una estabilización de los enlaces debido a la presencia de formas iónicas resonante. Así, el enlace H – Cl presenta cierto grado de carácter iónico, es decir, en el HCl encontramos enlaces covalentes normales, .. .. H + : Cl : −, estos últimos, por supuesto en menor proporción. del tipo H : Cl : y iónicos: .. .. La alta energía que presenta un enlace iónico repercute en un aumento de la energía de enlace normal. La diferencia ∆ de energía es mayor mientras mayor sea el carácter iónico parcial de un enlace, es decir mientras más difieran los elementos enlazados en su electronegatividad . ∆ representa entonces, hasta cierto punto, una medida de la diferencia de electronegatividad de los átomos enlazados. Al mismo tiempo, es fácil observar que ∆ representa el calor de la reacción: 1 2 A 2(g) + 1 2 B 2(g) → AB (g) La energía extra ∆, se identifica con el calor de formación, en el caso de moléculas gaseosas simples AB. Un problema interesante aparece en el caso de los hidruros alcalinos, ya que en estos, la energía de enlace es menor que el promedio aritmético, lo que da por consecuencia valores negativos de ∆. Esto significa que el postulado de la aditividad de los enlaces normales covalentes, no es general. L. Pauling, por su parte, ha demostrado que, en realidad, es válido y de carácter general, el postulado del promedio geométrico, que establece que la energía de un enlace covalente normal A – B, debe ser igual al promedio geométrico de los valores correspondientes a A – A y B - B. Queda definido así, un nuevo valor de la energía extra, ∆’. igual a: ∆ ' = D (A - B) - D (A - A) . D (B - B) El caso expuesto se puede apreciar en la siguiente tabla: Li - Li Energías de enlace 1 2 [ D (M - M) Na - Na K - K Rb - Rb 26,5 18 13,2 12,4 10,7 Li H Na - H K-H Rb - H Cs - H 58,5 48,2 43,6 40 41,9 65,4 61,1 58,7 58,3 57 + D (H - H ] ∆ Cs - Cs H - H - 6,9 - 12,9 - 15,1 D (M M) D (H - H) 52,6 43,4 37,1 36,0 33,4 4,8 6,5 4,0 8,5 ∆ ' 5,9 - 18 104 - 15,6 TABLA DE ENERGIAS DE ENLACE (En Kcal/enlace) H C N O F Si S Cl Br I P 105 08,8 93,4 110,6 134,6 70,4 81,1 103,2 87,5 71,4 76,4 69,7 84,0 105,4 69,3 62,0 65,9 57,4 38,4 48,0 64,5 --- --- 47,7 58,0 - - - 50,0 --- N 33,2 88,2 --- 48,5 48,5 --- 84,0 --- O 46,6 129,3 71,0 60,6 61,0 --- 117,0 11,3 F 42,2 54,2 85,7 69,1 50,9 51,0 - - - Si 50,9 59,7 50,7 --- 55,0 --- S 58,0 52,3 50,3 79,1 68,9 Cl 46,1 42,5 65,4 65,5 Br 36,1 51,4 41,6 I 51,3 --- P 83,1 78,5 --- 63,0 As 58,6 --- H C 32,1 As Probl. 1. Determinar el valor de ∆’ para los enlaces C-H, N-H, O-H, y F-H, en función de los datos de la tabla ¿Cuál de éstos presenta el mayor carácter iónico? Resp. C-H = 5,8, N-H = 30,1, O-H = 41,8, F–H = 72,9. El enlace F-H es el mayor grado iónico. Hemos dicho ya que los valores de ∆’ aumentan mientras más difieren los elementos enlazados en su EN. Sin embargo, si se confecciona una tabla de los valores de ∆’ para una serie de enlaces, se puede apreciar que no siguen una regularidad ni son perfectamente aditivos. Así, por ejemplo, los valores de ∆’ , para C – H y C - F son, respectivamente , 5,8 y 50,2 Kcal. Cabria esperar un valor de 56 Kcal para el enlace H – F, pero éste presenta un valor de ∆’ de 72,9 Kcal. Igualmente, para P – Cl, ∆’ es 24,5, y para P – Br es 16,7. Para Cl – Br, cabe esperar un ∆’ de 7,8, pero el valor real es de 0,6 Kcal. En todo caso, se ha podido demostrar que las raíces cuadradas de los valores de ∆’ presentan cierta regularidad y son, hasta cierto punto, aditivos. Para los enlace P – Cl y P – Br, la ∆' es 4,95 y 4,1 respectivamente. Para el enlace Cl – Br es 0,77 bastante aproximado al valor esperado de 0,85. Pauling define la diferencia de EN entre dos átomos enlazados, por un enlace covalente simple, en función de la raíz cuadrada de ∆’. Aún más, se ha escogido una unidad de EN igual a 30 Kcal/mol. Entonces tenemos: XA - XB = ∆ ' / 30 = 0,18 ∆' Probl. 2. Calcular las diferencias de EN entre los siguientes átomos: a) P-H, b) C-Si, c) As-Br, d) S-H, e) P-Cl Resp. a) 0,3 b) 0,6 c) 0,8 d) 0,5, c) 0,9. Con el fin de confeccionar una escala de valores individuales de EN. Pauling ha adjudicado al H un valor de 2,1, para así obtener un valor máximo de 4,0, correspondiente al flúor, el más electronegativo de los elementos. Algunos de los valores obtenidos se presentan en la siguiente tabla: H 2,1 C N O F 2,5 3,0 3,5 4,0 Si P S Cl 1,8 2,1 2,5 3,0 Ge As Se Bi 1,8 2,0 2,4 2,8 I 2,5 Se puede apreciar un incremento de los valores en EN al avanzar a la derecha en un período, como asimismo un decrecimiento dentro de una familia al aumentar el tamaño del elemento. Ej. a) A partir del valor 3,5 para la EN del O, calcular las EN de: a) C, b) F. Utilizar los valores de las energías de enlace dados en la tabla. Resp. a) Energía de enlace C – C = 83,1 “ “ “ O - O = 33,2 “ “ “ C – O = 84,0 ∆ ' = 84 Xo - Xc = 0,18 33,2 . 83,1 = 31,5 31,5 = 1,0, de donde Xc = 3,5 - 1,0 = 2,5 b) Energía de enlace F - F = 36,6 " " " F - O = 44,2 ∆' = 44,2 X F - X O = 0,18 33,2 . 36,6 = 9,3 9,3 = 0,5, de donde X F = 3,5 + 0,5 = 4,0 Probl. 3. A partir del valor 3,5 para la EN del O, calcular la EN de : a) H, b) Si, c) Cl. Emplear los datos de las energías de enlace, de la tabla. Resp. a) 2,2, b) 2,2, c) 3,1. Probl. 4. A partir del valor 2,5 para la EN del C, y de las energías de enlace, calcular las EN del : a) H, b) Si, c) Cl, d) Br. Resp. a) 2,1, b) 1,7, c) 3,0. d) 2,9. Probl. 5. Dado el valor 3,0 para la EN del Cl, y 2,8 para el Br, calcular la energía del enlace Br – Cl. Las energías de los enlaces Br – Br y Cl – Cl, son respectivamente: 46,1 y 58 Kcal. Resp. 52,7 Kcal. Probl. 6. La EN del I es 2,5 y del Br 2,8. Calcular la energía del enlace Br-I.. Energías de enlace: Br – Br = 46,1, I-I = 36,1 Kcal. Resp. 43,5 Kcal El calor de formación de un compuesto binario se identifica con el valor de ∆. De acuerdo con esto, Pauling ha deducido una expresión que permite obtener, sólo en forma aproximada, el calor de formación en función de la diferencia de EN. Para esto se empleó el promedio aritmético y se expresó los valores de ∆ en ev ( 1 ev = 23,06 Kcal). Tenemos entonces: −Q = ∆ XA − XB = ∆ / 23,06 = Q = 23,06 (X A − XB ) Q / 23,06 2 Para un compuesto binario que presenta más de un enlace: Q = 23,06 . n (X A − X B ) 2 , en que n es el número de enlaces existentes en la molécula. Para los compuestos binarios que presentan O o N, existe unos factores de corrección, y la ecuación anterior adopta la forma: 2 Q = 23,06 . n (X A − X B ) − 55,4 nN − 26,0 nO en que nN y nO son el número de átomos de N o de O que presenta el compuesto. Probl. 7. Calcular el calor de formación del NCl3, dadas: EN del N y del Cl = 3,0. Resp. – 55,4 Kcal. Ej. b) La EN del Cl es 3,0 y los calores de formación del respectivamente: 122,3 y 91,3 Kcal/mol. Calcular las EN del Be y del Sb. Resp. A partir de Q = 23,06 . n (XA - XB)2, tenemos: BeCl2 son, X A − X B = − X = Para el BeCl : X 2 Be Cl de donde : X Be Sb 122,3 = 1,63 23,06 . 2 = 3,0 - 1,63 = 1,37 Para el SbCl : X - X = 3 Cl Sb de donde : X Q 23,06 . n 91,3 = 1,15 23,06 . 3 = 3,0 - 1,15 = 1,85 Probl. 8. Calcular las EN del Al, Pb, y Si, dados los calores de formación de sus cloruros: AlCl3 = 166,0, PbCl2 = 85,8, SiCl4 = 145,7 Kcal/mol. EN del Cl es 3.0. Resp. Al = 1,46, Pb = 1,63, Si = 1,75. Probl. 9. La EN del H es 2.1 y la del O es 3,5. Calcular el calor de formación del agua. Rep. 66 Kcal/mol. 2.5. Probl. 10. Calcular el calor de formación del CCl4, si la EN del Cl es 3 y la del C es Resp. 23,06 Kcal/mol. Probl. 11. La EN del Cl es 3,0 y la de los elementos: Na, Mg, Al, Si. P y S. son respectivamente: 0.9, 1,2, 1,5, 1,8, 2,1 y 2,5. Calcular el calor equivalente de formación (calor de formación por equiv. gr) de: a) NaCl, b) MgCl2, c) AlCl3, d) SiCl4, e) PCl3, y f) SCl2. Resp. a) 101, b) 74, c) 52, d) 33, e) 19,6, f) 5,8. Observaciones. Los valores de EN permiten establecer una diferencia, un tanto arbitraria, entre metal y no metal. El valor 2.1, correspondiente a la EN del H, parece indicar el límite entre el carácter metálico y no metálico de los elementos. Así, aquellos cuyas EN sean inferiores a 2,1 se consideran como metales, presentando los no metales valores superiores a este. La división establecida de este modo, no es tan neta como pudiera parecerlo, ya que se presenta ciertos problemas con aquellos elementos cuyas EN bordean el valor 2,1, (Ej. P = 2.1, As = 2,0, B = 2,0, Si = 1,8, Sb = 1,9, Bi = 1,9) y cuyas propiedades físicas son intermedias entre las de los metales y no metales típicos. Siendo las energías de enlace función directa del tamaño de los elementos enlazados, las EN se relacionan de igual manera con este factor: son mayores mientras más pequeño sea el elemento en cuestión. Dentro de un período aumentan hacia la derecha y dentro de una familia, decrecen a medida que aumenta el tamaño del elemento. La EN decrece también a medida que disminuyen los electrones de valencia (observar regularidad dentro de un período). ESCALA DE ELECTRONEGATIVIDADES DE MULLIKAN Mullikan define a la electronegatividad de un elemento, como el promedio aritmético entre su electroafinidad y su primer potencial de ionización, ambos expresados en ev (1 ev = 23,066 Kcal). Es decir: XM = 1 2 (PI + EA) La EN queda así expresada en función de las energías captadas y entregadas, al ceder y ganar un electrón el elemento en cuestión. Sólo se han podido obtener algunos valores de EN, en esta escala, ya que aún no ha sido posible evaluar las electroafinidades de todos los elementos. La conversión de las unidades Mullikan y Pauling, se efectúa mediante la relación: Xp = Xm 2,78 Esta expresión ha permitido calcular, de manera aproximada, las electroafinidades de algunos elementos, a partir de la EN en unidades Pauling, ya que se conocen los primeros potenciales de ionización de todos los elementos. Ej. c) Calcular la EN, en la escala de Pauling, del Cl, dados: primer PI del Cl = 13 ev, electroafinidad – 87,3 Kcal. Resp. Reducción de la EA a ev = 87,3 / 23,06 = 3,78 ev. XM = ½ (3,78 + 13) = 8,39 ev, de donde Xp = 8,39/2,78 = 3,0. Probl. 12. Evaluar las EN de los metales alcalinos, en la escala de Pauling y de Mullikan, a partir de sus PI : Li = 5,39, Na = 5,14, K = 4,34, Rb = 4,18, Cs = 3,9 ev. Las EA de los alcalinos se pueden suponer nulas. Resp. Li = 0,97 y 2,69 Na = 0,92 y 2,57 K = 0,78 y 2,17 Rb = 0,75 y 2,09 Cs = 0,70 y 1,95 Probl. 13. Calcular las EN de los alcalino-térreos, Ca, Sr y Ba, dados sus primeros PI : Ca = 6,11, Sr = 5,69, Ba = 5,21 ev, y suponiendo nulas sus EA. Resp. Ca = 1,1, Sr = 1,0, Ba = 0,93. Probl. 14. Calcular las EA del Br y I, en Kcal/át. gr. Dados: EN en unidades Pauling: Br = 2,8, I = 2,5. Primer PI : Br = 11,8, I = 10,4 ev. Resp. Br = 86,9 Kcal, I = 80,7 Kcal. Probl. 15. Dada la EN = 4,0 para el F, en la escala Pauling, calcular su primer PI en ev, si su EA es de 83,8 Kcal. Resp. PI = 18,4 ev. ELECTRONEGATIVIDADES A PARTIR DE LA DENSIDAD ELECTRONICA (ESCALA DE SANDERSON) R.T. Sanderson define a la electronegatividad como la relación (relación de estabilidad) entre la densidad electrónica media del átomo y su densidad electrónica ideal: RE = D / Di La densidad electrónica media, D, se calcula suponiendo el átomo perfectamente esférico y con su nube electrónica uniforme, tanto en la periferia como en las proximidades del núcleo: D= Z 4/3 π R 3 = 0,24 Z R 3 3 (e / Å ) en que Z = Nº atómico R = radio covalente ( en Å) La densidad electrónica ideal, Di, es aquella que tendría el átomo, si manteniendo su Nº Atóm. poseyera la configuración de gas noble. La Di se obtiene por interpolación lineal entre los valores de D correspondientes a los gases inertes entre los que se encuentra el elemento en cuestión, en el Sistema Periódico. Las densidades electrónicas de los gases noble son: He = 0,59, Ne = 1,06, Ar = 0,82, Kr = 1,27, Xe = 1,41 y Rn = 2,09 e- / Å 3. Los valores de EN encontrados por Sanderson, se relacionan con los de Pauling, por la conversión: Xp = (0,21 RE + 0,77 ) 2 Ej.: d) Calcular la RE de los siguientes elementos, dados sus números atómicos y sus radios covalentes: a) F (Z = 9, R = 0,72), b) Na (Z = 11, R = 1,54), c) B (Z = 5, R = 0,82). Resp. Cálculo de las densidades electrónicas medias, D: F LLL D = 0,24 . 9/ (0,72) 3 = 5,75 Na LLL D = 0,24 . 11/ (1,54) 3 = 0,72 B LLL D = 0,24 . 5/ (0,82) 3 = 2,16 cálculo de las densidades ideales, Di: a) b) F, se encuentra entre He ( D = 0,59) y Ne (D = 1,06). Hay una diferencia de 0,47 unidades para 8 elementos, es decir, existe un incremento de 0,06 unidades por elementos. Como el F es el 7º elemento del período su Di será: 0,59 + 7 . 0,06 = 1,01. Na se encuentra entre Ne (D = 1,06) y Ar (D = 0,82). Hay una diferencia de 0,24 unidades para 8 elementos, o sea, hay un decrecimiento de 0,03 unidades por elemento. Siendo el Na el primer elemento del período, su Di es: 1,06 – 0,03 = 1,03. c) B es el 3er elemento del mismo período del F. Su Di será: 0,59 + 3 . 0,06 = 0,77. Cálculo de las RE: a) b) c) F LLLLL RE = 5,75 / 1,01 = 5,75 Na LLLLL RE = 0,72/ 1,03 = 0,70 B LLLLL RE = 2,16 / 0,77 = 2,84 Nota. Las RE del H y de los elementos muy metálicos (exceptuando el Na), han sido calculadas introduciendo ciertos factores de corrección, que no es del caso discutir aquí. Los valores corregidos, que serán los utilizados en los próximos ejercicios y problemas, son los siguientes: H = 3,55, Li = 0,74, Be = 1,91, Mg = 1,56, K = 0,56, Ca = 1,22, Rb = 0,53, Sr = 1,10, Cs = 0,49, Ba = 1,02 La escala de RE contempla un valor máximo de 5,75, para el F, y uno mínimo de 0,49, correspondiente el Cs. El valor 3,55, correspondiente al H, puede tomarse, al igual como en la escala de Pauling; como el valor límite entre los metales y no metales. Probl. 16. Calcular la RE de los elementos de la familia del O, dados sus radios covalentes: O (Z = 8, R = 0,73), S (Z = 16, R = 1,02), Se (Z = 34, R = 1,16), Te (Z = 52, R = 1,35). Resp. O = 5,21, S = 4,11, Se = 4,25, Te = 3,62. Probl. 17 Calcular la RE de los elementos de la familia del N: N (Z = 7, R = 0,75), P (Z = 15, R = 1,06), As (Z = 33, R = 1,19), Sb (Z = 51, R = 1,38), Bi (Z = 83, R = 1,46). Resp. N = 4,49, P = 3,34, As = 3,91, Sb = 3,37, Bi = 3,14. Observaciones. Los valores de EN, obtenidos por el procedimiento de Sanderson, se ajustan mejor a las propiedades químicas de los elementos y sus compuestos, que los valores hallados por Pauling. Así, si comparamos los valores de EN, en ambas escalas, para los elementos de las familias del O y N: Familia del O RE XP O S Se Te 5,21 4,11 4,25 3,62 3,5 2,5 2,4 2,1 Familia del N RE XP N P As Sb Bi 4,49 3,34 3,91 3,37 3,14 3,0 2,1 2,0 1,8 1,8 Hallamos ciertas diferencias. Según la escala de Sanderson, el As sería más no metálico que el P, lo que está de acuerdo con las propiedades oxidantes de los oxiácidos de As (III) y As (V), comparados con las homólogos de P. Lo mismo ocurre con el S y Se; a este último Sanderson le adjudica un mayor carácter no metálico. Si comparamos el elevado poder oxidante de los ácidos selenioso y selénico, con el de los ácidos sulfuroso y sulfúrico, debemos aceptar el mayor carácter metálico del S. La facilidad de reducción de los ácidos selenioso y selénico, así como arsenioso y arsénico, a Se y As elemental, respectivamente, demuestra claramente lo ya expuesto. Asimismo, se puede observar el mayor carácter metálico del Bi, comparado con el Sb (RE: 3,14 y 3,37), lo que no se aprecia en los valores dados por Pauling (ambos con EN = 1,8). Efectivamente, las propiedades químicas del Bi son las de un metal típico, más no así las del Sb. Otro hecho que corrobora las ventajas de la escala de Sanderson, es la Re del H = 3,55, menor que la del As (RE = 3,91). La escala de Pauling asigna un mayor carácter no metálico al H frente del As (EN = 2,1 y 2,0). Ahora bien, es un hecho conocido que el As elemental puede ser reducido a arsenamina, AsH3, es decir, en este compuesto, el As presenta un estado de oxidación negativo frente al H, que es el positivo. Esto confirma la mayor aproximación de los datos obtenidos, por las densidades electrónicas, con respecto a los datos de EN en función de las energías de enlace. La escala de RE de Sanderson indica claramente la relación entre el tamaño de un átomo y su electronegatividad, desde el momento que las densidades electrónicas son función directa del radio y del número atómico. Así, los elementos más pequeños, deben poseer los valores más elevados de RE. La influencia del radio es mucho mayor que la del número de electrones, ya que el primero lo encontramos elevado a la tercera potencia La relación deducida entre las escalas de Pauling y Mullikan y entre las de Pauling y Sanderson, nos permite calcular una serie de datos de un elemento, a partir de sus valores de EN. Ej. e) Las EN, en la escala Pauling, del K (Z = 19), Cu (Z = 29) y I (Z = 53), son 0,8, 1,7, y 2,5, respectivamente. Calcular sus radios covalentes. Resp. Transformando los valores de Xp a RE: 0,21 RE = RE = y como D = X p - 0,77 X p - 077 0,21 = D Di 0,24 Z 0,24 Z , tenemos : 3 = 3 R R Di de donde : R a = 0,05 Z Di ( X p - 0,77 y R =3 X p - 0,77 0,21 0,05 Z Di ( X p - 0,77 cálculo de las Di : K : primer elemento entre Ar (D = 0,82) y Kr (D = 1,27) Di = 0,82 + 0,025 = 0,84 Cu :11º elemento entre Ar y Kr (D = 0,82 y 1,27 respectivamente). Di = 0,82 + 11 . 0,025 = 1,09 I : 17º elemento entre Kr y Xe (D = 1,41) Di = 1,27 + 17 . 0,0077 = 1,40 Cálculo de los radios : K: R = 3 Cu : R = 3 I: R = 3 0,05 . 19 = 2,05 Å 0,84 (0,8 - 0,77) 0,05 . 29 1,09 (1,7 - 0,77) = 1,34 Å 0,05 . 53 = 1,33 Å 1,40 (2,5 - 0,77 Probl. 18. Calcular los radios covalentes del Hg y del B, dadas sus EN en la escala de Pauling: Hg = 1,9, B = 2,0, Nº Atóm.: Hg = 80, B = 5. Resp. Hg = 1,49 Å, B = 0,82 Å. Probl. 19. El radio covalente del P es 1,06 Å y del Cl es 0,99 Å. Calcular: a) b) c) d) EN del P y del Cl en la escala Sanderson “ “ “ “ “ Pauling “ “ “ “ “ Mullikan Calor de formación del PCl3 Resp. a) b) c) d) P P P Q = = = = 3,34 Cl = 4,93 2,16 Cl = 3,28 6,00 Cl = 9,12 86,5 Kcal/mol. Probl. 20. El calor de formación del AlCl3 es 166,2 Kcal/mol. La EN del Cl es 3,0, en la escala Pauling. Calcular: a) EN del Al en la escala Pauling b) RE del Al c) Radios covalentes del Al y Cl Resp. a) 1,59, b) 2,09, c) Al = 1,14 Å. Cl = 1,01 Å. Probl. 21. Calcular la electroafinidad, para un electrón, de los elementos de la familia del O, dados: O : S : Se : Te : Z Z Z Z = = = = 8, 16, 34, 52, R R R R = = = = 0,74 1,04 1,17 1,37 Å primer PI = Å „ „ = Å „ „ = Å „ „ = 13,6 10,3 9,8 9,0 ev ev ev ev Resp. O = 5,86 ev, S = 4,04 ev, Se = 3,00 ev, Te = 2,56 ev. ELECRONEGATIVIDADES A PARTIR DE LAS CARGAS NUCLEARES EFECTIVAS (ESCALA DE ALLRED Y ROCHOW) Allred y Rochow elaboraron una escala de EN en función de la carga nuclear efectiva de un átomo y de su radio. Consideran a la EN como una medida de la atracción que ejerce el núcleo del átomo por uno de los electrones de la capa de valencia. Esta atracción, de tipo electrostático, depende de la carga nuclear, de la distancia entre el electrón externo y el núcleo y del efecto pantalla ejercido por los electrones del elemento. La conversión a unidades Pauling está dada por: X p = 0,359 Z -S R2 + 0,744 Ejemplo f) Calcular la EN de los siguientes elementos, dados sus números atómicos y sus radios covalentes: a) Br (Zr = 35, R = 1,14), b) Pr ( Z = 59, R = 1,65). Resp. Cálculo de las cargas nucleares efectivas: a) Br ….. b) Pr ….. Zef = 35 - 0,35 . 7 - 0,85 . 18 - 10 = 7,25 Zef = 59 - 0,35 . 2 - 0,85 . 8 - 49 = 2,50 Cálculo de las EN: a) Br ….. XBr = 0,359 . 7,25/(1,14)2 + 0,744 = 2,74 b) Pr ….. XPr = 0,359 . 2,50/(1,65)2 + 0,744 = 1,07 Probl. 22. Calcular las EN de : a) U (Z = 92, R = 1,42), b) Ba (Z = 56, R = 1,98), c) Hf (Z = 72, R = 1,56). Resp. U = 1,22, Ba = 0,97, Hf = 1,16. Probl. 23. Calcular el radio covalente de los halógenos, dadas sus EN,: F = 4,0, Cl = 3,0, Br = 2,8, I = 2,5. Resp. F = 0,72, Cl = 0,95, Br = 1,13, I = 1,25 Å. Probl. 24. Calcular las EN de : a) Mo (Z = 42, R = 1,29), b) Ce (Z = 58, R = 1,65), c) Sm (Z = 62, R = 1,66), d) Eu (Z = 63, R = 1,85), e) Np (Z = 93, R = 1,42). Resp. Mo = 1,30, Ce = 1,08, Sm = 1,07, Eu = 1,01, Np = 1,22. ELECTRONEGATIVIDADES A PARTIR DEL RADIO COVALENTE Se han deducido dos expresiones, quizás las más simples, que relacionan la EN, en unidades Pauling, con el radio covalente y el número de electrones externos (electrones de valencia). Estas son: Fórmula de Liu: X p = 0,313 n + 2,6 R 23 Fórmula de Gordy: X p = 0,31 ( n +1 ) + 0,50 R es que : n = número de electrones de valencia R = radio covalente (en Å ). Ejemplo g) Calcular, mediante las fórmulas de Liu y de Gordy, las EN del Be y Mg, dados sus radios: Be = 0,89 Å, Mg = 1,36 Å. Resp. Aplicando la fórmula de Liu: X Be = 0,313 X Mg = 2 + 2,6 (0,89) 2/3 0,313 (2 + 2,6) (1,36) 2/3 = 1,55 = 1,17 Aplicando la fórmula de Gordy: X Be = 0,31 ( 2 + 1 ) 0,50 = 1,54 0,89 X Mg = 0,31 ( 2 +1 ) + 0,50 = 1,18 1,36 Probl. 25 . Utilizando las expresiones de Liu y Gordy, calcular las EN de los alcalino-térreos: Ca ( R = 1,74), Sr ( R = 1,91) y Ba (L = 1,98). Resp. Liu Gordy Ca Sr Ba 0,99 1,00 0,92 1,03 0,98 0,97 Probl. 26. La energía necesaria para expulsar totalmente un electrón del Al, equivale a la de una radiación de 2060 Å. El radio del Al es 1,25 Å. Calcular su electroafinidad, en ev. Resp. 2,36 ev. Probl. 27. La energía del enlace C - C es 83,1 Kcal, y la del F – F es 36,6 Kcal. Calcular la del enlace C – F, si el radio del C es 0,77 Å y el del F es 0,72 Å. Resp. 136,1 Kcal. ELECTRONEGATIVIDADES DE LAS MOLECULAS Sanderson ha definido la relación de estabilidad molecular, (RE) m, o electronegatividad de una molécula como el promedio geométrico de las RE de los átomos que la constituye. Para esto, se ha supuesto que, al formarse un compuesto, hay una redistribución de los valores de RE de cada átomo, de tal modo que todos adquieren un mismo valor, igual al promedio geométrico de los valores iniciales. Ejemplo h) Calcular la (RE) m de las moléculas: HClO3 y NH3, dadas las RE de los átomos constituyentes: H = 3,55, Cl = 4,93, O = 5,21, N = 4,49. Resp. Reduciendo los valores de RE a sus logaritmos decimales, tenemos: H = 0,5502, Cl = 0,6928, O = 0,7168, N = 0,6522. a) HClO 3 H : Cl : 3O: 0,5502 0,6928 2,1504 3,3934 : 5 = 0,6787 (RE) m del HClO 3 : antilog 0,6787 = 4,80 b) NH 3 N: 0,6522 3 H: 1,6506 2,3028 : 4 = 0,5757 (RE) m del NH 3 : antilog. 0,5757 = 3,76 Probl. 28. Calcular la (RE) m de las moléculas: CH3COOH y NH4NO3 . La RE del C es 3,79. Resp. CH3COOH = 4,00 NH4NO3 = 4,25. Probl. 29. Calcular y comparar las (RE) m de los siguientes pares de compuestos: a) H2SO4 y H2SeO4, b) C2H6 y C2H2, c) HIO3 y HIO4, d) KHSO4 y K2SO4. Resp. a) 4,51 y 4,53, b) 3,61 y 3,67, c) 4,54 y 4,64, d) 3,47 y 2,66. Observaciones. Se desprende inmediatamente la influencia de la RE de los elementos constituyentes, en la (RE) m del compuesto. Así, en una serie como HClO, HClO2, HClO3 y HClO4, la (RE) m aumenta a medida que aumenta el número de átomos de O, ya que este es el elemento más electronegativo del conjunto. Del mismo modo, la (RE) m del KHS debe ser mayor que la del K2S. Como veremos más adelante (Cap. V), la (RE) m influye notablemente en ciertas propiedades de las moléculas y de los iones. Por ejemplo, el carácter ácido de un oxiácido es mayor mientras mayor sea su (RE) m. Por otra parte, el carácter básico es mayor cuanto menor sea la (RE) m. (comparar HClO con HClO4, KHS con K2S, HNO2 con HNO3, H2SO3 con H2SO4). ELECTRONEGATIVIDADES DE IONES La RE, definida como el cuociente entre la densidad electrónica media y la ideal, no proporciona valores razonables en EN para los iones. Con el fin de obtener un procedimiento que permita obtener los valores de RE de cationes y aniones, Sanderson enfoca el problema desde el siguiente punto de vista: es lógico esperar que la EN de un ión, positivo sea mayor que la del elemento neutro, del mismo modo que la de un anión sea bastante menor. El aumento o disminución de la RE que experimenta un átomo al pasar a ión, viene dada por la siguiente relación empírica: ∆ RE = 2,08 . n RE en que RE es la EN del elemento neutro, y n es la carga del ión. La fórmula sólo es aplicable para los iones simples (ej. K+ , Fe+3, S-2, etc.) Ejemplo i) Calcular la RE de los iones Be+2 y Mg+2, a partir de las RE de los elementos: Be = 1,91, Mg = 1,56 Resp. El aumento de la RE al pasar de átomo neutro a ión dipositivo es: Be : ∆ RE = 2,08 . 2 1,91 = 5,75 Mg : ∆ RE = 2,08 . 2 1,56 = 5,20 La RE de los iones será : Be +2 = 1,91 + 5,75 = 7,66 Mg + 2 = 1,56 + 5,20 Probl. 30. elementos: = 6,76 Calcular la RE de los iones alcalino-térreos, dadas las RE de los Ca = 1,22, Sr = 1,10, Ba = 1,02. Resp. Ca + 2 = 5,82, Sr +2 = 5,46, Ba +2 = 5,22 Prob. 31. Calcular la RE de los haluros, dadas las RE de los halógenos: F = 5.75, Cl = 4,93, Br = 4,53, I = 3,84 Resp. F- = 0,76, Cl = 0,31, Br- = 0,10, I- = -0,23 Nota. El valor negativo para la RE del ión I- , explica la facilidad para oxidarse de este ión, es decir para entregar su electrón adicional. Probl. 32 .- Calcular la RE en la serie: Ti + 2 , Ti +3 y Ti + 4 , si la RE del Tiº es 2,27. Resp. Ti + 2 = 8,55, Ti +3 = 11,69, Ti + 4 = 14,83. Observaciones. El hecho de que cualquier ión positivo sea más electronegativo que el flúor, no es tan extraño como pudiera parecerlo, del mismo modo que los iones negativos sean menos electronegativos que los metales alcalinos. Debemos recordar que, justamente debido a eso, los iones no existen en forma aislada. Así, el ión Ca+2 (RE = 5,82) en las sales sólidas se encuentra rodeado de iones negativos, y en solución lo hallamos siempre solvatado con las moléculas del solvente. De este modo, su alta electronegatividad se halla considerablemente disminuida. Un catión aislado, sólo se obtiene en condiciones muy especiales (tubos de descarga, arcos voltaicos); al cesar el estimulo que provocó la ionización, el catión vuelve, en forma instantánea, al estado elemental. En solución acuosa los iones se encuentran siempre al estado de acuo complejos. El hecho de escribirlos como iones simples, es sólo una convención en aras de una mayor sencillez en la interpretación de las reacciones en solución. ELECTRONEGATIVIDAD DE IONES COMPLEJOS Dentro de la denominación de iones complejos, comprenderemos todas aquellas especies iónicas constituidas por más de un elemento: Ejemplo: SO 4−2 , NH +4 , Zn(NH 3 ) +42 , Al(H 2 O) 6+3 , etc. Para estos casos, Sauderson recomienda efectuar el cálculo en función de una sal del ión a estudiar. Para el caso de un catión complejo se escoge el fluoruro de este catión, y para el anión, su sal de Ag. El cálculo, fundamentalmente, es análogo al efectuado para los iones simples, es decir, obtener una expresión para el cambio de RE experimentado por el radical neutro al pasar al estado de ión complejo, ya sea positivo o negativo. El procedimiento seguido por Sanderson se puede ilustrar claramente empleando el ejemplo del ión acetato. La (RE) m del CH3COOAg se calcula fácilmente, y es igual a 3,762. La del radical CH3COO, sin carga, es 4,036. La Ag elemental tiene una RE de 2,30 y el ión Ag+ tiene una RE de 5,46. Ahora bien: la RE del radical acetato ha bajado en 0,274 unidades al combinarse con la Ag. A su vez la Ag, al pasar a ión ha subido en 3,155 unidades, y al pasar acetato de Ag, en 1,462 unidades. El cambio, entonces, de RE sufrido por el acetato, al pasar de radical a ión, se calcula multiplicando su variación al pasar a sal de Ag, por un factor igual a la relación entre el cambio de RE correspondiente al paso de Ag a Ag+, y de Ag a CH3COOAg. Es decir: ∆ RE = 0,274 3,155 = 0,591 1,462 La RE del ión acetato es entonces : 4,036 – 0,591 = 3,445. En forma general, se puede emplear las siguientes expresiones directas: a) Catión complejo: ∆ RE = - 4,99 (RE)s - (RE)r (RE)s - 5,75 b) Anión complejo : ∆ RE = 3,155 (RE)s - (RE)r (RE)s - 2,30 en que : ∆ RE = variación de la RE al pasar de radical neutro a ión complejo. (RE)s = RE de la sal de Ag (aniones) o del fluoruro (cationes) (RE)r = RE del radical neutro. 5,75 = Re del flúor 2,30 = RE de la plata 4,99 = variación de RE para el paso de F a F - . 3,155 = variación de RE para el paso de Ag a Ag + . Ejemplo j). Calcular la RE de los iones Zn(NH3) 4+2 y H2PO −4 , dadas las RE de los elementos : Zn = 2,84, N = 4,49, H = 3,55, P = 3,34, O = 5,21. Resp. Cálculo de las RE de los radicales neutros (RE)r: a) Zn(NH 2 ) 4 Zn : 0,4533 4 N : 2,6088 12 H : 6,6024 9.6645 : 17 = 0,5680 (RE)r = 3,70 b) H PO 4 2 2 H : 1,1004 P : 0,5237 4 O : 2,8672 4,4913 : 7 = 0,6416 (RE)r = 4,382 Cálculo de las (RE)s : a) Zn(NH 3 ) 4 F2 9,6645 2 F : 1,5194 11,1839 : 19 = 0,5884 (RE)s = 3,876 b) AgH 2 PO 4 4,4913 Ag : 0,3617 4,8530 : 8 = 0,6066 (RE)s = 4,042 Cálculo de las variaciones de RE : a) de Zn (NH 3 ) 4 a Zn (NH 3 ) 4−3 ∆ RE = - 4,99 3,876 - 3,70 = 0,47 3,876 - 5,75 b) de H 2 PO 4 a H 2 PO -4 : ∆ RE = 3,155 4,042 - 4,382 = - 0,615 4,042 - 2,30 La RE de los iones, es, en cada caso : a) Zn(NH 3 ) 4+ 2 RE = 3,70 + 0,47 = 4,17 b) H 2 PO −4 RE = 4,382 - 0,615 = 3,767 Probl. 33. Calcular la RE de los siguientes cationes: a) H 2 O + , b) NH 4+ , c) NO + . Las RE del N, O e H, son : 4,49, 5,21 y 3,55, respectivamente. Resp. a) 4,927, b) 4,481, c) 7,031. Pr obl. 34. Calcular la RE de los iones : a) BF4− , b) NO 3- , c) C 6 H 5 O - . Las RE del B, F y C, son respectivamente : 2,84, 5,75, 3,79 Resp. a) 4,079, b) 3,87, c) 3,453. Pr obl. 35. Calcular la RE de los cationes : a) CH 3+ , b) Co(NH 3 ) 5 H 2 O + + + , c) Bi(OH) 2+ , d) Co(NH 3 ) 5 OH + + Las RE del Bi y Co son: 3,14 y 2,50, respectivamente. Resp. a) 4,592, b) 4,24, c) 4,674, d) 4,09. Probl. 36. Calcular la RE de los siguientes aniones: a) SCN - , -2 b) NH 2− , c) SO -2 4 , d) SO 3 , e) ClO 4 RE : S = 4,11, Cl = 4,93. Resp. a) 2,725, b) 2,49, c) 3,13, d) 2,622, e) 4,224. Observaciones. Las variaciones de RE en los iones complejos presentan las mismas tendencias observadas en los iones simples y en las moléculas. Así: a) La RE es mayor con el aumento de la carga positiva. b) La RE es menor con el aumento de la carga negativa. c) La RE es mayor, mientras mayor sea el número de átomos muy electronegativos en el ión (comparar SO 3−2 con SO -24 ). Capítulo V APLICACIONES DE LAS ELECTRONEGATIVIDADES ENERGIAS DE ENLACE Y CALORES DE FORMACION Hemos visto ya, que, a partir de la relación: Xa - Xa = 0,18 ∆' y Q = 23 . n (Xa - Xa) 2 - 55,4 nN - 26 nO es posible calcular, en forma aproximada, las energías de enlace y el calor de formación de un compuesto binario. Mientras menor sea la diferencia de EN (mayor carácter covalente) los valores obtenidos se aproximan más a los experimentales. Las fórmulas indicadas sólo son aplicables a los enlaces simples y que no participan de formas resonantes . Las diferencias observadas, con respecto a los valores experimentales, en moléculas como benceno, sulfuro de carbono, etc., se atribuyen a la energía de resonancia, debido al carácter de enlace doble que pueden adoptar lo enlaces, simples y viceversa. Para calcular las energías de enlace de moléculas homcatómicas . Sanderson propone la relación: S = 11,8 (RE + 5,5) Rº - 5,6 en que E = energía de enlace, en Kcal/mol. Re = relación de estabilidad de la molécula Rº = longitud del enlace (doble del radio covalente). Ejemplo a) Calcular el calor de formación de: a) AlBr3 y b) PH3, dados las EN : Al = 1,5 Br = 2,8, P = 2,1, H = 2,1, en unidades Pauling Resp. Aplicando Q = 23 . n (X A - X B ) 2 - 55,4 nN - 26 nO, para cada caso, tenemos : a) AlBr3 : Q = 23 . 3 (2,8 - 1,5)2 = 116,6 Kcal/mol b) PH3 : Q = 23 . 3 (2,1 - 2,1)2 = 0,00 Kcal/mol Probl. 1. Dadas las EN : Sn = 1,8, I = 2,5 calcular el calor de formación del SnI2. Resp. 22,54 Kcal/mol. Ejemplo b) Calcular la energía de enlace de las moléculas: a) Na2, b) F2, dado los radios covalentes: Na = 1,54, F = 0,72 Å. Resp. Cálculo de las RE: a) Na : primer elemento entre Ne (D = 1,06) y Ar (D = 0,82): Di = 1,06 – 0,03 = 1,03 D = 0,24 . 11/ (1,54)3 = 0,72 RE = 0,72 / 1,03 = 0,70 b) F : séptimo elemento entre He (D = 0,59) y Ne: Di = 0,59 + 7 . 0,06 = 1,01 D = 0,24 . 9/ (0,72)3 = 5,75 RE = 5,75 / 1,01 = 5,75. Aplicando ahora la ecuación de Sanderson: a) Na 2 : E = 11,8 (0,70 + 5,5) 3,08 - 5,6 = 17,7 Kcal/mol. b) F2 : E = 11,8 (5,75 + 5,5) 1,44 - 5,6 = 86,6 Kcal/mol. Nota. Los valores experimentales son: Na = 17,3, F = 36,6. Este último valor es anormalmente bajo, con respecto al calculado. Efectivamente, debido a su pequeño tamaño el F debería presentar la mayor energía de enlace dentro de los halógenos, lo que no sucede así. No se ha hallado aún una razón de peso que explique la baja electroafinidad y pequeña energía de enlace del flúor, con respecto a los otros halógenos. Probl. 2. Calcular las energías de enlace de las moléculas de Cl2, Br2, I2, dados los radios: Cl = 0,99, Br = 1,14, I = 1,33 Å. Resp. Cl2 = 55,8, Br2 = 46,0, I2 = 36,8 Kcal/mol. Probl. 3. A partir de la energía del enlace Si - Si, en la molécula Sin = 37,5 Kcal, y de la EN del Si, en la escala Pauling = 1,8, calcular la longitud del enlace Si – Si. Resp. 2,24 Å. CARÁCTER IONICO PARCIAL DE LOS ENLACES COVALENTES El carácter iónico de un enlace depende directamente de la diferencia de EN de los átomos enlazados. Una de las ecuaciones más simples que relaciona estas propiedades es: P = 18 (X A - X B )1,4 en que P es el porcentaje iónico del enlace. Otra relación sencilla es: P = 16 (XA - XB) + 3,5 (XA - XB)2 El carácter iónico parcial de un enlace puede evaluarse también a partir del momento dipolar de este enlace. Para un enlace 100% iónico el momento dipolar viene dado por : u = e . d en que: u = momento dipolar (en Debye, 1 Debye = 10-1º u.e.s . cm) e = carga elemental de electricidad: 4,8 . 10-10 u.e.s d = longitud del enlace (en cm). El cuociente entre el valor experimental y el teórico (correspondiente a 100% iónico), es la fracción iónica del enlace, es decir: P = 100 µE µT El porcentaje iónico de un enlace, calculado a partir de las diferencias de EN, permite calcular, a su vez, el momento dipolar aproximado de este enlace. Conocido éste, el momento dipolar de una molécula viene a ser la suma vectorial de los momentos de enlace, lo que se verifica mediante la ecuación: µ 2 = µ12 + µ 22 + 2 µ1 µ 2 cos φ donde u es la resultante de dos momento de grupo o de enlace, que forman un ángulo φ entre sí. Es posible, por supuesto, determinar el ángulo de enlace, conociendo el momento dipolar de la molécula o grupo y el de cada enlace individual. Ejemplo c) Calcular los momentos dipolares de los ácidos HCl, HBr, y HI, dados los radios: H = 0,3, Cl = 0,99, Br = 1,14, I = 1,33 Å y las EN : H = 2,1, Cl = 3,0, Br = 2,8, I = 2,5. Resp. Cálculo del u teórico: a) HCl u = 4,8 . 10-10 . 1,29 . 10-8 = 6,2 D b) HBr u = 4,8 . 10-10 . 1,44 . 10-8 = 6,9 D c) HI u = 4,8 . 10-10 . 1,63 . 10-8 = 7,8 D Cálculo del porcentaje iónico de los enlaces: a) HCl P = 18 ( 3 - 2,1)1,4 = 15,3 % b) HBr P = 18 ( 2,8 - 2,1)1,4 = 11,0% c) HI P = 18 (2,5 - 2,1)1,4 = 4,97% El momento dipolar real es, en cada caso: a) HCl : 6,2 . 0,153 = 0,95 D b) HBr : 6,9 . 0,11 = 0,76 D c) HI : 7,8 . 0,0497 = 0,39 D Probl. 4. Calcular los momentos dipolares de los enlaces : a) P - Cl, b) Si - F, dados los radios covalentes: P = 1,06 Å, Si = 1,11 Å, Cl = 0,99 Å, F = 0,72 Å, y sus EN en unidades Pauling: Si = 1,8, F = 4,0, Cl = 3,0, P = 2,1. Resp. a) 1,52 D, b) 4,74 D. Probl. 5. El momento dipolar del enlace C – F es 2,3 D. El radio del C es 0,77 Å y del F es 0,72 Å. La EN del F es 4. Calcular: a) Porcentaje iónico del enlace C – F b) Electronegatividad del C c) Calor de formación del CF4 Resp. a) 32%, b) 2,5 c) 207 Kcal/mol. Probl. 6. El momento dipolar del enlace As – Cl es 2,06 D. Los radios del As y Cl son, respectivamente: 1,21 y 0,99 Å. Calcular : a) Porcentaje iónico del enlace As – Cl; b) Calor de formación del AsCl. Resp. a) 19,5%, b) 77,8 Kcal/mol. Ejemplo d) Calcular el ángulo de enlace del H2O, si el momento dipolar de la molécula es 1,84 D, el radio del H es 0,3 Å y el del 0 es 0,74 Å. EN: H = 2,1, O = 3,5. Resp. Cálculo del momento dipolar del enlace O – H : u teórico = 4,8 . 1,04 = 5,0 D % iónico = 18 (3,5 - 2,1)1,4 = 29% u real = 5 . 0,29 = 1,45 D. A partir de u 2 = u12 + u 22 + 2 u1 u 2 cos φ y como en este caso u1 = u2 tenemos : u 2 = 2 u12 ( 1 + cos φ ) reemplazando : (1,84) 2 = 2 (1,45) 2 (1 + cos φ ) de donde : 1 + cos φ = 3,386/4,20 = 0,806 cos φ = 0,806 - 1 = - 0,194 como : cos (180 - φ ) = - cos φ cos (180 - φ = 78º 50' φ = 101º 10' Nota.- El valor experimental es 104º 40: Probl. 7. El momento dipolar del enlace P – Cl es 1,52 D. El radio del P es 1,06 y el del Cl es 0,99 Å. Calcular: a) Porcentaje iónico del enlace P – Cl b) Calor de formación del PCl3. Resp. a) 15,4%, b) 55,2 Kcal/mol. Probl. 8. Calcular el momento dipolar del meta dinitro benceno. El momento del grupo – NO2 es 3,9 D, y el del enlace C – H se puede suponer igual a 0. Resp. 3,89 D. Probl. 9. El ángulo de enlace del H2S es 98º. Calcular el momento dipolar de esta molécula dados: radios: H = 0,3, S = 1,04 Å. EN : H = 2,1, S = 2,5. Resp. 0,42 D. CARGA IONICA PARCIAL, SEGÚN LA ESCALA DE SANDERSON Las relaciones de estabilidad permiten el cálculo de las cargas iónicas parciales de los átomos en un compuesto, obteniéndose valores un tanto diferentes a los obtenidos por Pauling, pero que, en todo caso, reflejan mejor las propiedades de los compuestos. La carga parcial de un átomo, en una molécula o ión complejo, viene dada por: ∂E= (RE )m - (RE)E 2,08 ∂E = carga iónica parcial en que (RE)E (RE)m = RE de la molécula o ión complejo. (RE)E = RE del elemento en cuestión. Las cargas iónicas obtenidas por el método de Sanderson, permiten la evaluación de momentos dipolares con un error máximo de 15%. Ejemplo e) Calcular la carga iónica parcial de cada átomo, en los compuestos: a) NH4Cl, b) BrO 3- . Las RE son : N = 4,49, H = 3,55, Cl = 4,93, Br = 4,53, O = 5,21. Resp. Cálculo de las (RE) m: a) NH 4 Cl LL N : 0,6522 4 H : 2,2008 Cl : 0,6928 3,5458 : 6 = 0,5909 (RE)m = 3,90 b) BrO 3- LL Br : 0,6561 3 O : 2,1504 AgBrO3 LL 2,8065 : 4 = 0,7016 (RE)r = 5,03 2,8065 Ag : 0,3617 3,1682 : 5 = 0,6336 (RE)s = 4,30 4,3 - 5,03 ∆ RE = 3,155 = - 1,15 (RE)m = 5,03 - 1,15 = 3,88 4,3 - 2,3 Cálculo de las cargas iónicas: a) NH 4 Cl LLL ∂ N = ∂H = ∂ Cl = 3,90 - 4,49 2,08 4,49 3,90 - 3,55 2,08 3,55 3,90 - 4,93 2,08 4,93 = - 0,13 = + 0,088 = - 0,22 Comprobación : - 0.13 + 4 . 0,088 - 0,22 = 0,0 3,88 - 4,53 = - 0,146 b) BrO 3− LLL ∂Br = 2,08 4,53 ∂O = 3,88 - 5,21 2,08 5,21 = - 0,28 Comprobación: -0,146 – 3 . 0,28 = - 0,99 (aprox.- 1,0) Probl. 10. Calcular la carga iónica sobre cada uno de los átomos en los siguientes compuestos: a) SOF2 , b) Al(CH 3 ) 3 , c) Be(H 2 O) 4+2 , d) PO -34 ). Las RE de los átomos son: S = 4,11, O = 5,21, F = 5,75, Al = 1,94, C = 3,79, H = 3,55, Be = 1,91, P = 3,34. Resp. a) S = + 0,25, O = - 0,015, F = - 0,118 b) Al = + 0,512, C = - 0,087, H = - 0,028 c) Be = + 0,87, H = + 0,22, O = - 0,17 d) P = - 0,33, O = - 0,66. Ejemplo f). Calcular, por el procedimiento de Sander son, los momentos dipolares de las moléculas HCl y HBr. Radios: H = 0,30, Br = 1,14, Cl = 0,99 Å. Las RE son: H = 3,55, Br = 4,53, Cl = 4,93. Resp. Cálculo del u teórico: a) HBr = 4,8 . 1,45 = 6,96 D b) HCl = 4,8 . 1,30 = 6,24 D Cálculo de las (RE)m y de la carga iónica parcial: a) HBr L H : 0,5502 Br : 0,6561 ∂BR = 1,2063 : 2 = 0,6032 (RE)m = 4,01 4,01 - 4,53 = - 0,117 ∂H = + 0,117 4,43 b) HCl LL H : 0,5502 Cl : 0,6928 1,2430 : 2 = 0,6215 (RE)m = 4,18 4,18 - 4,93 ∂cl = = - 0,16 ∂H = + 0,16 4,62 Cálculo del u real: a) HBr = 6,96 . 0,117 = 0,81 D b) HCl = 6,24 . 0,16 = 1,00 D Probl. 11. Calcular el momento dipolar de las moléculas: a) LiBr, b) CsCl, c) LiI. Longitudes de enlace : LiBr = 2,17, CsCl = 2,91, LiI = 2,39 Å , Re : Li = 0,74, Br = 4,53, Cs = 0,49, Cl = 4,93, I = 3,84. Resp. a) 6,24 D, b) 10,06 D, c) 5,97 D. Probl. 12. Calcular el momento dipolar de las mismas moléculas del Probl. 11, empleando el método le Pauling. EN: Li = 1,0, Br = 2,8, Cs = 0,7, Cl = 3,0, I = 2,5. Resp. a) 4,25 D, d) 8,1 D, c) 3,72 D. Observaciones. Los valores experimentales de los momentos dipolares de las moléculas HBr, HCl, LiBr, CsCl y LiI, son respectivamente: 0,80, 1,0, 6,3, 10,4 y 6,6 D. Se puede apreciar la gran aproximación que presenta el método de las relaciones de estabilidad para la evaluación de las cargas iónicas. Así, por ejemplo el % iónico calculado para el CsCl es, según Pauling, 58%, y según el procedimiento de Sanderson es 72%. Intuitivamente, este último valor parece más razonable, de acuerdo a las propiedades del compuesto. APLICACIONES DE LAS CARGAS PARCIALES Estabilidad de compuestos y iones. La estabilidad de una molécula o ión complejo es función directa de las cargas parciales de los átomos constituyentes. Así, una elevada concentración de la carga sobre un átomo, redunda en una mayor inestabilidad del conjunto. Por otra parte, no existen, o son muy inestables, aquellos compuestos o iones que poseen átomos adyacentes con cargas del mismo signo, debido, precisamente, a la repulsión coulombiana. Ejemplo g) Ordene el siguiente grupo de iones hidratados, de acuerdo a su estabilidad decreciente: Al(H 2 O) 6+3 , Si(H 2 O) +44 , Ca(H 2 O) 4+2 , Pb(H 2 O) 4+4 . Indique además, cuál o cuáles de éstos no deben tener existencia real. Las RE son : Al = 1,94, H = 3,55, O = 5,21, Si = 2,62, Ca = 1,22, Pb = 3,06. Resp. Cálculo de las (RE)m: a) Al(H 2 O) 6 Al : 0,2878 6 H 2 O :10,9032 11,1910 : 19 = 0,5890 (RE)r = 3,88 Al(H 2 O) 6 F3 11,1910 3F : 2,2791 13,4701 : 22 = 0,6122 (RE)s = 4,10 ∆ RE = - 4,99 b) Si(H 2 O) 4 4,10 - 3,88 = 0,66 (RE)m = 3,88 + 0,66 = 4,54 4,10 - 5,75 Si : 0,4183 4 H 2 O : 7,2688 7,6871 : 13 = 0,5913 (RE)r = 3,91 Si(H 2 O) 4 F4 7,6871 4 F : 3,0388 10,7258 : 17 = 0.6309 (RE)s = 4,28 ∆ RE = - 4,99 4,28 - 3,91 = 1,25 (RE)m = 3,91 + 1,25 = 5,16 4,28 - 5,75 c) Ca(H 2 O) 4 Ca : 0,0864 4 H 2 O : 7,2688 7,3552 : 13 = 0,5658 (RE)r = 3,68 Ca(H 2 O) 4 F2 7,3552 2 F : 1,5194 8,8756 : 15 = 0,5916 (RE)s = 3,91 ∆ RE = - 4,99 3,91 - 3,68 = 0,62 (RE)m = 3,68 + 0,62 = 4,30 3,91 - 5,75 Pb : 0,4886 d) Pb(H 2 O) 4 4 H 2 O : 7,2688 7,7574 : 13 = 0.5967 Pb (H 2 O) 4 F4 (RE)r = 3,95 7,7574 4 F : 3,0388 10,7962 : 17 = 0,6350 (RE)s = 4,31 ∆ RE = - 4,99 4,31 - 3,95 = 1,25 (RE)m = 3,95 + 1,25 = 5,20 4,31 - 5,75 Cálculo de las cargas iónicas parciales : 4,54 - 1,94 = + 0,90 2,9 5,54 - 5,21 ∂o = = - 0,14 4,75 4,54 - 3,55 ∂H = = + 0,25 3,92 5,16 - 2,62 : ∂ si = = + 0,75 3,37 a) Al(H 2 O) 6+3 : ∂ Al = b) Si(H 2 O) 4+ 4 ∂o = 5,16 - 5,21 = - 0,01 4,75 ∂H = 5,16 - 3,55 = + 0,41 3,92 c) Ca(H 2 O 4 ) + 24 : ∂ ca = 4,30 - 1,22 = + 1,34 2,30 ∂o = 4,30 - 5,21 = - 0,19 4,75 ∂H = 4,30 - 3,55 = + 0,18 3,92 d) Pb (H 2 O) +4 4 : ∂ Pb = 5,2 - 3,08 = + 0,58 3,64 ∂O = 5,2 - 5,21 = 4,75 ∂H = 5,2 - 3,55 = + 0,43 3,92 0,00 H Conclusión. En todos estos iones, el enlace es del tipo M+n O .Mientras más positiva H sea la suma algebraica de los valores de las cargas iónicas parciales del H y del O, mayor es la inestabilidad del compuesto, debido a la mayor repulsión electrostática entre el catión central, positivo, y los átomos de H. Esto se traduce en un aumento de la acidez, ya que el protón se entrega con relativa facilidad, debido a la inestabilidad del enlace O – H. Los en los cationes considerados es: valores de la suma ∂o + ∂H, Ca(H 2 O) +42 : - 0,01, Al(H 2 O) 6+3 : + 0,11, Si(H 2 O) 4+4 : + 0,40, Pb(H 2 O) 4+4 : + 0,43. Los dos últimos no deben tener existencia real en disolución; la repulsión de los protones por el catión central es demasiado pronunciada, perdiéndose estos protones y formándose el compuesto hiroxilado correspondiente, insoluble: Si(H 2 O) +44 → Si(OH) 4 + 4 H + ac. orto silícico (SiO 2 2H 2 O). Pb(H 2 O) +4 4 → Pb(OH) 4 + 4 H + dióxido de Pb hidratado (PbO 2 . 2H 2 O) Probl. 13. Calcular las cargas parciales de cada uno de los átomos, en los siguientes complejos animados, y establecer su orden de estabilidad: + +3 +3 + a) Zn(NH 3 ) 4 , b) Al(NH 3 ) 6 , c) Fe(NH 3 ) 6 , d) Ag(NH 3 ) 2 . RE : Zn = 2,84, N = 4,49, Fe = 2,35, Ag = 2,30. Resp. a) ∂zn = + 0,38, ∂N = - 0,075, ∂H = + 0,16, b) ∂Al = + 0,76, ∂N = - 0,073, ∂H = + 0,15, c) ∂Fe = + 0,58, ∂N = - 0,075, ∂H = + 0,16, d) ∂Ag = + 0,54, ∂N = - 0,10, ∂H = + 0,10. La mejor distribución de las cargas las encontramos en el complejo de Ag, que es precisamente el más estable de los cuatro. Le sigue el Zn(NH 3 ) +42 , y por último, con estabilidades análogas, el Al(NH 3 ) 6+3 y Fe(NH 3 ) 6+3 . Probl. 14. Ordenar los oxihaluros de S (IV), (haluros de tionilo) : a) SOF2, b) SOCl2, c) SOBr2, d) SOI2, de acuerdo a sus estabilidades decrecientes. ¿Cuál de ellos no debe tener existencia real? RE: S = 4,11, O = 5,21, F = 5,75, Cl = 4,93, Br = 4,53, I = 3,84. Resp. Cargas parciales: a) b) c) d) S S S S = = = = + + + + 0,25, 0,16, 0,11, 0,03, O O O O = = = = - 0,01, 0,09, 0,13, 0,21, F Cl Br I = = = = - 0,12 - 0,03 + 0,01 + 0,09 La estabilidad decrece desde el fluoruro al yoduro. El SOBr2 debe ser muy inestable y el SOI2 no debe existir (cargas vecinas del mismo signo). Probl. 15. Ordene los siguientes cationes de acuerdo a su estabilidad decreciente: a) NH , b) PH +4 , c) AsH +4 , d) SbH +4 ¿Cuál o cuáles no deben tener existencia real?. + 4 Las RE son : P = 3,34, As = 3,91, Sb = 3,37. Resp. Cargas parciales : a) b) c) d) N = 0,00, P = + 0,27, As = + 0,12, Sb = + 0,24, H H H H = = = = + + + + 0,25 0,18 0,22 0,19 Sólo existe el catión NH +4 , ya que los otros presentan cargas vecinas del mismo signo. Probl. 16. Ordene los oxihaluros de P (V) de acuerdo a su estabilidad. ¿Cuál de ellos no debe existir?. Resp. Cargas parciales: POF3 …………… P = + 0,45, POCl3 …………… P = + 0,33, POBr3 …………… P = + 0,27, POI3 …………… P = + 0,16, F Cl Br I = = = = - 0,14 - 0,07 - 0,03 + 0,03 El POI3 no debe tener existencia real. Observaciones.- En relación al probl. 14, acerca de la estabilidad de los haluros de tionilo, algunas constantes físicas son las siguientes: SOF2 SOCl2 SOBr2 Punto de fusión - 110ºC - 104,5ºC - 50,0ºC Punto de ebullición - 30ºC 78,8ºC 68,0ºC SOI2 (compuesto desconocido) (se descompone a 80ºC (A 40 mm. A la presión de 1 átm. se descompone a 25ºC). La no existencia del SOI2 y la baja estabilidad del SOBr2, son consecuencia directa del efecto de las cargas parciales del mismo signo, entre el átomo central de S y el halógeno. De la misma manera, en relación al probl. 15, podemos indicar que no son conocidas las sales de los cationes AsH +4 y SbH +4 Del PH +4 se han obtenido algunos haluros, sumamente inestables. Las sales de amonio, por su parte, son bastante conocidas y de relativa estabilidad (descomposición a elevada temperatura). De los oxihaluros de P (V), probl. 16, podemos observar las siguientes constantes físicas: POF3 POCl3 POBr3 POI3 Punto de fusión - 68ºC 1,17ºC 56ºC (compuesto desconocido) Punto de ebullición - 40ºC 107,2ºC 189,5ºC El POI3 no tiene existencia real, en tanto que se conocen los otros tres, bastante estables, siendo el POF3 el más estable. Carácter ácido y básico de iones y moléculas. La fuerza de los ácidos y bases se relaciona perfectamente con las cargas parciales de los átomos. Mientras más negativa sea la carga sobre un átomo, poseedor de un par electrónico no compartido (base de Lewis), mayor es el carácter básico del compuesto que lo presenta, y viceversa. A su vez, mientras más positiva sea la suma algebraica de las cargas parciales de los átomos de O y de H de un oxiácido, o catión hidratado, mayor será la fuerza del ácido. Por otra parte, para los hidróxidos metálicos, el carácter básico es mayor mientras más negativas sea la suma algebraica de las cargas parciales sobre los átomos de O e H. En los aniones el carácter básico aumenta con el aumento de la carga parcial negativa sobre los átomos de O. Para lo hidrácidos, por último, la comparación de las fuerzas relativas debe efectuarse considerando la distancia interatómica H – X, así como la carga parcial, de acuerdo a la ley de Coulomb: F = q1, q2/r2, en que q1 y q2 son las cargas iónicas parciales, y r la distancia interatómica. Mientras mayor sean las cargas iónicas y menor el radio del no metal, mayor es la fuerza de atracción entre el no metal y el H, y, por lo tanto, más débil es el ácido. Ejemplo h) Ordenar los oxiácidos del Cl de acuerdo a sus fuerzas relativas. RE del Cl = 4,93. Resp. Cálculo de las (RE)m: a) HClO 2 : H : 0,5502 Cl : 0,6928 O : 0,7168 1,9698 : 3 = 0,6563 (RE)m = 4,53 b) HClO 2 : 1,9698 0,7168 2,6866 : 4 = 0,6716 (RE)m = 4,70 c) HClO 3 : 2,6866 0,7168 3,4034 : 5 = 0,6807 (RE)m = 4,80 d) HClO 4 : 3,4034 0,7168 4,1202 : 6 = 0,6867 (RE)m = 4,86 Cargas parciales del O y del H: a) HClO : O = 4,53 - 5,21 4,53 - 3,55 = - 0,14 ; H = = + 0,25 4,75 3,92 b) HClO 2 : O = 4,70 - 3,55 4,70 - 5,21 = - 0,10 ; H = = + 0,30 3,92 4,75 c) HClO 3 : O = 4,80 - 5,21 4,80 - 3,55 = - 0,08 ; H = = + 0,32 4,75 3,92 d) HClO 4 : O = 4,86 - 5,21 4,86 - 3,55 = - 0,07 ; H = = + 0,33 4,75 3,92 La suma de las cargas parciales es, en cada caso: HClO : HClO 2 : - 0,14 + 0,25 = + 0,11 - 0,10 + 0,30 = + 0,20 HClO 3 : - 0,08 + 0,32 = + 0,24 HClO 4 : - 0,07 + 0,33 = + 0,26 La fuerza aumenta desde el HClO hasta el HClO4. Nota. Los valores experimentales de las constantes de acidez son: HClO = 3,7 . 10 -8 HClO 2 = 1,0 . 10 -2 HClO 3 = aprox. 10 5 HClO 4 = aprox. 10 9 Ejemplo i) Ordenar los hidrácidos de los halógenos de acuerdo a su acidez. Distancias interatómicas : HF = 1,03, HCl = 1,30, HBr = 1,45, HI = 1,64 Å. Resp. Cálculo de las (RE)m: a) HF H : 0,5502 F : 0,7597 1,3099 : 2 = 0,6549 b) HCl (RE)m = 4,52 H : 0,5502 Cl : 0,6928 1,2430 : 2 = 0,6215 c) HBr (RE)m = 4,18 H : 0,5502 Br : 0,6561 1,2063 : 2 = 0,6031 d) HI (RE)m = 4,01 H : 0,5502 I : 0,5843 1, 1345 : 2 = 0,5672 (RE)m = 3,69 Cálculo de las cargas iónicas parciales: a) HF : F = 4,52 - 5,75 = - 0,25 ; H = + 0,25 4,99 b) HCl : Cl = 4,18 - 4,93 = - 0,16 ; H = + 0,16 4,62 c) HBr : Br = 4,01 - 4,53 = - 0,12 ; H = + 0,12 4,43 d) HI : I = 3,69 - 3,84 = - 0,04 ; 4,08 H = + 0,04 Cálculo de la fuerza de atracción coulombiana: a) HF : F = (0,25) 2 /(1,03) 2 = 0,059 b) HCl : F = (0,16) 2 /(1,30) 2 = 0,0116 c) HBr : F = (0,12) 2 /(1,45) 2 = 0,007 d) HI : F = (0,04) 2 /(1,64) 2 = 0,0006 La fuerza de atracción entre el halógeno y el H, es considerablemente menor en el HI, con respecto a los otros hidrácidos, lo que se traduce en una mayor acidez. La fuerza de los haluros de H, como ácidos, aumenta desde el HF hasta el HI. Las constantes experimentales son : HF = 10-4, HCl = 107, HBr = 10º, HI = 1010. Probl. 17. Ordenar los siguientes cuerpos de acuerdo a su basicidad: a) ClO-, b) c) IO-. Las RE son : Cl = 4,93, O = 5,21, Br = 4,53, I = 3,84. Resp. Cargas parciales sobre el O : a) - 0,52, b) - 0,55, c) - 0,62. El IO- es el más básico; le siguen el BrO- y el ClO- , en ese orden. BrO-, Probl. 18. Ordenar los siguientes alcoholes, de acuerdo a su carácter básico: a) CH3OH, b) C2H5OH, c) C3H7OH, RE del C = 3,79. Resp. Cargas parciales sobre el O : a) – 0,29, b) - 0,30, c) – 0,31. El carácter básico aumenta ligeramente desde el metanol hasta el propanol. Probl. 19. Ordenar los siguientes óxidos de acuerdo a su acidez : a) CO2, b) SO2, c) SiO2, d) SeO2, e) TeO2. Las RE son: C = 3,79, O = 5,21, S = 4,11, Si = 4,25, Se = 4,25, Te = 3,62. Resp. Cargas parciales sobre el O : a) -0,11, b) - 0,08, c) – 0,225, d) - 0,07, e) – 0,13. La acidez aumenta en el orden : SiO2, TeO2, CO2, CO2, SO2, SeO2. Probl. 20. Ordenar los siguientes pentóxidos de acuerdo a su acidez: a) N2O5, b) P2O5, c) As2O5, d) Sb2O5, e) Bi2O5. La RE son : N = 4,49, P = 3,34, As = 3,91, Sb = 3,37, Bi = 3,16. Resp. Cargas parciales sobre el O : a) – 0,046, b) - 0,13, c) - 0,085, d) - 0,13, e) - 0,15. La acidez aumenta en el orden Bi2O5, Sb2O5, P2O5, As2O5, N2O5. Ejemplo j) Ordene los siguientes óxidos metálicos, según su carácter básico: a) PbO2, b) Al2O3, c) Na2O, d) Ag2O, e) ZnO, f) BaO, g) CrO3. Las RE son : O = 5,21, Al = 1,94, Pb = 3,08, Na = 0,70, Ag = 2,30, Zn = 2,84, Ba = 1.02, Cr = 2,40. Resp. Cálculo de las (RE)m: a) PbO 2 b) Al 2 O 3 Pb : 0,4886 2 O: 1,4336 1,9222 : 3 = 0,6407 2 Al : 0,5756 3O: c) Na 2 O (RE)m = 4,37 2,1504 2,7260 : 5 = 0,5452 2 Na : - 0,3098 (RE)m = 3,51 O : 0,7168 d) Ag 2 O 0,4070 : 3 = 0,1357 2 Ag : 0,7234 (RE)m = 1,37 O : 0,7168 (RE)m = 3,02 e) ZnO 1,4402 : 3 = 0,4800 Zn = 0,4533 O = 0,7168 (RE)m = 3,85 f) BaO 1,1701 : 2 = 0,5850 Ba : 0,0086 O : 0,7168 : 2 = 0,3627 (RE)m = 2,30 : 4 = 0,6327 (RE)m = 4,29 g) CrO 3 0,7254 Cr : 0,3802 3 O : 2,1504 2,5306 Cálculo de las cargas iónicas parciales: a) PbO 2 : b) Al 2 O 3 : c) Na 2 O : d) Ag 2 O : 4,37 - 3,08 3,64 3,51 - 1,94 Al = 2,90 1,37 - 0,70 Na = 1,74 3,02 - 2,30 Ag = 3,155 Pb = = + 0,36 ; O = - 0,18 = + 0,52 ; O = - 0,35 = + 0,40 ; O = - 0,80 = + 0,125 ; O = - 0,25 e) ZnO : f) BaO : g) CrO 3 : 3,85 - 2,84 = + 0,28 ; O = - 0,28 3,50 2,30 - 1,02 = + 0,60 ; O = - 0,60 Ba = 2,10 4,29 - 2,40 = + 0,57 ; O = - 0,19 Cr = 3,20 Zn = Siendo la mayoría de estos óxidos, de fórmula global diferente, la comparación del carácter básico no puede efectuarse, como en los casos anteriores, considerando sólo la carga parcial sobre el O. Un procedimiento de comparación bastante razonable, es multiplicar el número de átomos de O del óxido por un factor tal que la relación entre el Nº de átomos de metal y de O sea 1 : 1. Las cargas parciales, multiplicadas por ese factor, son ahora, perfectamente comparables: a) PbO 2 : - 0,18 . 1/2 = - 0,09 b) Al 2 O 3 : - 0,35 . 2/3 = - 0,23 c) Na 2 O : - 0,80 . 2 = - 1,6 d) Ag 2 O : - 0,25 . 2 = - 0,50 e) ZnO : f) BaO : g) CrO 3 : - 0,28 . 1 = - 0,28 - 0,60 . 1 = - 0,60 - 0,19 . 1/3 = - 0,063 El orden de basicidad es, de mayor a menor : Na2O, BaO, Ag2O, ZnO, Al2O3, PbO2, CrO3. Los tres primeros son francamente básicos, el ZnO y Al2O3 presentan características intermedias (anfoterismo), y los dos últimos son más bien ácidos. Probl. 21. Ordene los siguientes hidróxidos de acuerdo a su carácter básico: a) Ca(OH)2, b) KOH, c) Cu(OH)2, d) Al(OH)3, e) Si(OH)4. Las RE son: Ca = 1,22 K = 0,56, Cu = 2,43, Al = 1,94, Si = 2,62. Resp. Suma de las cargas parciales sobre el O e H: a) – 0,45, b) – 0,94, c) – 0,222, d) – 0,22, e) – 0,12. El carácter básico es, mayor a menor: KOH, Ca(OH)2, Cu(OH)2, Al (OH)3, Si(OH)4. Probl. 22. Ordene los siguientes cationes hidratados, de acuerdo a su acidez decreciente: a) Co(H 2 O) 6+3 , b) Sn(H 2 O) +44 , c) Sn(H 2 O) +42 , d) Mg(H 2 O) +42 , e) Li(H 2 O) +4 , f) I(H 2 O) +43 . Las RE son : Co = 2,50, Sn = 3,10, Mg = 1,56, Li = 0,74, I = 3,84. Resp. Suma de las cargas parciales sobre el O e H : a) + 0,13, b) + 0,43, c) + 0,16, d) + 0,05, e) - 0,21, f) + 0,29. La acidez decrece en el orden : Sn(H 2 O) +44 , I(H 2 O) +43 , Sn(H 2 O) +42 , Co(H 2 O) 6+3 , Mg(H 2 O) +42 , Li(H 2 O) +4 . Probl. 23. Ordenar los siguientes cuerpos de acuerdo a su carácter básico: a) N(CH3)3, b) P(CH3)3, c) As(CH3)3. Las RE son : N = 4,49, C = 3,79, P = 3,34, As = 3,91. Resp. Carga parcial sobre el N = - 0,19, P = - 0,04, As = - 0,07. La basicidad disminuye es el orden ; N(CH3)3, As(CH3)3, P(CH3)3. Probl. 24. Empleando el procedimiento de las cargas parciales, indique cuál es el más ácido entre los siguientes pares: a) HNO2 y HNO3, b) H3PO3 y H3PO4, c) H2SO3 y H2SO4, d) HAsO2 y H3AsO4. Resp. En todos los casos, el segundo es el más ácido. Probl. 25. Demuestre que el carácter ácido de los hídridos de la familia del O, aumenta en la serie : H2O, H2S, H2Se, H2Te. Las RE son : S = 4,11, Se = 4,25, Te = 3,62. LONGITUDES DE ENALCE. A medida que aumenta la diferencia de EN (mayor polaridad del enlace), hay una mayor contracción en la longitud de un enlace, con respecto al valor esperado. Así, para una diferencia de EN igual a 0 (moléculas homoatómicas, o constituídas por átomos muy semejantes), la distancia interatómica se corresponde exactamente con la suma de los radios covalentes. Para los enlaces entre átomos de diferentes EN, la longitud del enlace viene dada por : R = RA + RB - 0,09 (XA - XB ) Fórmula de Shoemaker – Stevenson en que : R = distancia interatómica RA y RB = radios covalentes XA - XB = diferencia de EN, en la escala Pauling. M. Huggins propuso una relación sencilla, entre la longitud de un enlace, su energía y unas constantes, llamadas “radios de energía constante”, tiene valores, por lo general, alrededor de 0,4 Å mayores que el radio covalente: R = R 'A + R 'B - 1/2 log E AB en que : R = distancia interatómica R 'A y R 'B = radios de energía constante para el átomo B y el átomo A. E AB = energía del enlace A - B, en Kcal. Por su parte, Sanderson, ha deducido una expresión que permite calcular el radio de un átomo en un compuesto determinado, en función de las RE de la molécula y de la Di del elemento en cuestión: R = 3 Z 4,19 (RE)m Di Conocida la distancia interatómica de un enlace, y la carga parcial sobre los átomos enlazados, es posible evaluar, en forma bastante aproximada, la energía de un enlace heteroatómico: 11,8 [(RE)m + 5,5] 339 q 2 E = - 5,6 + R R 2 330 q en que es el factor de corrección debido a la polaridad del enlace R q = carga iónica parcial R = longitud del enlace. Las longitudes de enlace, calculadas a partir de las (RE)m, deben ser corregidas, multiplicándolas por un factor que depende del orden del enlace (doble, triple, simple) y de los enlaces vecinos presentes en la molécula en estudio. Estos factores de corrección son : Factor 1,000 Tipo de enlace Enlaces simples, excepto los indicados abajo. 0,962 Enlaces simples vecinos a enlaces dobles Ej. C – Cl en el COCl2. Enlaces simples de F, O, Cl o N, con elementos muy electronegativos Ej. Br – O, N – S, Cl – F, etc. 0,923 Enlaces simples entre los dos enlaces olefínicos: Ej.: C – C, en H2C = CH – CH = CH2. Enlaces simples vecinos a triples, Ej.: C – C en HC ≡ C – CH3. 0,885 Enlaces C – C en anillos aromáticos. Enlaces C = S. Enlaces simples, entre dos triples. Ej. : C – C en HC ≡ C - C ≡ CH. 0,845 Dobles enlaces olefínicos. Enlaces S = O y Se = O en óxido u oxihaluros Ej.: SOCl2, SO3. 0,770 Enlaces triples C ≡ C y C ≡ N. Todos los enlaces carbonílicos (C = O). Enlace N = O. Ejemplo k) Calcular la longitud de enlace S – X, en los haluros de tionilo, según el método de: a) Shoemaker – Stevenson, b) Huggins, c) Sanderson. Datos. EN : S = 2,5, F = 4,0, Cl = 3,0, Br = 2,8. Radios covalentes: S = 1,04, F = 0,72, Cl = 0,99, Br = 1,14. Radios de energía constante: S = 1,46, F = 1,11, Cl = 1,44, Br = 1,56. RE : S = 4,11, F = 5,75, Cl = 4,93, Br = 4,53 Di : S = 0,88, F = 1,00, Cl = 0,85, Br = 1,24. Energías de enlace: S – F = 71, S – Cl = 59,7, S – Br = 50,7 Kcal. Resp. A) relación de Shoemaker – Stevenson: S - F S - Cl S - Br R = 1.04 + 0,72 - 0,09 (4 - 2,5) = 1,625 Å R = 1,04 + 0,99 - 0,09 (3 - 2,5) = 1,985 Å R = 1.04 + 1,14 - 0,09 (2,8 - 2,5) = 2,153 Å B) Método de Huggins: S - F S - Cl S - Br R = 1,46 + 1,11 - ½ log 71 = 1,645 Å R = 1,46 + 1,44 - ½ log 59,7 = 2,012 Å R = 1,46 + 1,56 - ½ log 50,7 = 2,168 Å C) Método de Sanderson: Cálculo de las (RE)m : SOF2 LL S : 0,6138 O : 0,7168 2 F : 1,5194 2,8500 : 4 = 0,7125 SOCl 2 LL S : 0,6138 ( RE )m = 5,16 O : 0,7168 2 Cl : 1,3856 2,7162 : 4 = 0,6790 SOBr2 LL S : 0,6138 ( RE )m = 4,78 O : 0,7168 2 Br : 1,3122 2,6428 : 4 = 0,6607 ( RE )m = 4,58 Cálculo de los radios de enlace del S y del halógeno en cada compuesto: SOF2 Rs = 3 RF = 3 16 = 4,19 . 5,16 . 0,88 3 0,84 = 0,943 9 = 3 0,41 = 0,745 4,19 . 5,16 . 1,00 Para el enlace S – F, hay un factor de corrección de 0,952. Luego: Rs-F = 0,962 (0,943 + 0,745) = 1,624 Å SOCl 2 : Rs = 16 = 4,19 . 4,78 . 0,88 3 RCl = 3 Rs - Cl 3 0,91 = 0,969 17 = 3 1,00 = 1,000 4,19 . 4,78 . 0,85 = 1,969 Å SOBr2 Rs = 3 16 = 4,19 . 4,58 . 0,88 3 0,94 = 0,980 SOBr2 RBr = 3 35 = 3 1,50 = 1,150 4,19 . 4,58 . 1,24 Rs - Br = 2,130 Å Nota.- Los valores experimentales son : S – F = 1,60 Å, S – Cl = 2,05 Å, S – Br = 2,27. Probl. 26.- Calcular las energías de los enlaces: a) Si – Cl, b) I – Br, c) N – F, a partir de las relaciones de estabilidad. Datos.- RE : Si = 2,62, Cl = 4,93, I = 3,84, Br = 4,53, N = 4,49, F = 5,75. Di : Si = 0,94, Cl = 0,85, I = 1,40, Br = 1,24, N = 0,88, F = 1,00. Resp. : a) 81,8, b) 41,4, c) 86,5 Kcal. Probl. 27.- Calcular la energías de los enlaces: a) C – F, b) I – Cl, c) Na – Na, d) S – H. RE : C = 3,79, F = 5,75, I = 3,84, Cl = 4,93, Na = 0,70, S = 4,11, H = 3,55. Di : C = 0,82, F = 1,00, I = 1,40, Cl = 0,85, Na = 1,03, S = 0,88. Radio del H combinado = 0,30 Å. Resp.: a) 84,63, b) 47,60, c) 19,4, d) 77,1 Kcal. Probl. 28.- Utilizando la relación de Shoemaker – Stevenson, calcular la longitud de los enlaces: a) C – F, b) C – Cl, c) C – Br, d) C – I. Radios covalentes: C = 0,77, F = 0,72, Cl = 0,99, Br = 1,14, I = 1,33. EN: C = 2,5, F = 4,0, Cl = 3,0, Br = 2,8, I = 2,5. Resp.: a) 1,35, b) 1,71, c) 1,88, d) 2,01. Probl. 29.- Los radios de energía constante para los halógenos, N, O, S y C, son: F = 1,11, Cl = 1,44, Br = 1,56, I = 1,73, N = 1,12, O = 1,12, S = 1,46, C = 1,22. Los radios covalentes son : F = 0,72, Cl = 0,99, Br = 1,14, I = 1,33, N = 0,75, O = 0,74, S = 1,04 y C = 0,77. Calcular las energías de enlace X – X en cada caso. Resp.: F2 = 37, Cl2 = 63,1, Br2 = 47,9, I2 = 40, N – N = 30,2; O – O = 33,2, S – S = 47,9, C – C = 63,1 Kcal. Probl. 30.- La energía del enlace Se - Se es 65 Kcal, y la del Te – Te es 52 Kcal. Los radios covalentes son: Se = 1,17 Å y Te = 1,37 Å. Calcular: a) Los rodios de energía constante, b) La longitud del enlace Se – Te (la energía de este enlace es 61 Kcal). Resp.: a) Se = 1,62, Te = 1,80, b) 2,53 Å Probl. 31.- Calcular la longitud del enlace C – C en los siguientes compuestos: a) H – C ≡ C – C ≡ C – H b) N ≡ C – C ≡ N c) C6H5 – C ≡ C – C6H5 d) CH3 – C ≡ C – H RE : C = 3,79, H = 3,55, N = 4,49 Di : C = 0,82 Resp.: a) 1,376 Å, b) 1,327 Å, c) 1,44 Å, d) 1,44 Å. Probl. 32.- Calcular la longitud del enlace C – F en el : a) CFCl3, y b) CF4. RE : C = 3,79, F = 5,75 Di : C = 0,82, F = 1,00 Resp.: a) 1,42 Å, b) 1,375 Å. Probl. 33.- Calcular la longitud del enlace Sn – Cl, en : a) Cl-Sn(CH3)3, y b) SnCl4. RE : Sn = 3,10, Cl = 4,93, H = 3,55 Di : Sn = 1,38, Cl = 0,85. Resp.: a) 2,428 Å, b) 2,263 Å. Nota.- Los valores experimentales correspondientes a los enlaces de los 3 últimos problemas son: Probl. 31.- a) 1,36, b) 1,37, c) 1,40, d) 1,46. Probl. 32.- a) 1,44, b) 1,36. Probl. 33.- a) 2,37, b) 2,30. APENDICE CONSTANTES NUMERICAS DE LOS ATOMOS Elemento 1 H 2 He 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar 19 K 20 Ca 21 Sc 22 Ti R conv. 0,37 0,93 1,34 0,90 0,82 0,77 0,75 0,73 0,72 1,31 1,54 1,30 1,18 1,11 1,06 1,02 0,99 1,74 1,96 1,74 1,44 1,36 D --0,59 0,30 1,31 2,16 3,11 3,95 4,90 5,75 1,06 0,72 1,30 1,88 2,46 3,04 3,62 4,19 0,82 0,60 0,91 1,68 2,09 DI --0,59 0,65 0,70 0,76 0,82 0,88 0,94 1,00 1,06 1,03 1,00 0,97 0,94 0,91 0,88 0,85 0,82 0,84 0,87 0,89 0,92 RE 3,55 --0,74 1,91 2,84 3,79 4,49 5,21 5,75 --0,70 1,56 1,94 2,62 3,34 4,11 4,93 --0,56 1,22 1,88 2,27 EN (Pauling) 2,1 --1,0 1,5 2,0 2,5 3,0 3,5 4,0 --0,9 1,2 1,5 1,8 2,1 2,5 3,0 --0,8 1,0 1,3 1,6 2,08 RE Zef 3,92 0,70 --1,40 1,79 1,00 2,88 1,70 3,50 2,25 4,05 2,90 4,41 3,55 4,75 4,20 4,99 4,85 --5,50 1,74 1,85 2,56 2,50 2,90 3,15 3,37 3,80 3,80 4,45 4,22 5,10 4,62 5,75 --6,40 1,55 1,85 2,30 2,50 2,85 2,65 3,13 2,80 ..................................................................................................................................................... 29 30 31 32 33 34 35 36 37 38 39 40 Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr 1,38 1,31 1,26 1,22 1,19 1,16 1,14 1,89 2,11 1,92 1,62 1,48 2,66 3,18 3,70 4,20 4,67 5,19 5,65 1,27 0,94 1,28 2,26 2,94 1,09 1,12 1,14 1,17 1,19 1,22 1,24 1,27 1,28 1,28 1,29 1,30 2,43 2,84 3,23 3,59 3,91 4,25 4,53 --0,53 1,10 1,75 2,26 1,7 1,5 1,6 1,7 2,0 2,4 2,8 --0,8 1,0 1,3 1,6 3,24 3,50 3,74 3,94 4,11 4,29 4,43 ---1,51 2,18 2,75 3,13 3,35 4,00 4,65 5,30 5,95 6,60 7,25 7,90 1,85 2,50 2,65 2,80 …………………………………………………………………………………………………. Elemento 47 Ag 48 Cd 49 In 50 Sn 51 Sb 52 Te 53 I 54 Xe 55 Cs 56 Ba 57 La R conv. 1,53 1,48 1,44 1,41 1,38 1,35 1,33 2,09 2,25 1,98 1,69 D 3,13 3,54 3,92 4,28 4,68 5,05 5,38 1,41 1,15 1,72 2,82 DI 1,36 1,36 1,37 1,38 1,39 1,39 1,40 1,41 1,42 1,43 1,48 RE 2,30 2,59 2,86 3,10 3,37 3,62 3,84 --0,49 1,02 1,90 EN (Pauling) 1,7 1,4 1,5 1,7 1,8 2,1 2,5 --0,7 0,9 1,1 2,08 RE Zef 3,15 3,35 3,35 4,00 3,52 4,65 3,66 5,30 3,82 5,95 3,96 6,60 4,08 7,25 --7,90 1,45 1,85 2,10 2,50 2,91 2,65 ..................................................................................................................................................... 79 80 81 82 83 Au Hg Tl Pb Bi 1,50 1,49 1,48 1,47 1,46 5,59 5,75 5,97 6,16 6,38 1,94 1,96 1,98 2,01 2,03 2,88 2,93 3,02 3,06 3,14 2,1 1,9 1,9 1,8 1,8 3,53 3,53 3,61 3,64 3,70 3,35 4,00 4,65 5,30 5,95 ..................................................................................................................................................... 86 Rn 2,14 2,09 2,09 ------7,90 RADIOS IONICOS, ENERGIAS DE HIDRATACION Y DATOS TERMODINAMICOS Radio Iónico ..... H+ Li+ 0,78 Å Na+ 0,95 K+ 1,33 + Rb 1,49 Cs+ 1,65 Cu+ 0,93 Ag+ 1,13 Au+ 1,37 Tl+ 1,49 Energ. Hidr. (Kcal) 263 123 100 79 75 68 139 116 154 80 ∆ Fº (Kcal) 0,00 -70,70 -62,59 -67,43 -68,80 -69,80 12,04 18,44 --- 7,76 ∆ Hº (Kcal) 0,00 - 66,00 - 57,50 - 60,30 - 61,00 - 62,10 ---25,20 ---0,80 Sº (cal/át.ºK) Sº (elem) Sº(ión) 15,6 0,00 6,7 4,7 12,2 14,0 15,2 24,2 16,6 28,7 18,4 33,2 8,0 --10,2 17,5 11,4 --15,4 30,5 ........................................................................ Mg+2 0,66 Ca+2 0,99 Sr+2 1,27 Ba+2 1,43 Ti+2 0,85 V+2 0,82 Cr+2 0,80 Mn+2 0,91 Fe+2 0,83 Co+2 0,82 Ni+2 0,78 Cu+2 0,72 Zn+2 0,83 Cd+2 1,03 Sn+2 1,10 +2 Hg 1,12 Pb+2 1,32 +3 Al Ti+3 V+3 Cr+3 Mn+ Fe+3 Co+3 Tl+3 Sn+4 0,57 0,64 0,69 0,65 0,66 0,67 0,65 1,05 0,71 464 382 350 316 446 453 460 445 468 497 507 507 492 437 374 441 359 -107,80 -132,70 -133,20 -133,95 ------- 39,40 - 48,60 - 20,30 - 12,80 - 11,53 15,91 - 35,18 - 18,55 - 6,28 39,42 - 5,81 - 110,20 - 129,50 - 130,00 - 128,40 ------- 43,00 - 49,20 - 20,60 - 16,50 - 15,20 - 15,00 - 36,30 - 17,60 ---41,60 - 0,20 7,8 10,0 13,3 15,1 ----5,7 7,5 6,5 6,8 7,1 8,0 10,0 12,3 12,3 18,5 15,5 ------------------------------------------------------6,8 - 115,50 - 126,30 1122 -------1027 -------1053 5,7 - 65,00 - 49,00 1105 ------1098 6,5 - 9,30 - 2,53 1072 6,8 --28,90 1126 15,4 28,00 49,74 984 12,3 ---0,70 1827 ------------------------------------------------ - 31,6 - 11,4 - 7,3 2,3 ------19,1 - 25,9 ----- 26,5 - 25,7 - 15,6 - 4,9 - 6,5 3,9 - 76,0 --------- 61,0 ------- Radio Iónico 1,36 F1,81 ClBr 1,95 I2,16 Energ. Hidr. (Kcal) 122 89 81 72 ∆ Fº (Kcal) -65,70 -31,33 -24,58 -12,33 ∆ Hº (Kcal) -78,20 -39,90 -28,70 -13,60 Sº (cal/át.ºK) Sº (elem) Sº(ión) 24,3 - 2,3 26,7 13,5 29,3 19,7 31,2 25,3 DATOS TERMOQUIMICOS CORRESPONDIENES AL CICLO DE BORN - HABER Compuesto Q(Kcal) 144,7 LiF 97,5 LiCl 83,7 LiBr 65,0 LiI 136,6 NaF 98,2 NaCl 86,3 NaBr 69,5 NaI 134,5 NF 104,9 KCl 94,2 KBr 78,9 KI 132,8 RbF 104,9 RbCl 96,1 RbBr 80,8 RbI 131,4 CsF 106,6 CsCl 97,5 CsBr 83,9 CsI 263,6 MgF2 153,4 MgCl2 123,8 MgBr2 86,0 MgI2 290,4 CaF2 190,0 CaCl2 161,4 CaBr2 127,8 CaI2 290,4 SrF2 198,0 SrCl2 171,2 SrBr2 135,6 SrI2 287,0 BaF2 205,6 BaCl2 180,4 BaBr2 144,0 BaI2 146,0 MgO 151,7 CaO 141,0 SrO 133,0 BaO S(Kcal) 38,3 38,3 38,3 38,3 26,0 26,0 26,0 26,0 21,7 21,7 21,7 21,7 19,9 19,9 19,9 19,9 19,1 19,1 19,1 19,1 36,5 36,5 36,5 36,5 47,5 47,5 47,5 47,5 39,7 39,7 39,7 39,7 49,1 49,1 49,1 49,1 36,5 47,5 39,7 49,1 D(Kcal) 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 36,6 58,0 46,1 36,1 118,4 118,4 118,4 118,4 I(Kcal) 123,8 123,8 123,8 123,8 118,0 118,0 118,0 118,0 99,6 99,6 99,6 99,6 95,9 95,9 95,9 95,9 89,4 89,4 89,4 89,4 520,6 520,6 520,6 520,6 412,9 412,9 412,9 412,9 383,8 383,8 383,8 383,8 349,0 349,0 349,0 349,0 520,6 412,9 383,8 349,0 EA(Kcal) 82,0 87,3 82,0 75,7 82,0 87,3 82,0 75,7 82,0 87,3 82,0 75,7 82,0 87,4 82,0 75,7 82,0 87,3 82,0 75,7 82,0 87,3 82,0 75,5 82,0 87,3 82,0 75,7 82,0 87,3 82,0 75,7 82,0 87,3 82,0 75,7 - 168,0 - 168,0 - 168,0 - 168,0 U(Kcal) 240,1 193,3 183,1 170,7 215,0 180,4 171,7 160,8 190,4 164,4 157,8 149,0 181,8 158,9 152,5 144,2 172,8 148,9 143,5 136,1 705,1 588,7 561,7 524,1 618,7 527,5 505,7 474,8 557,4 482,7 464,4 438,3 529,8 461,6 444,8 431,0 940,3 842,3 790,7 747,3 B I B L I O G R A F I A CONSULTA GENERAL A. Cotton – G. Wilkinson …… “Advanced Inorganic Chemistry”. Interscience Publ. 1962. J. Kleinberg – W. Argersinger …. “Inorganic Chemistry”. D.C. Heath Co. 1960. T. Moeller……………………… “Química Inorgánica”. Edit. Reverté 1956. E. Gould ………………………. “Curso de Química Inorgánica”. Selecc. Científicas. 1956. E. S. Gilraeth …………………. “Fundamentals Concepts of Inorganic Chemistry”. Mc Graw Hill Book Co. 1958. ESPECIALIZADOS Y MONOGRAFIAS L. Pauling …………………….. “The Nature of the Chemical Bond”. Cornell Press 1960. Cap. III (p. 65 – 105). VII (P. 221 – 257) XII (P. 505 -559). R.T. Sanderson ………………. “Chemical Periodicity”. Reinhold 1960, Cap. II y III (P. 16 -56). A.E. Van Arkel ………………. “Molecules and Crystals in Inorganic Chemistry”. Butterworths 1960. Cap. III y IV (F 29 -¿6). E. J. Little – M. M. Jones ……. “A Complete Table of Electronegativities”. J. of Chem. Ed. 37, 231 (1960). M. L. Huggins ……………….. “Bond Energies and Polarities”. J. Am. Chem. Soc. 75, 4123 (1953). A. Allred – E. Rochow ……… “A Scale of Electronegativities Based on Electrostatic Forces”. J. Inorg. Nucl. Chem. 5, 264, (1958). H. Pritchard – H. Skinner ……. “The Concept of Electronegativity” Chem. Reviews, 55, 745, (1955). R. T. Sanderson ……………….. “An Explanation of Bond Lengths, and a Classification of Bonds”. Science 114, 670, (1951). T. Gibb – A Winnerman ……… “Chemical Geometry. Aplication to Salts”. J. of Chem. Ed. 35, 578 (1958) y 36, 46, (1959). W. F. Kieffer …………………. “The Activity Series of the Metals”. J. of Chem. Ed. 27, 659, (1950). PREFACIO CAPITULO I. EL ESPECTRO DE RAYAS Y EL ATOMO DE BOHR ………………… 5 CAPITULO II. RELACIONES DE TAMAÑO …………………………………………..13 - Cálculo de radios iónicos a partir de las cargas nucleares efectivas ...……………..23 - Cálculo de radios iónicos a partir de las energías reticulares de los cristales ……...28 - Cálculo de radios iónicos a partir de las densidades y geometría de los cristales…..30 CAPITULO III. EL CICLO TERMOQUIMICO DE BORNHABER Y SUS APLICACIONES …………………………………………………………………………..46 CAPITULO IV. ELECTRONEGARIVIDADES………………………………………….69 - Electronegatividades a partir de las energías de enlace (escala de Pauling)………..69 - Escala de electronegatividades de Mullikan………………………………………..78 - Electronegatividades a partir de la densidad electrónica (escala de Sanderson)……79 - Electronegatividades a partir de las cargas nucleares efectivas (escala de Allred y Rochow) ………………………………………………………………………….86 - Electronegatividades a partir del radio covalente…………………………………..87 - Electronegatividades de las moléculas……………………………………………...89 - Electronegatividades de iones………………………………………………………91 - Electronegatividades de iones complejos…………………………………………..93 CAPITULO V. APLICACIONES DE LAS ELECTRONEGATIVIDADES……………..97 - Energías de enlace y calores de formación ………………………………………...97 - Carácter iónico parcial de los enlaces covalentes…………………………………100 - Carga iónica parcial, según la escala de Sanderson……………………………….103 - Aplicaciones de las cargas parciales………………………………………………107 - Estabilidad de compuestos y iones………….……………………………………..107 - Carácter ácido y básico de iones y moléculas.…………………………………….114 - Longitudes de enlace………………………………………………………………123 APENDICE CONSTANTES NUMERICAS DE LOS ATOMOS……………………………………...131 RADIOS IONICOS, ENERGIAS DE HIDRATACION Y DATOS TERMODINAMICO………………………………………………………………………133 DATOS TERMOQUIMICOS CORRESPONDIENTES AL CICLO DE BORNHABER……………………………………………………………………………………..135 BIBLIOGRAFIA…...………………………………………………………………………137 PROBLEMAS Y EJERCICIOS DE QUIMICA INORGANICA por A. Morales B y T. Meruane C. Se termino de imprimir el día seis de Octubre del dos mil seis, por Lucy Vargas Calderón.