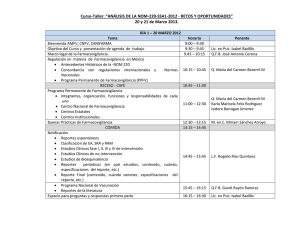
CLUSTER DE NOTIFICACIÓN DE REACCIONES LOCALES CON
Anuncio

LA SEGURIDAD DE LOS MEDICAMENTOS: REACCIONES ADVERSAS Contribución de la enfermería en el uso racional de los medicamentos Centro de Farmacovigilancia de la Comunidad de Madrid DEFINICIÓN de RAM Una respuesta a un fármaco que es nociva e involuntaria, que se produce a dosis utilizadas normalmente en el hombre para la profilaxis, diagnóstico o tratamiento de una enfermedad, o para la modificación de funciones fisiológicas (OMS, Directiva 93/39 de la UE, RD 711/2002). Centro de Farmacovigilancia de la Comunidad de Madrid DIAGNÓSTICO de una REACCIÓN ADVERSA ¾ El mismo síndrome clínico puede ser producido por causas no farmacológicas y por una gran variedad de fármacos. ¾ El mismo fármaco puede producir una variedad de eventos clínicos o de síndromes. ¾ En un paciente es a menudo imposible probar el papel causal del fármaco sospechoso. Centro de Farmacovigilancia de la Comunidad de Madrid IMPACTO SANITARIO ¾ Las RAM son entre la cuarta y la sexta causa de muerte en los EEUU, por encima de la diabetes o la neumonía. Lazarou et al. JAMA 1999; 279(15):1200-1205 ¾ El 4% de todos los ingresos hospitalarios son atribuibles a RAM con una estancia media debida a RAM de 9 a 11 días. Garijo B. Rev Clin Esp. 1991;188(1):7-12 Centro de Farmacovigilancia de la Comunidad de Madrid En el mundo... ¾ En las últimas 4 décadas se han retirado por motivos de seguridad 121 productos farmacéuticos. ¾ La mitad en los 5 primeros años de comercialización y 1/3 en los dos primeros años. (Fung M et al. Drug Information Journal 2001; 35:293-317) Centro de Farmacovigilancia de la Comunidad de Madrid SEGURIDAD vs RIESGO ¾ Para que las Autoridades aprueben la comercialización de un medicamento éste debe haber demostrado que es seguro y eficaz. Centro de Farmacovigilancia de la Comunidad de Madrid La Relación Beneficio/Riesgo √ Ningún fármaco es completamente seguro √ Un fármaco es seguro si su riesgo es aceptable Centro de Farmacovigilancia de la Comunidad de Madrid SEGURIDAD POSTAUTORIZACIÓN ¾ La evaluación de la seguridad requiere tres tipos de actividades À1.-Identificar el riesgo À2.-Cuantificarlo À3.-Valorar su aceptabilidad Centro de Farmacovigilancia de la Comunidad de Madrid SEGURIDAD POSTAUTORIZACIÓN S requiere ¾ La evaluación de la seguridad O G tres tipos de actividades S E I R E À1.-Identificar el Driesgo S I S I À2.-Cuantificarlo L Á N A À3.-Valorar su aceptabilidad Centro de Farmacovigilancia de la Comunidad de Madrid FARMACOVIGILANCIA “Es la actividad de salud pública destinada a la identificación, cuantificación, evaluación y prevención de los riesgos del uso de los medicamentos” Real Decreto 711/2002 por el que se regula la Farmacovigilancia de medicamentos de uso humano Centro de Farmacovigilancia de la Comunidad de Madrid FIN de la FARMACOVIGILANCIA ÀProporcionar de forma continuada la mejor información posible sobre la seguridad de los medicamentos. ÀPosibilitar la adopción de las medidas oportunas que aseguren que los medicamentos disponibles en el mercado presenten una relación beneficio-riesgo favorable en las condiciones de uso autorizadas. Centro de Farmacovigilancia de la Comunidad de Madrid FARMACOVIGILANCIA ¾ Responsabilidad compartida entre: 9Profesionales Sanitarios 9Autoridades Sanitarias 9Titulares de autorización de comercialización Centro de Farmacovigilancia de la Comunidad de Madrid SISTEMA ESPAÑOL de FARMACOVIGILANCIA ¾ Los profesionales sanitarios ¾ Los órganos competentes en materia de farmacovigilancia de las Comunidades Autónomas ¾ Agencia Española del Medicamento (AEM) Centro de Farmacovigilancia de la Comunidad de Madrid CARACTERÍSTICAS ¾ Programa permanente. ¾ Organización logística sencilla. ¾ No interfiere con los hábitos de prescripción y utilización de medicamentos. ¾ Cubre a todos los pacientes, profesionales sanitarios y medicamentos. ¾ Es capaz de detectar RAM de baja frecuencia. ¾ Es capaz de detectar RAM previamente no descritas. ¾ Genera señales de alerta. Centro de Farmacovigilancia de la Comunidad de Madrid IDENTIFICACION DE RIESGOS Centro de Farmacovigilancia de la Comunidad de Madrid NOTIFICACIÓN ESPONTÁNEA de SOSPECHAS de RAM ¾ Objetivo principal: Detectar precozmente las señales de problemas relacionados con la seguridad de los medicamentos que no han podido ser detectadas durante la realización de los ensayos clínicos debido a sus limitaciones respecto a tamaño, duración y representatividad de la práctica clínica habitual. Centro de Farmacovigilancia de la Comunidad de Madrid SEÑAL ¾ “Información comunicada sobre una posible relación causal entre un acontecimiento adverso y un fármaco, cuando dicha relación es desconocida o no está bien documentada” WHO Collaborating Centre for International Drug Monitoring 9 Al proceso de revisión de las notificaciones de sospechas de RAM para detectar problemas de seguridad se le denomina generación de señales Centro de Farmacovigilancia de la Comunidad de Madrid PRIORIDAD de una SEÑAL ¾ La gravedad 9 Mortal o ponga en peligro la vida del paciente, produzca ingreso o prolongación del mismo, sea causa de incapacidad o de malformación congénita, o médicamente relevante ¾ La novedad 9 Previamente no descrita o de frecuencia superior a la descrita ¾ La posibilidad de adoptar medidas preventivas ¾ La probabilidad de que realmente sea una señal Centro de Farmacovigilancia de la Comunidad de Madrid La “TARJETA AMARILLA” CONFIDENCIAL NOTIFICACION DE SOSPECHA DE REACCION ADVERSA A UN MEDICAMENTO o bien ponga un asterisco junto al nombre de los medicamentos sospechosos, si cree que hay más de uno. 3. Notifique todos los demás fármacos, incluidos los de automedicación, tomados en los tres meses anteriores. Para malformaciones congénitas, notifique todos los fármacos tomados durante la gestación. 4. No deje de notificar por desconocer una parte de la información que le pedimos 1. Por favor, notifique todas las reacciones a fármacos recientemente introducidos en el mercado y las reacciones graves o raras a otros fármacos (vacunas, productos estomatológicos y quirúrgicos, DIU, suturas, lentes de contacto y líquidos deben ser considerados medicamentos). 2. Notifique en la primera línea el fármaco que considere más sospechoso de haber producido la reacción, NOMBRE DEL PACIENTE (Con la finalidad de saber si se ha repetido alguna reacción). (Indique también el número de historia para los pacientes hospitalizados). * (Indique el nombre comercial) MEDICAMENTO (S) Sexo Peso (Kg.) Femenino Dosis diaria y vía admón. (Vease nota 2) * Para Edad Masculino Motivo de la Fecha prescripción Comienzo Final ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... las vacunas, indique el número de lote. REACCIONES Desenlace Fecha (P. Ej. recuperado, secuelas, mortal, etc.) Comienzo Final ....../....../............/....../...... ....../....../............/....../...... ....../....../............/....../...... OBSERVACIONES ADICIONALES Requirió ingreso SI NO (Emplee hojas adicionales si lo requiere) NOTIFICADOR Nombre .......................................................................... Profesión ........................................................................ Especialidad ................................................................... Centro de Trabajo .......................................................... Teléfono de contacto ..................................................... Pot favor, marque con una cruz si necesita más tarjetas, Marque con una cruz si quiere informe, ....../....../...... Fecha .................. Firma ÎGrave: 9 Pone en peligro la vida o causa la muerte 9 Es causa de ingreso 9 Provoca incapacidad o secuelas permanentes 9 Malformaciones congénitas 9 Médicamente relevante ÎPoco o nada conocido ÎToda sospecha de RAM con medicamentos nuevos Centro de Farmacovigilancia de la Comunidad de Madrid EVALUACIÓN de una SRAM Paciente Edad Sexo RAM Fechas Evolución Demanda Asistencial Fármaco/s sospechosos Fechas Dosis, vía Causas alternativas Medicación concomitante La/s enfermedad de base Otras GRAVEDAD IMPUTABILIDAD CONOCIMIENTO FEDRA Centro de Farmacovigilancia de la Comunidad de Madrid ELEMENTOS BASICOS para la EVALUACION ¾ Secuencia temporal de inicio À Fecha índice de la enfermedad À Tiempo biológicamente plausible ¾ Resultado de la retirada del medicamento ¾ Resultado de la reexposición al medicamento ¾ Conocimiento previo de ese efecto por el fármaco. ¾ Causas alternativas al fármaco Centro de Farmacovigilancia de la Comunidad de Madrid Generación de señales del SEFV FEDRA ANALISIS CLINICO ANALISIS CUANTITATIVO Centro de Farmacovigilancia de la Comunidad de Madrid Cluster de notificación de reacciones locales con la vacuna Infanrix® (toxoide tetánico, toxoide diftérico, antígenos de Bordetella Pertussis) en niños de 4 años en la Comunidad de Madrid Centro de Farmacovigilancia de la Comunidad de Madrid Comunidad de Madrid: Vacunación con Infanrix® ¾ Desde agosto de 1999: vacunas combinadas que incluyen pertussis acelular en las inmunizaciones de 2, 4, 6, 18 meses y 4 años. ¾ Desde febrero de 2001: importante incremento de la notificación de reacciones adversas locales en la dosis de recuerdo de los 18 meses: 9 Año 2000: 0 de 44.646 vacunados 9 Año 2001: 16 de 49.700, descartándose entonces un posible error programático o de calidad. ¾ Marzo de 2004: incremento del nº de notificaciones de reacciones locales en niños de 4 años Centro de Farmacovigilancia de la Comunidad de Madrid Centro de Farmacovigilancia de la Comunidad de Madrid o g s e Análisis de las notificaciones i r l recibidas en el Centro de de n ó Farmacovigilancia i c a c i f i t n e d I Centro de Farmacovigilancia de la Comunidad de Madrid Evolución temporal del nº de notificaciones de sospechas de reacciones adversas con DTPa hasta el 31/8/2004 Número de notificaciones 60 50 40 30 20 10 0 2001 2002 2003 en-abr2004 may-ag2004 4 años 18 meses Centro de Farmacovigilancia de la Comunidad de Madrid Lotes, áreas y centros implicados en las notificaciones de niños de 4 años ¾ Las 81 notificaciones recibidas proceden de 9 áreas sanitarias diferentes y de un centro privado y de 20 Centros de Salud diferentes, no predomina ningún lote en las notificaciones de cada área o Centro de Salud. ¾ En las 79 notificaciones en las que consta el lote, están implicados 13 lotes diferentes, con una frecuencia que oscila entre 1 a 22 notificaciones. Centro de Farmacovigilancia de la Comunidad de Madrid Notificaciones con Infanrix® en edad de 4 años de 1/1/2004 a 31/8/2004 20 N º n o t if ic a c io n e s 18 l o te T9 T8 T7 T6 T2 T10 T1 S7 S 16 S 12 R9 R20 R17 R14 P7 16 14 12 10 8 6 4 2 0 A B 1 C D 2 E F 3 G H 4 I J 5 K L M N 6 O P Q 8 R S T 10 U V 11 P Á r e a S a n ita r ia y C e n tr o d e S a lu d Centro de Farmacovigilancia de la Comunidad de Madrid a u “C i r l e Encuesta” d n ó i c a c i if t n o g es Centro de Farmacovigilancia de la Comunidad de Madrid Método ¾ Entre el 22 y el 23 de junio se envió una encuesta a los notificadores de 12 Centros de Salud que habían notificado entre enero y el 15 de junio de 2004 sospechas de reacciones adversas en niños vacunados con Infanrix®. ¾ En la encuesta se solicitaba: 9 la fecha de nacimiento 9 fecha de vacunación en la dosis de refuerzo correspondiente a los 18 meses 9 antecedentes de reacciones adversas locales en la administración de 18 meses 9 Nº de niños de 4 años vacunados de enero al 15 de junio. Centro de Farmacovigilancia de la Comunidad de Madrid Resultados encuesta ¾ Respondieron 9 Centros de Salud. ¾ Dos Centros de Salud que no respondieron a la encuesta sí aportaron la información de número de niños vacunados en el período entre el 1 de enero y el 15 de junio. ¾ Se aporta información individual de 39 niños ¾ La fecha de nacimiento está entre 9 el 29 de junio de 1999 y el 5 de julio de 2000 9 desde agosto de 1999 se utilizan vacunas combinadas que incluyen pertussis acelular Centro de Farmacovigilancia de la Comunidad de Madrid Análisis de las notificaciones del período 1/1/04 a 15/6/04 ¾ Niños de 4 años de edad vacunados con Infanrix® en 11 Centros de Salud: 1.162. Número de notificaciones: 61 ¾ Tamaño de las 62 reacciones locales: 9 > 5 cm en 28 (45%) 9 de 2 a 5 cm en 15 (24%) 9 < de 2 cm 1 (2%) 9 No consta 18 (29%) ¾ Frecuencia 5,01% (rango de 0,95% a 48,10%) ¾ El Centro de Salud que notifica reacciones locales en el 48% de los niños vacunados, comunica reacciones de 2 a 5 cm en el 77% de los casos y >5 cm en el 8% de las notificaciones. Centro de Farmacovigilancia de la Comunidad de Madrid Resultados encuesta (39 notificaciones) ¾ La vacunación de los 18 meses de edad se realizó entre 9 los 17 meses y 5 días y los 19 meses y 23 días ¾ La vacunación de los cuatro años entre 9 los 3 años y 10 meses y 4 años y 8 meses y medio ¾ Reacción local con la dosis de 18 meses À en 30 (77%) constaba en la HC que no había aparecido À en 2 (5%) se había presentado À en 7 (18%) no se pudo recuperar dicha información Centro de Farmacovigilancia de la Comunidad de Madrid Revisión de la literatura ¾ Con 5ª dosis de vacunación en 580 niños a los que se administró durante todo el calendario vacuna que contiene toxoide difterico, toxoide tetanico, y 2 antigenos de pertussis: Inflamación: 61,4%, > 5 cm 25%, completa del brazo 3% (Liese JG, and col. Pediatr Infect Dis J. 2001;20:981-88) ¾ La frecuencia de reacciones locales se incrementa con dosis sucesivas de vacuna DTP tanto acelular como celular. (Pichichero ME. Pediatrics 2000,105:e1-e8) ¾ La frecuencia de reacciones locales es mayor con la administración durante todo el calendario vacunal de DTPa que con el uso en las dosis primarias de DTP celular completa. (Skowronski DM and col. Pediatrics 2003;112(6):e453-e459) Centro de Farmacovigilancia de la Comunidad de Madrid Conclusiones ¾ La dispersión de áreas sanitarias y lotes, junto con la edad real de administración de la 4ª y 5ª dosis de DTPa descartan un problema de lote, un error programático o una hiperinmunización ¾ El incremento del número de notificaciones en la Comunidad de Madrid de reacciones adversas locales en la dosis de recuerdo administrada a los 4 años con vacuna de difteria, tétanos y pertussis acelular coincide con la administración de esta vacuna a niños de 4 años que por primera vez han seguido todo el calendario de vacunación con pertussis acelular Centro de Farmacovigilancia de la Comunidad de Madrid Conclusiones ¾ La notificación de reacciones locales en niños inmunizados durante todo el calendario de vacunación con DTPa reproduce los resultados de estudios epidemiólogicos previos, en los que se ha observado que 9 las reacciones locales se incrementan con dosis sucesivas de DTP 9 las reacciones locales después de la 4ª y 5ª dosis son más frecuentes cuando se utiliza el componente pertussis acelular en todo el calendario de vacunación que cuando se ha utilizado en las dosis primarias pertussis celular. Centro de Farmacovigilancia de la Comunidad de Madrid EVALUACIÓN DE LOS RESULTADOS ÀInforme y análisis conjunto con los d responsables de Enfermedades Transmisibles a d i l del Instituto de Salud Públicabde i la a t Comunidad de Madrid. p e c a u s r ÀPresentación y a discusión en el Comité Técnico r o del SistemaalEspañol de Farmacovigilancia V Centro de Farmacovigilancia de la Comunidad de Madrid Conclusiones de la evaluación ÀLa relación beneficio/riesgo continúa siendo favorable ÀInforme a los notificadores a los que se les ha realizado la encuesta ÀInclusión en el Boletin RAM (vol 11 nº 3 2004) de los resultados de la encuesta y recomendaciones, entre ellas la importancia de advertir a los padres. ÀInformación a otras comunidades autónomas que han introducido más tarde la vacuna con pertussis acelular en calendario vacunal Centro de Farmacovigilancia de la Comunidad de Madrid Centro de Farmacovigilancia de la Comunidad de Madrid En RESUMEN ... ÎEl SEFV se basa en la colaboración de los profesionales sanitarios ÎLos profesionales de enfermería son fundamentales en la detección de RAM, especialmente en aquellas relacionadas con administración parenteral de medicamentos ÎEs prioritario comunicar las sospechas de RAM: • Graves • Poco conocidas o desconocidas por su naturaleza, intensidad o frecuencia • Cualquier sospecha de RAM con medicamentos nuevos Centro de Farmacovigilancia de la Comunidad de Madrid Para CONTACTAR con NOSOTROS ... ¾ Centro de Farmacovigilancia de la Comunidad de Madrid. Subdirección General de Control Farmacéutico y PS. Dirección General de Farmacia y PS. Pº Recoletos 14. ¾ Teléfonos: 91 426 92 31 /17 ¾ Correo electrónico: cfv.cm@salud.madrid.org ¾ Página web del CFV de la CM Centro de Farmacovigilancia de la Comunidad de Madrid Centro de Farmacovigilancia de la Comunidad de Madrid VI Jornadas de Farmacovigilancia Fechas: 29 y 30 de marzo de 2006 Lema: Hacia la prevención del riesgo Centro de Farmacovigilancia de la Comunidad de Madrid