ENFERMEDADES DEL HOMBRE
Anuncio
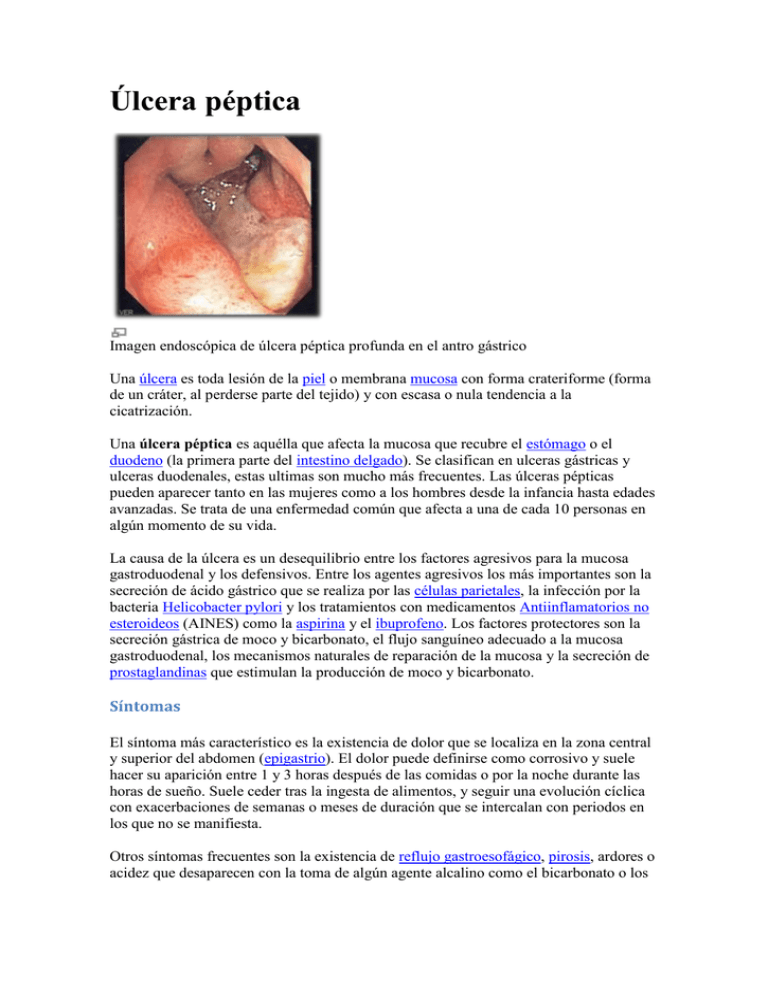
Úlcera péptica Imagen endoscópica de úlcera péptica profunda en el antro gástrico Una úlcera es toda lesión de la piel o membrana mucosa con forma crateriforme (forma de un cráter, al perderse parte del tejido) y con escasa o nula tendencia a la cicatrización. Una úlcera péptica es aquélla que afecta la mucosa que recubre el estómago o el duodeno (la primera parte del intestino delgado). Se clasifican en ulceras gástricas y ulceras duodenales, estas ultimas son mucho más frecuentes. Las úlceras pépticas pueden aparecer tanto en las mujeres como a los hombres desde la infancia hasta edades avanzadas. Se trata de una enfermedad común que afecta a una de cada 10 personas en algún momento de su vida. La causa de la úlcera es un desequilibrio entre los factores agresivos para la mucosa gastroduodenal y los defensivos. Entre los agentes agresivos los más importantes son la secreción de ácido gástrico que se realiza por las células parietales, la infección por la bacteria Helicobacter pylori y los tratamientos con medicamentos Antiinflamatorios no esteroideos (AINES) como la aspirina y el ibuprofeno. Los factores protectores son la secreción gástrica de moco y bicarbonato, el flujo sanguíneo adecuado a la mucosa gastroduodenal, los mecanismos naturales de reparación de la mucosa y la secreción de prostaglandinas que estimulan la producción de moco y bicarbonato. Síntomas El síntoma más característico es la existencia de dolor que se localiza en la zona central y superior del abdomen (epigastrio). El dolor puede definirse como corrosivo y suele hacer su aparición entre 1 y 3 horas después de las comidas o por la noche durante las horas de sueño. Suele ceder tras la ingesta de alimentos, y seguir una evolución cíclica con exacerbaciones de semanas o meses de duración que se intercalan con periodos en los que no se manifiesta. Otros síntomas frecuentes son la existencia de reflujo gastroesofágico, pirosis, ardores o acidez que desaparecen con la toma de algún agente alcalino como el bicarbonato o los antiácidos. También náuseas, vómitos y pérdida de peso. En algunos casos hasta sangrado. Hay que tener en cuenta que este cortejo de manifestaciones no siempre están presentes. Algunas personas presentan tan solo un síntoma leve o ninguno. Muchos de estos síntomas son semiologías compartidas por otras afecciones como la gastritis erosiva, litiasis biliar, pancreatitis, cáncer de estómago, etc.1 Complicaciones Hemorragia digestiva Los síntomas son variables, pues la hemorragia puede ser masiva y manifestarse en forma de vómitos con sangre (hematemesis) o bien como deposiciones de color negro y aspecto característico que se llaman melenas. A veces pasa inadvertida para el paciente y produce una anemia que progresa en el plazo de días o semanas. Se trata de una complicación muy peligrosa que puede poner en peligro la vida del paciente, por lo cual ante su presencia o sospecha es preciso acudir urgentemente al médico. Generalmente es preciso realizar una endoscopia para comprobar con exactitud el punto de sangrado.2 Perforación Es una grave complicación que se produce cuando la úlcera atraviesa totalmente la pared del estómago o duodeno. El contenido gástrico entra en contacto con el peritoneo y produce una peritonitis aguda. Se manifiesta por un intenso dolor abdominal localizado en la porción superior del abdomen (epigastrio) que comienza de forma abrupta y se describe frecuentemente como "dolor en puñalada".3 Si se confirma la presencia de esta complicación, es imprescindible la realización con carácter urgente de una intervención quirúrgica para cerrar la perforación.2 Obstrucción pilórica El píloro es la válvula que comunica el estómago con el intestino. Cuando existe una ulcera péptica situada cerca del píloro, puede ocurrir que los fenómenos de inflamación y cicatrización reiterados originen una obstrucción en esta estrecha zona. Ello ocasiona que el contenido del estómago tenga dificultad en seguir su camino natural hacia el duodeno y el intestino delgado para continuar la digestión. El síntoma más característico de la obstrucción pilórica es el vómito retencionista de alimentos ingeridos entre 6 y 8 horas antes. Penetración Se produce principalmente en las ulceras situadas en la cara posterior, las cuales pueden perforar lentamente la pared del estómago o duodeno y penetrar en órganos vecinos como páncreas, epiplón, vía biliar, hígado y colon. Cuando esto ocurre, el dolor cambia sus características clásicas, se hace más intenso y permanente. Aparecen nuevos síntomas dependiendo del órgano afectado, por ejemplo elevación de los niveles de amilasa en sangre si la penetración tiene lugar sobre el páncreas. Diagnóstico de la úlcera El diagnostico se basa en la presencia de síntomas sugestivos y en la realización de pruebas complementarias que demuestren la lesión. La técnica diagnóstica más eficaz es la endoscopía. Esta se realiza mediante el endoscopio, que es un tubo fino y flexible provisto de una luz y una pequeña cámara en la punta. Después de haberle dado un sedante al paciente, el médico introduce cuidadosamente el endoscopio por la boca de la persona y lo va haciendo descender por la garganta hasta llegar al esófago, estómago y duodeno. De esta manera, se puede observar directamente el revestimiento de estos órganos. El médico puede valerse del endoscopio para tomar fotos de las úlceras o para extraer un fragmento diminuto de tejido para examinarlo con el microscopio (biopsia). Si se identifica una úlcera, el médico puede realizar pruebas para comprobar si el paciente está infectado con H. pylori. Estos estudios pueden realizarse mediante pruebas de sangre, aliento y tejido. Las pruebas de sangre son las más comunes. Permiten detectar anticuerpos contra dicha bacteria. La prueba de aliento se usa principalmente después del tratamiento para ver si este dio resultado, pero se pueden usar también para el diagnóstico. Si no es posible realizar la endoscopia, puede recurrirse a radiografías con contraste. Se da a beber al paciente un líquido de consistencia parecida al yeso (contraste de bario). Gracias al mismo cualquier posible úlcera se ve más claramente en la radiografía. La radiología es una técnica que tiene menor sensibilidad y especificidad que la endoscopia y además no permite la toma de biopsias, por lo cual no esta recomendada como primera opción diagnóstica. Apendicitis - campaña Síntomas Los campaña Síntomas de la apendicitis y varian servicios PUEDE Difícil diagnosticarla en Niños pequeños, ancianos "y Mujeres en Fértil EDAD. Clásicamente, la cartilla es sintoma El El Dolor alrededor del ombligo (ver: dolor abdominal ). Este dolor inicialmente Puede Ser vago, Pero Cada Vez sí Vuelve Más graves y Agudo. Es posibles Que se PRESENTE inapetencia, náuseas, vómitos y baja Fiebre. A Medida Que se incrementa la inflamación en El Appendix, sulfa Tiende una desplazarse al estilo de instancia de parte inferior Derecha del abdomen y sí concentración Directamente Sobre el Appendix en Lugar Llamado de la ONU El punto de McBurney . Si sí presentación ruptura del Appendix, sulfa PUEDE Disminuir brevemente y Sentirse Mejor Usted PUEDE; embargo de pecado, Una Vez Que infecta e inflama sí El revestimiento de Cavidad abdominal la (Una afección Llamada peritonitis ), dolor empeora y El Usted sí torna Más Enfermo . El dolor abdominal PUEDE empeorar al toser o Caminar es y Que posibles Usted prefiera quedarse quieto debido una Que los Movimientos súbitos le causan dolor. Los campaña Síntomas tardíos abarcan: Escalofríos Estreñimiento Diarrea Fiebre Inapetencia Náuseas Temblores Vómitos Exámenes y Pruebas: Si Usted TIENE apendicitis, El Dolor incrementa CUANDO el Médico libera súbitamente la pressure despues de presionar Con suavidad El área inferior Derecha del vientre. Si la peritonitis TIENE, Tocar El área del vientre PUEDE causar espasmo muscular de las Naciones Unidas. PUEDE revelar Una Exploración rectal SENSIBILIDAD En El Lado Derecho del recto. Los Médicos generalmente pueden diagnosticar la apendicitis Por La Que Usted da Descripción de los campaña Síntomas, Físico El exámen y Las Pruebas de Laboratorio solas. ALGUNOS En Casos, sí pueden necesitar Exámenes adicionales, de Como: Tomografía computarizada del abdomen Ecografía abdominal Laparoscopia Diagnóstica Hipertensión arterial Hipertensión arterial Proceso de remodelado arterial en la hipertensión arterial La hipertensión arterial (HTA) es una enfermedad crónica caracterizada por un incremento continuo de las cifras de presión sanguínea en las arterias. Aunque no hay un umbral estricto que permita definir el límite entre el riesgo y la seguridad, de acuerdo con consensos internacionales, una presión sistólica sostenida por encima de 139 mmHg o una presión diastólica sostenida mayor de 89 mmHg, están asociadas con un aumento medible del riesgo deaterosclerosis y por lo tanto, se considera como una hipertensión clínicamente significativa. 1 La hipertensión arterial se asocia a tasas de morbilidad y mortalidad considerablemente elevadas, por lo que se considera uno de los problemas más importantes de salud pública, especialmente en los países desarrollados, afectando a cerca de mil millones de personas a nivel mundial. La hipertensión es una enfermedad asintomática y fácil de detectar; sin embargo, cursa con complicaciones graves y letales si no se trata a tiempo. La hipertensión crónica es el factor de riesgo modificable más importante para desarrollar enfermedades cardiovasculares, así como para la enfermedad cerebrovascular y renal.2 La hipertensión arterial, de manera silente, produce cambios en el flujo sanguíneo, a nivel macroy microvascular, causados a su vez por disfunción de la capa interna de los vasos sanguíneos y el remodelado de la pared de las arteriolas de resistencia, que son las responsables de mantener el tono vascular periférico. Muchos de estos cambios anteceden en el tiempo a la elevación de la presión arterial y producen lesiones orgánicas específicas. En el 90% de los casos la causa de la HTA es desconocida, por lo cual se denomina «hipertensión arterial esencial», con una fuerte influencia hereditaria. Entre el 5 y 10% de los casos existe una causa directamente responsable de la elevación de las cifras tensionales. A esta forma de hipertensión se la denomina «hipertensión arterial secundaria» que no sólo puede en ocasiones ser tratada y desaparecer para siempre sin requerir tratamiento a largo plazo, sino que además, puede ser la alerta para localizar enfermedades aún más graves, de las que la HTA es únicamente una manifestación clínica.3 Los diuréticos y los betabloqueantes reducen la aparición de eventos adversos por hipertensión arterial relacionados con la enfermedad cerebrovascular. Sin embargo, los diuréticos son más eficaces en la reducción de eventos relacionados con la enfermedad cardíaca coronaria. Los pacientes hipertensos que cumplen su tratamiento tienen menos probabilidades de desarrollar hipertensión severa o insuficiencia cardíaca congestiva.4 En la mayoría de los casos, en losancianos se utilizan dosis bajas de diuréticos como terapia inicial antihipertensiva. En pacientes ancianos con hipertensión sistólica aislada suele utilizarse como terapia alternativa un inhibidor de los canales de calcio de acción prolongada, tipo dihidropiridina. En pacientes ancianos con hipertensión no complicada, aún se están realizando ensayos para evaluar los efectos a largo plazo de los inhibidores de la enzima convertidora de angiotensina y los bloqueadores del receptor de la angiotensina-II.4 A la hipertensión se la denomina «la plaga silenciosa del siglo XXI». El Día Mundial de la Hipertensión se celebra el 17 de mayo. Accidente Cerebrovascular ¿Qué es un accidente cerebrovascular o una apoplejía? Bases del proceso Obstrucción del riego sanguíneo. El cerebro recibe un 25% del oxígeno del cuerpo, pero no puede almacenarlo. Las células del cerebro requieren un aporte constante de oxígeno para mantenerse sanas y funcionar correctamente. La sangre, entonces, necesita llegar continuamente al cerebro a través de los dos sistemas arteriales importantes: Las arterias carótidas, que suben por la parte anterior del cuello. (El pulso de una arteria carótida puede notarse poniendo los dedos suavemente en cualquier lado del cuello por debajo de la mandíbula). Las arterias basilares se forman en la base del cráneo a partir de las arterias vertebrales, que recorren la columna vertebral y llegan por la parte posterior del cuello. Una reducción del flujo sanguíneo durante un mínimo período de tiempo puede resultar desastrosa y es la causa principal de embolismo. Una embolia tiene la misma relación con el cerebro que un ataque cardiaco tiene con el corazón. Las dos cosas son resultado de una obstrucción de un vaso sanguíneo que interrumpe el suministro de oxígeno a las células, provocando la muerte de tejido vital. Un accidente cerebrovascular (ACV) normalmente es de dos tipos: Isquémico (causado por una obstrucción en una arteria). Hemorrágico (causado por un desgarro de la pared de la arteria que produce una hemorragia en el cerebro) Las consecuencias de un ACV, el tipo de funciones afectadas y la gravedad, difieren según el punto en el que se localiza la oclusión y la extensión de la lesión. Necrosis celular. Otros procesos localizados en el cerebro agravan la lesión. Los científicos están llevando a cabo investigaciones con el fin de descubrir el ciclo de acontecimientos involucrados en la necrosis celular una vez que se pierde el oxígeno. Una de las hipótesis es la siguiente: Cuando la sangre no llega al cerebro, se liberan las proteínas denominadas aminoácidos "excitadores", entre las que se incluyen el glutamato y la glicina. Éstas proteínas abren canales en las membranas que cubren las neuronas (células del cerebro) y permiten la entrada de grandes cantidades de calcio. El calcio reacciona en las neuronas y libera sustancias nocivas que dañan las células. Las partículas naturales liberadas por los procesos químicos del cuerpo humano denominadas radicales libres de oxígeno tal vez desempeñen un papel en la lesión provocada por el AVC. (Los peróxidos lípidos son algunos de los radicales libres de oxígeno que están siendo estudiados). Otra hipótesis se centra en una enzima denominada PARP (Poli(ADP-ribosa)polimerasa): La PARP normalmente efectúa reparaciones moleculares menores. Sin embargo, ante una lesión importante, la reacción de la PARP es desmesurada y absorbe todas las enzimas ATP, las cuales constituyen la principal fuente de energía celular. Las células mueren. En cuestión de minutos, la zona donde se produce la necrosis celular inicial es rodeada por células del cerebro adicionales dañadas y en proceso de necrosis. El proceso puede alargarse durante horas. Accidente cerebrovascular de origen isquémico El ACV isquémico constituye la forma más frecuente de apoplejía, siendo la causa del 80% de todos los accidentes cerebrovasculares. Denominamos isquemia al déficit de aporte de oxígeno en los tejidos vitales. Las embolias se producen por la formación de coágulos que normalmente son de dos tipos: Trombosis cerebral. Los trombos son coágulos sanguíneos que se forman en el interior de algunas de las arterias del cerebro. Embolia. Los émbolos son coágulos que desde otros emplazamientos son arrastrados por la sangre, y se van acumulando en la arteria (émbolos). Arteriosclerosis y trombosis. Por lo general, una trombosis cerebral se produce cuando un coágulo de sangre obstruye una arteria del cerebro; el coágulo de sangre se forma como consecuencia de la arteriosclerosis, proceso involutivo de endurecimiento de las arterias. A veces estos accidentes cerebrovasculares reciben el nombre de ACV de grandes arterias. Este proceso es complejo y se produce con el tiempo: Las paredes de las arterias se hacen poco a poco más gruesas, rígidas y estrechas hasta reducir el flujo sanguíneo, una alteración denominada estenosis (estrechamiento). Las lesiones en las arterias anómalas indican al sistema inmunológico cuándo liberar glóbulos blancos (especialmente aquellos denominados neutrófilos y macrófagos) en el lugar afectado. Los macrófagos se "comen" literalmente los restos y se convierten en células espumosas que se adhieren a las células de los músculos lisos de los vasos sanguíneos, haciendo que se acumulen. El sistema inmunológico, al detectar una mayor agresión, libera otros factores denominados citoquinas, que atraen más glóbulos blancos y perpetúan el ciclo regenerativo. A medida que continúan estos procesos, el riego sanguíneo es más lento. Además, las paredes interiores lesionadas no consiguen producir suficiente óxido nítrico, una sustancia vital para el mantenimiento de la elasticidad de los vasos sanguíneos. Las arterias se calcifican y pierden elasticidad. Las arterias endurecidas y rígidas son incluso más vulnerables a lesionarse. Si se desgarran, puede formarse un coágulo sanguíneo o trombo. A continuación el coágulo sanguíneo obstruye completamente la arteria ya estrecha y no deja llegar oxígeno hasta determinadas partes del cerebro. Entonces se produce un accidente cerebrovascular. Embolias y fibrilación auricular. Por regla general, una embolia se produce por la emigración de un coágulo sanguíneo, que circula por los vasos sanguíneos hasta quedar atascado en una arteria. Los émbolos representan un 60% de los accidentes cerebrovasculares debido a varios trastornos: En un 15% de todos los casos, las embolias se forman originalmente como consecuencia de una alteración del ritmo cardíaco denominada Fibrilación Auricular, un latido irregular rápido en las aurículas del corazón. A consecuencia del bombeo irregular, parte de la sangre puede acumularse en la aurícula, donde da lugar a coágulos, que pueden posteriormente soltarse y llegar al cerebro como émbolos. Los émbolos también pueden originarse por coágulos de sangre localizados en el emplazamiento de válvulas cardíacas artificiales, tras un infarto de miocardio, o como resultado de la alteración de una válvula del corazón. Los émbolos pueden producirse también después de un infarto de miocardio o en relación con una insuficiencia cardiaca. (Rara vez un émbolo se forma a partir de partículas grasas, células de tumores, o burbujas de aire que circulan a través del torrente sanguíneo). Infarto lacunar. Denominamos infartos lacunares a una serie de accidentes cerebrovasculares isquémicos menores que son la causa de torpeza de movimientos, debilidad y variabilidad emocional. Representan un 25% de embolias y a veces constituyen señales de aviso de una embolia grave. Accidente cerebrovascular hemorrágico Hemorragia. El 20% de lo ACV se producen por una hemorragia (sangrado repentino). Las embolias hemorrágicas pueden clasificarse por cómo y cuándo ocurren: Hemorragia cerebral o parenquimatosa, se produce dentro del cerebro. Representan más de la mitad de apoplejías hemorrágicas. Suelen ser principalmente resultado de una hipertensión que ejerce presión excesiva en las paredes arteriales dañadas ya por la aterosclerosis. Los pacientes con ataque cardiaco que han recibido fármacos para romper los coágulos o fármacos para diluir la sangre tienen un riesgo ligeramente elevado de este tipo de apoplejía. Hemorragia subaracnoidea, el otro tipo principal de embolia hemorrágica, se produce en los tejidos que rodean el cerebro. Suelen estar causadas por la ruptura de un aneurisma, una pared de un vaso sanguíneo debilitada, que a menudo es un trastorno heredado.. Malformación o fístulas arteriovenosas (MAV), es una conexión anormal entre arterias y venas. Si se produce en el cerebro y se rompe, puede causar también una embolia hemorrágica. Baja presión arterial (hipotensión). Aunque no es tan frecuente, una presión sanguínea demasiado baja puede reducir el suministro de oxígeno al cerebro y causar un ACV. Esta situación puede darse en el caso de un infarto de miocardio, de un episodio hemorrágico grave, de una infección grave (sepsis), o del uso de anestesia quirúrgica o un tratamiento excesivo de hipertensión. ¿Cuáles son los síntomas de un accidente cerebrovascular? Las personas con factores de riesgo, así como los compañeros o las personas que atienden a individuos que presentan riesgo de embolias, deberían conocer cuáles son los síntomas generales a fin de que la víctima de un ACV sea trasladada a un hospital lo antes posible tras la aparición de estas señales de aviso. Resulta especialmente importante que las personas que padezcan migrañas o dolores de cabeza agudos frecuentes sepan cómo distinguir un dolor de cabeza corriente de los síntomas de una embolia. Ataques isquémicos transitorios Los ataques isquémicos transitorios (TIA) son pequeñas embolias isquémicas, a menudo causadas por émbolos diminutos que se adhieren a una arteria y rápidamente se fragmentan y disuelven. Las alteraciones mentales y físicas producidas a consecuencia de estos TIA suelen desaparecer en menos de un día; de hecho, casi todos los síntomas desaparecen en menos de una hora. No hay daño residual alguno. Sin embargo, los ataques isquémicos transitorios son señales de aviso de embolias isquémicas, del mismo modo que una angina constituye un indicio de un posible infarto de miocardio. Aproximadamente el 5% de las personas que experimentan ataques isquémicos transitorios sufren una embolia en cuestión de un mes y, si no reciben tratamiento, una tercera parte padecerán ACV en el transcurso de los cinco años siguientes. (De hecho, dada la relación que existe entre la arteriosclerosis, la enfermedad arterial coronaria y los AVC, los ataques isquémicos transitorios son también signos de aviso de un posible ataque cardíaco). Es frecuente que uno de los dos sistemas arteriales principales esté implicado en un ataque isquémico transitorio, ya sean las arterias carótidas o la arteria basilar: Síntomas de ataques isquémicos transitorios en las arterias carótidas. Las arterias carótidas empiezan en la aorta y asciendo por el cuello, alrededor de la tráquea hasta llegar al cerebro. Cuando se producen en esta zona los TIA, pueden causar síntomas en la retina del ojo o en el hemisferio cerebral (una de las mitades del cerebro): Cuando se reduce el paso de oxígeno al ojo, la gente describe efectos visuales semejantes a cuando baja una persiana. También pueden sufrir una mala visión nocturna. Cuando la zona afectada por el TIA es uno de los hemisferios cerebrales, una persona puede experimentar problemas de habla y parálisis, sensación de hormigueo, y entumecimiento, a menudo en un único lado del cuerpo. Síntomas de ataques isquémicos transitorios en la arteria basilar. La segunda ubicación problemática más importante, la arteria basilar, tiene su origen en la base del cráneo a partir de las arterias vertebrales, que recorren la medula espinal. Cuando el TIA se localiza en esta arteria, ambos hemisferios cerebrales pueden resultar afectados, de manera que los síntomas aparecen en ambos lados del cuerpo. Algunos de estos síntomas son los siguientes: Visión temporalmente difusa, gris, borrosa en ambos ojos. Hormigueo o entumecimiento en la boca, mejillas o encías. Dolor de cabeza en la parte posterior. Mareos. Náuseas y vómitos. Dificultad en la deglución. Incapacidad de hablar claramente. Debilidad en brazos y piernas, a veces provocando una súbita caída. Síntomas de un accidente cerebrovascular isquémico grave Rapidez en el inicio de los síntomas. El inicio de los síntomas en un ACV grave puede variar en función del origen: Si el ataque isquémico grave es causado por émbolos que han circulado por los vasos sanguíneos hasta adherirse a una arteria en el cerebro, la aparición es repentina. Cuando la causa del ACV es una trombosis, coágulo de sangre formado en una arteria estrechada, la aparición es, por regla general, más gradual, en un tiempo que va de minutos a horas. En casos infrecuentes, progresa de días a semanas. Síntomas. Los síntomas de un ACV grave son extremadamente variables: Los síntomas precoces pueden ser idénticos a los de un ataque isquémico transitorio, dado que, en ambos casos, el coágulo puede ser el causante de una oclusión en un tramo de las arterias carótidas o basilar. [Ver más arriba]. (En el caso de un ataque isquémico transitorio, los síntomas desaparecen). Por regla general, el coágulo de sangre afecta al lado del cuerpo opuesto a su localización en el cerebro, con la consiguiente posible pérdida de sensibilidad en uno de los lados de la cara, en un brazo o pierna, o ceguera en un ojo. Pueden producirse problemas de habla si está afectado el hemisferio izquierdo del cerebro. (En algunas personas, especialmente en aquellas que son zurdas, las facultadas del habla pueden verse afectadas por un coágulo localizado en el hemisferio derecho del cerebro). La víctima de una apoplejía podría ser incapaz de expresar verbalmente pensamientos o de entender palabras cuando le hablan. Pueden sufrir convulsiones graves y posiblemente un coma. Síntomas de un ACV hemorrágico Síntomas de una hemorragia cerebral. Los síntomas de una hemorragia cerebral, o parenquimatosa, suelen aparecer repentinamente y desarrollarse durante varias horas y, entre otros, son: Dolor de cabeza Náuseas y vómitos Alteración del estado mental. Hemorragia subaracnoidea. Cuando la hemorragia es de tipo subaracnoidea, pueden producirse una serie de señales de alerta desde unos días hasta un mes después, debidas a un vaso sanguíneo roto después de que el aneurisma (dilatación y debilitamiento de la pared del vaso) se desarrolle por completo y se rompa. Estas señales de alarma incluyen: Dolores de cabeza repentinos Náuseas y vómitos Sensibilidad a la luz. Diferentes síntomas neurológicos Cuando el aneurisma se rompe, el paciente puede presentar: Un terrible dolor de cabeza Rigidez de nuca Vómitos Alteración del nivel de conciencia Los ojos pueden quedar fijos en una dirección o perder visión Puede producirse apatía, rigidez y coma. Infartos cerebrales silentes Ni más ni menos que el 31% de las personas de la tercera edad padecen infartos cerebrales subclínicos. Se trata de ACV menores que no causan síntomas perceptibles y que, sin embargo, contribuyen en gran medida al deterioro de las facultades mentales de los mayores. Los fumadores e hipertensos constituyen dos grupos de riesgo considerable. ¿Cuáles son los factores de riesgo de un accidente cerebrovascular? Los accidentes cerebrovasculares o ictus son actualmente uno de los problemas más importantes de salud pública en nuestro país, ya que más de 100.000 españoles se ven afectados cada año por este tipo de enfermedades que constituyen la primera causa de invalidez permanente y segunda de muerte entre la población adulta en España. Se calcula que cada seis minutos una persona sufre una trombosis cerebral, una embolia o un derrame cerebral. Edad y sexo Personas mayores. Las personas con un riesgo mayor de ACV son las personas mayores, especialmente aquellas con presión arterial elevada, sedentarios, con sobrepeso, fumadores o diabéticos. La edad avanzada está también vinculada con un índice mayor de demencia post apoplejía. En los grupos de mayor edad, los estudios son variados al respecto de los ACV según el sexo. Las mujeres pueden tener un riesgo mayor de ACV hemorrágico que los hombres. Algunos han revelado que hay más mujeres que fallecen por ACV, aunque un análisis canadiense del 2000 de casi 45.000 registros de pacientes afirmó que, aunque los hombres mayores recibían un tratamiento más agresivo, las mujeres ancianas tenía una ligera ventaja en la supervivencia un año después de un ACV. Adultos jóvenes. Tampoco son inmunes las personas más jóvenes; un 28% de los pacientes tienen menos de 65 años. Los accidentes cerebrovasculares en personas más jóvenes afectan por igual a hombres y mujeres. Presión arterial alta (Hipertensión) La presión arterial alta (conocida como hipertensión) es uno de los factores causantes del 70% de los casos de ACV. De hecho, los investigadores han calculado que casi la mitad de los ACV podrían evitarse si se controla bien la presión arterial. Se utilizan dos cifras para describir la presión sanguínea: La presión sistólica (la primera cifra, la más elevada) se mide cuando el corazón se contrae para bombear la sangre. La presión diastólica (la segunda cifra, la más baja) se mide cuando el corazón se relaja a fin de permitir la entrada de sangre entre latido y latido. Al parecer, una presión diastólica elevada comporta un riesgo considerable de ACV. Fibrilación auricular Cada vez es más frecuente esta alteración en el ritmo cardiaco, que en España afecta a cerca del 10 por ciento de los mayores de 70 años y es responsable de la elevada tasa de embolias cerebrales que se detecta en individuos de edad avanzada, sin lesión cardiaca previa. Las mujeres con fibrilación auricular corren un riesgo mayor de ACV que los hombres con este trastorno. La fibrilación auricular puede suponer también un riesgo mayor de complicaciones tras una embolia. Tabaco Las personas que fuman un paquete al día tienen casi un riesgo de 2 veces y media más de riesgo de ACV que los que no fuman. Los factores específicos de un riesgo mayor de ACV en fumadores incluyen lo siguiente: Fumadores empedernidos Fumadores actuales. El riesgo puede seguir siendo elevado durante 14 años después de dejar e fumar. Las mujeres fumadores que toman anticonceptivos orales Dejar el tabaco reduce significativamente el riesgo. En un estudio, los ex fumadores tenían casi el mismo riesgo que aquellas personas que nunca había fumado. Diabetes y resistencia a la insulina La diabetes es un factor de riesgo importante de la embolia isquémica, tal vez debida a los factores de riesgo acompañantes, como obesidad e hipertensión arterial. Los estudios han implicado también la resistencia a la insulina, que suele producirse en diabéticos insulinodependientes, como factor independiente en la aparición de la aterosclerosis y la embolia. Con este trastorno, los niveles de insulina son de normales a elevados, pero el cuerpo es incapaz de usar con normalidad la insulina para metabolizar el azúcar en sangre. El cuerpo compensa al elevar el nivel de insulina (hiperinsulinemia), que puede, a su vez, aumentar el riesgo de coágulos sanguíneos y reducir niveles HDL (forma beneficiosa de colesterol). La diabetes no parece aumentar el riesgo de una embolia hemorrágica. [Para más información, ver el capítulo de la enciclopedia sobre Diabetes Tipo II]. Obesidad y sedentarismo La obesidad se asocia con la embolia, principalmente porque el sobrepeso refleja la presencia de otros factores de riesgo, incluyendo resistencia a la insulina y diabetes, hipertensión arterial y niveles de colesterol poco saludables. El peso que se centra en torno al abdomen (el sobrepeso denominado en forma de manzana) tiene una mayor asociación con la embolia, como también con la enfermedad cardiovascular, que el peso distribuido entorno de las caderas (en forma de pera). Homocisteína y deficiencias de vitamina B Los niveles anormales en sangre del aminoácido homocisteína, que se producen con deficiencias de vitamina B6, B12, y ácido fólico, están fuertemente vinculados a un aumento del riesgo de enfermedad de las arterias coronarias y de un accidente cerebrovascular. Algunos expertos creen que la homocisteína es un factor de riesgo importante de embolia, seguido sólo por la hipertensión arterial. La homocisteína parece ser tóxica para las células que recubren las arterias y que contribuyen a la coagulación sanguínea. Colesterol y otros lípidos Aunque un exceso del colesterol "malo" tiene gran importancia en la aterosclerosis que provoca la enfermedad cardíaca, su importancia en la embolia está menos clara. Distintos factores del colesterol pueden tener efectos diferentes: Los estudios indican que las HDL (lipoproteína de alta densidad, considerada colesterol saludable) tal vez ayude en la prevención de apoplejías isquémicas e incluso reduzca el riesgo de ACV causado por hemorragia. Por ejemplo, en un estudio del 2000, con los niveles de colesterol HDL más elevados tenían un 32% menos de riesgo de embolia que los hombres con los niveles de HDL más bajos. En contraste con este lípido, la lipoproteína a y la apoE son lípidos (moléculas grasas) que parecen aumentar el riesgo de apoplejía. La lipoproteína a presenta una estructura similar a la de la LDL y transporta una proteína que puede obstaculizar la habilidad del cuerpo de disolver coágulos de sangre. Son pocas las pruebas que señalan la presencia de niveles elevados de colesterol y LDL (el considerado colesterol perjudicial) como desencadenantes de ACV isquémicos; de hecho, un nivel bajo de colesterol puede constituir un factor de riesgo de apoplejía hemorrágica. Según un estudio realizado en 1999, existe una asociación entre la presencia de LDL y un riesgo elevado de demencia tras un accidente cerebrovascular. Abuso de drogas, alcohol y café Alcohol. El abuso desmesurado de alcohol, especialmente un historial reciente de alcoholismo, se asocia con un riesgo elevado de ACV isquémico y hemorrágico. Sin embargo, algunos estudios han indicado que el consumo moderado de alcohol (de una a siete copas por semana) está asociado con un riesgo considerablemente más bajo de apoplejía isquémica, aunque no de apoplejía hemorrágica. Café. Algunos estudios sugieren que tomar tres o más tazas de café al día podría aumentar el riesgo de ACV en hombres mayores con hipertensión. Al parecer, el café no comporta ningún peligro en el caso de hombres con una presión arterial normal. Abuso de drogas. El abuso de drogas, especialmente en el caso de la cocaína y, cada vez más, de la metanfetamina (una anfetamina), constituye un factor importante de riesgo en la incidencia de casos de apoplejía entre los jóvenes. Los esteroides utilizados para la tonificación del cuerpo también aumentan el riesgo. Factores genéticos y congénitos La genética puede ser responsable de la mayor parte de los casos de ACV. Los estudios indican que la existencia de una historia familiar de apoplejía, especialmente en el padre, constituye un factor de riesgo importante. Genética y hemorragia subaracnoidea. Los factores genéticos son especialmente importantes en el caso de hemorragia subaracnoidea, siendo la causa del 7% al 20% de los casos. Los aneurismas fisurados que presentan dichos pacientes suelen aparecer a una edad más temprana, ser menores, y presentar una probabilidad de recidiva más elevada que en el caso de pacientes sin dicha condición genética. Un estudio realizado con personas que habían sufrido hemorragias subaracnoideas detectó que los parientes más cercanos de los pacientes con apoplejía presentaban un riesgo elevado que oscilaba entre el 2% y el 5%. Algunos expertos recomiendan realizar pruebas de detección en personas con más de un familiar cercano que haya sufrido una embolia hemorrágica. Trastornos hereditarios que contribuyen al ACV. Algunos casos de fibrilación auricular pueden ser hereditarios. Las alteraciones genéticas también están asociadas con ACV producidos por hemorragia; entre éstas se incluyen la enfermedad poliquística renal, el síndrome de Ehlers-Danlos tipo IV, la neurofibromatosis tipo 1 y el síndrome de Marfan. Se recomienda realizar pruebas para la detección de posibles aneurismas en aquellas personas con más de un pariente cercano que haya sufrido un ACV hemorrágico. Factores genéticos específicos que están siendo investigados. Se están investigando determinados factores genéticos específicos. Algunos de ellos son los siguientes: El déficit congénito de los factores denominados proteína C y S, factores, que inhiben la coagulación de la sangre, puede ser la causante de ACV en adultos jóvenes, aunque un estudio indica que no es importante. Una mutación genética del factor V Leiden puede estar relacionada con riesgo de coagulación sanguínea. Las personas que han heredado un gen llamado apolipoproteina (Apo) E-4 pueden correr un mayor riesgo de ACV. Este gen está también asociado con el de la enfermedad de Alzheimer. Se requieren, no obstante, más estudios. Enfermedad cardiaca y sus tratamientos La enfermedad cardiaca y los ACV están fuertemente relacionados por muchos motivos: A menudo tienen en común factores de riesgo, incluyendo una presión arterial alta y la diabetes. El riesgo de ACV aumenta durante las intervenciones quirúrgicas que implican cirugía en las arterias coronarias, tales como operaciones de bypass aorto coronario, angioplastia y arteriectomía coronaria. El peligro es mayor en aquellas personas que presentan factores de riesgo de ACV, como presión sanguínea alta, diabetes y soplos carotídeos. Los fármacos antitrombóticos (substancias disolventes de coágulos) y otros anticoagulantes que se utilizan en el tratamiento de infartos de miocardio también aumentan ligeramente el riesgo de ACV hemorrágico. Un infarto de miocardio por sí sólo ya aumenta el riesgo de ACV; el peligro es aún mayor durante los primeros días tras un ataque, aunque sigue sin ser demasiado elevado. Aquellos que presentan más riesgo son las personas mayores y las personas que sufren también insuficiencia cardiaca congestiva. Se cree que el prolapso de la válvula mitral constituye una de las causas principales de apoplejía entre los jóvenes, pero aún no se ha investigado adecuadamente tal conexión. Un estudio de 1999 no proporciona prueba alguna que confirme que una anomalía cardíaca leve tenga algún tipo de efecto en la aparición de un caso de ACV. Factores mentales y emocionales Estrés. En algunas personas, el estrés mental prolongado o frecuente causa un aumento exagerado de la presión arterial; con el tiempo, este efecto ha sido vinculado con un engrosamiento de las arterias carótidas. De hecho, una serie de estudios han descubierto una asociación entre el estrés mental prolongado y un estrechamiento progresivo de la carótida. Depresión. La depresión también se ha vinculado a un riesgo más elevado de apoplejía e índices de supervivencia inferiores después de sufrir una. En un estudio del 2000, los pacientes con depresión grave tenían un riesgo de un 73% más de ACV y aquellos con depresión moderada tenían un 25% de riesgo más que la media. Migraña y factores de riesgo asociados Los estudios han descubierto que la migraña o el dolor de cabeza grave es un factor de riesgo de ACV tanto en hombres como en mujeres, especialmente antes de los 50. De hecho, la migraña se asocia con un 19% de todas las ACV. Hay que destacar que muchas personas con migraña presentan un riesgo bajo, un 2.7% para las mujeres y un 4.6% para hombres, según un estudio. Las mujeres del estudio corrían un riesgo mayor entre 45 y 65 años y los hombres antes de los 45. En ambos sexos, el riesgo disminuía con la edad. Los anticonceptivos orales se añaden al riesgo de ACV en mujeres jóvenes con migraña, pero sólo que aquellas personas que sufren auras. Fumar intensifica este riesgo. Infecciones Los informes han indicado durante algún tiempo que determinadas bacterias y virus pueden tener importancia en la aterosclerosis y enfermedad cardiaca, provocando generalmente una respuesta inflamatoria en las arterias. Pueden funcionar también mecanismos similares con un ACV. Algunas pruebas que vinculan infecciones con los ACV son las siguientes: Infecciones pulmonares. En dos estudios del 2000, la infección crónica con Chlamydia pneumoniae, un microorganismo no bacteriano que causa una leve neumonía en adultos se relacionaba con un aumento de riesgo de ACV. Uno de los estudios revelaba un engrosamiento de las paredes internas de los vasos de las arterias carótidas en pacientes portadores del microorganismo. La Chlamydia también ha sido vinculada con la enfermedad cardiaca. Un estudio del 1998 descubrió que los pacientes hospitalizados por ACV eran tres veces más propensos que los pacientes que no habían sufrido una apoplejía de haber estado expuesto recientemente a las infecciones, normalmente infecciones leves en el aparato respiratorio. Enfermedad periodontal. La enfermedad periodontal ha sido asociada con un mayor riesgo de apoplejía y enfermedad cardiaca. Las bacterias que causan periodontitis pueden estimular factores que causan coagulación sanguínea y otras proteínas que contribuyen a un riesgo más elevado. Virus Varicela Zóster. El virus varicela zóster (virus causante de la varicela y el herpes) ha sido asociado a la vasculitis cerebral, trastorno en que los vasos sanguíneos del cerebro se inflaman. Es una causa de ACV en niños. El virus se ha asociado también con algunos casos de ACV en adultos jóvenes. Otras factores asociados Una serie de trastornos y situaciones puede contribuir al riesgo de ACV: La apnea del sueño, que puede contribuir al estrechamiento de la arteria carótida, parece aumentar el riesgo de ACV multiplicándolo por tres e incluso por seis. El embarazo comporta un riesgo mínimo de apoplejía, principalmente se da en mujeres embarazadas con presión arterial alta o a aquellas a las que se les practica una cesárea. El riesgo parece ser mayor durante los períodos posteriores al parto, tal vez debido al cambio repentino de la circulación y del nivel de hormonas. Casi un 40% de jóvenes con ACV y un 10% de todos los pacientes con apoplejía tienen componentes del sistema inmunitario conocidos como anticuerpos antifosfolípido que aumentan las probabilidades de coagulación sanguínea. Las personas con anemia falciforme corren riesgo de ACV a una edad temprana. Otros factores de riesgo generales Momento del día. Como el ataque cardiaco y la muerte cardiaca repentina, el ACV parece ser más común en las horas de la mañana, algo que tal vez se deba a un aumento transitorio de la presión arterial en ese momento. Distintos estudios apuntan a un riesgo más elevado de ACV los fines de semana, los lunes y en vacaciones. El riesgo de embolia hemorrágica también puede ser mayor en invierno, especialmente en personas mayores hipertensas. ¿Cuál es la gravedad de un accidente cerebrovascular? Un ACV siempre es grave; a diferencia de las células de otras regiones del cuerpo humano, las células del cerebro no pueden repararse o regenerarse. Los estudios han indicado que un tercio de todos los accidentes cerebro vasculares son mortales en los primeros 30 días. Embolia isquémica frente a hemorrágica Las personas que sufren embolias isquémicas tienen más probabilidades de sobrevivir que aquellas que sufren embolias hemorrágicas. Dentro de las categorías de ACV isquémicos, las más peligrosas son las embolias isquémicas, seguidas por las trombosis de grandes arterias y las embolias lacunares. La embolia hemorrágica no solo destruye las células cerebrales, sino que también supone riesgo de otras complicaciones, entre otras, un aumento de la presión en el cerebro o espasmos en los vasos sanguíneos, ambas cosas pueden ser muy peligrosas. Factores que afectan la recurrencia El riesgo de recurrencia a los cinco años es de un 22%. Este riesgo de recurrencia de cualquier tipo de apoplejía es mayor en los primeros seis meses, así que deberían adoptarse medidas preventivas lo antes posible. Algunos factores de riesgo específicos de recurrencia precoz son los siguientes: Ser mayor Hemorragia o embolia cerebral Diabetes. Alcoholismo Enfermedad valvular cardiaca Fibrilación auricular Anemia La anemia es una enfermedad hemática que es debida a una alteración de la composiciónsanguínea y determinada por una disminución de la masa eritrocitaria que condiciona una concentración baja de hemoglobina (ver los parámetros estándares). Rara vez se registra en forma independiente una deficiencia de uno solo de estos factores. La anemia es una definición de laboratorio que entraña un recuento bajo de eritrocitos (véase hematocrito) y un nivel de hemoglobina menor de lo normal. Cronicidad La anemia se considera crónica si dura más de cinco meses. Valores normales Los rangos de normalidad son muy variables en cada población, dependiendo de factores ambientales(nivel sobre el mar) y geográficas. A nivel del mar encontraremos valores normales mínimos, y a gran altura los valores normales deberán ser más altos (la menor presión parcial de oxígeno (O2) obliga al organismo a optimizar su transporte). Además, hay variaciones de sexo, observando valores menores en las mujeres (posiblemente por la pérdida de eritrocitos y contenido sanguíneo en cada ciclo menstrual). Sexo Número de Eritrocitos Hematocrito Hemoglobina Hombres 4,2-5,4 x 106/mm3 42-52 % 13-17 g/dl Mujeres 3,6-5,0 x 106/mm3 36-48 % 12—16 g/dl MCV: 80-100 fl. MCHC: 31-37 g/dl. MCH: 27-31 pg/célula. RDW: 11,5-14,5 En general, se establece como normal para un varón un hematocrito entre 42% y 52%, hemoglobina entre 13 y 17 g/dl, y para una mujer: hematocrito entre 36% y 48%, y hemoglobina entre 12 y 16 g/dl. Estos niveles son algo arbitrarios, pues existen límites en los valores normales. Por ejemplo, un sujeto puede tener una disminución de 1 a 2 g/dl en su hemoglobina, y aun así estar dentro de los límites normales. Expresión clínica Los síntomas y signos de la anemia se correlacionan con su intensidad, su rapidez de instalación y el sitio donde se produce. Otros factores influyentes en el cuadro sintomático son la edad, el estado nutritivo, cardiovascular y respiratorio. Los síntomas que se observan en la anemia aguda se denominan síndrome anémico, e incluyen: debilidad (astenia), palpitaciones y falta de aire (disnea) con el esfuerzo. Frecuentemente y sobre todo en las anemias severas se observa esplenomegalia, hepatomegalia, petequias,equimosis, y/o ictericia. También puede incluir síntomas propios de otros sistemas, como cardiovascular (taquicardia, disnea de esfuerzo marcada, angor, claudicación intermitente), digestivo (dispepsia, disfagia, anorexia, diarrea) o neuropsiquiátrico , depresión, cambios de carácter como irritabilidad. En la pérdida súbita de sangre (hemorragia aguda) y en particular si es voluminosa (aprox. 2 L o 40% del volumen sanguíneo), predominan los síntomas de inestabilidad vascular por hipotensión, contracción vascular, aparecen los signos del shock hipovolémico, tales como confusión, respiración de Kussmaul, sudoración, y taquicardia.1 Diagnóstico Es fácil diagnosticar un estado de anemia, pero la labor médica debe orientarse a caracterizarla, para así establecer su causa (etiología). Para ello se deben estudiar a fondo las características de los glóbulos rojos, de los reticulocitos, leucocitos y plaquetas que circulan en la sangre mediante un hemograma o citometría hemática, verificando el hematocrito, y las características de las series hematopoyéticas mediante unmielograma. Generalmente salen moretones en la cadera, también conocida como peltre. Síntomas La anemia afecta si el paciente no presenta suficiente hemoglobina o eritrocitos por litro de sangre. Desde los síntomas tempranos de la anemia, es suave, es fácil confundir los síntomas de la anemia desde síntomas de una cierta enfermedad seria. Los síntomas importantes de la anemia incluyen: palpitación de corazón, fatiga, vértigos, pérdida de concentración, respiración rápida del corazón y piel pálida. La falta de ánimo y la depresión podían también ser un síntoma importante de la anemia. El pulso del dolor de cabeza, de la irritabilidad, del síncope y de limitación son también síntomas de la anemia. Las muestras observables de la anemia son: taquicardia, edema periférico suave, murmur sistólico de la eyección y ronquidos venosos. Los pectoris de la angina entre la gente mayor son una muestra clara de la anemia. Las mujeres tienden para desarrollar la menstruación y el amenorrhea anormales si la anemia los afecta mientras que los varones desarrollan impotencia y disminuyen en libido. La anemia podría o ser el resultado de un desorden heredado o podría resultar debido a su ambiente, tal como infección o exposición a una toxina o a una droga. Clasificación . Anemia Índice de producción de reticulocitos inadecuada respuesta productora a la Índice de producción reticulocitos con respuesta adecuada productora = hemolisis o pérdida de anemia. Sin hallazgos clínicos de hemolisis o pérdida de sangre: Alteración de la producción. Anemia macrocítica(VCM>100) Hallazgos clínicos y MVC anormal: Hemolisis o pérdida y alteración crónica de la producción*. Anemia normocítica(80<VCM<100) sangre sin problemas en la producción de reticulocitos. Hallazgos clínicos y MVC normal: Hemolisis aguda o pérdida sin tiempo para compensar por la médula ósea**. Anemia microcítica (VCM<80) Anemia Drepanocítica: Los glóbulos rojos adoptan forma de hoz en estados de bajo oxígeno (hipoxia) debido a una alteración en la hemoglobina (HbS) y de su membrana; aumentando su fragilidad y subsecuente destrucción intravascular. La clasificación fisiopatológica está basada en el mecanismo que conlleva al estado de anemia, diferenciándolas en: Anemias mediadas por trastornos en la producción de glóbulos rojos Eritropoyesis insuficiente: Endocrinopatías Proceso inflamatorio crónico Fallo renal crónico Anemia aplásica Eritropoyesis inefectiva: Defecto en la síntesis de ácidos nucleicos: deficiencia de ácido fólico y cobalamina Defecto en la síntesis del grupo hemo: déficit de hierro y anemia sideroblástica Defecto en la síntesis de las globinas: talasemia beta y anemia drepanocítica Anemias por pérdida de sangre Pérdidas agudas (repentinas) Pérdidas crónicas (hemofilias, lesiones gastrointestinales, trastornos de la menstruación, etc.) Anemias hemolíticas Talasemia alfa Anemia drepanocítica o de células falciformes Esferocitosis hereditaria Anemia por déficit de la enzima G6FD Anemia por hemoglobinopatías Anemia por infecciones (paludismo) Anemia por agresiones mecánicas (anemia microangiopática, coagulación intravascular diseminada, púrpuras trombocitopénicas, etc.) Anemias autoinmunes (anemia perniciosa, anemia paroxística nocturna, anemia inmunohemolítica) Causas Generalmente, la anemia puede ser provocada por varios problemas, entre los que se incluyen los trastornos en la producción de los eritrocitos: Eritropoyesis insuficiente: Endocrinopatías: alteración en la regulación neuro-hormonal de la homeostasis. Hipotiroidismo: deficiencia de hierro y de eritropoyetina. Hipertiroidismo: aumento del plasma, generando una pseudo anemia por hemodilución. Insuficiencia Adrenal: la disminución de glucocorticoides disminuye la eritropoyesis. Hipoandrogenismo: la disminución de andrógenos disminuye la eritropoyesis. Falta de alimentación. Hipopituitarismo: la disminución de las hormonas adenohipofisiarias disminuye la eritropoyesis (excepto la prolactina, compensando la presencia de esta anemia). Hiperparatiroidismo: el aumento de la parathormona disminuye la eritropoyesis, además de aumento significativo del riesgo de fibrosis en la médula ósea. Proceso inflamatorio crónico: el aumento de la producción de citoquinas (sobre todo la Interleukina-6) ejerce un efecto inhibidor de laeritropoyesis, al aumentar la síntesis y liberación de hepcidina hepática, cuyo mecanismo es bloquear la salida de hierro hepático, aumentar los almacenes de hierro en los macrófagos y disminuir la absorción intestinal de hierro. Además el TNF-alfa y la interleucina-1 están relacionados con una resistencia a la eritropoyetina. Fallo renal crónico: principalmente por una disminución de la producción de eritropoyetina en el riñón. Aunque secundariamente, por un acúmulo de metabolitos tóxicos y alteración del ambiente medular para la eritropoyesis. Anemia aplásica: generalmente adquirida por consumo de fármacos que generan una reacción autoinmune de los linfocitos T (benceno,metotrexato, cloranfenicol) contra las células precursoras de eritrocitos y leucocitos (excepto de los linfocitos). Se caracteriza por unapancitopenia. Existen algunas formas hereditarias, siendo la más común la anemia de Fanconi, que se caracteriza por un defecto en la reparación del ADN eritrocitario (BRCA 1 y 2, Rad51); es de carácter autosómica recesiva, localizada en el cromosoma 16. Eritropoyesis inefectiva Defecto en la síntesis de ácidos nucleicos Déficit de ácido fólico: el tetra hidro folato (THF; forma activa del ácido fólico) es un transportador de fragmentos de un sólo carbono. Con este carbono, el metil-THF formado, contribuirá con la enzima timidilato sintetasa, para la conversión de deoxi-uridilato a timidilato (de U a T en el ADN). Un defecto en el ácido fólico, produce errores en las cadenas de ADN. Déficit de cobalamina: la cobalamina (derivado de la cianocobalamina - vitamina B12) se requiere para la conversión de homocisteína a metionina, esta reacción necesita de un grupo metilo que es brindado por el Metil-THF. Si hay una deficiencia de cobalamina, no se produce esta reacción de la sintetasa de metionina; con el consecuente acúmulo de metil-THF. Esta forma del metil-THF no puede ser retenido en la célula y escapa, generando también una deficiencia de ácido fólico. (El THF para ser retenido necesita conjugarse con residuos de glutamato, empero, como metil-THF, no puede realizarse esta conjugación, además de no liberar su grupo Metil en la reacción; se escapa de la célula). Defecto en la síntesis del grupo Hem Déficit de hierro: en la síntesis del grupo Hem, el último paso es la incorporación del hierro a la Protoporfirina IX; reacción catalizada por la ferroquelatasa en la mitocondria de la célula eritroide. El 67% de la distribución de hierro corporal se encuentra en las moléculas de Hb. En consecuencia, una deficiencia (severa) de Hierro, genera una baja producción de eritrocitos, además de otros síntomas como alteraciones esofágicas, en uñas, etc. Anemia sideroblástica: en la síntesis del grupo Hem, el primer paso es la condensación de una glicina con un Succinil-CoA para formar una molécula conocida como delta - ALA (delta - ácido amino levulínico), reacción catalizada por la enzima ALA-sintasa. Esta enzima requiere al piridoxal fosfato (derivado de la vitamina B6) como coenzima y de Metil-THF como donador del grupo Metilo. En la anemia sideroblástica congénita, existe una mutación en la codificación de la enzima ALA-sintasa que produce una consecuente alteración en la síntesis del grupo Hem. En la anemia sideroblástica adquirida (por alcohol, cloranfenicol, plomo, zinc), se postula el descenso de los niveles de piridoxal fosfato (B6), conllevando a una baja síntesis del grupo Hem. Nótese que se produce un aumento del Metil-THF que, al igual que la anemia por deficiencia de cobalamina, concluye en un escape del ácido fólico. Defecto en la síntesis de las globinas Talasemias: la hemoglobina más abundante en los seres humanos adultos es la conocida como A1 (un par alfa y un par beta). En las talasemias se produce un defecto en la síntesis de las globinas. Si ésta es localizada en la globina alfa se llama alfa-talasemia (donde se evidencia un aumento compensatorio de la globina beta). Si ésta es localizada en la globina beta se llama beta-talasemia (donde se evidencia un aumento compensatorio de la globina alfa). En la alfa talasemia se reconoce una anemia hemolítica, consecuentemente más aguda y peligrosa; en la beta talasemia se reconoce una anemia no tan agresiva (a pesar de la No unión del 2,3 DPG a la cadena Beta). Notar que el acúmulo de las globinas dentro del eritroide puede producir lisis celular. Existe un aumento de los niveles de hierro, debido a la lisis y la destrucción por los macrófagos quienes liberan el Hierro nuevamente a la sangre o lo dirigen hacia el ambiente de la médula ósea. Esto generará una hipertrofia hepática (para conjugar la bilirrubina), hipertrofia esplénica (por la destrucción de los eritrocitos) y una hipertrofia medular (para compensar los bajos niveles de eritrocitos en sangre). Drepanocitosis (anemia falciforme): la función de la hemoglobina en el eritrocito es permitir la captación del oxígeno gaseoso y facilitar de manera reversible su liberación en los tejidos que lo requieran. En la anemia falciforme (drepanocítica) hay una mutación en el ADN que codifica la estructura de las globinas (valina por glutamato en el 6to aminoácido), lo que se constituye en una llamada hemoglobina anormal tipo S. Esta hemoglobina S, ante una baja PO2, tiende a agregarse, generando un cambio estructural en el eritrocito; adaptando una forma de guadaña o plátano (falciforme). Además se ha evidenciado un defecto en la membrana (en el canal de Ca+2, permitiendo su entrada a la célula, con la compensatoria salida de K+) comprometiendo aún más la gravedad de esta anemia. Esta particular forma no les permite un paso fluido por los capilares más pequeños, produciendo una hipoxia tisular grave; con riesgo de isquemia, infarto y agregación microvascular. Infecciones:2 anemia por inflamación/infección crónica. Ciertas enfermedades: enfermedad renal y del hígado. Ciertos medicamentos: los que interfieren en la síntesis de ADN, o que suprimen la producción de ácido gástrico. Nutrición deficiente:3 niños malnutridos, alcoholismo crónico, celiaquía. Asma Asma Inflamación y obstrucción del bronquiolo por exudado mucoso característica del asma. El asma es una enfermedad crónica del sistema respiratorio caracterizada por vías aéreas hiperreactivas (es decir, un incremento en la respuesta broncoconstrictora del árbol bronquial).1Las vías aéreas más finas disminuyen ocasional y reversiblemente por contraerse su musculatura lisa o por ensanchamiento de su mucosa al inflamarse y producir mucosidad,2 por lo general en respuesta a uno o más factores desencadenantes3 como la exposición a un medio ambiente inadecuado (frío, húmedo o alergénico), el ejercicio o esfuerzo en pacientes hiper-reactivos, o el estrés emocional. En los niños los desencadenantes más frecuentes son las enfermedades comunes como aquellas que causan el resfriado común. Ese estrechamiento causa obstrucción y por lo tanto dificultad para pasar el aire que es en gran parte reversible, a diferencia de la bronquitis crónica donde hay escasa reversibilidad. Cuando los síntomas del asma empeoran, se produce una crisis de asma. Por lo general son crisis respiratorias de corta duración, aunque puede haber períodos con ataques asmáticos diarios que pueden persistir por varias semanas. En una crisis severa, las vías respiratorias pueden cerrarse tanto que los órganos vitales no reciben suficiente oxígeno. En esos casos, la crisis asmática puede provocar la muerte.4 El asma provoca síntomas tales como respiración sibilante, falta de aire (polipnea y taquipnea), opresión en el pecho y tos improductiva durante la noche o temprano en la mañana.5 Entre las exacerbaciones se intercalan períodos asintomáticos donde la mayoría de los pacientes se sienten bien, pero pueden tener síntomas leves, como permanecer sin aliento -después de hacer ejercicio- durante períodos más largos de tiempo que un individuo no afectado, que se recupera antes. Los síntomas del asma, que pueden variar desde algo leve hasta poner en peligro la vida, normalmente pueden ser controlados con una combinación de fármacos y cambios ambientales pues la constricción de las vías aéreas suele responder bien a los modernos broncodilatadores. Clasificación Asma producido por esfuerzo. Entre 40% y 80% de la población asmática infantil, presenta broncoconstricción durante el ejercicio, de breve duración. Asma nocturna. Es otra presentación, más frecuente en pacientes mal controlados cuya mortalidad (70%) alcanza pico en la madrugada. Asma ocupacional Asma alérgica Asma estacional Asma inestable o caótica Basada en los patrones de obstrucción bronquial medida a través de aparatos de registro tipo flujometría o espirometría: Asma intermitente: el síntoma aparece menos de una vez por semanas con síntomas nocturnos menos de 2 veces cada mes. Las exacerbaciones tienden a ser breves y entre una crisis y la próxima, el paciente está asintomático. En las pruebas de respiración pulmonar, la PEF o FEV1 son mayores de 80% Asma persistente: tiene tres variedades, la persistente leve con síntomas más de una vez por semana y PEF o FEV1 >80%, la persistente moderada con síntomas diarios y PEF o FEV1 entre 50%-80% y la persistente grave con síntomas continuos, limitación de las actividades físicas y un PEF o FEV1 <50%. Como fundamento en los niveles de control del paciente ya diagnosticado con asma: Controlado: sin síntomas diarios o nocturnos, no necesita medicamentos de rescate, sin exacerbaciones y un PEF normal. Parcialmente controlado: síntomas diurnos o más de dos veces por semana, algún síntoma nocturno, a menudo amerita uso de medicamento de rescate > de 2 veces por semana, con 1 o más crisis por año. No controlado: 3 o más características del asma, con exacerbaciones semana Epidemiología El asma es una enfermedad frecuente que varía mucho de un país a otro. Afecta alrededor del 3 al 7% de la población adulta, siendo más frecuente en edades infantiles. Es una de las más importantes enfermedades crónicas, es decir, de duración prolongada, en niños.5 Es más frecuente en el sexo masculino en una relación de 2:1, pero al llegar a la pubertad, esta relación tiende a igualarse.6 En los últimos veinte años se ha registrado un aumento en su incidencia debido en parte a la contaminación ambiental y las consecuencias de esta, y en parte al aumento de la población mundial. Por ejemplo, la Organización Mundial de la Salud reportó que un 8% de la población suiza padecía de asma, comparado con solo 2% hace 25-30 años atrás.7 La enfermedad tiene un fuerte componente hereditario, expresado como un antecedente familiar de rinitis, urticaria y eccema, por ejemplo. Sin embargo, muchos asmáticos no tienen antecedentes familiares que indiquen una asociación atópica. Hasta el momento no se ha demostrado ninguna de las hipótesis infecciosas propuestas como origen del cuadro. Los niveles más elevados de asma mudial, de acuerdo con el Global INitiative for Asthma (GINA) en febrero de 20048 ocurrieron en aproximadamente 30% de los niños en el Reino Unido, Nueva Zelanda y Australia o 20% de los niños en el Perú, Nueva Zelanda y Austalia (varía dependiendo del método de investigación usado para los cálculos) y aproximadamente 25% de los adultos en Gran Bretaña, Australia yCanadá. Hay un mayor porcentaje de fumadores y de enfermedades concomitantes alérgicas tales como rinitis, conjuntivitis y dermatitis entre los pacientes diagnosticados de asma alérgica que en otros pacientes.9El asma bronquial es común en personas jóvenes con una historia clínica de catarros recurrentes, o con antecedentes familiares asmáticos. Las crisis de asma se relacionan con el consumo de ciertos alimentos o la presencia de determinados agentes alérgenos. Las causas que provocan el asma bronquial y motivan la respuesta de los mecanismos principalmente inmunológicos se clasifican en:1 Extrínsecas. Iniciada en la infancia con antecedentes familiares positivos para alergias y se asocia con una hipersensibilidad tipo 1 y otras manifestaciones alérgicas (IgE), inducidas por agentes alérgenos como el polen, lana, polvo, etc., o contaminación atmosférica, materias irritantes, variaciones meteorológicas, aspergilosis y otros. En aproximadamente 50% de los niños con asma y un porcentaje menor de adultos, la exposición a alérgenos es responsable parcial o sustancialmente de la inflamación asmática por medio de reacciones dehipersensibilidad.10 Las crisis son súbitas, autolimitadas y breves en duración. Cursan con buen pronóstico, responden a la inmunoterapia y a esteroides a largo plazo por vía inhalada con absorción sistémica minúscula, de modo que los efectos sobre el resto del cuerpo son virtualmente inexistentes. Intrínsecas o idiopática. Por lo general comienza en mayores de 35 años y sin antecedentes personales ni familiares. Se inicia por estímulos no inmunológicos, sin elevar IgE, representados por microbios, hongos, tos, trastornos psíquicos, estrés, etc. Mixtas. Combinación con frecuencia de naturaleza bacteriana de factores intrínsecos y extrínsecos. ]Ambientales Existen varios factores de riesgo ambientales que están asociados al asma, sin embargo pocos han sido replicados de manera consistente o que contengan metaanálisis de varios estudios para poner en evidente una asociación directa. Algunos de estos factores ambientales incluyen: Aire de pobre calidad, producido por contaminación automovilística o niveles elevados de ozono, tiende a estar repetidamente asociado a un aumento en la morbilidad asmática y se ha sugerido una asociación con la aparición por primera vez de asma en un individuo. 11 12 Humo de cigarrillo ambiental, en especial por fumadoras maternas, se asocia a un mayor riesgo de prevalencia y morbilidad asmática incluyendo infecciones respiratorias. 11 Infecciones virales a una edad temprana, junto con exposición a otros niños en guarderías puede resultar protector en contra del asma, aunque los resultados son controversiales y puede que esta protección aparezca en el contexto de una predisposición genética. 11 13 14 El uso de antibióticos temprano en la vida puede causar la aparición de asma al modificar la flora microbiana normal de un individuo, predisponiéndolo a una modificación del sistema inmune. 15 Las cesáreas tienden a asociarse con el asma con más frecuencia que el parto vaginal, aparentemente por razones similares a los antibióticos, es decir, una modificación del componente microbiano e inmunitario del individuo nacido por una cesárea. 16 Estrés psicológico.11 Infecciones virales. Varias infecciones virales como HSV, VSV, CSV, han sido correlacionadas con diversos tipos de asma15 [editarGenética Se ha asociado a más de 100 genes con el asma, por lo menos en un estudio genético.17 Aunque en el estudio aún se necesita añadir un componente de replicación genética, para el 2005, unos 25 genes se habían asociado con el asma en seis o más poblaciones diferentes, entre ellos GSTM1, IL-10, IL-4, IL13, CTLA4, CD14, TNF y el receptor β-2 adrenérgico ADRB2. Muchos de estos genes se relacionan con el sistema inmune o modulan los procesos de la inflamación. Sin embargo, a pesar de esta lista de genes y su posible asociación con el asma, los resultados no son del todo consistentes entre las diferentes poblaciones,17 es decir, estos genes no se asocian al asma bajo todas las condiciones, sino que la causa genética del asma es una interacción compleja de diversos factores adicionales. Patogenia Vías aéreas inflamadas y broncoconstricción en el asma. Aunque se conoce que el asma es una condición causada por unainflamación (del latín, inflammatio, encender , hacer fuego) persistente o crónica de las vías aéreas, los componentes precisos de esta inflamación están todavía por dilucidar y las causas de esta inflamación son inciertas. Muchas células inflamatorias pueden estar implicadas e interactuar con otras de alguna manera compleja. La activación de estas células y la subsecuente producción de mediadores inflamatorios puede que sean de mayor relevancia que la sola presencia de estas células en las vías aéreas. 18 Este proceso de inflamación crónica puede que conduzca a cambios estructurales, tales como la fibrosis, el engrosamiento o hipertrofiadel músculo liso bronquial, hipertrofia de las glándulas y la angiogénesis lo que puede dar lugar a una obstrucción irreversible de la vía aérea. Desde el punto de vista emocional, si bien no se ha precisado su causa, está bien definido que las emociones del paciente toman un papel muy importante en el desarrollo de la enfermedad. En un nivel subconsciente el asma puede desarrollarse más en infantes que provienen de hogares conflictivos, evidenciando de esta manera que el estrés es el principal factor desencadenante. Es fundamental, para el enfermo de asma, llevar una vida no solo llena de cuidados en relación a los agentes patógenos desencadenantes, sino también cuidados en cuanto a su ambiente emocional para que su vida transcurra sin estrés. Bronquiolitis La bronquiolitis es una enfermedad común del tracto respiratorio, provocada por una infección que afecta las diminutas vías respiratorias, denominadas “bronquiolos”, que llevan a los pulmones. A medida que estas vías respiratorias se inflaman, se hinchan y se llenan de mucosidad, por lo que resulta difícil respirar. Bronquiolitis: afecta con mayor frecuencia a bebés y niños pequeños, porque sus pequeñas vías respiratorias se bloquean con mayor facilidad que las de los niños de más edad o los adultos suele darse en los dos primeros años de vida, con una mayor incidencia entre los 3 y los 6 meses es más común en niños varones, en aquellos que no fueron amamantados y en los que viven hacinados La asistencia a guarderías y la exposición al humo del cigarrillo también pueden aumentar las probabilidades de que un bebé contraiga bronquiolitis. Si bien, a menudo, se trata de una enfermedad leve, algunos bebés están en riesgo de sufrir una afección más grave que requiere hospitalización. Las condiciones que aumentan el riesgo de una infección severa incluyen el nacimiento prematuro, una enfermedad pulmonar o cardíaca crónica previa y un sistema inmunológico debilitado por enfermedades o medicamentos. Los niños que han padecido bronquiolitis tienen más probabilidades de desarrollar asma en una etapa posterior de la vida, pero aún no resulta claro si la bronquiolitis provoca o dispara el asma, o si los niños que finalmente padecen asma sólo eran más propensos a desarrollar bronquiolitis siendo bebés. Se están realizando estudios para aclarar la relación entre la bronquiolitis y el desarrollo posterior del asma. La bronquiolitis suele ser provocada por una infección viral, por lo general el virus sincicial respiratorio (VSR). Las infecciones causadas por este virus son responsables de más de la mitad de todos los casos de bronquiolitis y ocurren sobre todo en el invierno y principios de la primavera. Otros virus asociados con la bronquiolitis incluyen el rinovirus, el virus de la influenza y el metapneumovirus. Bronquitis INFORMACIÓN GENERAL ¿Qué es la bronquitis? en directorio de enfermedades de la a-z en entorno medico La inflamación de los bronquios en los pulmones es a lo que se le llama Bronquitis. Siempre se debe a virus o bacterias, pero el humo del cigarro y la contaminación también pueden ser culpables de este mal, que muchas veces se da después de un catarro que no se curó bien o de una infección respiratoria. SÍNTOMAS de la bronquitis Los signos primarios y los síntomas son la disnea y la tos leve persistente que puede o no producir mucosidad. Según progresa la enfermedad, la dificultad para respirar puede limitar la capacidad de la persona para llevar a cabo su actividad diaria. Otros síntomas son: Una sensación de tener el pecho apretado, cansancio, fiebre baja, dolor de garganta, nariz que escurre y un silbido característico al respirar. TRATAMIENTOS Y RECOMENDACIONES de la bronquitis El manejo médico adecuado y unos hábitos de vida saludables pueden ayudar a aquellas personas con la enfermedad a gozar de una mejor calidad de vida, aumentar la tolerancia a la actividad física habitual y reducir las perspectivas de complicaciones. 1. Medicación -Broncodilatadores : Mediante la relajación y el ensanchamiento de los bronquios, estos medicamentos permiten que se introduzca más oxígeno en los pulmones. Hay broncodilatadores en jarabes, en comprimidos o en aerosol. Vacunas. Dado que algunas enfermedades comunes, relativamente leves en otros pacientes, pueden presentar graves riesgos para la salud en los pacientes, suele recomendarse en estos pacientes una vacuna antigripal (administrada en octubre o noviembre antes del comienzo de la estación de la gripe) y una vacuna contra la neumonía (una inyección de una sola vez). Antibióticos: Pueden ser necesarios para tratar una infección respiratoria aguda y, en algunos casos, para ayudar a prevenir una infección bacteriana. 2. Ejercicio: Un programa de ejercicio moderado siempre bajo supervisión médica puede ayudar a los pacientes a que lleven vidas más activas. La forma física no puede mejorar la función de los pulmones, pero puede aumentar la tolerancia de una persona al esfuerzo, al permitir al corazón y otros músculos a utilizar el oxígeno disponible de forma más eficiente. A veces puede ser necesario algún medicamento broncodilatador antes de una sesión de ejercicio. Son muy importantes los ejercicios de respiración para aumentar la fuerza y la resistencia de los músculos que controlan la inspiración y la espiración, así como ciertas técnicas para ayudar a despejar los pulmones de secreciones mucosas. 3. Nutrición e hidratación: Los hábitos nutricionales adecuados desempeñan una función importante en la forma física y la resistencia a la infección. Los pacientes que experimentan disnea al comer, pueden tolerar mejor comidas más pequeñas y frecuentes. Pueden estar indicados ciertos suplementos nutricionales si su médico sospecha que no están satisfaciéndose las necesidades nutricionales de un paciente. Es fundamental para todo paciente permanecer bien hidratado(a), bebiendo al menos ocho vasos de agua u de otros líquidos al día, lo que ayudará a mantener una expectoración más floja y fluída, y por lo tanto una tos más eficaz. 4.Otras medidas: No fumar NUNCA. Evitar áreas cerradas donde están fumando otras personas. Evitar el contacto con personas que sufren resfriados o gripe. Al primer signo de una infección respiratoria, contactar al médico. Respirar siempre por la nariz, como manera de introducir en los pulmones aire más caliente. En pleno invierno, use una bufanda sobre la boca y la nariz. En días de especial polución atmosférica, debido al ozono alto u otros contaminantes, permanezca dentro de casa con las ventanas cerradas. Evite respirar polvo, gases del automóvil, pintura, aerosoles, etc. Emplee un humidificador si el aire en su hogar es muy seco. En el futuro, nuevas terapias médicas. Ahora bajo investigación puede que mejoren la calidad de vida de las personas que desarrollan la Enfermedad Pulmonar Obstructiva Crónica. Es evidente, sin embargo, que la mejor manera de prevenir esta enfermedad tan incapacitante es crear un mundo libre de humo. Infección urinaria Infección del Tracto Urinario Leucocitos en orina vistos bajo un microscopio de una muestra de una paciente con infección urinaria. La infección urinaria, infección de orina, o infección del tracto urinario (ITU), es la existencia de gérmenes patógenos en la orina por infección de la uretra, la vejiga, el riñón o lapróstata. Los síntomas que acompañan a una infección de orina son los que componen elsíndrome miccional, teniendo en cuenta que las infecciones de orina también pueden ser asintomáticas. Desde el punto de vista microbiológico, cuando se detecta un crecimiento de 10.000 unidades formadoras de colonia por mililitro (ufc/ml) en una muestra de orina bien recogida, puede existir una infección urinaria. Cuando existen síntomas urinarios o piuria se considera ITU con valores mucho menores (hasta 100 ufc/ml). Cuando el recuento de colonias es superior a 10.000 ufc/ml y hay más de dos especies de gérmenes indica contaminación de la muestra. Se considerabacteriuria asintomática cuando, en ausencia de síntomas, hay más de 10.000 ufc/ml de unmicroorganismo en cultivo puro en dos muestras diferentes. Ante un síndrome miccional en el que se excluyen otras causas del mismo (vaginitis, uretritis,prostatitis) y se confirma la presencia de leucocitos en orina se puede hacer el diagnóstico de infección urinaria sin necesidad de realizar urocultivo. Las infecciones del tracto urinario pueden ser tratadas con éxito con antibióticos. En casos no complicados, a menudo la enfermedad cede sin medicamentos. Epidemiología El número de casos nuevos en un año (incidencia) se acerca al 5% en el sexo femenino en los grupos de menor edad. A mayor edad se eleva alrededor del 20%. Aunque son infrecuentes las infecciones del tracto urinario en los hombres jóvenes, su riesgo se vuelve similar a la de las mujeres con el paso de los años. Existen tres picos de frecuencia para las infecciones del tracto urinario en la población. Una primera aparición de casos agrupados se encuentra en lactantes y niños pequeños, ya que todavía no reciben tratamiento de posibles malformaciones del tracto urinario. Asimismo, en este grupo de edad se vuelven frecuentes las infecciones con repetición. El segundo pico de frecuencia se encuentra entre las mujeres adultas, probablemente por el aumento en la actividad sexual y una mayor susceptibilidad durante el embarazo. Las personas mayores de ambos sexos, son el tercer grupo con mayor incidencia de la enfermedad. Las razones de ello son el estrechamiento de las vías urinarias por la degeneración relacionada con la edad, tales como la hiperplasia prostática en hombres y trastornos del útero en mujeres. Las infecciones urinarias son la principal causa de bacteriemia por bacterias Gram negativas.1 Etiología de la infección urinaria Muchos gérmenes distintos pueden invadir el tracto urinario, pero los microorganismos más frecuentes son los bacilos gramnegativos como: Escherichia coli: Provoca el 80% de las infecciones urinarias agudas en general. Proteus y Klebsiella son las bacterias aisladas con más frecuencia en personas con litiasis. Enterobacter, Serratia y Pseudomona. Entre las bacterias Gram positivas encontramos: Staphylococcus saprophyticus Streptococcus agalactiae Enterococcus: Indica infección mixta o patología urinaria orgánica. Staphylococcus aureus: Cuando está presente debe descartarse la contaminación urinaria por vía hematógena si el paciente no es portador de sonda urinaria. Candida: Es el hongo más frecuente en pacientes con diabetes mellitus, pacientes con sonda urinaria y pacientes que han recibido tratamiento antibiótico previamente. Patogenia Una infección del tracto urinario se produce en el 95-98% de casos con aumento de agentes microbianos instalados a través de la uretra. En los demás casos, la infección del tracto urogenital se instala a través del torrente sanguíneo. El agente, generalmente bacterias, en la mayoría de los casos proviene del mismo cuerpo, fundamentalmente de la flora intestinal, vía la apertura exterior de la uretra y viajan por la uretra hasta la vejiga, donde se instala una inflamación de la vejiga llamada cistitis. Cuando la colonización asciende en dirección al riñón, puede conducir a la inflamación de la pelvis renal, incluyendo la infección del propio tejido renal (pielonefritis), y, por último, colonización de la sangre (Urosepsis). Algunos factores que aumentan el riesgo de una ITU incluyen: Actividad sexual Embarazo Obstrucción urinaria Disfunción neurógena Reflujo vesicouretral Factores genéticos El agente colonizante debe valerse de elementos propios para superar los mecanismos de defensa del hospedador. Algunos de estos mecanismos de defensa consisten en el flujo de líquido durante la micción, el urotelio o epitelio del tracto urinario, así como los anticuerpos IgAque se encuentran en el urotelio. Esto hace que la vejiga en individuos sanos se mantenga estéril. La orina de por sí es eficaz únicamente frente a unas pocas especies bacterianas y puede incluso promover el crecimiento de muchos tipos de agentes patógenos. Los factores que afectan la germinación del patógeno durante el ascenso urinario incluyen la formación de una cápsula bacteriana, la producción de hemolisina para la disolución de los glóbulos rojos y la formación de filamentosos pilosos celulares que permiten la fijación de las bacterias a la superficie del tejido de las vías urinarias. La mayor densidad de receptores sensibles a estos pili se encuentra en la entrada de la vagina, la vejiga, uréter y pelvis renal. ]Clasificación Según la localización principal del tracto urinaria donde se localiza la infección se considera: Uretritis: Infección urinaria localizada en la uretra. Cistitis: Localizada en la vejiga urinaria. Pielonefritis: Localizada en los riñones. Prostatitis: Localizada en la próstata. Recientemente se ha discutido la utilidad de clasificar las infecciones urinarias basadas en los hallazgos clínicos porque tiene la ventaja de dividir a los pacientes en grupos basados en factores clínicos comunes, lo que puede tener impacto sobre la morbilidad y el tratamiento.2Basado en ello, se clasifican las infecciones urinarias en:3 Cistitis no complicadas en mujeres jóvenes Cistitis recurrentes en mujeres jóvenes Pielonefritis agudo no complicada en mujeres jóvenes Infección urinaria complicada y sus variedades Infección urinaria asociada a colocación de catéteres Infección urinaria en hombres Bacteriuris asintomática Cistitis no complicada en mujeres jóvenes Las mujeres jóvenes sexualmente activas son quienes tienen un mayor riesgo de infecciones urinarias. Esta propensidad se debe a suanatomía, especialmente a una uretra corta y a factores de conducta,2 incluyendo el posponer la micción, actividad sexual y el uso de diafragmas y espermicidas que promueven la colonización de bacterias coliformes en el área periuretral. Afortunadamente la mayoría de las ITU en esta población no son complicadas y rara vez se ven asociadas con anormalidades funcionales o anatómicas.2 En estudios de mujeres que consultan por dolor al orinar y frecuencia urinaria aumentada, al realizar en ellas estudios de pielografía intravenosa y ultrasonido se demostró una muy baja cantidad (tasas menores al 1%) de anormalidades del tracto urinario. Por lo tanto, no se justifica insistir en planes diagnósticos agresivos en mujeres jóvenes que presentan un episodio de cistitis. Un estimado de 40% de mujeres reportan haber tenido una ITU al menos una vez en sus vidas. Patogenia La cistitis no complicada se limita a pocos patóvenos. Hasta un 90% de episodios no complicados de cistitis son causados por E. coli y el resto por Staphylococcus saprophyticus coagulasa negativa y otros Enterobacteriaceae y enterococos. Adicionalmente la susceptibilidad antimicrobiana de estos organismos es altamente predecible. La mayoría, hasta un tercio, son resistentes a la ampicilina y sulfonamidas pero la mayoría, entre 85-95%, persiste susceptibles al trimetoprim-sulfametoxazol (TMP-SMX) y fluoroquinolonas. Diagnóstico El diagnóstico de una ITU se basaba en cultivos urinarios que presentaban más de 100 mil unidades formadoras de colonias (UFC) por cada mililitro de orina, un valor con gran especificidad para el diagnóstico de una verdadera infección, aún en pacientes asintomática. Sin embargo, en estudios recientes se ha establecido que un tercio o más de los casos de mujeres asintomáticas tenían UFC por debajo al acostumbrado de 100 mil por mililitro. Un contaje de 100 CFU/mil resultó ser un valor altamente predictivo de una cistitis en mujeres asintomáticas. Desafortunadamente, algunos laboratorios clínicos no reportan conteos menores de 10 mil CFU por mil de orina. En vista de ello, las infecciones urinarias causadas por un reducido número de bacterias. En vista del limitado espectro de organismos que causan cisitits no complicada en mujeres jóvenes y que la susceptibilidad de esos organismos es tan predecible, los cultivos de orina y antibiogramas en estos pacientes no añaden información adicional en términos delantibiótico a ser usado en el tratamiento de la infección. Por lo tanto, no se justifican los cultivos de orina como parte de los perfiles rutinarios en estas pacientes.2 Tratamiento Las opciones de tratamiento en mujeres jóvenes sospechadas o diagnosticadas con cistitis no complicada incluye una dosis deantibioticoterapia o cursos de tres a siete días con antibióticos. El tratamiento por más de siete días, aunque efectivo, se asocia a mayores efectos secundarios por lo que no suele indicarse más. El tratamiento con una sola dosis ofrece la ventaja de costos reducidos, mejor adherencia al tratamiento y una efectividad comparable a otros regímenes. Se ha estudiado el uso de una sola dosis de 3 gr de amoxicilina, 400 mg de trimetoprima y TMP-SMX a dosis dos o tres veces más altas de lo usualmente indicado, 800 mg de norfloxacina, 125 mg deciprofloxacina y 200 mg de ofloxacina, los cuales confirmaron que la terapia con una sola dosis es altamente efectiva en el tratamiento de la cistitis no comlicada con tasas de curación que van de 80 a 90%. La fosfomicina puede indicarse como dosis única de 3 gr para el tratamiento de ITU no complicadas. El medicamento es activo en contra de E. coli, enterococos y Citrobacter, Enterobacter, Klebsiella y Serratia. Las tasas de curación suelen alcanzar el 99% y puede ser usada en mujeres embarazadas. El uso de antibióticos en una sola dosis ha perdido preferencia cuando se observó que las pacientes tenían un mayor riesgo de recurrencia en las primeras seis semanas posterior al tratamiento inicial. El riesgo se le atribuye que el antibiótico tomado una sola vez no eliminaba las bacterias gram negativas del recto, la fuente o reservorio de los patógenos causantes de la ITU. A diferencia del tratamiento con una sola dosis de antibióticos, la terapia por tres días reduce la carga bacteriana del recto y no suele estar asociado a recurrencias. Por lo tanto, el tratamiento por tres días parece ofrecer la combinación más óptima en cuanto a conveniencia, bajo costo, efectividad y menores efectos secundarios en comparación con tratamientos por siete días o más.2 La terapia menos costosa suele ser dosis dobles dos veces al día de TMP-SMX por tres días. Otros antibióticos usados por tres días incluyen la nitrofurantoína (100 mg cuatro veces al día), cefadroxilo (500 mg dos veces al día) y amoxicilina (500 mg diarios). Las fluoroquinolonas, 250 mg de ciprofloxacina dos veces al día y 200 mg de ofloxacina dos veces al día, suelen tener menos toxicidad que la trimetropim-sulfa y tienen mejores efectos curativos aunque son más costosas. Las quinolonas usadas para el tratamiento de cistitis complicada y no complicada incluyen la ciprofloxacina, norfloxacina, ofloxacina,enoxacina, lomefloxacina, esparfloxacina y la levofloxacina. La fluoroquinolona de nueva generación esparfloxacina (400 mg el primer día y luego 200 mg los siguientes dos días) tiene efectos comparables a la ofloxacina o la ciprofloxacina, pero causa fototoxicidad y está asociada a prolongación del intervalo QT. Las fluoroquinolonas deben ser reservadas para pacientes que no toleran las sulfonamidas o el tripetropim o que tengan una mayor frecuencia de resistencia a estos antibióticos. La duración óptima es por tres días. Las terapias por siete días se consideran en pacientes embarazadas,diabéticas y mujeres con síntomas por más de una semana y, por lo tanto, con una mayor probabilidad de pielonefritis por retardo en el tratamiento. == Cistitis recurrentes en mujeres jóvenes == ve al doctor lucero La cistitis aguda recurrente puede aparecer hasta en 20% de mujeres jóvenes.3 La identificación del organismo causante de episodios de infección recurrente permite distinguir entre una recaída por el mismo organismo o una recurrencia por un organismo diferente a los anteriores. Las infecciones causadas por el mismo microorganismo son, en principio, infecciones urinarias complicadas y requieren cursos más prolongados de antibioticoterapia, así como otras posibles medidas de diagnóstico. Afortunadamente, las estadísticas demuestran que las ITU recurrentes por lo general no se asocian con el mismo organismo.3Estas infecciones tampoco suelen ser causadas por anoramliadades anatómicas y en la mayoría de los casos no requieren extensas medidas genitourinarias diagnósticas. Las pacientes con más de tres infecciones urinarias documentadas por cultivo urinario en el último año, suelen ser manejadas por una de tres medidas preventivas: 1. Tratamiento con un curso de tres días con el antibiótico de costumbre 2. Profilaxis post-coital con media dosis de trimetropim-sulfa de doble fuerza (40/200 mg) si se ha determinado que la ITU se relaciona con la actividad sexual 3. Profilaxis continua por seis meses con uno de los siguientes: 1. Trimetoprim-sulfametoxazol, media tableta de 40/200 mg diarios; 2. Nitrofurantoína, 50 a 100 mg diarios; 3. Norfloxacina, 200 mg diarios; 4. Cefalexina, 250 mg Se ha demostrado que cada uno de los anteriores disminuye la morbilidad de ITU recurrentes sin un aumento concomitante en la resistencia a estos antibióticos. Infecciones urinarias complicadas Las infecciones urinarias complicadas son aquellas que se presentan en cualquiera de las siguientes situaciones: Embarazo Paciente varón Trastornos estructurales o funcionales del tracto urinario, incluyendo malformaciones, procesos obstructivos como tumores de próstata y prolapsos genitales Diabetes mellitus. Inmunosupresión, cualquier estado fisiopatológico en donde halla una disminución de las defensas como en el caso de tratamientos oncológicos, neutropenia, esplenectomía, SIDA, ancianos Manipulación urológica reciente Síntomas de más de una semana de evolución o cuando se aíslan gérmenes resistentes o atípicos como la Pseudomonas; E. coliresistentes a antibioticoterapia convencional Enfermedad médica subyacente como cardiopatías o enfermedad respiratoria crónica.
