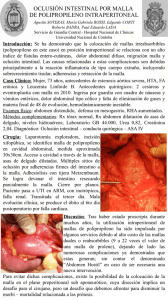
Tesis - Universidad de Colima
Anuncio

Universidad de Colima Doctorado en Ciencias Médicas “SELLOS DE FIBRINA PARA LA PREVENCIÓN DE LA FORMACIÓN DE ADHERENCIAS EN LA REPARACIÓN DE LAS HERNIAS DE LA PARED ABDOMINAL: MODELO ANIMAL EN RATAS.” Tesis que para obtener el Grado de Doctor en Ciencias Médicas PRESENTA M. en C. EMILIO PRIETO DÍAZ CHÁVEZ Asesores CLÍNICOS: D. en C. BENJAMÍN TRUJILLO HERNÁNDEZ Médico Especialista en Medicina Interna D. en C. ECTOR JAIME RAMÍREZ BARBA Médico Especialista en Cirugía General BÁSICO: D. en C. RAFAEL COLL CÁRDENAS. Investigador Titular, Centro Universitario de Investigaciones Biomédicas Coasesores: M. en C. OSCAR URIBARREN BERRUETA. Estudiante del Doctorado en Ciencias. Médico Especialista en Ginecología y Obstetricia. M. en C. RAFAEL BUSTOS SALDAÑA Estudiante del Doctorado en Ciencias Médicas, Médico Familiar de HGZ # 12 del I.M.S.S Jalisco Colima, Col. Enero de 2003 UNIVERSIDAD DE COLIMA Centro Universitario de Investigaciones Biomédicas DR. ALEJANDRO ELZALDE LOZANO DIRECTOR FACULTAD DE MEDICINA PRESENTE. Comunico a usted que el candidato a Doctor en Ciencias Médicas, Maestro en Ciencias EMILIO PRIETO DÍAZ CHÁVEZ, ha terminad su tesis “SELLOS DE FIBRINA PARA LA PREVENCIÓN DE LA FORMAClÓN DE ADHERENCIAS EN LA REPARACIÓN DE LAS HERNIAS DE LA PARED ABDOMINAL: MODELO ANIMAL EN RATAS.” Las indicaciones emitidas por los examinadores en el preexamen, han sido tomadas en consideración, por lo que en mi calidad de asesor expreso que el M. en C. Prieto Díaz Chávez puede presentar su examen en la fecha más próxima posible. Atentamente, ’ ARDO. POSTAL 199 TEL. (01-3) 3 16 11 29 C.P. 28000 COLIMA. COL. , MÉXICO UNIVERSIDAD DE COLIMA Centro Universitario de Investigaciones Biomédicas DR. ALEJANDRO ELKALDE LOZANO DIRECTOR FACULTAD DE MEDICINA PRESENTE. Comunico a usted que el candidato a Doctor en Ciencias Médicas, Maestro en Ciencias EMILIO PRIETO DÍAZ CHÁVEZ, ha terminad su tesis “SELLOS DE FIBRINA PARA LA PREVENCIÓN DE LA FORMACIÓN DE ADHERENCIAS EN LA REPARACIÓN DE LAS HERNIAS DE LA PARED ABDOMINAL: MODELO ANIMAL EN RATAS.” Las indicaciones emitidas por los examinadores en el preexamen, han sido tomadas en consideración, por lo que en mi calidad de asesor expreso que el M. en C. Prieto Díaz Chávez puede presentar su examen en la fecha más próxima posible. Atentamente, D. EN C. RAFAEL COLL CÁRDENAS DIRECTOR DE TESIS APDO. POSTAL 199 TEL. (01-3) 3 16 11 29 C.P. 28000 COLIMA, COL., MÉXICO JURAMENTO HIPOCRÁTICO “Juro por Apolo médico, por Asclepio, Higiea y Panacea, así como por todos los dioses y diosas, poniéndolos por testigos, dar cumplimiento en la medida de mis fuerzas y de acuerdo con mi criterio a este juramento y compromiso: Tener al que me enseño este arte en igual estima que a mis progenitores, compartir con él mi hacienda y tomar a mi cargo sus necesidades si le hiciere falta; considerar a sus hijos como hermanos míos y enseñarles este arte, si es que tuvieran necesidad de aprenderlo, de forma gratuita y sin contrato; hacerme cargo de la preceptiva, la instrucción oral y todas las demás enseñanzas de mis hijos, de los de mi maestro y de los discípulos que hayan suscrito el compromiso y estén sometidos por juramento a la ley médica, pero a nadie más. Haré uso del régimen dietético para ayuda del enfermo, según mi capacidad y recto entender; del daño y la injusticia le preservaré. No daré a nadie, aunque me lo pida, ningún fármaco letal, ni haré semejante sugerencia. Igualmente tampoco proporcionaré a mujer alguna un pesario abortivo. En pureza y santidad mantendré mi vida y mi arte. No haré uso del bisturí ni aun en los que sufren del mal de la piedra: dejaré esta práctica a los que la realizan. A cualquier casa que entrare acudiré para asistencia del enfermo, fuera de todo agravio intencionado o corrupción, en especial de prácticas sexuales con personas, ya sean hombres o mujeres, esclavos o libre. Lo que en el tratamiento, o incluso fuera de él, viere u oyere en relación con la vida de los hombres, aquello que jamás deba trascender, lo callaré teniéndolo por secreto. En consecuencia, séame dado, si a este juramento fuere fiel y no lo quebrantaré, el gozar de mi vida y de mi arte, siempre celebrando entre todos los hombres. Mas si lo transgredo y cometo perjurio, sea de esto lo contrario.” Traducido del griego de Ma. Lara Nava. Gredos, Madrid, 1983. INVOCACIÓN “Dios, llena mi alma de amor por el arte y todas las criaturas. Aparta de mí la tentación de que la sed de lucro y la búsqueda de la gloria me influencien en el ejercicio de mi profesión. Sostén de la fuerza de mi corazón para que esté siempre dispuesto a servir al pobre y al rico, al amigo y al enemigo, al justo y al injusto. Haz que no vea más que al hombre en aquél que sufre. Haz que mi espíritu permanezca claro en toda circunstancia pues grande y sublime es la ciencia que tiene por objeto conservar la salud y la vida de todas las criaturas. Haz que mis enfermos tengan confianza en mi y en mi arte y que sigan mis consejos y prescripciones. Aleja de sus lechos a los charlatanes, al ejército de parientes con sus mil consejos y a los vigilantes que siempre lo saben todo; es una casta peligrosa, que hace fracasar por vanidad las mejores intenciones. Concédeme, Dios mío, indulgencia y paciencia con los enfermos obstinados y groseros. Haz que sea moderado en todo, pero insaciable en mi amor por la ciencia. Aleja de mí la idea de que lo puedo todo. Dame la fuerza, la voluntad y la oportunidad de ampliar cada vez más mis conocimientos, a fin de que pueda procurar mayores beneficios a quienes sufren ¡Amén! Moisés Ben-Maicomoniodes, el Español. ÍNDICE: ÍNDICE DE FIGURAS Y TABLAS........................................................................ 1 1. HOJA PRESENTACIÓN.................................................................................. 3 A. TÍTULO........................................................................................................ 3 B. NOMBRE Y ADSCRIPCIÓN DEL INVESTIGADOR.................................. 4 C. NOMBRE DE LOS ASESORES: CLÍNICOS, BÁSICOS Y EXTERNOS... 4 D. NOMBRE DE LOS DEPARTAMENTOS Y/O UNIDADES DONDE SE DESARROLLARÁ EL PROYECTO............................................................ 4 E. DOMICILIO Y TELÉFONO DEL INVESTIGADOR..................................... 4 2. DEDICATORIA Y AGRADECIMIENTOS......................................................... 5 3. RESUMEN....................................................................................................... 6 4. INTRODUCCIÓN...................... ...................................................................... 8 5. MARCO TEÓRICO........................................................................................... 10 A. ANTECEDENTES CIENTÍFICOS................................................................ 10 HISTORIA.................................................................................................... 10 CONSIDERACIONES ANATÓMICAS............................................................................................. 11 FISIOLOGÍA DE LA PARED ABDOMINAL................................................. 12 HISTOLOGÍA MUSCULAR.......................................................................... 13 B. ESTADO ACTUAL DEL CONOCIMIENTO................................................. 16 CLASIFICACIÓN......................................................................................... 18 RECURRENCIAS........................................................................................ 18 TÉCNICAS LIBRES DE TENSIÓN.............................................................. 19 MATERIALES ALOPLÁSTICOS.................................................................. 22 RESPUESTA INFLAMATORIA A LA AGRESIÓN....................................... 23 FORMACIÓN DE ADHERENCIAS.............................................................. 32 SELLOS DE FIBRINA EN LA CICATRIZACIÓN.......................................... 34 MODELO ANIMAL....................................................................................... 36 C. MARCO CONCEPTUAL............................................................................. 37 6. DEFINICIÓN DEL PROBLEMA....................................................................... 38 7. JUSTIFICACIÓN.............................................................................................. 39 A. MAGNITUD................................................................................................. 39 B. TRASCENDENCIA...................................................................................... 39 C. VULNERABILIDAD.................. .................................................................... 40 D. FACTIBILIDAD............................................................................................ 40 E. VIABILIDAD................................................................................................. 40 8. HIPÓTESIS...................................................................................................... 42 A. GENERAL.................................................................................................... 42 B. ESTADÍSTICA............................................................................................. 42 9. OBJETIVOS..................................................................................................... 43 A. GENERAL.................................................................................................... 43 B. ESPECÍFICOS............................................................................................. 43 10. MATERIAL Y MÉTODOS........... .................................................................... 44 A. DISEÑO DE ESTUDIO.................................................................................. 44 B. DEFINICIÓN DEL UNIVERSO DE ESTUDIO............................................. 44 C. TAMAÑO DE MUESTRA............................................................................. 44 D. DEFINICIÓN DE LAS UNIDADES DE OBSERVACIÓN............................. 45 E. DEFINICIÓN DEL GRUPO CONTROL....................................................... 45 F. CRITERIOS DE INCLUSIÓN....................................................................... 45 G. CRITERIOS DE NO-INCLUSIÓN................................................................ 45 H. CRITERIOS DE EXCLUSIÓN..................................................................... 45 11. DEFINICIÓN OPERACIONAL DE LAS VARIABLES..................................... 46 12. PROCEDIMIENTOS DE RECOLECCIÓN DE LA INFORMACIÓN (SELECCIÓN DE LAS FUENTES, MÉTODOS, TÉCNICAS Y MANIOBRA EXPERIMENTAL). ......................................................................................... 48 13. DEFINICIÓN DEL PLAN DE PROCESAMIENTO Y PRESENTACIÓN DE LA INFORMACIÓN (ANÁLISIS ESTADÍSTICO)............................................ 56 14. ORGANIZACIÓN DE LA INFORMACIÓN................................................ 57 15. CONSIDERACIONES ÉTICAS...................................................................... 58 16. RECURSOS................................................................................................... 59 17. RESULTADOS............................................................................................... 60 18. DISCUSIÓN.................................................................................................... 72 19. CONCLUSIONES........................................................................................... 78 20. ANEXOS......................................................................................................... 79 A. ANEXO 1. PROGRAMA DE GANTT........................................................... 79 B. ANEXO 2. ANÁLISIS DE COSTOS............................................................. 80 C. ANEXO 3. HOJA DE RECOLECCIÓN DE DATOS.................................... 83 D. ANEXO 4. GUÍA PARA EL PROCEDIMIENTO DE LLENADO DEL CUESTIONARIO......................................................................................... 85 E. ANEXO 5. TABLA DE NÚMEROS ALEATORIOS...................................... 88 F. ANEXO 6 HOJA DE CONTROL Y VIGILANCIA DE RATAS EN BIOTERIO................................................................................................... 89 21. REFERENCIAS BIBLIOGRÁFICAS............................................................... 90 1 ÍNDICE DE FIGURAS Y TABLAS: 1. Figura 1: Eduardo Bassini (1844-1924) ........................................................... 10 2. Figura 2: Línea alba y capas musculares......................................................... 12 3. Figura 3: Colocación de malla retromuscular................................................... 20 4. Figura 4: Malla de polipropileno macroporosa................................................. 23 5. Figura 5: Neutrófilos PMN................................................................................ 25 6. Figura 6: Interleucina 1..................................................................................... 28 7. Figura 7: Factor de Necrosis Tumoral.............................................................. 28 8. Figura 8: Interleucina 6..................................................................................... 29 9. Figura 9: Colágena........................................................................................... 30 10. Figura 10: Banda de adherencia.................................................................... 33 11. Figura 11: Características del sello de fibrina................................................ 35 12. Figura 12: Se muestran ratas macho Wistar adultas..................................... 48 13. Figura 13: Preparación de fibrina................................................................... 48 14. Figura 14: Microscopio Zeiss utilizado para realizar cirugías......................... 49 15. Figura 15: Defecto en la pared abdominal..................................................... 49 16. Figura 16: Preparación de la jeringa dúo....................................................... 50 17. Figura 17: Aplicación de sello de fibri na en spray.......................................... 50 18. Figura 18: Área de trabajo en el laboratorio de cirugía experimental del CUIB.............................................................................................................. 51 19. Figura 19: Densidad de las adherencias: Escala modificada de Diamond.... 52 20. Figura 20: Medición de la densidad de adherencias Sistema de Información Geográfica ER Mapper................................................................ 52 21. Figura 21: Presencia de malla sin adherencias y con adherencias............... 52 22. Figura 22: Tipo de órgano adherido al injerto................................................. 53 23. Figura 23: Diagrama de Flujo......................................................................... 60 24. Figura 24: Comparación de la severidad de las adherencias........................ 61 25. Figura 25: Promedio de malla cubierta con adherencias............................... 62 26. Figura 26: Presencia o no de adherencias a la malla.................................... 63 27. Figura 27: Adherencias de órganos en grupo sin fibrina................................ 65 2 28. Figura 28: Mucosa de intestino adherida a malla (A), extensión del proceso cicatrizal (B) y presencia de fibroblastos (C) .................................................. 66 29. Figura 29: Tipo de complicaciones................................................................. 68 30. Figura 30: Principales tipos de complicaciones presentadas......................... 68 31. Figura 31: Presencia de esfacelación............................................................ 71 32. Tabla 1: Cuadro de Variables 47 33. Tabla 2: Clasificación de reacción tisular propuesta por Kruiningen.............. 54 34. Tabla 3: Grado de respuesta inflamatoria de acuerdo a la clasificación de Kruiningen....................................................................................................... 55 35. Tabla 4: Densidad de las adherencias (Escala modificada de Diamond)...... 61 36. Tabla 5: Superficie con adherencias.............................................................. 62 37. Tabla 6: Presencia de Adherencias................................................................ 64 38. Tabla 7: Tipo de órgano adherido a la malla.................................................. 65 39. Tabla 8: Hallazgos histopatológicos............................................................... 66 40. Tabla 9: Comparación del Índice de Reacción Tisular de Kruiningen............ 67 41. Tabla 10: Seromas......................................................................................... 69 42. Tabla 11: Hematomas.................................................................................... 69 43. Tabla 12: Granulomas.................................................................................... 70 44. Tabla 13: Esfacelación................................................................................... 71 3 1. HOJA DE PRESENTACIÓN. A. TÍTULO: “Sellos de fibrina para la prevención de la formación de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas” B. NOMBRE Y ADSCRIPCIÓN DEL INVESTIGADOR PRINCIPAL: M. en C. EMILIO PRIETO DÍAZ CHÁVEZ. Estudiante del Doctorado en Ciencias Médicas Servicio de Cirugía General, Adscrito al H.G.Z.M.F. # 1 DEL I.M.S.S. Colima. A. NOMBRE DE LOS ASESORES: A) CLÍNICOS: D. en C. BENJAMÍN TRUJILLO HERNÁNDEZ Médico Especialista en Medicina Interna: H.G.Z.M.F. # 1 I.M.S.S. Colima. D. en C. ECTOR JAIME RAMÍREZ BARBA Médico Especialista en Cirugía General. Universidad de Guanajuato B) BÁSICO: D. en C. RAFAEL COLL CÁRDENAS. Salud Pública e Investigador Titular. CUIB Universidad de Colima. C) EXTERNOS: M. en C. OSCAR URIBARREN BERRUETA. Estudiante de Doctorado en Ciencias Médicas CUIB Universidad de Colima, y Médico Especialista en Ginecología y Obstetricia. M. en C. RAFAEL BUSTOS SALDAÑA Estudiante del Doctorado en Ciencias Médicas, y Médico Familiar de HGZ # 12 del I.M.S.S Jalisco. M en C ALEJANDRO GONZÁLEZ OJEDA. Médico Cirujano General e Investigador Asociado C.M.N.O. I.M.S.S. Jalisco. D) NOMBRE DE LOS DEPARTAMENTOS Y/O UNIDADES EN DONDE SE DESARROLLARÁ EL PROYECTO: Departamento de Cirugía General del H.G.Z.M.F. # 1, I.M.S.S. Colima. Centro Universitario de Investigaciones Biomédicas, Universidad de Colima. E) DOMICILIO Y TELÉFONO DEL INVESTIGADOR: Corregidora # 380, Jardines de la Corregidora. Cp. 28030, Colima, Colima, México. Teléfono y Fax: (312) 314-44-04 Y 313-01-11. e-mail: epdch@cgic.ucol.mx 2. DEDICATORIA Y AGRADECIMIENTOS. A MI ESPOSA SUSANA: “ El AMOR DE MI VIDA”. Quien ha sabido comprenderme en estos momentos difíciles, y en quien he encontrado siempre palabras de apoyo , por su manera de impulsarme ¡GRACIAS POR TODO ESE AMOR! A MIS HIJOS EMILIO Y SERGIO ALBERTO: “LOS ENANOS”. Son la razón de mi ser y todo lo que hago en esta vida tiene una dedicatoria especial para ellos. Ojalá que yo les pueda servir de ejemplo para su superación profesional. A MIS HERMANOS SERGIO Y CECILIA: Ellos que siempre me han apoyado, ¡Mi familia, GRACIAS! A MI MADRE AMELIA: “MELLO”. Quien siempre ha estado velando por mí, y reza por todos nosotros. Que más le pudiera yo pedir. Muy en especial a la memoria de mi padre EMILIO, “El Güero del Express”, quien siempre deseó lo mejor para mí, y que me heredo al mayor de los tesoros: “EL SABER”, que he tratado de seguir su ejemplo y de quien simplemente estoy muy orgulloso, que más puedo decir. “GRACIAS PAPÁ DONDE QUIERA QUE ESTÉS”. Un AGRADECIMIENTO ESPECIAL a todas aquellas personas que me han apoyado incondicionalmente; así como a las Autoridades del I.M.S.S. y Universitarias quienes me han permitido continuar con mis estudios de postgrado, y a todos aquellos que han intervenido en mi formación. ¡MUCHAS GRACIAS! 7 3. RESUMEN. OBJETIVO: Evaluar el efecto de sellos de fibrina durante la colocación de malla de polipropileno en modelo de hernia de pared abdominal en ratas. MATERIAL Y MÉTODOS: A 20 ratas se les realizó un defecto muscular cubierto posteriormente con 2.25cm2 de malla. Las ratas fueron aleatorizadas a un grupo con fibrina y otro control. A los15 días se evaluó la densidad de las adherencias, el área de malla cubierto por adherencias y tipo de adherencias. RESULTADOS: El promedio de densidad fue 0.65±0.58 para fibrina contra 2.0±0.56 para el control (p<0.05). El promedio de área cubierto por adherencias fue 29.9% para fibrina y 71.6% para el control (p<0.05). Epiplón o estómago se adhirieron a la malla en 12 de 20 (60%) con fibrina contra 20 de 20 (100%) en el control (p<0.05). CONCLUSIONES: Aplicar sello de fibrina reduce la densidad y severidad de adherencias intrabdominales en un modelo animal en ratas. 8 ABSTRACT OBJECTIVE: To evaluate the effect of fibrin glue in presence of polypropylene mesh in a model of hernia of the abdominal wall in rats. MATERIAL AND METHODS: 20 rats underwent laparotomy to create a muscular defect and covered with 2.25cm2 of mesh. Rats were randomized to either fibrin glue or to control group. At 15 days, the adhesion density, the percentage of mesh area covered by adhesions and type of adhesions was evaluated. RESULTS: The mean adhesion density was 0.65±0.58 for the fibrin versus 2.0±0.56 for controls (p <0.05). The mean percentage adhesion was 29.9±32% for fibrin and 71.6±27 for controls (p <0.05). Epiplon or stomach were adherent to the mesh in 12 of 20 (60%) in fibrin versus 20 of 20 (100%) in controls (p <0.05). CONCLUSIONS: Topical fibrin glues reduces the density and severity of intraabdominal adhesions in an animal model in rats. 8 4. INTRODUCCIÓN. La historia de la hernia acompaña al hombre desde sus inicios, así como los intentos para solucionar este problema ancestral o sus complicaciones. Es un hecho real que los planes de solución que se han aplicado en el transcurso de la historia han sido desde la simple observación y espera de las complicaciones, pasando por curas verdaderamente crueles en la época medieval, llegando a la era de la cirugía científica en donde se intentan reparaciones que solucionen el problema y a la vez ofrezcan comodidad al paciente que se somete 1. En la época actual existen diversas técnicas quirúrgicas que ofrecen curación para esta afección, pero hay que estar concientes de que cuando existen muchas formas de solucionar un problema, probablemente ninguna sea la ideal. El período de recuperación después de la hernioplastía abdominal suele ser lento y doloroso, y el regreso a las actividades de la vida diaria se ve retrasado por consecuencia, este período se extiende alrededor de cuatro a seis semanas en la mayoría de países occidentales incluyendo el nuestro y la hernia puede recurrir, incrementando la posibilidad de incapacidad prolongada2,3. Es el conocimiento general que las metas de la cirugía moderna son reparación de las hernias con menos dolor postoperatorio, período de recuperación corto, y bajo índice de complicaciones, bajo costo y prevención de futuras herniaciones que son tan importantes como el lograr un menor índice de recidivas 4 . El inconveniente de la cirugía tradicional es que es una operación sumamente traumática, los pacientes tienen una restauración a sus actividades en forma retardada, suele pasar una noche en el hospital, cursan con mayor dolor durante mayor tiempo y pueden realizar trabajo de escritorio hasta pasados 1 a 2 semanas y tareas pesadas en 3 a 4 semanas 2,5-7. Las hernioplastías libres de tensión han sido recientemente introducidas, demostrando ser superiores a las operaciones tradicionales que utilizan los mismos tejidos para su realización con menos dolor postoperatorio y más pronta recuperación; así como un muy bajo índice de recurrencias ( 0.5 y 1%)2,5,7,8. Por otra parte materiales aloplásticos han sido recomendados en EUA muchos años atrás para reforzar la fascia, evitando así la tensión sobre la línea de sutura, necrosis 9 muscular y conservando la anatomía del canal inguinal, estos métodos basan sus diferencias a corto plazo en los objetivos antes descritos en comparación con las técnicas convencionales9. La creciente popularidad de las reparaciones protésicas ha llamado la atención sobre nuevos síndromes causados por la colocación de materiales extraños sobre todo en la región inguinal. El uso de bioprótesis llama la atención para el estudio sobre efectos locales de la malla en las estructuras y su función. La inguinodinia crónica o la neuralgia aunque raras, se pueden presentar10,11. En la cavidad abdominal la formación de adherencias es la causante de múltiples y complejos síndromes, entre los cuales destaca la obstrucción intestinal12. La malla de polipropileno se utiliza con mayor frecuencia en la reparación de hernias de la pared abdominal13. Esta técnica se piensa puede cambiar la respuesta inflamatoria al trauma que pudiera sucederse posterior a la operación. La evaluación de esta es un abordaje objetivo para determinar el estado de respuesta de los tejidos al manejo de procedimientos quirúrgicos14. Por lo tanto la modulación de la respuesta inflamatoria y el evitar los efectos adversos de los materiales más comúnmente utilizados, como lo es la malla de polipropileno, sobre los tejidos debe ser el objetivo central al comparar esta respuesta entre procedimientos libres de tens ión y la utilización de mecanismos para evitarlos. 10 5. MARCO TEÓRICO. A. ANTECEDENTES CIENTÍFICOS: Las hernias son una de las enfermedades más frecuentes que afligen al ser humano. Algunos autores la definen en términos de una mutilidad o un orificio anormal en la capa envolvente, otros hacen mención de una protrusión a través de un orificio más que el orificio mismo, es más, otros resaltan que es una combinación de ambos 15 . HISTORIA: La hernia es poco mencionada en los escritos de Hipócrates; el concepto de ruptura proviene de Galeno quien consideró que la hernia era el producto de la ruptura del peritoneo con estiramiento de las fascias y los músculos suprayecentes. Asley Paston Cooper es mejor conocido entre los epónimos de hernia por sus trabajos en fascia transversalis, hernia femoral, herniotomo, tendón conjunto y ligamento pectíneo, mejor conocido como ligamento de Cooper16. El primer procedimiento quirúrgico que narra la apertura del canal inguinal fue reportado por el cirujano alemán Vinzenz Czerny. Littre en 1871 publicó el primer artículo referido a la herniorrafia antiséptica que se tituló: “Ultimo uso de las ligaduras carboxiladas de catgut” y Eduardo Bassini (Fig.1) en 1880 revolucionó el trabajo de la hernia inguinal al describir la operación que ha sido la base de la herniorrafia moderna9 , William Halsted reportó casi al mismo tiempo una cirugía parecida. Georg Lotheissen en 1898 recomendó que el músculo oblicuo interno y el transverso abdominal se fijaran al ligamento de Cooper. Método que fue descrito en América por Chester McVay junto con Anson1,2,15. Las hernias ventrales son hernias de la pared abdominal que se consideran iatrogénicas, desde que J. W. Mayo en 1899 describió la reparación transversa para corregir estos defectos aponeuróticos poco se ha adelantado en este Figura 1 Eduardo Bassini (1844-1924). campo. Años después, varios investigadores, han planeado más interrogantes y solo finales del siglo pasado, al reconocer la importancia funcional-estructural de las aponeurosis de la pared anterior, ha sido posible aclararlas17. 11 CONSIDERACIONES ANATÓMICAS: El abdomen, llamado vulgarmente vientre, es una gran cavidad esplácnica en la que se alojan la mayor parte de los aparatos digestivo y genitourinario. La pared abdominal anterolateral, llamada simplemente pared abdominal por algunos autores, rellena el espacio comprendido entre el reborde costal, por arriba, y los huesos de la cadera por debajo. Las capas generales de la pared abdominal anterolateral son: Piel, fascia superficial, otra capa de revestimiento de la fascia profunda, los músculos con sus fascias correspondientes, la fascia transversalis, la fascia extraperitoneal y el peritoneo parietal18. La piel es delgada, fina, blanda y muy movible. El tejido celular subcutáneo forma por casi todos lados una fascia superficial de dos hojas, entre las cuales se deposita una capa de tejido adiposo. La capa musculoaponeurótica contiene una serie de músculos, envueltos por vainas comunes que Testut19 detalla a continuación: “a) Recto mayor del abdomen: Nace, por su extremo inferior, en el cuerpo del pubis. De allí se dirige hacia arriba y un poco hacia fuera, insertándose en el apéndice xifoides, en el cartílago de la séptima costilla, en el borde de la quinta y sexta costillas. b) Piramidal del abdomen: Pequeño músculo triangular de base inferior, situado delante del recto mayor, en la parte anterior e inferior de la región. c) Músculos anchos del abdomen: 1. Músculo oblicuo mayor: Es el más superficial, nace del borde de las ocho últimas costillas, en forma de gran abanico, se dirige a la vez hacia abajo, adelante y adentro terminando algunos fascículos en la cresta iliaca, otros, constituyendo un verdadero tendón musculoso, se insertan en la línea media, en el pubis y en el ligamento inguinal. 2. Oblicuo menor: Situado por debajo del anterior, dirigido en sentido inverso, se extiende desde la región lumboíliaca y las últimas costillas, a la línea media y al pubis. 3. Transverso del abdomen: Se encuentra situado por debajo del oblicuo menor, nace por detrás en la cara interna de las seis últimas costillas, en la cresta iliaca, de la columna lumbar, de estos sitios de inserción se dirige de atrás a adelante hacia el músculo recto del abdomen. 4. Fascia transversalis. Representa la hoja posterior de la aponeurosis de envoltura del 12 músculo transverso. Recordemos que debajo del arco de Douglas forma, ella sola, la pared posterior de la vaina del músculo recto. 5. Línea alba: Las fibras tendinosas de todas las capas de las vainas del recto mayor, al acercarse a la línea media, se entrecruzan con las fibras del lado opuesto”. Este entrecruzamiento forma una zona aponeurótica blanquecina “la zona aponeurótica de la línea media” o línea alba17. El conducto inguinal en el adulto es una estructura tubular oblicua situado por arriba del arco crural, el anillo externo o superficial es un orificio triangular formado por la aponeurosis del oblicuo mayor, el anillo inguinal interno o profundo es una abertura de la fascia transversalis, sitio por donde provienen las hernias indirectas20. La pared anterior del conducto la forman la aponeurosis del músculo oblicuo mayor, y en sentido externo la participación del oblicuo menor, la pared superior o “techo” la forman el oblicuo mayor y el transverso del abdomen y la pared inferior el arco crural y el ligamento de Ginbernat, la pared posterior es el elemento más importante por razones anatómicas y quirúrgicas formada fundamentalmente por la fusión de las aponeurosis del transverso y la fascia transversalis21. FISIOLOGÍA DE LA PARED ABDOMINAL: La pared abdominal anterior puede ser dividida estructural y funcionalmente en dos zonas: 1) el área superior permite movimientos respiratorios y 2) la inferior que actúa como área de soporte. Una falla funcional en el abdomen permite una herniación sea ventral en la parte superior o inguinal en la inferior. Asimismo, tensiones incordinadas como deportes extremos, accesos de tos o vómitos suelen rasgar las fibras aponeuróticas en la línea alba estrechando la decusación aponeurótica y permitir el desarrollo de protrusiones de tejidos a través del desgarro22 (Fig.2). Figura 2. Línea alba y capas musculares 13 Debido a sus componentes musculares, la pared abdominal se puede contraer y relajar, contribuyendo, por lo tanto, a acomodar el tamaño de la cavidad abdominopélvica a los cambios volumétricos de las vísceras comprendidas en ella y al control de la presión intrabdominal18. Marey en 1863 y Burt en 1870 describieron por primera vez a la presión intrabdominal al estudiar el síndrome de hipertensión abdominal, demostrando las correlaciones entre presiones intrabdominales y la función respiratoria23. La transmisión de la presión intrabdominal dentro de la cavidad abdominal es entendida de acuerdo a la ley de la distribución de fluidos mecánicos. Esta transmisión de la presión es uniforme en un sentido cefalocaudal así como de lado a lado siendo extremadamente homogénea24; se ha informado de la existencia de dos técnicas principales para medir la presión intrabdominal en el ser humano: 1) métodos indirectos a través de una ve ntana intravesical, intragástrica y la transrectal, y 2) con métodos directos con presiones medidas a través de un dren intrabdominal23. Las presiones intrabdominales normales pueden variar entre 3 y 10 mmH 20 (grado I) y un incremento de esta se considera leve a partir de mediciones de 15 a 25cc H20 (grado II), moderado de 25a 35cc H20 (grado III) y severo > 35cc H20 (grado IV)25. En el individuo normal, intervienen dos mecanismos para conservar anatómicamente al conducto inguinal. En primer lugar existe la acción del esfínter del músculo transverso y del oblicuo menor a nivel del anillo profundo. Cuando se contrae el transverso, desplaza hacia arriba y afuera el ligamento de la fascia transversalis, cerrando el anillo profundo alrededor del cordón. El segundo mecanismo que permite cerrar el conducto inguinal es la acción obturadora del arco aponeurótico del transverso, que en estado de reposo presenta una concavidad inferior. Cualquier aumento de tensión aproxima el arco al ligamento inguinal, cubriendo el cordón y reforzando el piso del conducto inguinal26. HISTOLOGÍA MUSCULAR: Aproximadamente el 40% del cuerpo esta formado por músculo esquelético, y casi otro 10% por músculo liso y cardíaco. Las células musculares, como las neuronas, pueden ser excitadas química, eléctrica y mecánicamente, para producir un potencial de acción que se transmite a lo largo de su membrana celular. 14 Los músculos se dividen en tres tipos: esqueléticos, cardíaco y liso, aunque este último no constituye una sola categoría uniforme. El músculo esquelético comprende a la gran masa de la musculatura somática, tiene estrías transversales bien desarrolladas y se contrae normalmente en presencia de estímulos nerviosos y usualmente se encuentra bajo el gobierno de la voluntad27. La organización del músculo esquelético esta integrada por numerosas fibras cuyo diámetro oscila entre 10 y 80 micras. El sarcolema es la membrana celular de la fibra muscular, y se rodea por un revestimiento externo de material polisacárido que contiene numerosas fibrillas de colágeno; en el extremo se funde con una fibra de tendón, y estas a su vez, se unen en haces que forman los tendones musculares, que se insertan en los huesos28. Miofibrillas y filamentos de actina y de miosina: Cada miofibrilla contiene unos 1500 filamentos de miosina y 3000 filamentos de actina, que son polímeros proteicos responsables de la contracción muscular, los cuales se integran parcialmente, lo que hace que las miofibrillas posean bandas claras y oscuras alternas; las claras contienen sólo filamentos de actina y se denominan Bandas I, y la banda oscura A que contiene en el centro a la banda H más clara. La interacción entre los puentes cruzados y los filamentos de actina es la responsable de la contracción. Las miofibrillas están suspendidas dentro de la fibra muscular en una matriz denominada sarcoplasma con un número enorme de mitocondrias, el retículo sarcoplásmico presenta una organización especial que es de gran importancia en el control de la contracción muscular28 . Mecanismo general de la contracción muscular: El mecanismo contráctil en el músculo esquelético depende de las proteínas miosina, actina, tropomiosina y troponina. La despolarización de la membrana de la fibra muscular se inicia en la placa terminal motora; el potencial de acción se trasmite a lo largo del músculo e inicia la respuesta contráctil. La contracción muscular implica un acortamiento de los elementos contráctiles; pero debido a que los músculos tienen elementos elásticos y viscosos en serie con el mecanismo contráctil, tal contracción se llama isométrica, la contracción contra una carga constante, aproximación de los extremos del músculo, es isotónica27. 15 El comienzo y ejecución de la contracción muscular según describe Guyton28 se produce siguiendo estas etapas sucesivas: 1. Un potencial de acción viaja por un nervio motor hasta el final del mismo. 2. En cada extremo, el nervio secreta una pequeña cantidad de neurotransmisor: acetilcolina. 3. La acetilcolina actúa localmente, en una zona de la membrana de la fibra muscular, abriendo múltiples canales para iones sodio. 4. La apertura de esos canales permite la entrada a la fibra muscular de grandes cantidades de iones de sodio, en el punto correspondiente a la terminal nerviosa. De esta forma comienza un potencial de acción en la fibra muscular. 5. Ese potencial de acción se desplaza a lo largo de la membrana de la fibra muscular, igual al que sucede con los potenciales de acción en las membranas de los axones nervios. 6. El potencial de acción despolariza la membrana de la fibra muscular y también viaja a su interior, provocando la liberación de grandes cantidades de calcio que se encuentra almacenado en el retículo sarcoplásmico. 7. Los iones calcio inician fuerzas de atracción entre los filamentos de actina y miosina, haciendo que se deslicen juntos; este es el proceso de contracción. 8. Una fracción de segundo después, se bombean los iones calcio hacia el retículo sarcoplásmico, donde se almacena hasta que llegue un nuevo potencial de acción. La contracción muscular requiere de energía y la fuente inmediata que la provee son los derivados del fosfato orgánico de alta energía encontrados en el músculo, siendo la fuente última de esta el metabolismo intermedio de los carbohidratos y lípidos. Biofísica del sistema contráctil: La medida de la contracción también es una manera de estimar los efectos que sobre dicha contracción poseen los neurotransmisores. La fuerza variará con el tamaño del músculo y se expresa mejor como la fuerza ejercida por una determinada superficie de músculo. Un músculo relajado es elástico y requiere una cierta fuerza para que se estire hasta lograr una cierta longitud. La relación entre la fuerza y la longitud, o entre la fuerza/unidad de superficie y la 16 longitud, refleja primariamente las propiedades del tejido conectivo en las fibras musculares intactas. Cuando se estimula un músculo, la fuerza/superficie isométrica es mayor que la fuerza/superficie pasiva ejercida a cualquier largo de la fibra muscular. La máxima tensión (fuerza/superficie) generada depende de la longitud muscular, el número de puente transversales que se activan y el tipo de músculo 29. B. ESTADO ACTUAL DEL CONOCIMIENTO: Aunque la reparación de hernias de la pared abdominal ha constituido por mucho tiempo la clase más frecuente de cirugía “mayor” realizada por un cirujano general, se ha dedicado poca atención a los aspectos epidemiológicos y fisiopatológicos de la enfermedad y a su reparación30,31 . Las hernias inguinales comparten la característica común de emerger a través del orificio miopectíneo de Fruchaud, que sirve de paso a vasos sanguíneos, nervios músculos y tendones entre al abdomen y las extremidades, este defecto evolutivo desafortunado entre los seres humanos se complica al adoptar la posición de pie, cambiando desde una locomoción cuadrúpeda a una bípeda. Se considera que este cambio ha abierto la región inguinal trayendo consigo alteraciones anatómico funcionales en el hombre, lo cual conduce a una mayor propensión para desarrollar hernias32. Las hernias de la pared abdominal siguen siendo una de las complicaciones más frecuentes de los procedimientos quirúrgicos abdominales, y es una fuente importante de morbilidad, mortalidad y perdida de trabajo productivo. Una vez que la eventración se desarrolla, en forma inevitable tiende a crecer con el paso de tiempo, pudiendo presentar encarcelamiento, obstrucción o producir necrosis de la piel y perforación lo cual aumenta en forma los riesgos para la vida del paciente. La frecuencia de eventración postoperatoria va de 0.5% al 13.9% en pacientes sometidos a operaciones abdominales33. Hay diversos factores del paciente relacionados con la tendencia a desarrollar hernias de pared abdominal. Estos son la obesidad, edad madura, distensión abdominal y complicaciones pulmonares así como factores específicos relacionados con la operación como infección de la herida, tipo de incisión y técnica de cierre 17 sobre todo cuando esta se efectúa bajo tensión de los elementos anatómicos de la pared abdominal con el consecuente incremento de la presión intrabdominal34. Una presión intrabdominal normal fisiológicamente se considera por debajo de los 15cc H20, aunque el límite crítico de esta es por arriba de los 35cc H20 en que se consideraría un síndrome compartamental del abdomen ya que dentro de los efectos de la presión intrabdominal se observa un aumento notable de las presiones inspiratorias terminales con disminución de gasto cardiaco y volumen circulatorio en 36%35-37. Los primeros cirujanos generales en reconocer las complicaciones de aumento de la presión intrabdominal y en utilizar el cierre abdominal con acomodo temporal del volumen extra fueron Rowlands y cols. quienes en 1984 utilizaron láminas de Silastic suturadas a la fascia dejando chimeneas parecidas a los métodos para tratar onfaloceles, posteriormente se publicaron diversos informes sobre el uso de cierta variedad de materiales para lograr un cierre libre de tensión, siendo la más utilizada, la bolsa de lavado genitourinario25 de plástico conocida como “bolsa de Bogotá”. Se ha informado de una gran variedad de situaciones que causan un incremento de la presión intrabdominal de importancia clínica, entre ellas se encuentran traumatismos abdominales, hemorragia, neumoperitoneo, ascitis o cualquier situación, como el cierre a tensión de la pared abdominal, todas estas alteraciones producen un incremento agudo del volumen abdominal, suficiente para provocar disfunción terminal de órganos relacionados con la presión principalmente cardiovascular (disminución del gasto cardíaco), renal (perfusión renal insuficiente, obstrucción del flujo sanguíneo venoso renal y obstrucción de flujo ureteral) y pulmonar (hipercapnia y pobre distensibilidad pulmonar)23. La malla de polipropileno se utiliza en la actualidad con mayor frecuencia en la reparación de hernias de la pared abdominal. La formación de adherencias, que es inevitable posterior a la reparación de hernias incisionales con prótesis de mallas, se presenta con una prevalencia de 67% a 93%, pueden causar múltiples desordenes incluyendo obstrucción intestina l, formación de fístulas enterocutáneas e infertilidad1238,39 . La utilización de barreras físicas llamadas sellos de fibrina, una combinación de fibrinógeno humano y trombina bovina, han sido utilizados para reducir, en al menos un 50%, la formación de adherencias dentro de la cavidad abdominal12,40-42. 18 CLASIFICACIÓN: Conforme se van informando los resultados de las hernioplastías se van encontrando dificultades para clasificar los diversos tipos anatómicos de hernias. De esta forma la mayoría de los peritos propondrían un esquema de clasificación aceptable que sirviera para la comprensión anatómica de la región y ayudara a la evaluación más científica de las diversas reparaciones quirúrgicas, medición de resultados y diferenciaría entre los buenos resultados y las fallas quirúrgicas43. Casten en 1967, presentó un esquema de clasificación de hernias inguinales que se basó en su anatomía funcional y su tratamiento quirúrgico. Tres años después Halverson y McVay clasificaron las hernias inguinales en indirectas pequeñas, intermedias, directas de gran tamaño y hernia crural. En 1986 Gilbert estableció un esquema de clasificación más detallado que se basó en los defectos anatómicos y funcionales identificados durante la operación determinando cinco clases, Rutkow y Robbins añadieron dos tipos más a éstas. Bendavid en 1992, propuso el esquema de clasificación denominado Type, Staging and Dimension (T.D.S.) describiendo cinco tipos de hernias inguinales. Hace poco Nyhus describió un esquema de clasificación de hernias inguinales y crurales, así como recurrentes, clasificándose según la gravedad de la lesión del anillo interno o del defecto del triángulo de Hesselbach en tipo I, Tipo II, tipo III a, b y c, y tipo IV 3,30,44. RECURRENCIAS: La recurrencia es lo que por muchos años ha marcado el éxito o fracaso de los diferentes procedimientos para la reparación de la hernia. Casi 700,000 reparaciones de hernia se realizan anualmente en EUA, de las cuales 50,000 a 100,000 se realizarán por recurrencia, fracasando del 10% al 15% de todas las reparaciones primaria de la hernia5,45. En nuestro país, hay pocas estadísticas reportadas, y la mayoría de los trabajos se han presentado en foros de discusión de la especialidad. Pero se sabe que la hernioplastía inguinal es una de las intervenciones quirúrgicas electivas más frecuentes, predominando la hernia inguinal tipo IIIb de la clasificación de Nyhus, que tiene una frecuencia de complicación de 3 a 6% y recidivas de 3 a 20% siendo la técnica que utiliza el ligamento de Cooper (McVay) la más frecuentemente realizada 46-48. 19 En el H.G.Z.M.F # 1 del I.M.S.S en Colima, la cirugía de la hernia ocupa el 6º lugar entre las operaciones realizadas, con un promedio de 160 cirugías por año, teniendo actualmente estadísticas iniciales acerca del tipo de cirugía efectuado, las recidivas y complicaciones de las mismas49 . En la actualidad se acepta que el 62% de las recidivas se presentan en el primer año, y un 31% más en el segundo año, por lo que se puede concluir que el seguimiento mínimo para observar el 93% de las recidivas debe ser de 2 años45,50. La mayoría de métodos quirúrgicos aseguran curación de más del 95%, aunque los índices de recurrencia aceptados para las diferentes técnicas son, como se ha mencionado, del orden del 3 al 20%; el problema continúa en una constante búsqueda de un procedimiento quirúrgico que pueda ser usado para todos los tipos de hernias, independientes del tipo, tamaño, o hábitos personales. Los índices de recidiva aceptados para las diferentes técnicas deberían de ser del 1%, pero, en la actualidad, las metas de la cirugía moderna además de la prevención de futuras herniaciones son, reparación de las hernias con menos dolor postoperatorio, período de recuperación corto, bajo índice de complicaciones y bajo costo que son tan importantes como el lograr un menor índice de recidivas4. Amid y cols. han reportado con el uso de técnicas libres de tensión sobre la pared abdominal un índice de recurrencia menor al 1% en 1400 pacientes intervenidos con esta técnica 51. TÉCNICAS LIBRES DE TENSIÓN: Todas las modificaciones de las técnicas de hernioplastía convencional han tenido como desventaja común la tensión sobre la línea de sutura, las incisiones relajantes no han podido disminuir la tensión ni lograr el alivio de la misma3,5,47. La desventaja de este tipo de cirugía es que es una operación más extensa que la mayor parte de las otras operaciones, los pacientes tienen una convalecencia más lenta, suele pasar una noche en el hospital, tienen más dolor durante varios días y realizan trabajo de escritorio hasta pasados 1 a 2 semanas y tareas pesadas en 3 a 4 semanas 2,5-7. A fines de los 50’s y principio de los 60’s un progreso importante para el tratamiento de las hernias fue el trabajo iniciado por Usher y colaboradores quienes informaron por primera vez el uso de una redecilla de malla de Marlex, reconociendo al mismo tiempo junto con Collier y Griswold que la tensión era la causa primaria de 20 recurrencia. Materiales aloplásticos han sido recomendados en EUA desde los 80’s para reforzar la fascia inguinal, evitando así la tensión sobre la línea de sutura, necrosis muscular y conservando la anatomía del canal inguinal9,52. El siguiente concepto notable para eliminar la tensión o el defecto tisular con material protésico fue el tapón cilíndrico enrollado descrito por Lichtenstein en 1974 para tratar las hernias inguinales, crurales y recurrentes. En 1986 Lichtenstein y cols. fueron los primeros en utilizar el termino “Hernioplastía sin tensión”. Estos autores describieron una técnica quirúrgica que consiste en colocar un parche sobrepuesto de redecilla de malla que se sutura en el sitio como la reparación primaria de la hernia, no haciendo ningún intento de aproximar los tejidos debilitados con puntos, Figura 3. Colocación de malla retromuscular. por lo que se evita la deformación de la anatomía normal lo mismo que la tensión sobre la línea de sutura, esta técnica es totalmente sin tensión y se parece al concepto de tapar una botella con un corcho3,7,45, habiéndose operado hasta la fecha a más de 6,000 paciente sin aproximación de los márgenes del defecto8,52. Gilbert en 1997 dio el siguiente paso lógico en la evolución de la técnica del taponamiento de redecilla, procedimiento que ideó para tratar las hernias indirectas pequeñas o moderadas y se refiere al término de reparación “sin sutura”, colocando una segunda pieza de redecilla de polipropileno recortada para ajustarla al conducto inguinal, reportando recurrencias del 0.3%, regreso al trabajo que va de 2 días a una semana (15 días para trabajo pesado) y bajo índice de complicaciones con las ventajas de: simplicidad de la técnica, mínima curva de aprendizaje, reparación libre 21 de tensión, mínimo dolor, retorno inmediato a las actividades normales y costo mínimo3,20. Robbins y Rutkow en el Hernia Center de New Jersey al progresar con la técnica del tapón de malla ampliaron los criterios para el tratamiento de todas las hernias inguinales (tipo I a VII de Gilbert). Desde 1989 hasta finales de 1997, se han reportado por los autores un total de 3268 pacientes operados con esta técnica5,53. Más específicamente este procedimiento se ha utilizado en pacientes con defectos aponeuróticos de la pared abdominal anterior en utilizando la técnica de reparación retromusc ular (Fig. 3) basado en los principios quirúrgicos del Dr. Stoppa 51. Basados en la proposición para la prevención de recurrencias: 1º: Nunca depender de estructuras fasciales para cerrar o reforzar el defecto, 2º: Como son defectos de la fascia transversalis, debe de reforzarse todo el piso del conducto, 3º: Se debe evitar toda tensión en la línea de sutura, 4º: No debe dependerse de tejido cicatrizal o desvascularizado para la reparación y 5º: Debe efectuarse refuerzo permanente 45 . Hay reportes que estos mismos principios de reparación libre de tensión pueden ser aplicados a los defectos de la pared abdominal. La reparación retromuscular preperitoneal con malla descrita por Stoppa, ha probado tener éxito con resultados adecuados de acuerdo a los principios modernos de la reparación de las hernias51. Hasta ahora no hemos encontrado reportes específicos sobre la estimación de la respuesta inflamatoria después de cirugía de reparación de defectos en la pared abdominal anterior con técnicas libres de tensión, pero si se ha puesto de manifiesto la relevancia de los efectos colaterales a que pueden estar sujetos los individuos en los cuales se les ha colocado una prótesis de malla de polipropileno. La formación de adherencias intrabdominales que no son otra cosa que estructuras fibróticas, que corren en forma de cuerda o ataduras entre los órganos intrabdominales y la pared abdominal conectándolos en un conjunto y que pueden ser causa de complicaciones clínicas serias 54. Durante el siglo pasado, la comprensión qui rúrgica de la biología y fisiología peritoneal y la reparación de heridas ha permitido identificar una variedad de técnicas nuevas que tienden a limitar el desarrollo de la formación de adherencias. Concentrados de fibrina preparados a base de componentes sanguíneos 22 procedentes de críoprecipitados o preparaciones químicas combinados con trombina llamados sellos de fibrina han sido utilizados para control hemorrágico, adherencia de tejidos y sellamiento de defectos tisulares54,55. Se han realizado múltiples intentos por disminuir estas adherencias y sus complicaciones, esto ha sido plasmado en múltiples trabajos utilizando sellos de fibrina en cirugía intraperitoneal para la reducción de las adherencias intrabdominales39-42,56 pero, hasta la actualidad sólo un grupo de trabajo ha tratado de probar su utilidad reduciendo estos inconvenientes en el cierre de la pared abdominal al utilizar materiales protésicos con resultados alentadores57,58. MATERIALES ALOPLÁSTICOS: La malla de Marlex (polipropileno) ha sido utilizada desde finales de los años 50’s con una gran cantidad de artículos estudiando su biocompatibilidad y la ausencia de efectos adversos, demostrando que es un material inerte aún en presencia de 59 proceso infeccioso . La actividad fibroblástica a través de la malla y su intersticio puede causar una barrera permanente contra futuras herniaciones, el uso de cono es preferido al simple parche por algunos autores ya que los intersticios del tapón de redecilla de forma cónica quedan totalmente infiltrados por fibroblastos y la reparación se conserva permanentemente fuerte y la malla no se rechaza constituyendo una oclusión completa del defecto sin tensión y su extensión hacia la cavidad preperitoneal impide la protrusión de epiplón o intestino 5,45. Las bioprótesis se clasifican de la siguiente forma: 1. - Puramente microporosos: Con poros menores de 10 micrones (Gorotex, Dual Mesh). 2.- Puramente macroporosos: Tamaño del poro mayor de 100 micrones son de monofilamento, polipropileno (Marlex, Prolene, Surgiporo). 3.- Microporos y macroporos combinados: Multifilamento (Teflón), multifilamento dacrón (Mersilene) multifilamento polipropileno (Surgiporo), PTFE perforado (Mycromesh). El material de protésico ideal debe tener 4 características fundamentales: 1) ser inerte, 2) ser monofilamento con poros mayores de 100 micrones de diámetro, 3) estimular la fibroplastía y 4) fijarse rápido a los tejidos en su sitio por la fibrina del 23 huésped, logrando esto un menor rechazo, menor incidencia de infecciones debida al tamaño del poro (evitada por poros mayores de 100 micrones), menor formación de seroma, menos adhesiones intestinales y fístulas y menor desplazamiento por un efecto “velcro”45 . Solo las mallas de polipropileno (Marlex? ) han manifestado satisfacer todos los requisitos (Fig. 4) probando ser lo más efectivo para este procedimiento, la memoria desarrollada por el tamaño de sus poros así como el efecto “velcro” mencionado la mantienen en su lugar, el tamaño de sus poros permite un suficiente crecimiento fibrovascular que la incorpora a los tejidos en un promedio de 2 meses20. Es resistente, biológicamente Figura 4. Malla de polipropileno macroporosa. inerte, monofilamentosa y resistente a las infecciones, conserva su resistencia en forma indefinida (fuerza tensil), no está sujeta a deterioro, el rechazo es excepcional, es porosa permitiendo la reacción desmoplástica para la infiltración de fibroblastos y la integridad a los tejidos47. RESPUESTA INFLAMATORIA A LA AGRESIÓN: Los objetivos de la reparación de la hernia habían sido el alivio permanente de las molestias y prevención de la estrangulación, estos objetivos habían permanecido sin cambios por más de 100 años desde que Bassini introdujo la era moderna de la herniorrafia, la introducción de nuevas técnicas de herniorrafia (laparoscópica y libres de tensión) han logrado disminuir el dolor y propiciar un pronto regreso al trabajo a causa de incisiones mínimas lo que se ha integrado como nuevos objetivos, basados en técnicas de mínima invasión aludiendo así una menor respuesta inflamatoria60,61. La inflamación tiende a ser una respuesta hemostática inmune protectora a la lesión, caracterizada por la iniciación de la cascada de mediadores pro-inflamatorios movilizando mecanismos inmunes de tipo celular e humoral. Lesiones extensas, en ocasiones, resultan en una respuesta citotóxica hiperinflamatoria desregulada asociada con un síndrome de respuesta inflamatoria sistémico severo que puede progresar a falla orgánica múltiple. Mecanismos de retroalimentación que intentan 24 atenuar esta respuesta pueden persistir inapropiadamente, creando un huésped inmunocomprometido. La amplitud de esta respuesta es proporcional a la magnitud del estímulo inicial62. Los cambios de la reacción inflamatoria siguen una sucesión uniforme y ordenada. Sin embargo, la cronología de estas modificaciones y la intensidad de la reacción dependen de la gravedad y carácter del daño, tejido específico atacado y capacidad de reacción del huésped. Los procedimientos quirúrgicos desencadenan una sucesión en cascada organizada y compleja de fenómenos celulares y bioquímicos. Con fines didácticos la respuesta al trauma puede dividirse en tres clases netas, pero superpuestas en un continuo: 1) hemostasia e inflamación, 2) proliferación y 3) maduración o remodelación. La prolongación o ineficacia de una de estas fases puede retrasar la cicatrización y por ende la recuperación del individuo 63. 1) FASE DE HEMOSTASIA E INFLAMACIÓN: La fase inflamatoria es una etapa esencial de la cicatrización, que se caracteriza por mayor permeabilidad vascular, quimiotaxis de células desde la circulación en torno de la herida, liberación local de citocinas y factores de crecimiento, y activación de las células migratorias. El coagulo de fibrina que se forma en el sitio de trauma constituye un “entramado” para que penetren células como neutrófilos, monocitos, fibroblastos y células endoteliales. Células sanguíneas: Los elementos formes o glóbulos sanguíneos son los eritrocitos hematíes, las plaquetas y diversos tipos de leucocitos. Estos últimos se clasifican en dos grupos: los granulocitos o polimorfonucleares (PMN) y los agranulocitos, los PMN tienen un núcleo de forma irregular y presentan gránulos específicos en el citoplasma, y de acuerdo a la anterior se distinguen tres tipos neutrófilos, eosinófilos y basófilos. Los neutrófilos presentan núcleos sin segmentación en forma de bastón, el abundante citoplasma de estos está cargado de granulaciones específicas; los gránulos específicos de los neutrófilos destruyen las bacterias fagocitadas principalmente por la producción de aniones superóxido de H2O2 constituyendo la 25 primera línea de defensa celular frente a la invasión de microorganismos, siendo fagocitos activos de partículas de pequeñas dimensiones 64. Los neutrófilos PMN (Fig. 5) parecen ser un importante estimulador celular en la génesis de la respuesta inflamatoria secundaria a trauma. Un aporte masivo de PMN y su persistencia favorece la presencia de un estado hiperinflamatorio: La Interleucina 6 (IL -6) juega un papel específico en la proliferación de progenitores PMN y Figura 5. Neutrófilos PMN. puede afectar la inflamación mediada por PMN modulando la apoptosis y la muerte celular programada62. Quimiotaxis: Los neutrófilos son las primeras células migratorias en llegar a la herida, a causa de factores que permiten mayor permeabilidad vascular causada por la inflamación y por la liberación de prostaglandinas junto con un gradiente de concentración de sustancias quimiotácticas tales como factores del complemento, interleucina-1 (IL -1), interleucina 6 (IL -6) factor de necrosis tumoral alfa (TNF -? ), TNF-? , factor plaquetario-4 y productos bacterianos65,66. La respuesta de las células a la señal quimiotáctica es mediada también por receptores de superficie celular, las citocinas y los factores de crecimiento tienen varios efectos específicos en las células. La quimiotaxis de las células en el entorno de la herida es seguida de activación funcional; durante la inflamación predominan los polimorfonucleares (PMN), neutrófilos, macrófagos y linfocitos actuando estos dos últimos de manera imprescindible. La activación de macrófagos hace que se liberen citocinas que median respuesta inflamatoria, culminando con la síntesis de oxido nítrico que posee innumerables funciones y el cual ve mermada su síntesis en modelos con deficiencia de cicatrización. Los macrófagos activan otras células, como linfocitos, a través de las citocinas liberando interferón e IL -1 y TNF-? . La activación celular durante la inflamación también conlleva a cambios en los fibroblastos teniendo una mayo r síntesis de colágena 67. Es de vital importancia para el cirujano tener un profundo conocimiento de los fenómenos celulares y biomoleculares que se presentan en la inflamación ya que 26 una respuesta desmedida de ésta puede resultar en un mecanismo de lesión más que de protección por lo que se le ha dado en llamarla ¿“Villano o Benefactor”? 68 . 2) FASE DE PROLIFERACIÓN: El aumento de la permeabilidad vascular con los fenómenos consiguientes de tumefacción tisular y edema es carácter importante de todas las reacciones inflamatorias. Este proceso se inicia en las vénulas, pero rápidamente abarca todos los capilares lo que provoca la perdida de agua plasmática así como el escape de leucocitos y eritrocitos. Cabe preguntarse cómo los leucocitos, denotados principalmente por los polimorfonuclerares, llegan al sitio de lesión y qué hacen cuando han llegado. Se sabe que las alteraciones de flujo sanguíneo motivan la orientación periférica de los leucocitos (migración), siendo las células principales que participan en la reacción activa a la inflamación aguda. Poco después parecen pavimentar las superficies endoteliales de los microvasos lesionados. Cuando se han adherido, como lo describió tan vívidamente Cohnheim69 los leucocitos emigran por un fenómeno de fluir entre las células endoteliales. Poco después por alguna vía desconocida, escapan a la barrera de la membrana basal y llegan a los espacios tisulares y una vez ahí migran al sitio exacto de lesión (quimiotaxis). Los conglomerados de polimorfonucleares en la reacción aguda son las primeras células que aparecen en el sitio de la lesión. Ulteriormente los monocitos excederán en número a los PMN, y más tarde aún pueden aparecer linfocitos. La fagocitosis es el beneficio último que se obtiene de la reacción inflamatoria 69. Los factores conocidos como citocinas (IL -1, TNF-? , IL -6) que estimulan a los tipos mencionados de células provienen más bien de plaquetas y macrófagos activados, algunos de ellos almacenados en el coagulo de fibrina intravascular induciendo a las propias células del mesénquima para que a su vez liberen mayor número de citocinas por un mecanismo autócrino 67. Los neutrófilos llegan a la apoptosis (muerte programada) y son ingeridos por macrófagos. La migración de leucocitos contribuye a la lesión tisular, probablemente por la liberación de moderadores pro -inflamatorios como lo son los radicales libres y enzimas hidrolíticas. 27 ANÁLISIS DEL LÍQUIDO TISULAR: Se piensa que el líquido de la herida refleja el entorno en ella en cualquier momento durante la cicatrización; por esta razón se ha estudiado dicho líquido en busca de sustancias y refleja la suma de todas las actividades específicas en el momento en que se estudia. CITOCINAS: Los péptidos llamados citocinas son mediadores de los cambios tanto locales como sistémicos ante la presencia de un trauma severo o una infección y su acción en el organismo puede ser benéfica o deletérea dependiendo de si su liberación es local o sistémica y de la magnitud de su liberación. A dosis bajas y localmente su acción es benéfica como parte del mecanismo de defensa contra el trauma. Las citocinas son pues, pequeñas proteínas con peso molecular de 800 a 30,000, las cuales tienen secuencia de aminoácidos bien definida y actúan como receptores específicos, son producidas por una variedad de células y actúan íntimamente con algunos tejidos orgánicos. Los receptores de citocinas son el eslabón de una o más vías intercelulares que comprometen las señales de segundos mensajeros70. Weissenbach y cols 62 en 1980, identificaron primeramente a la IL-6 durante un esfuerzo para clonar Interferón ? humano. En 1988, un grupo de científicos en el congreso anual de la Fundación para estudios del Cáncer en la Academia de Ciencias de Nueva York discutieron acerca de la nomenclatura de citocinas62. Los nombres de las citocinas no siguen un sistema lógico pero han sido asignados acorde a sus propiedades biológicas liberadas en muchas condiciones biológicas. En cirugía las citocinas más importantes liberadas son IL-1, IL-6, TNF? y ? . El TNF? , IL-1? e IL-6 son los mediadores mayores de la fase aguda de la respuesta inflamatoria en humanos. TNF? e IL-1? son considerados los responsables primarios de las manifestaciones no hepáticas de la respuesta como son fiebre niveles elevados de prostaglandinas, taquicardia y catabolismo acelerado. IL-6 in Vitro es el responsable primario de los componentes hepáticos de esta fase71. INTERLEUCINA 1 (IL-1): La IL-1 es el nombre general de dos distintas proteínas IL1a e IL -1-b que son consideradas las primeras de una pequeña familia de citocinas reguladoras e inflamatorias. La producción de estas es típicamente inducido, 28 generalmente por inflamación siendo consideradas un prototipo de citocinas proinflamatorias. (Fig.6) Información estructural: La IL -1 es sintetizada como 31 -33 kDa, Pro-citocinas glicosilada variable que contiene 25% de aminoácidos idénticos a través de su estructura precursora, y 22% de aminoácidos en sus segmentos maduros. Receptores: La IL -1 ejerce sus efectos a través unir dos receptores específicos, dos distintas proteínas calificadas en la familia tipo IV de receptores de citocinas. Función: Figura 6. Interleucina 1. IL-1 es expresada por muchas células y tiene múltiples funciones, incluyendo la inflamación local. A continuación de su unión bacteriana o a inmunoglobulinas de monocitos/macrofagos CD14 o CD64, estas pueden liberarse dentro del medio local. Dentro de este medio, IL -1 impacta un sinnúmero de células, primero, células de capilares endoteliales son inducidas a dos situaciones: Secreción de quimioquinas como MCP-1 y regulación de moléculas de adhesión vascular, además induce la expresión por si misma del arribo de nuevos monocitos 72. Se ha detectado IL -1 en el líquido de lesión poco después de acaecida la lesión67, disminuye en las dos a cuatro primeras horas después del trauma y no es medible durante cinco días. La IL-1 a nivel sistémico se eleva raramente si no hay trauma mayor asociado, aunque la producción local es alta 73. FACTOR DE NECROSIS TUMORAL (TNF): La primera evidencia de la existencia de que una molécula tumoral necrotizante existía fue realizada al observar que pacientes con cáncer ocasionalmente mostraban regresión espontánea de sus tumores posterior a infecciones bacterianas. Estudios subsecuentes en los 60s indicaron que mediadores asociados (endógenos), sintetizados en Figura 7. Factor de Necrosis Tumoral. respuesta a productos bacterianos, fueron responsables de los efectos observados. 29 En 1975 se demostró un factor circulante inducido por bacterias que mostraba una fuerte actividad anti-tumor contra tumores implantados en la piel de ratón. Este factor, designado TNF (Fig. 7), producido por macrófagos, fue aislado y clonado posteriormente, y se encontró que era el prototipo de una familia de moléculas que están involucradas en la reacción inmune e inflamación, considerándose como un primer mediador. TNF? : El TNF? es un residuo de aminoácidos, un polipéptido no glicosilado que existe como una proteína soluble que es creado por un evento proteolítico que normalmente circula como un homotrimero 72. La actividad del TNF? surge en los inicios de la inflamación, con punto máximo a tres días después de acaecida la lesión67 . Los niveles normales se han reportado entre los 10 a 80 pg/ml. TNF? : El TNF? , mejor conocido como linfotoxina-alfa (LT? ) es una molécula que se sintetiza al mismo tiempo junto con TNF? y que circula como un residuo de aminoácido, Al igual que TNF? se une a los mismo receptores. Los niveles circulantes de TNF? se han reportado alrededor de 150 pg/ml. El TNF alcanza su máximo nivel a las dos Figura 8. Interleucina 6. horas de iniciado el trauma73 . INTERLEUCINA 6 (IL-6): Puede ser considerada una citocinas pleiotropica prototípica (Fig. 8), La IL-6 humana es una variable glicosilada de glicoproteinas secretadas que sirve como un prototipo de una familia de moléculas. Los receptores funcionales para IL -6 son un complejo de dos glicoproteinas transmembrana que son miembros de la súper familia de receptores clase I de citocinas. Las células conocidas que expresan IL-6 incluyen células T CD8, fibroblastos y células endoteliales entre otras, y ha sido descrita como moléculas pro y anti inflamatorias 72. La IL -6 se eleva después de trauma hasta 100 veces de su cifra basal en pocas horas, para mantenerse elevada por varias semanas, por lo que puede ser usada como indicador pronóstico. Su nivel comúnmente baja hacia el tercer día, pero puede descender hasta el día veintisiete 73. 30 3) FASE DE MADURACIÓN O REMODELAMIENTO: La característica principal de esta fase es el depósito en la herida, desde el punto de vista clínico es la fase más importante en la cicatrización, por que elementos como la rapidez, calidad y cantidad total de depósito de la matriz son los que rigen la resistencia y fuerza de la cicatriz. La degradación de la colágena durante la cicatrización comienza en fases tempranas y muestra gran actividad durante la inflamación, la actividad de la colágena es controlada rígidamente por las citocinas y por el citoesqueleto de las células. El Tejido conjuntivo se caracteriza morfológicamente por presentar diversos tipos de células separadas por abundante material intercelular, estando representado por una parte por las fibras del tejido conjuntivo, y por otra por la sustancia fundamental amorfa. Las fibras del tejido conjuntivo son de tres tipos principales: Colágenas, reticulares y elásticas, siendo las de colágeno las más frecuentes en el tejido conjuntivo 64 . El colágeno constituye Figura 9. Colágena. una familia de proteínas que se diferencian durante la evolución y adoptan una morfología característica (Fig. 9). Al microscopio electrónico, las fibrillas colágenas presentan una estriación transversal típica estando constituidas por una glucoproteína estructural, denominada colágeno, cuya composición de aminoácidos es muy característica. El aminoácido glicina aparece en proporción del 33.5%, mientras que la prolina y la hidroxiprolina están representadas en proporción de 12 y 10% respectivamente. La molécula de colágeno (tropocolágeno) es alargada, mide 280 nm de longitud por l.5 nm de espesor y está formada por tres cadenas peptídicas en forma de hélice (cadenas alfa), cada una de ellas codificada por un gen que da origen a diversas clases de colágeno. Se ha descrito más de una docena de colágenos, los tipos del I al V y el XI son los más frecuentes: Colágeno tipo I: Constituye el 90% del total del cuerpo, forma fibras y haces muy resistentes. Se encuentra en diferentes órganos y es sintetizado por los fibroblastos, odontoblastos y osteoblastos67. 31 Colágeno tipo II: Es el tipo que se encuentra en los cartílagos hialinos y elástico, está producido por las células cartilaginosas67. Colágeno tipo III: Frecuentemente asociado al tipo I. Es el que forman las fibras reticulares y es producido por los fibroblastos y células reticulares67. Colágeno tipo IV: No forma parte de los tejidos conjuntivos. Está presente en las láminas basales, sus moléculas forman un especie de fieltro, que no se polimeriza en fibrillas y es sintetizada por las células epiteliales67. Colágeno tipo V: Aunque en pequeñas cantidades, está presente en los mismos tejidos donde hay colágeno tipo I, asociándose a éste para formar fibrillas67 . Colágeno tipo XI: Se encuentra en los cartílagos hialino y elástico, participando de la estructura de las fibrillas colágenas, junto con el colágeno tipo II67. Los cambios en la composición de la matriz de la herida siguen un patrón con el transcurso del tiempo: al principio las sustancias están compuestas más bien de fibrina y fibronectina. Más adelante las colágenas constituyen las proteínas predominantes en la cicatriz67 . La dermis intacta esta compuesta predominantemente por colágena I (80 a 90%) y Colágena III (10 a 20%). En el tejido de granulación, la colágena de tipo III aumenta (30%) en tanto que en la cicatriz madura dicho tipo de colágena es más bien escaso (10%) 67. SÍNTESIS DE COLÁGENA: La fascia transversalis es a lo mucho una capa no poderosa de la pared abdominal; la capacidad para soportar los incrementos fisiológicos y patológicos de la presión intrabdominal depende del estado de las fibras de colágena que conforman sus tejidos y le dan su resistencia. La síntesis de 19 colágenas conocidas acaece como la de cualquier otra proteína dentro de la célula. La molécula de colágena se caracteriza por contar con repeticiones de la secuencia Gly-prolina -hidroxyprolina; la molécula pasa por ocho fases postaduccionales hasta que es secretada en forma de procolágena. Después de completar estas fases la triple hélice es secretada en esta forma en el medio extracelular. Como paso siguiente comienza el proceso de formación de fibrillas, se producen enlaces cruzados entre estos grupos y otros no transformados, siendo un tejido vivo activo que se mantiene por un balance constante de producción y 32 absorción. Las anomalías de la colágena dependen de ciertos factores congénitos del tejido conectivo relacionados con la herencia, teniendo un papel en la génesis de las hernias inguinales32,66. Hay evidencia morfológica y bioquímica que las hernias del adulto se asocia con un desorden metabólico en el tejido fibroconectivo, con repercusión en la fuerza tensil de los tejidos aponeuróticos debido a la presencia de sustancias como el BAPN (beta,amino,propiomitrito) que causan una disminución de la hidroxiprolina lo cual sugiere hidroxilación con disminuida de prolina y del contenido de colágena, estos cambios debilitan la fascia transversalis y permiten la formación de hernias inguinales 3,4. La falta de colágena intrínseca, infección de pared, esfuerzo postoperatorio excesivo, y hernias no detectadas son algunas de las causas de recidiva 74 . A este respecto se ha reportado que se desarrollan recurrencias tempranas (mecánicas) durante los dos primeros años que siguen a la operación inicial, haciéndose énfasis en que la tensión sobre la línea de sutura es la causa principal de estos fracasos, siendo la recurrencia tardía (metabólica) la menos frecuente 3. FORMACIÓN DE ADHERENCIAS: En la práctica de la cirugía se sabe que una buena técnica quirúrgica sola no evita que se formen adherencias con síntomas que van desde molestias abdominales hasta la obstrucción intestinal y formación de fístulas haciendo que la repetición del acto quirúrgico sea peligrosa y se vuelva un dispendio de tiempo y recursos constituyendo una causa importante de ineficiencia de la cirugía. La causa más frecuente de adherencias peritoneales son actos quirúrgicos he chos con anterioridad y posteriormente la colocación de materiales extraños, como mallas, que entran en contacto con el contenido intrabdominal75,76. En 1919 se señaló que la regeneración o cicatrización peritoneal difiere del resto de los tejidos, ya que toda la superficie se epiteliza de manera simultánea y no de modo gradual desde los bordes como ocurre en la piel. La inflamación, que se manifiesta por infiltración local de leucocitos PMN, edema y neovascularización, es parte integral de la reparación postquirúrgica. Milligan y Raftery77 describieron la morfología de la formación de adherencias; esta comienza con una matriz de fibrina que surge de manera típica durante la coagulación entre el primero y el tercer día de 33 postoperatorio, después del cuarto día, ha desaparecido gran parte de la fibrina y surge mayor cantidad de fibroblastos con la colágena que los acompaña y los macrófagos constituyen los leucocitos predominantes de la malla de fibrina. Para el quinto día la red de fibrina por lo regular está organizada y contiene haces discernibles de colágena, fibroblastos y células cebadas y finos conductos vasculares que contienen células endoteliales. Entre el quinto y el décimo día los fibroblastos se alinean dentro de la adherencia en tanto que avanza el deposito y la organización de colágena. A las dos semanas, las células son relativamente escasas y uno a dos meses después de la lesión, las fibrillas de colágena se han organizado en haces discretos, entre los cuales están interpuestos fibroblastos Figura 10. Banda de adherencia. fusiformes y unos cuantos macrófagos, al final la adherencia madura se vuelve una banda fibrosa que suele contener pequeños nódulos de calcificación77 (Fig. 10). La cicatrización del defecto peritoneal ocurre primariamente por un proceso de metaplasia de tejido conectivo mesenquimatoso subyacente, en un crecimiento centrípeto desde los márgenes de defecto, causando trasudación de líquidos serosamguinolentos ricos en proteínas. Como consecuencia, estructuras intraperitoneales adyacentes son conectadas a través de material fibrinoso que después se disuelve como resultado de actividad fibrinolítica, pero cuando esta actividad es suprimida la masa proteínica no se disuelve y el coagulo de fibrina es infiltrado por fibroblastos seguido de vascularización y crecimiento celular con las resultantes adherencias78. Mecanismo de la coagulación: La fibrina participa en los procesos de coagulación, involucrada en la conversión de protrombina a trombina, la cual en su momento convierte el fibrinógeno a fibrina. El concepto de la cascada de la coagulación fue descrito simultánea e independientemente por Davie y Ratnoff y por Macfarlane. La coagulación sanguínea consiste en una serie de activación de zimógenos causada por una proteólisis regulada con múltiples componentes actuando simultáneamente, estos incluyen proteinasas, proteínas acelerantes, una superficie localizada y 34 organizada y en ocasiones calcio. La serie compleja de reacciones que al final permite la transformación del fibrinógeno soluble a un coagulo insoluble constituye el proceso de la coagulación. El Factor VII (proconvertina) o su forma activa VIIa, el cual es estimulado por acción de los Factores X a o XIIa activan el Factor X (protrombina) y este a su vez proteoliza a la protrombina (Factor II) para formar trombina (Factor IIa), esta conversión es acelerada por el Factor V (proacelerina), lipoproteínas, fosfolípidos y Calcio. La trombina activa el factor estabilizador de fibrina (Factor XIII) y permite la conversión de fibriniopeptidos del fibrinógeno (Factor I) a una forma de monómero de fibrina formando un coagulo estable 79. SELLO DE FIBRINA EN LA CICATRIZACIÓN: El concepto de utilizar substancias hemostáticas provenientes de sangre humana para el manejo y prevención de la hemostasia en órganos sangrantes puede ser ubicada en los principios del siglo XX, cuando Bergel reportó el efecto hemostático de la fibrina. En 1916, Harvey reporta el uso de parches de fibrina para detener el sangrado de órganos sólidos durante cirugía. En 1940, Young y Medawar reportaron una anastomosis nerviosa en forma experimental con sellos de fibrina. En 1972, un crioprecipitado con un alto concentrado de sello de fibrina, fue desarrollado en Viena Austria con el propósito de anastomosar nervios. En los 80s, un preparado comercial fue introducido en Europa conteniendo dos componentes del sistema de la coagulación, trombina humana y altas concentraciones de fibrinógeno 80,81. Este trabajo se ocupa específicamente del sello de fibrina, y su empleo clínico, como medios para facilitar y mejorar el proceso de cicatrización y la prevención de la formación de adherencias. El sello de fibrina posee propiedades adherentes y hemostáticas extensas que lo vuelven un complemento beneficioso para el cierre de heridas y estimulación de la cicatrización como se señala en la figura No. 11. A diferencia de las suturas, el sello de fibrina no induce mayor inflamación o reactividad tisular82 . En un lapso de 10 años se ha utilizado este material con diversas aplicaciones como son hemostasia, sellar líneas de sutura, fijar injertos cutáneos, aminorar hemorragia perioperatoria, eliminar fugas de fístulas y disminuir espacios muertos y por consiguiente la disminución de seromas y más recientemente como protector contra la formación de adherencias. 35 Figura 11. Características del sello de fibrina. Estudios de diferentes laboratorios han señalado que tiene un efecto beneficioso para estimular la cicatrización de las heridas con un aumento en la hidroxiprolina indicando que en la herida hay una mayor cantidad de colágena, acelerando la revascularización, razón por la cual la regeneración es más rápida y aunado a esto, al actuar como una barrera física permite una menor formación de adherencias entre los tejidos protegidos82. Los sello de fibrina, como ya se comentó, estaban hechos en un inicio de una mezcla de altas concentraciones de fibrinógeno humano y de trombina bovina. Actualmente estos pueden contener diferentes concentraciones de fibrinógeno humano, trombina humana para evitar reacciones de compatibilidad, calcio y factor XIII (factor estabilizador de fibrina). Los sellos de fibrina han sido recientemente aprobados por la Food And Drug Administration para la hemostasia durante cirugía, así como agente sellante en la realización de anastomosis intestinales. Sus efectos como preventivo en la formación de adhesiones esta aún en fase de investigación y se cree que este pudiera deberse a neoangiogénesis de la superficie peritoneal, disminución en la vascularización de las adherencias y al actuar como una barrera física entre las estructuras42,57. Mecanismo de acción: Los sellos de fibrina son hechos primero de concentrados de fibrinógeno/factor XIII/fibronectina y trombina, en presencia de clorhidrato de calcio, esos dos componentes activan el fibrinógeno para formar el coágulo de fibrina insoluble. Un agente antifibrinolítico (Vg. aprotinina) es adicionado para disminuir o inhibir la degradación del coagulo como naturalmente ocurre en el sistema 36 fibrinolítico humano; Los sellos de fibrina imitan los últimos pasos de la cascada de la coagulación80 . MODELO ANIMAL PARA LA ENSEÑANZA E INVESTIGACIÓN EN CIRUGÍA: La rata y el ratón de laboratorio son animales que a través del tiempo han demostrado ser el modelo ideal para la investigación, debido a las siguientes características: 1. Su alta capacidad de reproducción, 2) Su corto período de gestación y de lactancia, 3) Su alto número de crías por camada, 4) Ocupan poco espacio, 5) Docilidad que los hace adecuados para su manipulación, 6) Alta capacidad de adaptación y 7) Sus aparatos y sistemas son muy parecidos a los del ser humano. Se cree que la rata se estableció en Europa central proveniente de países Escandinavos, esta especie empezó a ser popular como animal de laboratorio en la segunda mitad de siglo XIX, siendo la rata albina la primera variedad reconocida, y aunque existen diferentes razas de estas como lo son la Spraque-Dawley y la LongEvans, la cepa Wistar es una rata de cabeza ancha con la cola más corta que su cuerpo y de orejas largas mas resistente a ciertas enfermedades respiratorias y más prolífica. La rata Wistar tuvo su origen en el Instituto Wistar de Anatomía y Biología en Filadelfia en EUA inaugurado en Mayo de 1894. Después de la segunda guerra mundial resurgió de manera muy importante el uso de rata s en la investigación biomédica. La tabla de reproducción de la rata muestra que esta alcanza la pubertad entre los 70 a 80 días (280 a 300 gr) alcanzando la etapa adulta joven entre de 3 y 6 meses (300 a 400 gr) y posterior a este tiempo se considera que inicia su período de envejecimiento. Las constantes fisiológicas de la rata son: temperatura 36.5 a 37º C, frecuencia cardiaca de 90 a 130 LPM, frecuencia respiratoria de 90 a 140 por minuto, glóbulos blancos de 7.4 a 10.3 103 x mm3, glóbulos rojos de 5.9 a 8.5 106 x mm3 , y además un volumen sanguíneo de 6.7cc por cada 100 gr de peso. Siendo los sitios de elección para la toma de muestras sanguíneas en la rata: corazón, vena safena anterior, vena femoral, vena yugular, venas de la cola y seno orbitario venoso 83. En el momento actual, los modelos animales para cirugía preferidos son los que emplean al cerdo y al perro, sin embargo desde el punto de vista práctico, los 37 modelos experimentales en rata permiten llevar a cabo un sinnúmero de intervenciones quirúrgicas complejas 84. El objeto de numerosos estudios es el de buscar un modelo experimental útil para la enseñanza y la investigación en el campo de la cirugía experimental, que reúna las siguientes características: Menor costo, fácil manejo y la posibilidad de implementarse en laboratorios no especializados. La Rata, animal ampliamente empleado en el laboratorio, reúne los requisitos mencionados, especialmente en el área quirúrgica, donde el trauma tisular se reproduce en forma importante, así lo han demostrado una multiplicidad de investigadores en recientes publicaciones84-87. C. MARCO CONCEPTUAL: En nuestro hospital no existen estadísticas exactas escritas de la frecuencia del problema pero de acuerdo a información del Sistema de Información Médica (SIMO) la hernia inguinal ocupa el 6º lugar como causa de intervención quirúrgica después de la cirugía ambulatoria, de la vesícula biliar, septum, reducciones de fracturas abiertas o cerradas y cataratas. Se realizan un promedio de 160 procedimientos anuales la mayoría en forma electiva sin obstrucción ni gangrena ocupando el 31.2% de camas censables del hospital. Los efectos de la malla colocada en los tejidos y su respuesta inflamatoria así como los esfuerzos realizados por reducir sus efectos adversos y complicaciones han sido hasta el momento poco estudiados, por lo tanto hay pocas evidencias de tales efectos de las bioprótesis y sus reacciones ante la respuesta inflamatoria. 38 6. DEFINICIÓN DEL PROBLEMA. Una de las intervenciones quirúrgicas más frecuentemente practicadas en los últimos 100 años es la reparación de hernias. La desventaja de este tipo de cirugías es que son una operación extensa, los pacientes tienen una convalecencia más lenta, tienen más dolor durante varios días y realizan trabajo de escritorio hasta pasados 1 a 2 semanas, tareas pesadas en 4 a 6 semanas y todas las modificaciones de las técnicas de hernioplastía han tenido como desventaja en común la tensión sobre la línea de sutura lo que repercute en un mayor estrés quirúrgico secundario a la lesión. La formación de adherencias es una complicación casi obligada ya que se llega a presentar hasta en el 93% de los casos, sobre todo después de la utilización de materiales protésicos, los esfuerzos para reducir su frecuencia mejorando las técnicas quirúrgicas han dado buenos resultados, pero a pesar de ellos el problema continúa siendo grave, sin embargo la introducción del uso de sellos de fibrina en la cavidad intrabdominal ha reducido significativamente las adherencias en diferentes modelos animales por lo cual planteamos: ¿La utilización de sellos de fibrina será más eficaz en la prevención de formación de adherencias intrabdominales en presencia de un cuerpo extraño, como la malla de polipropileno, en un modelo de hernia de pared abdominal en ratas? 39 7. JUSTIFICACIÓN: A. MAGNITUD: La magnitud de este problema es poco específica, ya que no existen datos concretos al respecto. Las hernias de la pared abdominal siguen siendo una de las complicaciones más frecuentes de los procedimientos quirúrgicos abdominales, y su frecuencia varía desde el 0.5% al 13.9% de los pacientes sometidos a cirugía, siendo una fuente importante de morbilidad y mortalidad y pérdida de trabajo productivo. El costo de una reparación de hernia de pared en nuestro hospital, de acuerdo a trabajos realizados, es de aproximadamente $8,408.9941 lo que significaría un gasto anual aproximado de $187,015.93 en reoperaciones, por lo que la utilización de bioprótesis con malla de polipropileno durante la hernioplastía abdominal es ahora considerado como de rutina, y ha sido preferida por los cirujanos generales porque la técnica es simple, rápida, efectiva, y segura, con menos dolor postoperatorio, incomodidad, pronto regreso al trabajo y baja tasa de recurrencias. Pero la formación de adherencias, que es inevitable posterior a la reparación de hernias incisionales con prótesis de mallas cuando éstas quedan en contacto directo con el contenido abdominal, con una prevalencia de 67% a 93%, pueden causar múltiples desórdenes incluyendo obstrucción intestinal, formación de fístulas enterocutáneas e infertilidad. La utilización de barreras físicas llamadas sellos de fibrina, han sido empleadas para reducir, en al menos un 50%, la formación de adherencias dentro de la cavidad abdominal por lo que se plantea su utilización con la finalidad de resolver esta problemática. En el H.G.Z.M.F. # 1 del I.M.S.S en Colima la cirugía de la hernia ocupa el 6º lugar entre las operaciones realizadas con un promedio de 160 cirugías por año, ocupando el 31.2% de camas censables del hospital, y no existen datos que sugieran la magnitud de las complicaciones por el uso de bioprótesis de este tipo, pero el incremento en su utilización es notable. Entonces tenemos la obligación del estudio de los efectos de estos materiales utilizando un modelo animal. B. TRASCENDENCIA: Posterior a una laparotomía la incidencia de formación de adherencias puede variar de 63% a 93% y, cuando se utilizan materiales protésicos esta se puede ver 40 incrementada, Obstrucción intestinal, formación de fístulas, obstrucción ureteral, infertilidad y dolor pélvico crónico son complicaciones frecuentes y mortales de las adherencias intrabdominales. Este trabajo tiene como finalidad revisar y comparar algunos aspectos de la formación de adherencias posterior a la colocación de materiales aloplásticos, y la evolución postoperatoria de las hernias de la pared abdominal en modelos animales manejados con sellos de fibrina, tratando de probar su utilidad en cuanto a la colocación de materiales inertes y biocompatibles que no alteren la respuesta inflamatoria del paciente quirúrgico mejorado así la cicatrización, así como sus complicaciones mórbidas asociadas al uso de dichos materiales y de esta manera estandarizar los procedimientos de reparación a través de servicios especializados de manejo. C. VULNERABILIDAD: Con el advenimiento de la cirugía libre de tensión ha renacido el interés por el tratamiento de las hernias de la pared abdominal, tratando de probar que utilidades puede brindar este método quirúrgico para el manejo de ellas que justifique el abandono de técnicas convencionales y menos efectivas que se han venido utilizando hasta la actualidad. La creación de grupos de trabajo especializados, dedicados al estudio y manejo quirúrgico de la hernia, llamados también Clínica de Hernias, tendrían a demostrar las ventajas de la especialización bajo un protocolo permitiendo obtener mejores resultados a corto y largo plazo con la consecuente mejora en la calidad de la atención, resultando en un substancial ahorro económico de recursos. D. FACTIBILIDAD: En nuestro hospital los gastos variables para realizar una reparación libre de tensión (incluyendo la malla) son de aproximadamente $ 7,957.77 por caso a costos institucionales, iniciar la realización de estudios de efectos de técnicas libres de tensión a causa de la disponibilidad del equipo existente se amortizarían los precios ya que la mayor parte del equipo requerido ya existe. E. VIABILIDAD: 41 Este estudio fue considerado como viable ya que existió en el Centro Universitario de Investigaciones Biomédicas y en el Hospital General de Zona y Medicina Familiar # 1 del Instituto Mexicano del Seguro Social los recursos humanos y de equipamiento para su realización, se contó con los insumos necesarios dentro de cuadro básico (material protésico) para su ejecución. El resto de insumos como el modelo animal en convenio con el Centro Universitario de Investigaciones Biomédicas (CUIB) de la Facultad de Medicina se proporcionaron sin incremento del costo. Los reactivos necesarios para las mediciones de la intensidad de reacción tisular y presencia de adherencias, las concreciones histopatológicas así como el desarrollo del modelo experimental se apoyó, para su realización, en los diferentes fondos para la investigación existentes los cuales asignaron recursos para su realización los siguientes: El FOFOI con una aportación de $ 75,000.00 y el SIMORELOS dependiente de CONACYT con una cantidad de $ 146,749.62. 42 8. HIPÓTESIS. A. GENERAL: La utilización de sellos de fibrina en la técnica de hernioplastía libre de tensión con bioprótesis de polipropileno en hernias de la pared abdominal en un modelo animal con ratas es más eficiente al modular la formación de adherencias al actuar como una barrera física entre las superficies despulidas separándolas y disminuyendo la excreción de substancias proinflamatorias locales que inducen formas adherentes de tejidos, mejorando la angiogénesis y la acumulación local de células mononucleares permitiendo así una mejor cicatrización peritoneal. B. ESTADÍSTICA: Ho: La formación de adherencias al utilizar sellos de fibrina durante la técnica de hernioplastía libre de tensión en hernias de la pared abdominal en un modelo animal con ratas no es diferente que cuando se coloca la malla de polipropileno sin dicha barrera. H1: La formación de adherencias al utilizar sellos de fibrina durante la técnica de hernioplastía libre de tensión en hernias de la pared abdominal en un modelo animal con ratas es diferente que cuando se coloca la malla de polipropileno sin dicha barrera. 43 9. OBJETIVOS. A. GENERAL: Evaluar el efecto de los sellos de fibrina como una barrera bioabsorbible compuesta de una mezcla de fibrinógeno y trombina humana ante la presencia de un cuerpo extraño, como la malla de polipropileno, en un modelo de hernia de la pared abdominal en ratas. B. ESPECÍFICOS: A) Determinar el efecto tópico de los sellos de fibrina en la formación de adherencias en un modelo de hernia de pared abdominal en ratas. B) Comparar la densidad de las adherencias al colocar sellos de fibrina a través de escalas de adhesión validadas. C) Cotejar la superficie adherida al parche de malla de polipropileno en cm 2 o porcentaje al utilizar o no sellos de fibrina. D) Relacionar el tipo de órganos adheridos a la superficie del injerto de polipropileno al utilizar o no sellos de fibrina. E) Confrontar a través de parámetros histológicos y escalas de reacción tisular el tiempo y la cantidad de síntesis de nueva colágena en unidades de observación sometidas a hernioplastías libres de tensión al utilizar o no sellos de fibrina. 44 10. MATERIAL Y MÉTODOS. A) DISEÑO DEL ESTUDIO: Ensayo experimental controlado. B) DEFINICIÓN DEL UNIVERSO DE ESTUDIO: Ratas adulta Wistar machos entre 300 a 400 gr (4 a 6 meses de edad), cepas existentes en el bioterio del CUIB y de la Facultad de Medicina de la Universidad de Colima. C) TAMAÑO DE MUESTRA: Se utilizó un muestreo simple al azar basándose en fórmula para ensayos clínico aleatorios con diseño para encontrar una diferencia entre dos proporciones88 para lograr un máximo de precisión con el tamaño mínimo de muestra. Basados en un poder del 80% para detectar un nivel de significación, el estudio fue calculado para detectar una diferencia del 50% estimando que el 80% de los operados sin sello de fibrina tendrán una mayor formación de adherencias y solo el 30% de los operados con aplicación de sello de fibrina las presentarán. El intervalo de confianza utilizado para todos las pruebas fue del 95%; se considero una significación estadística cuando se alcanzó un valor alfa del 95% n= (Z α / 2 + Z β) 2 p(1 ()(?− p) (r +1) 2 (d ) r Zα al 95% = 1.961 (para una cola) Z β al 80% = 0.84 (para una cola) d = Valor nulo de las diferencias en proporciones = p 2 – p1 = 0.70 – 0.32 = 0.34 r = Razón entre el número de individuos en ambos tratamientos = 1 p 2 = Proporción de individuos en el peor tratamiento que no se recuperan = 1 -.30 = .70 p 1 = Proporción de individuos en el mejor tratamiento que no se recuperan = 1-.80 = .20 _ P = Promedio Ponderado = (p 2 + rp1) / (1+ r) = .70 + (1)(.20) / 1 + 1 = .45 (Zα /2 + Zβ )2 = 7.842 45 n = Número de individuos por tratamiento = 16 Lo cual nos dio un total de 16 unidades por grupo con una diferencia esperada entre ambos tratamientos del 50% más un 20% de pérdidas siendo 20 unidades de observación en total a estudiar. D) DEFINICIÓN DE LAS UNIDADES DE EXPERIMENTACIÓN: Ratas adultas cepa Wistar machos entre 300 a 400 gr de 3 a 6 meses de edad, a las cuales previamente se les realizó un defecto en la pared abdominal de 2.25 cm2 de acuerdo a modelos reportados en la literatura 31)de Virgilio y posteriormente fueron sometidos a plastía de pared abdominal con técnica libre de tensión y aplicación de sello de fibrina. E) DEFINICIÓN DEL GRUPO CONTROL: Ratas adultas cepa Wistar machos entre 300 a 400 gr de 3 a 6 meses de edad, a las cuales previamente se les realizó un defecto en la pared abdominal de 2.25 cm2 y posteriormente fueron sometidos a plastía de pared abdominal con técnica libre de tensión y sin aplicación de sello de fibrina. F) CRITERIOS DE INCLUSIÓN: 1. Ratas Wistar adultos machos provenientes de una misma camada. 2. De 300 gr. a 400 gr. de peso entre 4 a 6 meses de edad, cepas existentes en el bioterio del CUIB de la Universidad de Colima. G) CRITERIOS DE NO-INCLUSIÓN: 1. Que no cumplan con los criterios de inclusión. H) CRITERIOS DE EXCLUSIÓN: 1. Muerte durante la intervención para la realización del defecto abdominal. 2. Muerte después de la primera intervención antes del período de observación y evaluación. 3. Enfermedad concomitante después del postoperatorio inmediato. 4. Animales extraviados. 46 11.DEFINICIÓN OPERACIONAL DE LAS VARIABLES. Véase tabla 1. 1. VARIABLES INDEPENDIENTES: 1) APLICACIÓN DE SELLO DE FIBRINA: Plastía abdominal realizada con la técnica libre de tensión con colocación de bioprótesis o malla de polipropileno sobre el defecto abdominal realizado previamente y cubierta con una barrera física biodegradable llamada sello de fibrina. Variable cualitativa nominal medida como presente o ausente. 2) SIN APLICACIÓN DE SELLO DE FIBRINA: Plastía abdominal realizada con la técnica libre de tensión con colocación de bioprótesis o malla de polipropileno sobre el defecto abdominal realizado previamente y sin cubrir con una barrera física biodegradable llamada sello de fibrina. Variable cualitativa nominal medida como presente o ausente. 2. VARIABLES DEPENDIENTES: 1) DENSIDAD DE LAS ADHERENCIAS: Presencia de estructuras fibróticas que corran en forma de liga calificadas, así como la firmeza de adhesión entre los órganos abdominales y el injerto de malla de polipropileno en la pared abdominal. Variable cualitativa ordinal medida a través de la escala validada modificada de Diamond 42,89. 2) SUPERFICIE DE MALLA CON ADHERENCIAS: Cálculo total de la superficie del injerto en cm2 de malla de polipropileno que es cubierto por adherencias. Variable cuantitativa de razón medida como el total estimado de superficie en cm2 de injerto de malla de polipropileno cubierto por adherencias. 3) ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO: Presencia de órganos o estructuras intra-abdomina les adheridos a la malla de polipropileno. Variable cualitativa nominal medida como Presente o ausente. 4) TIPO DE ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO DE POLIPROPILENO: Clasificados con el nombre del órgano (sólidos o huecos) o la estructura (epiplón) que se encuentre adherido a la superficie de la malla de polipropileno. 47 Variable cualitativa nominal medida como presente o ausente. 5) PARÁMETROS HISTOLÓGICOS: Conjunto de variaciones celulares a la cicatrización desencadenado por diferentes respuestas de reactividad tisular. Variable cualitativa intervalar que mide la reactividad histológica obtenida por microscopia de luz a través del sistema validado de graduación de Van Kruiningen90. VARIABLE NATURALEZA MEDICIÓN INTERRELACIÓN INDICADOR DEFINICIÓN APLICACIÓN DE SELLO DE FIBRINA DENSIDAD DE LAS ADHERENCIAS SUPERFICIE DE MALLA CON Cualitativa Cualitativa Cuantitativa Nominal Ordinal De Razón Independiente Presente o ausente Dependiente Escala validada modificada de Diamond Dependiente ADHERENCIAS ÓRGANOS O ESTRUCTURAS Cualitativa Nominal Dependiente Presente o ausente LA MALLA TIPO DE ADHERIDO A LA Nombre del Cualitativa Nominal Dependiente PARÁMETROS HISTOLÓGICOS órgano adherido MALLA Cualitativa Intervalar Dependiente Firmeza de adhesión entre los órganos Chi Cuadrado U de Mann Whitney con grupos independientes Superficie 2 Superficie total en cm t de Student 2 total en cm del injerto de para muestras estimada malla de independientes polipropileno cubierto por adherencias ADHERIDOS A ÓRGANO Técnica libre de tensión con malla de polipropileno + sello de fibrina PRUEBA Sistema de reacción tisular de Van Kruiningen Presencia de órganos o estructuras intraabdominales adheridas Tipo de órganos o estructuras adheridos a la superficie Respuestas celulares a la cicatrización Chi cuadrado Chi cuadrado t de Student para muestras independientes 48 12. PROCEDIMIENTO DE RECOLECCIÓN DE LA INFORMACIÓN (MANIOBRA DE INTERVENCIÓN). Tomando en consideración los criterios de inclusión se seleccionaron 40 ratas de la cepa Wistar (Fig. 12) de 300 gr a 400 gr de peso. El estudio se sometió a la aprobación del Comité de Investigación del H.G.Z.M.F # 1 con el número 2000-101-0024 y se manejó de acuerdo a los reglamentos vigentes para el uso de animales de laboratorio descritos en la Ley General de Salud de México y por el Manual de la rata de laboratorio cepa Figura 12. Ratas macho Wistar adultas. Wistar del bioterio del CUIB de la Facultad de Medicina de la Universidad de Colima. ALMACENAMIENTO Y PREPARACIÓN DE LA FIBRINA: Los viales de fibrina (Quixil? OMRIX Biopharmaceuticals)se almacenan a largo plazo en congelación a –20°C hasta su utilización. Una vez en el laboratorio experimental se procedió a descongelar los frascos de una de las siguientes formas: Dejándolos de 2 a 8°C en refrigerador, los frascos se descongelaron en un día, o dejándolos de 20 a 25°C, los frascos se descongelan en una hora, posteriormente y de manera independiente, los viales se agitan entre las manos hasta lograr visualizarlos en forma de líquidos transparente (Fig. 13). No se deben dejar los frascos a 37°C por más de 90 minutos ni mantenerlos a temperatura ambiente por más de 8 horas. El almacenamiento de la fibrina restante a corto plazo, ya preparada debe ser en Figura. 13 Preparación de la fibrina. refrigeración entre 2 y 8°C, alejados de la luz por hasta 14 días, y una vez descongelados no se pueden volver a congelar. 49 MANIOBRA QUIRÚRGICA: En el bioterio del CUIB dependiente de la Facultad de Medicina, en un cubículo proporcionado por el Laboratorio de Epidemiología, las ratas se anestesiaron con pentobarbital sódico a una dosis de 60 mg/kg de peso, por vía intraperitoneal, para lo cual se tomaron 10cc del frasco de Pentobarbital sódico (6.5 gr x 100cc) y se agregaron 90cc de agua estéril para aplicar .5cc por cada 100 gr. de peso vivo del animal. La cirugía fue realizada utilizando un microscopio Zeiss ® con lentes focales de 200mm y binoculares de 160mm, este microscopio proporciona magnificación entre 8x y 24x. (Fig. 14) una Figura 14. Microscopio Zeiss utilizado para realizar cirugías. Posterior a la asepsia y antisepsia con Isodine solución? , se procedió a colocar a las ratas en la tabla quirúrgica fabricada para este propósito para a continuación fijarlas de las extremidades, cada animal fue sometido a una laparotomía media de aproximadamente 3 cm de longitud, procediendo a disecar la piel y el tejido celular subcutáneo, se resecó con tijera para iris el músculo recto abdominal, Figura 15. Defecto en la pared abdominal. su aponeurosis e incluyendo el peritoneo, lo que creó un defecto de 1.5 x 1.5 cm (2.25 cm2) de acuerdo a modelos reportados en la literatura 41 (Fig. 15). Una vez abierta la cavidad abdominal y creado el defecto, tanto el intestino delgado como el grueso en toda su longitud fueron expuestos para su revisión. Se procedió a realizar tres lavados de 10 minutos con solución de cloruro de sodio al 0.9%, posteriormente y por encima del peritoneo a cada rata se les colocó un pedazo estéril de malla de polipropileno de 1.5x1.5 cm (Marlex ® ), contaminada con el talco de los guantes, debajo del músculo recto restante para cubrir el defecto de la cavidad abdominal creado utilizando una sutura corrida de nylon 5/0. Los animales fueron divididos mediante una lista de números aleatorios generada por un programa computacional en dos grupos de estudio de 20 ratas cada uno: 50 Grupo A: Plastía abdominal realizada con la técnica libre de tensión con colocación de bioprótesis o malla de polipropileno sobre el previamente y cubrir sin defecto con abdominal una realizado barrera física biodegradable de sello de fibrina. El grupo A no tuvo tratamiento alguno sobre los parches de malla. Grupo B: Plastía abdominal realizada con la técnica libre de tensión con colocación de bioprótesis o malla de polipropileno sobre previamente y el defecto cubierta con abdominal una realizado barrera física biodegradable o sello de fibrina. Preparación del Sistema de aplicación Mixject – Spray o sello de fibrina (Quixil ® ): Tomando la jeringa dúo con una mano, con la otra se toman los émbolos y se tracciona una mano adelante y la otra hacia atrás. Posteriormente procedemos a insertar los dos viales (Fibrina y Trombina humana) dentro de las copas para viales. Las copas para viales pueden ser manejadas con técnica estéril. Instrucciones de llenado: Una vez insertados los viales se toman las copas para viales, se empuja la tapa del vial dentro del conector del vial que esta fijo dentro de la jeringa aplicadora. Figura 16. Preparación de la jeringa dúo. Tomamos la jeringa dúo con una mano, aspiramos el contenido de los dos viales lentamente (los viales con el fondo hacia arriba). Si es necesario se regresan al vial y se vuelven a aspirar para expeler el aire. Mientras tomamos la jeringa dúo con una mano, lentamente se rota el conector y el Figura 17. Aplicación de sello de fibrina en spray. 51 vial con la otra mano. El conector, el vial y la copa para vial en combinación se desconectan automáticamente. Si se requiere sistema para spray, conectamos el tubo al regulador de presión y el aplicador está listo para utilizarse (Fig. 16). 1cc de sello de fibrina (0.5cc de fibrinógeno humano y 0.5cc de trombina humana equivalente a 180 mg/ml y 1000 UI/ml respectivamente, además de 6.24 mmol/L de calcio) fueron dispersados con efecto de spray (Fig. 17) sobre la superficie de la malla de polipropileno, permitiendo la formación de una capa gelatinosa que cubra el parche y la sutura. La incisión media fue cerrada en una capa utilizando sutura corrida de nylon 4/0. Los animales fueron sacrificados a los 15 días con una dosis letal de pentobarbital sódico intraperitoneral, realizándosele una necropsia inmediata a través de la línea media para la evaluación de las variables a través de la extirpación de la pieza quirúrgica en bloque junto con las adherencias. Las piezas quirúrgicas fueron analizadas por un observador ciego al procedimiento en el laboratorio de histopatología de la Facultad de Medicina. Figura 18. Área de trabajo en el laboratorio de cirugía experimental del CUIB. MEDICIÓN DE VARIABLES: A. DENSIDAD DE LAS ADHERENCIAS: La densidad de las adherencias se midió con la escala modificada de Diamond 42,89 , graduándolas de 0 a 3 de la siguiente manera: Grado 0: Sin adherencias, Grado 1: Pocas adherencias y separables fácilmente de la malla, Grado 2: Moderadas adherencias, difícilmente separables de la malla y Grado 3: Adherencias severas, se requieren instrumentos para su separación (Fig. 19). 52 Figura 19. Grado 0 Grado 1 Grado 2 Grado 3 B. SUPERFICIE DE MALLA CON ADHERENCIAS: Se determinó calculando la superficie de la malla de polipropileno en cm2 que esta cubierto por adherencias pudiendo ser este de 0 a 2.25 cm2. Esto se calculó utilizando un programa computacional Sistema de Información Geográfica ER Mapper G.O. ? del Centro Universitario de Investigaciones en Ciencias del Ambiente de la Universidad de Colima (Fig. 20) a cargo de Dr. Ignacio Galindo Estrada y el Ing. Juan Pablo López Pérez, estimando un acercamiento mayor al 99%91. Figura 20. Densidad medida con el Sistema de Información Geográfica ER Mapper. C. ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO: Se estipuló la presencia o ausencia de órganos o estructuras intra-abdominales adheridos a la malla de polipropileno. Figura 21. Presencia de malla sin adherencias y con adherencias. 53 D. TIPO DE ÓRGANOS O ESTRUCTURA ADHERIDOS A LA SUPERFICIE DEL INJERTO DE POLIPROPILENO: Se registró el tipo de órganos o estructura adheridos a la malla y se clasifico de acuerdo a su consistencia en sólidos o huecos, así como el nombre específico del órgano o estructura adheridos. Figura 22. Tipo de órgano adherido: sólido (epiplón) o hueco (ciego). E. PARÁMETROS HISTOLÓGICOS: Se analizaron, por parte del Departamento de Histopatología de la Facultad de Medicina a cargo del Dr. Francisco Fierro Velasco, Dr. Luis Robledo Peña y la Dra. Alejandrina Rodríguez Hernández, muestras de te jido de la región cicatrizal en la pared abdominal intervenida de ambos grupos bajo microscopia de luz para identificar los tipos de colágena de la muestra en tinciones de hematoxilina y eosina. Los bloques de músculo de las ratas de laboratorio y la malla adherida que fueron obtenidos por necropsia fueron fijados en formol al 10%. Cada bloque conteniendo el injerto de malla y el músculo circunvecino así como el tejido adherido a la malla se tiñeron en sus bordes con tinta china y se seccionaron transversalmente del borde superior al inferior, incluyéndose en cápsulas separadas para su proceso histológico. La preparación histológica fue como sigue: Deshidratación con alcohol al 70%, 80% y 90% progresivamente, posteriormente utilización de alcohol absoluto y alcohol absoluto-xilol y aclaración con xilol, se procede a doble baño de parafina a 56° con orientación e inclusión total en parafina para proceder a congelación a -20 °C y corte en microtomo con secciones de 4 micras de espesor. Tinción: Se procedió a desparafinar en la estufa a 30 minutos y utilización de xilol, alcohol-xilol, alcohol absoluto, alcohol a 96° y agua corriente, aplicación de colorante de Hematoxilina de Harris por 5 minutos , lavado con agua corriente y 54 alcohol de 96°, aplicación de Eosina amarillenta de 3 a 5 minutos y finalmente lavado con alcohol de 96°, alcohol absoluto y alcohol- xilol. Fotografía digital fue tomada de los especímenes y procesada en la computadora. Las áreas a evaluar se manejaron a través de procesamiento digital por computadora para lograr magnificaciones del espécimen entero y de las áreas de interés en donde pudiera ser visible bajo microscopía con alto poder de magnificación (40x). La extensión de la cicatriz se evalúo en micrones con regla digital procesada por la computadora, el conteo celular se logró a través de proceso computacional por bloques celulares en tres áreas específicas promediando su número lo mismo se realizó con el tipo celular que se determino en tres áreas especificas registrando el de mayor predominio. Posteriormente se procedió a evaluar la reacción tisular a través del SISTEMA DE REACCIÓN TISULAR (SRT) propuesta por Kruiningen90 de la siguiente manera: Una calificación, intervalar, cuantitativa de reactividad tisular se determinó con microscopía de luz. La escala de reacción tisular se obtuvo por la suma de calificaciones de tres parámetros: 1) cicatriz inflamatoria, 2) cuantificación celular y 3) tipo celular predominante. Cada parámetro fue asignado a una calificación de 1 a 4 dependiendo de su magnitud: ESCORE CICATRIZ (I) # CELULAR (II) TIPO CELULAR (III) (micrones) FACTOR DE PESO (IV) 1 < 200 < 50 NEUTRÓFILOS = 6 (1) X 5 2 200 -399 50-199 LINFOCITOS = 2 (2) X 3 3 400 -600 200-700 EOSINÓFILOS = 2 4 > 600 > 700 CÉLULAS GIGANTES = 2 FIBROBLASTOS = 1 MACRÓFAGOS = 1 Tabla 2. Clasificación de reacción tisular (SRT) propuesta por Kruiningen. Cada calificación (I y II) fue entonces multiplicada por un factor de peso predeterminado (IV). Posteriormente se obtuvo la CALIFICACIÓN DE PESO 55 CELULAR (V) = TIPO CELULAR (III) X # CELULAR (II), para obtener por último la calificación final se aplicó la siguiente formula: TRS = CICATRIZ (I) + # CELULAR (II) + PESO CELULAR (V) (Tabla 2) A mayor calificación obtenida se tradujo en una mayor respuesta inflamatoria a la cicatrización. Ejemplo (Tabla 3): PACIENTE I CALIF. IV II CALIF. IV III 1 309µ m 2 2X5=10 86 2 2X3=6 L=2 2X2=4 10+6+2=20 2 764µ m 4 4X5=20 41 1 1X3=3 F=1 1X1=1 20+3+1=24 V (IIXIII) SRT(I+II+V) Tabla 3. Grado de respuesta inflamatoria de acuerdo a la clasificación de Kruiningen. 56 13. DEFINICIÓN DEL PRESENTACIÓN PLAN DE LA DE PROCESAMIENTO INFORMACIÓN Y (ANÁLISIS ESTADÍSTICO). En las variables cualitativas nominales se anotaron frecuencias, proporciones, porcentajes, tasas o razones, dependiendo del caso y resultados. Las estadísticas no paramétricas para dos grupos con muestras independientes se analizó con la prueba de Chi cuadrada. Los datos continuos se expresaron con promedios ± desviación estándar; y dependiendo de su distribución, otros datos continuos se expresan como medianas con rangos intercuartílicos. Para el análisis de las diferencias entre los grupos, utilizamos pruebas t de Student de dos colas, para comprobar que los resultados estuvieron normalmente distribuidos utilizamos la prueba de la homogeneidad de las varianzas de Barttlet. A. DENSIDAD DE LAS ADHERENCIAS: Para la comparación de la densidad de adherencias entre los dos grupos se utilizaron pruebas no paramétricas para grupos independientes con variables cualitativas como la U de Mann Whitney. B. PORCENTAJE DE MALLA CON ADHERENCIAS: Para cotejar el total de superficie de la malla con adherencias en cm2 se utilizó la prueba de t de Student para muestras independientes. C. TIPO DE ÓRGANOS ADHERIDOS A LA SUPERFICIE DEL INJERTO DE POLIPROPILENO: Para la evaluación este tipo de variables nominales en dos grupos con muestras independientes se utilizó la prueba de Chi cuadrado. D. PARÁMETROS HISTOLÓGICOS: Para confrontar a través de parámetros histológicos en el caso de la evaluación del sistema de graduación de Van Kruiningen se utilizaron pruebas paramétricas para muestras independientes como la prueba t de Student. Para evaluar la eficacia de la aplicación de fibrina respecto a las complicaciones, fueron determinados los siguientes factores: Reducción de Riesgo Absoluto (RRA), que se obtuvo substrayendo la proporción de unidades de experimentación en el grupo experimental que no mejoraron (Y), de la proporción de unidades en el grupo control (X) que no lo hicieron (Y - X); Riesgo Relativo (RR) proporción de unidades 57 que no mejoraron, unidades que sometidos a la aplicación de fibrina respecto a los pacientes del grupo control (Y / X); Reducción del Riesgo Relativo (RRR), expresado como un porcentaje (1 - [Y / X] x 100), lo que significa el grado en que el riesgo de complicarse es reducido respecto al grupo que se le aplicó fibrina con relación al grupo control, manifestando que el tratamiento con fibrina reduce el riesgo de eventos adversos con relación a lo que ocurre en el grupo sin fibrina, por lo que mientras mayor fue la RRR mayor fue la eficacia del tratamiento, y por último el Número Requerido a Tratar (NRT), indicando si el beneficio ofrecido por la aplicación de fibrina es mayor que el esfuerzo y costo involucrados en su adquisición o aplicación (1 / RRA), expresado como una medida de la eficacia de un tratamiento o sea el número de unidades experimentales que se necesitó tratar con fibrina para evitar la ocurrencia adicional de un evento adverso, llamado de otra forma, el beneficio ofrecido por la terapia propuesta; por lo que mientras mayor sea la probabilidad de presentar algún evento indeseable al no aplicarse fibrina, mayor será el beneficio de la terapia con fibrina y menor el número de unidades de experimentación que tendremos que tratar para prevenir un evento92 . Todos los valores de significación reportados fueron de dos colas con un nivel α de 0.05. El estudio fue de suficiente tamaño de muestra para detectar dife rencias del 50% con un poder de 80%. 14. ORGANIZACIÓN GANTT). Ver Anexo 1. DE LA INFORMACIÓN (PROGRAMA DE 58 15. CONSIDERACIONES ÉTICAS. Debido a que este es un estudio de investigación biomédica que utilizó animales de experimentación, materiales aloplásticos y ma teriales biodegradables como los sellos de fibrina en la reparación de la hernia ventral su ejecución se apegó a las normas establecidas por el Comité de Investigación Científica del H.G.Z.M.F. # 1 del I.M.S.S. en Colima. Aunque el objetivo fue el de estudiar la eficacia de dos modalidades de tratamiento quirúrgico en animales de experimentación se siguieron los prospectos del método científico y las buenas prácticas de la investigación clínica de acuerdo a la declaración de Helsinki y sus modificaciones en Tokio publicados en la Asamblea Mundial de la OMS en Japón en 1975, enmendada en 1989, así como la observancia de la reglamentación de la investigación biomédica descrita en el Código Sanitario Mexicano en su reglamento de uso de animales de laboratorio y la Guide for the care and use of laboratory animals of the National Institutes of Health93. 59 16. RECURSOS. A. HUMANOS: El trabajo se desarrolló con apoyo del personal del departamento de Cirugía General del H.G.Z.M.F. # 1 del I.M.S.S. en Colima, con la participación de dos cirujanos del departamento: Dr. Emilio Prieto Díaz Chávez, investigador responsable, y el Dr. José Luis Medina Chávez, investigador asociado, así como de personal del Laboratorio de Epidemiología Clínica del Centro Universitario de Investigaciones Biomédicas a cargo del Dr. Rafael Coll Cárdenas, del laboratorio de Patología de la Facultad de Medicina de la Universidad de Colima a cargo del Dr. Francisco Fierro Velasco, el Dr. Luis Robledo Peña y la Dra. Alejandrina Rodríguez Hernández, y el Ce ntro Universitario de Investigaciones en Ciencias del Ambiente de la Universidad de Colima a cargo de Dr. Ignacio Galindo Estrada y el Ing. Juan Pablo López Pérez. B. MATERIALES: Ver Anexo 2 60 17. RESULTADOS. SOBREVIDA DE LOS ANIMALES: Todos los animales analizados en este estudio sobrevivieron a la cirugía y se recuperaron del procedimiento anestésico en 5 a 10 minutos después de terminado el procedimiento. El tiempo de latencia para la anestesia fue de 28 ± 21 minutos para el grupo A y de 21 ±10 para el grupo de fibrina. Una rata de cada grupo murió una hora después de terminado el procedimiento por lo que fueron repuestas de manera aleatoria. La muerte de los animales fue a causa de la anestesia (Fig. 23). 44 Unidades elegibles Dos excluidas Razón: Muerte Transoperatoria Criterio (n = 42) 42 Aleatorizadas 21 Designadas al grupo con fibrina 20 Recibieron la intervención 1 No recibio la intervención Razón: Criterio de exclusión 21 Designadas al grupo sin fibrina 20 Recibieron la intervención 1 No recibio la intervención Razón: Criterio de exclusión Seguimiento a: Seguimiento a: 1 Semana: n = 20 2 Semanas: n =20 1 Semana: n = 20 2 Semanas. n = 20 20 Analizados 20 Analizados Datos disponibles de 20 (100%) Datos disponibles de 20 (100%) Figura 23. Diagrama de flujo en los grupos de aplicación o no de fibrina. El tiempo quirúrgico promedio fue de 33.05 ± 8.68 (recorrido intercuartílico de 24 a 53) minutos para el grupo A y de 28.3±7.76 minutos para el grupo B (RI de 18 a 15). No encontramos diferencia estadística significativa en los resultados de latencia y tiempo quirúrgico con una p mayor de 0.05.Todos los animales sobrevivientes perdieron peso inicialmente, pero la mayoría inició una ganancia de este a partir del día cinco, solo una rata del grupo A perdió 3 g de peso en tanto que una del grupo A y otra del B se mantuvieron sin cambios, todos los animales examinados que experimentaron ganancia hacia el día 10 habían rebasado su peso preoperatorio. Al final la ganancia de peso fue mayor para el grupo A con un promedio de 24 gr. 61 ±11.123 (RI: 0 a 40) mientras que para el B fue de 15 g ±11.160 (RI: 0 a 33) demostrando una diferencia estadística con p de 0.02. DENSIDAD DE LAS ADHERENCIAS: Tabla 4. Densidad de las adherencias (Escala modificada de Diamond): 0 1 2 3 _ X Fibrina (n = 20) 8 11 1 0 0.65 0 –2 ± 0.58 Control (n = 20) 0 3 14 3 2.0 1– 3 ± 0.56 Valor de p 0.001 0.02 0.0002 0.1 Rango DE 0.001 La severidad de las adherencias de acuerdo a la evaluación con la Escala Modificada de Diamond (Fig. 24) fue como sigue: el promedio de calificación para la densidad de las adherencias en el grupo A fue de 2.0 (± 0.56) en tanto que para el grupo B fue de 0.6 ( ± 0.58) con una p < 0.05. (Tabla. 4) _ _ Grupo B X 0.65 Grupo A X 2.0 Figura 24. Comparación de la severidad de las adherencias entre los grupos. 62 SUPERFICIE DE MALLA CON ADHERENCIAS: _ _ Grupo B X 0.65 Grupo A X 1.60 Figura 25. Promedio de malla cubierta con adherencias. El promedio de cm 2 del parche de malla de polipropileno cubiertos con adherencias (Fig. 25) fue de 1.60 cm2 ± 0.512 (rango de 0.4 a 2.25 cm2) para el grupo A en tanto que solo fue de 0.67 cm2 ± 0.655 (rango de 0 a 1.81) para el grupo B (p = 0.00001), lo que corresponde a un porcentaje en el grupo A de 71.60% ± 22.43 (rango de 17.96% a 100%) y un porcentaje en el grupo B de 29.94% ± 29.10 (rango de 0% a 80.30%) con una p < 0.001 (Tabla 5) Tabla 5. Superficie con adherencias: Fibrina Control (n = 20) (n = 20) p _ X malla adherida Cm2 ± DE 0.67 ±0.65 1.60 ±0.51 0.00001 % ± DE 29.94 ±29.10 71.60 ±22.4 0.00001 V.S. (%± DE) 33.7% ± 32 78.3% ± Diferencia estimada p: V.S: Valoración subjetiva. 0.001 0.5 63 Se realizó al mismo tiempo una valoración subjetiva tradicional con plantilla de aproximación del promedio de adherencias para compararlo con el método computacional propuesto, el promedio de porcentaje de malla de polipropileno cubierto por adherencias del grupo de fibrina con el método subjetivo fue de 33.7% ± 32 contra 78.3 ± 27 en el grupo control (p = 0.00003). La diferencia estimada entre los métodos no fue significativa con una p de 0.5 ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO: La pared abdominal fue evaluada para determinar la presencia de adherencias al tiempo de la medición de las variables. Las adherencias fueron determinadas al momento de la necropsia considerando a órganos sólidos (epiplón) o huecos (estómago, intestino delgado o ciego) los cuales se adhirieron a los parches de malla de polipropileno en 32 ratas (80%) y sólo en 8 casos no se encontraron adherencias (20%); las adherencias se presentaron más frecuentemente en el grupo sin fibrina (Fig. 26). Figura 26. Presencia o no de adherencias a la malla. Dentro del grupo de fibrina 8 de 20 parches (40%) no tuvieron adherencias, en tanto que todos los parches sin fibrina presentaron algún grado de formación de adherencias (p < 0.05). (Tabla 6) 64 Tabla 6. Presencia de Adherencias: Fibrina (n = 20) Órgano sólido o hueco 12/20 (60%) No Adherencias 8/20 (40%) Control (n = 20) p 20/20 (100%) 0/20 (0%) 0.001 Determinación del efecto de los sellos de fibrina: Si dentro del grupo sin fibrina se observaron 20 ratas con adherencias y solo 12 con algún tipo de esta en el grupo con fibrina, el cálculo del estimado puntual de la reducción del riesgo relativo (RRR) así como la reducción del riesgo absoluto (RRA) fueron del 40% con un riesgo relativo de (RR) 0.6 y una tasa de probabilidad (TP) de 0, requiriendo (NRT) un mínimo de tres ratas a tratar con sello de fibrina para prevenir una adherencia con un intervalo de confianza al 95% (IC al 95%) de 18% a 61% lo que señala un amplio beneficio de la terapia propuesta. Las adherencias fueron más extensas en animales sin tratamiento con fibrina con una significancia estadística marcada como ya se mencionó (p = 0.001). En ratas del grupo de estudio el sitio del injerto fue cubierto menos frecuentemente siendo el epiplón el más habitual y con poca adherencia. Se observaron otros órganos huecos o sólidos, en tanto que adherencias marcadas entre el injerto y órganos huecos, así como epiplón a la pared abdominal, fueron encontrados en los animales del grupo control. TIPO DE ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO DE POLIPROPILENO: Intestino grueso (uno en ciego) u órgano sólido (once en epiplón) se adhirieron en 12 de 20 parches de malla (60%) en el grupo de fibrina contra 20 de 20 parches de malla (100%) en el grupo sin fibrina (p = 0.003). No encontramos diferencias 65 estadísticas (p = 0.3) entre los grupos en cuanto al tipo de adherencia (sólida o hueca). (Tabla 7) Tabla 7. Tipo de órgano adherido a la malla: Fibrina Control (n = 20) (n = 20) Hueco 1/20 (5%) Sólido 11/20 (55%) 16/20 (80%) Total 12/20 (60%) 20/20 (100%) p 4/20 (20%) 0.3 0.001 En el grupo de animales sin fibrina, estuvieron presentes marcadas adherencias entre epiplón (dieciséis), ciego (dos), estómago o intestino delgado (Uno cada uno) (Fig. 27). Por el día 15, las adherencias fueron en general menos marcadas en el grupo de animales con fibrina. Figura 27. Adherencias de epiplón, ciego, estómago o intestino en grupo sin fibrina. PARÁMETROS HISTOLÓGICOS (Van Kruiningen): En el examen histopatológico los bloques de ratas tratadas con fibrina mostraron igual proliferación de fibroblastos (55%) que el grupo sin fibrina (55%), en tanto que en el resto observado, el predominio celular en el grupo con fibrina fue de linfocitos con 45% (9 de 20) en tanto que en el grupo sin fibrina predominaron los macrófagos con 3 de 20 (15%) sin encontrar una diferencia significativa con una p = 0.5 y 0.2 respectivamente. 66 Figura 28. Se muestra mucosa de intestino delgado adherida a malla (A) así como extensión del proceso cicatrizal a músculo (B) y presencia de fibroblastos (C) Secciones de especímenes del grupo sin fibrina mostraron adherencias al estómago, intestino delgado y /o epiplón. Ambos grupos de ratas, con y sin fibrina, mostraron inflamación crónica como una reacción local al material protésico, la continuación del proceso de cicatrización al músculo fue mayo r en el grupo de fibrina (Fig. 28) que en el grupo control (p = 0.02). Los hallazgos más frecuentes en el estudio Histopatológico se detallan en la tabla 8. Tabla 8. Hallazgos histopatológicos: Cicatriz (µ m ±DE) No. Celular (No. ±DE) Tipo Celular (No.) Fibrina (n = 20) 413.5 ±181 85.8 ? 29.8 F = 11/L = 9 Control (n = 20) 268.4 ±142 68.6 ? 32 Valor de p ? m: micrómetros 0.07 DE: Desviación Estándar Observaciones Músculo 20 F = 11/L = 6/M = 3 Músculo 14 Hemorragia 1 Malla adherida 3 Mucosa 1 T. Adiposo 1 0.04 F: Fibroblastos L: Linfocitos M: Macrófagos El resultado de la escala cuantitativa de reacción tisular fue obtenido por microscopía de luz para cada injerto implantado, se observo que después de 15 días los injertos fueron rodeados por un tejido inflamatorio crónico compuesto principalmente de fibroblastos. La calificación de reacción tisular fue de 17 ( ± 4.1) para el grupo sin fibrina con un rango intercuartil de 9 a 25 mientras que para el grupo con fibrina fue de 21 (± 4.9) con un rango intercuartil de 13 a 30 (p = 0.006). (Tabla 9) 67 Tabla 9. Índice de Reacción Tisular de Kruiningen (SRT): Cicatriz No. Celular Factor de peso SRT Fibrina (n = 20) 413 µ m 85.8 2 21 Control (n = 20) 268 µ m 68.6 1 17 Valor de p 0.006 La extensión del proceso cicatrizal fue mayor en el grupo con fibrina con un promedio de 413 micras de extensión (rango intercuartil de 187 a 979) contra 268 micras (rango intercuartil de 68 a 746) en el grupo sin fibrina (p = 0.007). El número celular observado en las biopsias fue en promedio de 85 (47 a 157) en el grupo de fibrina contra 68 (28 a 116) en el grupo control (p = 0.04). No observamos diferencia estadística en relación con el peso celular ya que el grupo de fibrina tuvo en promedio un peso celular calculado de 2.70 ± 1.12 contra 2.35 ± 1.04 del grupo control (p = 0.3). Los resultados señalan que el grupo de fibrina desarrolla un proceso inflamatorio mayor que el grupo sin aplicación de fibrina. El crecimiento vascular en el tejido regenerado basado en la densidad de vasos sanguíneos fue ligeramente mayor en las muestras con fibrina. COMPLICACIONES: Las complicaciones de los diferentes tratamientos fueron evaluadas durante los catorce primeros días de postoperatorio, en 20 (50%) se presentó algún tipo de complicación, los animales tratados con fibrina demostraron un incremento no significativo en el índice de complicaciones comparado con el grupo sin fibrina (60% vs. 40%, p = 0.2). (Figs. 29, 30) 68 Complicaciones Fibrina (n=20) Control (n=20) 6 F R E C U E N C I A 5 4 3 2 1 p = 0.5 0 S S: Seroma p = 0.2 H H: Hematoma p = 0.5 G G: Granuloma p = 0.02 E E: Esfacelacion Figura 29. Tipo de complicaciones durante los 14 primeros días. Seroma Hematoma Granuloma Esfacelación Figura 30. Principales tipos de complicaciones presentadas. SEROMA: De las 40 ratas evaluadas 3 presentaron la formación de seromas, dos de veinte (10%) del grupo sin fibrina y uno de veinte (5%) del grupo de sello de fibrina (p = 0.5). Con un RR de 0.5 y una TP de 0.47, una RRR del 50% con un IC 95% de 0.112 a 212 y RRA de 5% con un NRT de 20 ratas para evitar un seroma (Tabla10). 69 Tabla 10. Seromas Presente Ausente Fibrina (n = 20) Control (n = 20) 1 (5%) 2 (10%) 19 RR TP RRR IC 95% RRA NRT 18 p 0.05 0.5 0.47 50% 0.112 A 212 5% 20 HEMATOMA: La presencia de hematomas ocurrió en 2 ratas del grupo sin fibrina (10%) y ninguna rata de las 20 lo presento en el grupo de sello de fibrina (0%), esta diferencia no mostró diferencia significativa (p = 0.2) Con un RR de 0 y una TP de 0, una RRR del 100% con un IC 95% de 0.31 a 231 a fa vor del grupo de fibrina y RRA de 10% con un NRT de 10 ratas para prevenir un hematoma (Tabla 11). Tabla 11. Hematomas: Presente Ausente RR TP RRR IC 95% RRA NRT Fibrina (n = 20) Control (n = 20) 0 (0%) 2 (10%) 20 18 0 0 100% 0.31 A 231 10% 10 p 0.2 70 GRANULOMA: En la necropsia se encontraron 7 ratas con la formación de granulomas. Los hallazgos fueron 3 ( 15%) del grupo sin fibrina mientras que 4 (20%) del grupo de fibrina lo presentaron. Diferencia no estadística entre los grupos pudo ser determinada (p = 0.5). Con un RR de 1.33 y una TP de 1.41, una RRR del – 25% con un IC 95% de 0.190 a 123 y RRA de –5% con un NRT de 20 ratas para provocar un granuloma (Tabla 12). Los granulomas presentes en las ratas tratados con fibrina contenían un fragmento pequeño de fibrina sin degradar en el centro y generalmente de mayor tamaño que los encontrados en el grupo control. Tabla 12. Granulomas: Presente Ausente RR TP RRR IC 95% RRA NRT Fibrina (n = 20) Control (n = 20) 4 (20%) 3 (15%) 16 17 p 0.5 1.33 1.41 -25% 0.190 A 123 - 5% 20 ESFACELACIÓN: El uso de sellos de fibrina favoreció la presencia de esfacelación de la piel en el sitio de aplicación comparado con los animales del grupo control (35% vs. 5%, p = 0.02). Con un RR de 7 y una TP de 10.5, una RRR atribuible de –85.7% y RRA de –30% con un IC 95% del 1.12 a 93.35 con un NRT de 3 ratas para provocar una esfacelación (Tabla 13), además de que la esfacelación presente en el grupo sin fibrina fue menor que aquellos en el grupo con fibrina (Fig. 31). Por lo tanto, la esfacelación fue significativamente más común en animales tratados con sellos de fibrina que en aquellos sin sello. 71 Tabla 13. Esfacelación: Presente Ausente RR TP RRR IC 95% RRA NRT Fibrina (n = 20) Control (n = 20) 7 (35%) 1 (5%) 13 19 p 0.02 7 10.5 -85% 1.12 A 93.5 -30% 3 Figura 31. Presencia de esfacelación siendo más común en el grupo de fibrina. 72 18. DISCUSIÓN. Las tensiones incordinadas suelen permitir el desarrollo de protrusiones de tejidos a través de líneas de sutura en heridas quirúrgicas siendo fuente de mayor morbilidad y mortalidad posterior a cirugía abdominal94. El factor más importante que induce el estudio de este problema es la presencia o ausencia de adherencias posteriores a la reparación de defectos de la pared abdominal y su manera de prevenirlas41 . Esto en la práctica clínica no es fácil de evaluar por lo que se han propuesto modelos experimentales en ani males con el ánimo de transpolar estos resultados a los seres humanos. Los sellos de fibrina han sido utilizados para reducir, en al menos un 50%, la formación de adherencias dentro de la cavidad abdominal12,40-42 esto ha sido plasmado en múltiples trabajos utilizando estos compuestos en cirugía intraperitoneal para la reducción de las adherencias intrabdominales39,41,42,95. Entre otros, Jackson96 ha hecho referencia a un grupo de agentes conocido como adhesivos tisulares quirúrgicos que han sido recomendados principalmente para promover hemostasia y cierre hermético durante actos quirúrgicos, pudiendo ser naturales (basados en albúmina, componentes de la colágena) o sintéticos (cianoacrilatos, glutaraldehidos e hidrogeles), describiendo un efecto positivo en desenlaces quirúrgicos 97,98. El concepto de utilizar substancias hemostáticas procedentes de derivados sanguíneos para el manejo de heridas y facilitar la hemostasia en superficies sangrantes ha sido ubicado en la primera parte del siglo XX, cuando Bergel reportó el efecto hemostático de la fibrina80. Las propiedades de un sello de fibrina ideal deben ser: Clínicamente eficaz, seguro, manejable y relación costo-efectivo. Son cuatro las indicaciones primarias de los sellos de fibrina: 1. Para el control de la hemorragia (agentes hemostáticos) 2. Pegar tejidos 3. Sellar tejidos y 4. Liberación de drogas82,99, pero se han descrito en la actualidad numerosas aplicaciones más como son realización de anastomosis vasculares en cirugía vascular100 en cirugía gastrointestinal para sellar órganos perforados, sangrantes, anastomosis intestinales, manejo de fístulas perianales101-104 y resecciones hepáticas 105, manejo de 73 hidroceles 106, en cirugía de tórax para disminuir la pérdida de aire en anastomosis bronquiales107,108 en cirugía de infertilidad para evitar adherencias42,109 recientemente en cirugía de hernias110,111 así como esfuerzos para reducir adherencias postoperatorias12,39,41,42,57,58,112. Para evaluar la severidad, porción de superficie con adherencias, frecuencia, el tipo de órgano adherido, reacción tisular, complicaciones así como posibilidad de prevención de adherencias, formadas posteriores al implante de material protésico como lo es la malla de polipropileno, al aplicar sellos biológicos de fibrina este trabajo revisa esos parámetros al momento de la necropsia realizada 14 días después del procedimiento inicial. Hemos notado un efecto benéfico tanto en la severidad de adherencias como en la porción de superficie de malla cubierta con adherencias, así como lo ha reportado principalmente de Virgilio en sus series publicadas41,57 además de Evrard, Toosie y Chmielewski42,58,113. En el estudio adoptamos la clasificación de Diamond para la medición de la severidad de las adherencias ya que pensamos al igual que otros autores que es un método sencillo y validado para este fin42,57,58,78. Este estudio demuestra que el sello de fibrina reduce significativamente la presencia de adherencias intrabdominales en un modelo animal en ratas; al igual que ha sido reportado por otros autores41,42,57,58. Otros estudios también han demostrado reducción en la formación de adherencias, Rajaram114 en 1996 muestra una disminución del grado de adherencias al comparar la utilización de suturas contra sellos de fibrina en anastomosis de trompas en conejos en tanto que Jahoda39 en 1999 reporta disminución de la formación de adherencias intrabdominales e inhibición de la inflamación peritoneal al aplicar sellos de fibrina posterior del depósito de una inyección de talco para inducir adherencias en un modelo animal con ratones, nosotros pudimos demostrar que se requieren tres unidades experimentales a tratar con sello de fibrina para prevenir la formación de adherencias. En un estudio con humanos, Katkhouda et al111 evaluaron la respuesta inflamatoria a la aplicación de fibrina y las adherencias, no encontrando diferencia entre los grupos a diferencia de nuestros resultados y los estudios antes mencionados. 74 El análisis Anatomopatológico mostró una reabsorción del sello de fibrina, desapareciendo a los 14 días como lo muestra Llovo115 en su estudio, pero al contrario de sus resultados, nosotros sí observamos una respuesta inflamatoria severa evidenciada por el sistema de reacción tisular implementado con un promedio de 17 vs 21 lo cual fue significativo. Pero estos resultados no son del todo extraños, estudios previos han demostrado una intensa proliferación de tejido conectivo que puede favorecer la presencia de una matriz de fibroblastos y macrofagos116, ya que los sellos de fibrina actúan como una estructura que induce un crecimiento fibroblástico y que es reforzada por la acción quimiotáctica de los componentes de la trombina experimentando 111,117 perfecta histológicamente una cicatrización peritoneal . Un análisis cuantitativo de reacción tisular previamente validado fue utilizado durante el presente estudio utilizando la versión modificada de Sewell y cols 90, este sistema graduado de reacción tisular (SRT) nos permitió medir uniformemente la extensión de la respuesta inflamatoria así como el tipo y número celular encontrado, siendo acorde por lo reportado por el autor. De esta manera podemos decir que el efecto adhesivo de la fibrina se evidencia por las siguientes formas: Al igual que de Virgilio, postulamos que el efecto sellante de la fibrina se produce al separar dos superficies sirviendo como una barrera física que previene diseminación de sustancias inflamatorias exudadas que inducirían al epiplón e intestino a adherirse, con la consecuente formación de bandas adherenciales disminuyendo la posibilidad de adhesión peritoneal al inhibir el depósito de tejido conectivo 39,57 . En adición, su mecanismo de acción puede influir en la prevención de adherencias, siendo importante recordar que el hígado produce factores de la coagulación que pueden ser responsables de un incremento en la fibrinolisis en el período postoperatorio temprano, permitiendo una remodelación adecuada de los polímeros de fibrina insolubles, incrementando la capacidad para degradar los depósitos de fibrina 80, ya que la evidencia indica que la capacidad fibrinolítica del peritoneo es crucial en la formación o prevención de adherencias de la siguiente manera: La fibrinolisis es llevada a cabo por la activación del plasminógeno a plasmina; siendo 75 anteriormente evidenciado que la activación del plasminógeno disminuye durante la cirugía a causa de un incremento en la expresión de inhibidor del activador del plasminógeno (PAI-1)118 , al mismo tiempo se ha reportado una incremento del activador plasminógeno de tejido (tPA) a causa de una violación del endotelio vascular el cual transforma el plasminógeno en plasmina promoviendo la degradación de coágulos de fibrina, además del incremento de los niveles del activador plasminógeno de uroquinasa (uPA) asociado más con la remodelación de tejidos que con la degradación de fibrina, siendo teóricamente posible que los sellos de fibrina puedan reducir la formación de adherencias al no permitir localmente la diseminación del PAI-1, acelerando la angiogénesis favoreciendo una regeneración más rápida en los tejidos protejidos80,101,118. La diferencia de nuestro estudio con los anteriores reportados es que notamos una debilidad en la medición tanto de superficie de malla con adherencias y en la mayoría la falta de medición de reacciones tisulares, es por ello que ideamos una técnica objetiva con fotografía digital y programas computacionales (E.R. Mapper? )91 para la cuantificación de superficie adherida además de validar un método para la medición de reacción inflamatoria a través del Sistema de Reacción Tisular de Kruiningen90, procedimientos que no han sido reportados con anterioridad bajo esta perspectiva. Observamos que la aplicación de sellos de fibrina puede favorecer la presencia de complicaciones. La respuesta inflamatoria demostrada en nuestro modelo de hernia de la pared abdominal puede ser que favorezca una serie de fenómenos, por ejemplo, la esfacelación de tejido que resultó ser más significativa en el grupo de fibrina requiriendo tan solo 3 ratas intervenidas para provocarla, efecto que no había sido reportado con anterioridad, ya que no encontramos referencias claras al respecto. Así mismo percibimos la presencia de granulomas en la pared abdominal en ambos grupos, con ligero predominio no significativo a favor del grupo con fibri na pero con un incremento de riesgo absoluto de 25%, esto creemos es debido a la colocación de la fibrina en tejido subcutáneo de la rata y en consecuencia a la respuesta inflamatoria marcada ya descrita 111,116 ,117. La formación de seromas ha sido descrita con anterioridad por varios autores con el uso de sellos de fibrina119,120 pero al igual que ellos observamos que esta 76 complicación se presenta con menor frecuencia que en el grupo control ya que advertimos que se puede evitar su formación con una proporción de 20 a 1. La ganancia de peso observada en las ratas del grupo sin fibrina, siendo un dato que no se ha reportado en los artículos revisados, y aunque con significación estadística no se encontró con relación a la probabilidad de favorecer la aparición de complicaciones. El estudio también permite confirmar la utilidad de nuestro tratamiento para prevenir hemorragia mostrando que los sellos de fibrina son efectivos en la prevención de complicaciones hemorrágicas locales comparado con aquellos sujetos en los que no se les aplicó como lo han demostrado otros autores logrando prevenir un hematoma por cada 10 ratas tratadas80,121-123. En suma, los sellos de fibrina disminuyen significantemente la severidad y la frecuencia de las adherencias intrabdominales. No existe una tendencia en cuanto a la incidencia del tipo de órgano adherido, sólido o hueco, pero si hay una tendencia a disminuir la incidencia de seromas y hemorragia con incremento en la presencia de esfacelaciones de la piel. Perspectivas: Se realizó un estudio experimental en un modelo animal para la producción de adherencias utilizando varios métodos, escisión completa de la pared abdominal incluyendo peritoneo y capas musculares colocando un fragmento de malla sintética de polipropileno la cual es causa de adherencias severas, además esta se contaminó con el talco de los guantes para intensificar el efecto adhesivo, una sutura corrida de nylon fue colocada con la misma finalidad favoreciendo la isquemia y consecuentemente la proliferación de adherencias; y finalmente al intestino se le realizó un lavado abrasivo con solución salina para incrementar la reacción inflamatoria local al tiempo de la laparotomía y favorecer la presencia de adherencias, sin embargo los sellos de fibrina disminuyeron significativamente la severidad y grado de las adherencias como ya lo demostramos en este estudio en ratas. En consecuencia esta opción de tratamiento ofrece cierta protección en cirugía al minimizar las adherencias, siendo una alternativa válida para la prevención de estas 77 en un modelo de hernia de la pared abdominal en ratas, y que el uso clínico de estos adhesivos es ya una alternativa para la prevención de adherencias secundaria a la colocación de mallas en reparaciones de hernia como ya ha sido descrito 111. La elección óptima de estos siempre debe ser determinada por indicaciones clínicas en particular, ya que al alentar la posibilidad de la presentación de esfacelaciones y granulomas cuando se utiliza en tejido subcutáneo, probablemente debido a la intensa reacción inflamatoria demostrada, nos ha permitido hacer la recomendación de tener el cuidado de mantener una capa suficiente de tejido graso entre el sitio de aplicación y el reactivo o bien observar la colocación de la fibrina solamente en la cara ventral de la malla. Por último, no obstante la eficacia mostrada por los sellos de fibrina se hace necesaria la realización de futuros estudios clínicos para determinar si estos sellos serán agentes antiadhesivos igualmente efectivos en los humanos, lo cual podría lograrse a través de ensayos clínicos aleatorizados en pacientes sometidos a laparasocopia y evaluando clínicamente y a largo plazo los efectos de los sellos. 78 19. CONCLUSIONES. 1. Este estudio permite confirmar la utilidad de los sellos de fibrina en la reducción de adherencias en los grupos tratados. 2. Se determina un efecto benéfico tanto en la severidad de adherencias como en la porción de superficie de malla cubierta con adherencias. 3. El sello de fibrina reduce eficazmente la presencia de adherencias intrabdominales en un modelo animal en ratas. 4. Pueden ser utilizados con seguridad. 5. Observamos una respuesta inflamatoria severa evidenciada por el sistema de reacción tisular implementado. 6. Un factor desfavorable potencial de la utilización de los sellos de fibrina es el costo: a) Este se compensa por la posibilidad de evitar reoperaciones en pacientes con adherencias y sus posibles complicaciones como la prevención de obstrucción intestinal y fístulas. b) Otros factores como el posible incremento en la perdida de trabajo productivo deben ser incluidos en el análisis. 7. En suma, los sellos de fibrina disminuyen significativamente la severidad y grado de las adherencias como ya lo demostramos en este estudio en ratas. 8. Estudios confirmatorios serán necesarios para determinar el efecto antiadhesivo en humanos. 79 20. ANEXOS. ANEXO 1. VER PROGRAMA DE GANTT: 80 ANEXO 2. ANÁLISIS DE COSTOS: A) ELABORACIÓN DEL PROYECTO: CATEGORÍA COSTO UNITARIO $ 2.40 $ 40.50 FACTOR X Lápices Hojas blancas (paquete 500) Borrador $ 1.50 Pluma $ 1.70 Plumones (Juego) $ 26.10 Regla $ 2.50 Resistol $ 7.50 Corrector $ 6.60 Disquete (caja) $ 45.00 Cartucho impresora HP $ 328.68 670C Acetatos (caja/100) $ 77.50 Engrapadora $ 50.90 Perforadora $ 51.80 SUBTOTAL: B) DOCUMENTOS Y SERVICIOS DE INFORMACIÓN: CATEGORÍA Fotocopias Solicitud de artículos SUBTOTAL: COSTO UNITARIO $ .50 $ 80.00 TOTAL 3 3 $ 7.20 $ 121.50 1 2 2 1 1 1 2 1 $ 1.50 $ 3.40 $ 56.20 $ 2.50 $ 7.50 $ 6.60 $ 90.00 $ 328.68 2 1 1 $ 155.00 $ 59.90 $ 51.80 $ 878.78 FACTOR X TOTAL 500 10 $ 250.00 $ 800.00 $ 1,050.00 FACTOR X TOTAL 1 1 $ 12,998.45 C) EQUIPO DE COMPUTO: CATEGORÍA Pentium Celerón 533 MHz Unidad de CD/CD-RW 4x2x-24 Modem Integrado 56K ITU V..90 Disco Duro 17.0 GB Memoria 64 MB SyncDRAM 100 Impresora HP DJ 810C Scanner tipo cama SUBTOTAL: COSTO UNITARIO $12,998.45 1 1 1 $ 2,185.00 $ 1,500.00 1 1 $2,185.00 $ 1,500.00 $ 16,683.45 81 D) EQUIPO DE QUIRÓFANOS: CATEGORÍA Ratas Wistar Pentobarbital sódico Malla de polipropileno Nylon 4/0 (Caja con 36) Nylon 3/0 (Caja con36) Hojas de Bisturí # 12 Caja de Guantes desechables Rollo de Gasa 20x12 Alcohol galón (20 LITROS) Isodine espuma (galón) Escalpelo Miltex # 3 (4-7 ) Pinza de Halsted Miltex 5” curvas (7 -4) Pinza Suiza de relojero Miltex 12.1 cm (17-301) Porta agujas Castroviejo Miltex con seguro 71/8 18.1 cm (17-1024) Porta agujas Mayo Hegar Miltex 12.7cm 5” (8-42) Pinza Adson Miltex 43/4 12.1cm (6 -118) Tijera de iris 4 1/2” 11.4cm (5 SC-306TC) Cuda Headligth with universal cable end Cuda 150W light Source W/turret Perisphere 250 series Optics Alm Camera unit for headlamp SUBTOTAL: COSTO UNITARIO $ 50.00 $ 100.00 $ 1,100.00 $ 850.00 $ 850.00 $ 15.00 $ 100.00 FACTOR X TOTAL 40 3 5 2 2 40 2 $ 2,000.00 $ 300.00 $ 5,500.00 $ 1,700.00 $ 1,700.00 $ 600.00 $ 200.00 $ 203.00 $ 290.00 $ 110.00 $ 11.80 UD $ 37.00 UD 1 1 1 1 4 $ 203.00 $ 290.00 $ 110.00 $ 118.00 $ 1480.00 $ 27.30 UD 1 $ 273.00 $ 443.00 UD 1 $ 4430.00 $ 53.00 UD 1 $ 530.00 $ 32.50 UD 1 $ 325.00 $ 207.50 UD 1 $ 2075.00 $ 600.00 UD 1 $ 6,000.00 $ 650.00 UD 1 $6,500.00 $350.00 UD 1 $3,500.00 $2,500.00 UD 1 $2,5000.00 $ 6,2834.00 82 E) MATERIAL DE LABORATORIO: CATEGORÍA Quixil Sello de Fibrina Humano Estudio Histopatológico Probeta 50cc base plástico Vidrio reloj 150mm Vaso precipitado 100 ml Vaso precipitado 600 ml Matraz Volumétrico aforado 10cc Pipeta graduada de 1 cc 1/10 Tubo de ensayo 13x100 K 2HPO4 KH2PO4 Hexa -decyl-trimethyl Bromuro de Amonio (HTAB) Agua Bidestilada Solución de Dianisidina Peroxido de Hidrógeno SUBTOTAL: COSTO UNITARIO $ 220.00 UD/ml FACTOR X TOTAL 20 $50,600.00 $ 200.00 $ 84.62 $ 93.50 $ 46.58 $ 75.79 $ 311.15 40 1 1 1 1 1 $ 8,000.00 $ 84.62 $ 93.50 $ 46.58 $ 75.79 $ 311.15 $ 55.20 1 $ 55.20 $ 4.60 1 2 2 $ 4.60 2 2 2 2 $ 59,271.44 F) RECURSOS HUMANOS: CATEGORÍA VIÁTICOS O SUELDOS PASAJES APOYO A ESTUDIANTES (2) SUBTOTAL: COSTO UNITARIO $ 50.00 $ 20.00 $ 500.00 FACTOR X TOTAL 144 (días) 144 (viajes) 18 (meses) X 2 $ 7,200.00 $ 2,880.00 $ 18,000.00 $ 28,080.00 GRAN TOTAL: $ 168,797.67 Precios actualizados a Dic de 2002. 83 ANEXO 3. HOJA DE RECOLECCIÓN DE DATOS. “Sellos de Fibrina para la prevención de la formación de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas.” 1. NUMERO DE REGISTRO: FECHA: ___/___/___. 2. GRUPO: A (CONTROL) B (ESTUDIO) 3. SEXO: M (1), F (2). 4. PESO: (Gramos): 5. EDAD: (Meses): 6. DENSIDAD DE LAS ADHERENCIAS: (0, 1, 2, 3): 7. Grado 0: Sin adherencias, Grado 1: Pocas adherencias y separables fácilmente de la malla, Grado 2: Moderadas adherencias, difícilmente separables de la malla y Grado 3: Adherencias severas, se requieren instrumentos para su separación. 8. SUPERFICIE DE MALLA CON ADHERENCIAS: (0 a 2.25 cm2). Cm2: 9. %: ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO: (Y, N) 10. TIPO DE ÓRGANOS O ESTRUCTURA ADHERIDOS: (Sólido, hueco) (Nombre o estructura): 11. ESCALA DE REACCIÓN TISULAR DE KRUININGEN: TRS: CALIF. CICATRIZ (I) # CELULAR (II) TIPO CELULAR (III) (micrones) FACTOR DE PESO (IV) 1 < 200 < 50 NEUTRÓFILOS = 6 (CALIF1.) X 5 2 200-399 50-199 LINFOCITOS = 2 (CALIF2.) X 3 3 400-600 200-700 EOSINÓFILOS = 2 4 > 600 > 700 CÉLULAS GIGANTES = 2 FIBROBLASTOS = 1 MACRÓFAGOS = 1 Cada calificación predeterminado (IV) (I y II) será entonces multiplicada por un factor de peso 84 CALIFICACIÓN DE PESO CELULAR (V) = CALIF2 X TIPO CELULAR (III) PACIENTE I CALIF1. IV II CALIF2. IV III V (IIXIII) No: TRS (I+II+V) EJEMPLO 175? m 1 1X5=5 150 2 2X3=6 M=1 2X1=2 5+6+2=13 13. C O M Calificación: P LICACIÓN (Y, N) TIPO: 14. MUERTE: (Y, N) 15. ENFERMEDAD CONCOMITANTE EN PO INMEDIATO: (Y, N) 16. ANIMALES EXTRAVIADOS: (Y, N) 85 ANEXO 4. GUÍA PARA EL PROCEDIMIENTO DE LLENADO DEL CUESTIONARIO DEL PROTOCOLO: “Sellos de Fibrina para la prevención de la formación de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas”. 1. NÚMERO DE REGISTRO: Número progresivo del evento. 2. FECHA: Día, Mes y Año de realización de la cirugía. 3. GRUPO: Se denominará Grupo A al grupo de control (sin Fibrina) y Grupo B al grupo de estudio (con Fibrina). 4. SEXO: El sexo se determinará como masculino (1) o Femenino (2): M (1), F (2). 5. PESO: el peso se medirá en gramos completos (Gramos): 6. EDAD: La edad se medirá en cumplidos (Meses): 7. DENSIDAD DE LAS ADHERENCIAS: (0, 1, 2, 3) La densidad de las adherencias se medirá con la escala modificada de Diamond, graduándolas de 0 a 3 de la siguiente manera: Grado 0: Sin adherencias, Grado 1: Pocas adherencias y separables fácilmente de la malla, Grado 2: Moderadas adherencias, difícilmente separables de la malla y Grado 3: Adherencias severas, se requieren instrumentos para su separación. 8. SUPERFICIE DE MALLA CON ADHERENCIAS: (0 a 2.25 cm2). Cm2: Se determinará calculando la superficie de la malla de polipropileno en cm2 que esta cubierto por adherencias pudiendo ser este de 0 a 2.25 cm2. Esto se calculará utilizando una plantilla estimando un acercamiento mayor al 99%. 9. ÓRGANOS O ESTRUCTURAS ADHERIDOS A LA SUPERFICIE DEL INJERTO: (Y, N) Se estipulará la presencia o ausencia de órganos o estructuras intra-abdominales adheridos a la malla de polipropileno calificándose como presenta (Y) o ausente (N) 10. TIPO DE ÓRGANOS O ESTRUCTURA ADHERIDOS A LA SUPERFICIE DEL INJERTO DE POLIPROPILENO (Sólido, hueco, nombre o estructura): Se registrará el tipo de órganos o estructura adheridos a la malla y se clasificarán de acuerdo a su consistencia en sólidos (S) o huecos (H), así como el nombre específico del órgano o estructura adheridos. 86 11. PARÁMETROS HISTOLÓGICOS: Se analizarán muestras de tejido de la región cicatrizal en la pared abdominal intervenida bajo microscopia de luz para identificar los tipos de colágena de la muestra en tinsiones de hematoxilina y eosina y tintura de Masson. Posteriormente se procederá a evaluar la reacción tisular a través de la ESCALA DE REACCIÓN TISULAR propuesta por Kruiningen de la siguiente manera: CALIF. CICATRIZ (I) # CELULAR (II) TIPO CELULAR (III) FACTOR DE PESO (micrones) (IV) 1 < 200 < 50 NEUTRÓFILOS = 6 (CALIF1.) X 5 2 200-399 50-199 LINFOCITOS = 2 (CALIF2.) X 3 3 400-600 200-700 EOSINÓFILOS = 2 4 > 600 > 700 CÉLULAS GIGANTES = 2 FIBROBLASTOS = 1 MACRÓFAGOS = 1 Cada calificación (I y II) será entonces multiplicada por un factor de peso predeterminado (IV) CALIFICACIÓN DE PESO CELULAR (V) = TIPO CELULAR (III) X # CELULAR (II) PACIENTE I CALIF1. IV II CALIF2. IV III V (IIXIII) TRS No: (I+II+V) EJEMPLO 175? m 1 1X5=5 150 2 2X3=6 M=1 2X1=2 5+6+2=13 Calificación: 12. COMPLICACIONES: Se denominará complicación a la eventualidad concomitante secundaria al evento quirúrgico y en postoperatorio inmediato y se medirá como presente (Y) o ausente (N). 13. MUERTE: Se medirá como presente (Y) o ausente (N) y se considerará como muerte del animal de experimentación cuando el fallecimiento se presente 87 después de la primera intervención durante el periodo de observación y evaluación (30 días). 14. ENFERMEDAD CONCOMITANTE EN PO INMEDIATO: Se medirá como presente (Y) o ausente (N) y se considerará como enfermedad concomitante después del postoperatorio inmediato cuando algún tipo de patología clínica se presente en e animal de experimentación durante el periodo de observación de 30 días en el Bioterio. 15. ANIMALES EXTRAVIADOS: Se medirá como presente (Y) o ausente (N)y se considerará como animal extraviado a aquel que por cualquier razón no se tenga para su evaluación durante el periodo de observación de 30 días. 88 ANEXO 5 TABLA DE NÚMEROS ALEATORIOS: “Sellos de Fibrina para la prevención de la formación de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas.” Número total de pacientes 001 002 003 004 005 006 007 008 009 010 011 012 013 014 015 016 017 018 019 020 021 022 023 024 025 026 027 028 029 030 031 032 033 034 035 036 037 038 039 040 Grupo A Fecha 01 02 03 04 15-02-01 15-02-01 19-02-01 22-0201 07 08 Fecha 05 06 01-03-01 01-03-01 09 10 11 12 13 14 15 16 08-03-01 13-02-01 15-03-01 15-03-01 20-03-01 22-03-01 22-03-01 26-03-01 24 23-04-01 27 28 29 30 31 32 33 34 35 03-05-01 03-05-01 08-05-01 10-05-01 10-05-01 15-05-01 17-05-01 17-05-01 22-05-01 06-03-01 08-03-01 17 18 19 20 21 22 23 29-03-01 29-03-01 03-04-01 03-04-01 05-04-01 05-04-01 10-04-01 25 26 26-04-01 26-04-01 36 37 38 39 40 Grupo B 24-05-01 24-05-01 29-05-01 31-05-01 31-05-01 89 ANEXO 6. HOJA DE CONTROL Y VIGILANCIA DE RATAS EN BIOTERIO. “Sellos de Fibrina para la prevención de la formación de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas.” Ejemplo de una hoja de control y vigilancia de las ratas operadas en el bioterio del CUIB la cual se elaboró para cada una de las unidades de observación. BIBLIOGRAFIA ESTUDIO P‘RUEBA PILOTO 3ESARROLL0 ANÁLISIS DE LOS DATOS DE TESIS ARTÍCULO REPARACIÓN INFORME F. EDACCIÓN PRESENTACIÓN R P R P R P R P R P R I I \\ . .... ANEXO 1. CRONOGRAMA DE ACTIVIDADES l . 23 24 24 1 5 2 6 3 7 4 8 5 9 6 2 10 7 3 3 ll 8 4 4 12 9 5 5 13 10 6 6 14 ll 7 7 15 12 8 6 16 13 9 9 17 14 10 10 18 15 ll ll 19 16 12 12 20 17 13 13 21 18 14 14 22 19 15 15 23 20 16 16 24 22 17 17 25 23 16 18 26 24 19 19 25 28 2 22 23 28 4 1 21 22 27 3 26 20 2 26 2 27 20 25 1 26 24 28 25 17 18 19 17 23 27 19 16 22 26 16 15 16 21 25 1 15 20 24 27 19 23 26 22 ANEXO 6. HOJA DE CONTROL Y VIGILANCIA “Sellos de fibrina para la prevención de la formacón de adherencias en la reparación de las hernias de la pared abdominal: Modelo animal en ratas.” A N I M A L 01 COMIDA: DEFECACIÓN ACTIVIDAD RESPUESTA PESO: Fx INGRESO Fx RIP: ANIMAL 02 COMIDA: DEFECACIÓN 03 ACTIVIDAD RESPUESTA PESO: Fx INGRESO Fx RIP: ANIMAL COMIDA: DEFECACIÓN ACTIVIDAD RESPUESTA PESO: Fx INGRESO Fx RIP: A N I M A L 04 COMIDA: DEFECACIÓN ACTIVIDAD RESPUESTA PESO: Fx INGRESO Fx RIP: DR. EMILIO PRIETO DÍAZ CHÁVEZ H.G.Z.M.F. # 1 I.M.S.S. COLIMA 90 21. REFERENCIAS BIBLIOGRÁFICAS. 1. Read RC. Revisión histórica del tratamiento de la hernia . En: Nyhus LM, Condon RE. Hernia. Tercera edición; Philadelphia, Pennsilvania; Editorial Médica Panamericana; 1991: 25-38. 2. Rudledge RH. Reparación del ligamento de Cooper. Clínicas Quirúrgicas de Norteamérica 1993; Vol 3: 505-520. 3. Robbins AW, Rutkow IM. Hernioplastía con taponamiento de redecilla. Clínicas Quirúrgicas de Norteamérica 1993; 3: 535-548. 4. Amid PK, Shulman A, Lichtenstein IL, Hakakhs M. The Goals of modern hernia surgery. How to achieve then: Open or laparoscopic repair?. Problems in General Surgery 1995; Vol 12: 165-171. 5. Rutkow IM, Robbins AW, “Tension-Free” inguinal herniorraphy: A preliminary Report on the “Mesh Plug” technique. Surgery 1993; Vol 114 (1): 3-8. 6. Amid PK. Local anaesthesia for inguinal hernia repair step-by-step procedure. Annals of Surgery 1994; 220: 735-737. 7. Lichtenstein IL. Herniorrhaphy: A personal experience with 6,321. The Am J Surg 1987; Vol 153: 553-559. 8. Amid PK. The Lichtenstein open Tension-Free hernioplasty. Cir Gral 1998; Vol 20 (1) sup 1: 17-20. 9. Sachs M, Damm M, Encke A. Surgical History: Historical Evolution of inguinal hernia repair. World J Surg 1997; Vol 21: 218-223. 10. Uzzo R, Lemack GE, Morrissey KP, Goldstein M. The effects of mesh bioprosthesis on the spermatic cord structures: A preliminary report in a canine model. The Journal of Urology 1999; Vol 101: 1344-1349. 11. Heise CP, Starling JR. Mesh inguinodynia: A new clinical syndrome after inguinal herniorraphy? J Am Coll Surg 1998; Vol 187: 514-518. 12. Alponat A, Lakshminarasappa SR, Yavuz N, Goh PM. Prevention of adhesions by seprafilm, an absorbable adhesion barrier: an incisional hernia model in rats. Am Surg 1997; Vol 63: 818-819. 91 13. Watkins FH, Drake DB, Holmdahl LE, Cox MJ, Fay MF, Edilch RF . Peritoneal healing with adhesion formation: Current comment. J Long Term Med Implants 1997; Vol 7: 139-154. 14. Takahara T, Uyama I, Ogiwara H, Furuta T, Iida S. Inflammatory Response in open versus laparoscopic herniorraphy. J of Laparoendoscopic Surgery 1995; Vol 5: 317-326. 15. Amid PK. Simultaneous repair of bilateral inguinal hernia under local anaesthesia. Annals of Surgery 1996; Vol 223: 249-252. 16. Rutkow IM, Historia selectiva de la cirugía de hernia inguinal a principios del siglo XIX: atlas anatómicos de Astley Cooper, Franz Hesselbach, Antonio Scarpa y Jules-Germain Cloquet. Clínicas Quirúrgicas de Norteamérica 1998; Vol 6: 871-888. 17. Askar OM. Hernias aponeuróticas: observaciones recientes de hernias paraumbilicales y epigástricas. Clínicas Quirúrgicas de Norteamérica 1984; Vol 2: 307-324. 18. Netter FH. Pared abdominal anterolateral. En: Netter FH. Colección Ciba de ilustraciones médicas. Sistema Digestivo. Conducto inferior. Primera edición; Barcelona, España; Editorial Salvat; 1993: 12- 16. 19. Testut L. Paredes abdominales. En: Testud L, Jacob O. Tratado de Anatomía topográfica con aplicaciones medicoquirúrgicas. Octava edición; Barcelona, España; Editorial Salvat; 1982: 3 - 67. 20. Gilbert AL, Graham MF. Symposium on he Management of inguinal hernia 5. Sutureless Technique: Second Version. C J S 1997; Vol 40 (3): 209-212. 21. Skandalakis J, Colborn G, Androulakis JA, Skandalakis LJ, Penberton LB. Bases embrionarias y anatómicas de la herniorrafia inguinal. Clínicas Quirúrgicas de Norteamérica 1993; Vol 4: 843-881. 22. Devlin B. Functional Anatomy. En: Schumpelick V, Kingsnorth A.N. Incisional hernia. 1 st edition; Germany; Ed. Springer; 1999: 32-44. 23. Eddy V, Nunn C, Morris JA Jr. Abdominal compartment syndrome. The Nashville experience. Surg Clin North Am 1997; Vol 77 (4): 801-812. 92 24. Tzelepis GE, Nasiff L, McCool FD, Hammond J. Transmission of pressure within the abdomen. J Appl Physiol 1996; Vol 81 (3): 1111-1114. 25. Burch JM, Moore EE, Moore FA, Franciose R. The abdominal compartment syndrome. Surg Clin North Am 1996; Vol 76: 833-842. 26. Nyhus L, Bombeck CT. Hernias. En: Sabiston DC Jr, Tratado de patología quirúrgica de Davies-Christopher. Undécima edición; México D.F; Editorial Interamericana; 1981: 1313-1336. 27. Ganong W. Tejido excitable: Músculo. En: Ganong W G. Fisiología Médica Decimocuarta edición; México D.F; Editorial el Manual Moderno; 1994: 67 -79. 28. Guyton A. Fisiología de la membrana, el nervio y el músculo esquelético: Contracción del músculo esquelético. En: Guyton AC. Tratado de Fisiología Médica. 8ª edición; Madrid España; editorial Interamericana McGraw-Hill; 1992: 71-83. 29. Murphy R. Contracción de las células musculares. En: Berne R, Levy M. Fisiología. 1ª edición; Argentina; editorial Panamericana; 1986: 375-402. (18) 30. Rutkow IM, Robbins AW, Aspectos demográficos de clasificación y socioeconómicos en la reparación de hernia en los EU. Clínicas Quirúrgicas de Norteamérica 1993; Vol 3: 443-457. 31. Rutkow IM. Aspectos epidemiológicos económicos y sociológicos de la cirugía de hernia en los Estados Unidos, en e decenio de 1990. Clínicas Quirúrgicas de Norteamérica 1998; Vol 6: 889-899. 32. Abrahamson J. Causas y fisiopatología de la formación de hernia inguinal primaria y recurrente. 1998 Clínicas Quirúrgicas de Norteamérica 1998; Vol 6: 901-918. 33. Baker R. Eventraciones Postoperatorias. En: Nyhus LM, Condon RE. Hernia. Tercera edición; Philadelphia, Pennsilvania; Editorial Médica Panamericana; 1991: 315-330. 34. Santora TA, Roslyn JJ. Hernia Incisional. Clínicas Quirúrgicas de Norteamérica 1993; Vol 3: 597-611. 93 35. Ivantury R, Diebel L, Porter J, Simon R. Hipertensión intraabdominal y síndrome del compartimiento abdominal. Clínicas Quirúrgicas de Norteamérica 1997; Vol 4: 779-795. 36. Greenhalgh DG, Warden GD. The importance of intra-abdominal pressure measurements in burned children. J Trauma 1994; Vol 36(5): 685-90. 37. Williams M, Simms HH. Abdominal compartment syndrome: case reports and implications for management in critically ill patients. Am Surg 1997; Vol 63(6): 555-658. 38. Farmer L, Ayoub M, Warejcka D, Southerland S, Freeman A, Solis M. Adhesion formation after intraperitoneal and extraperitoneal implantation of polypropylene mesh. Am Surg 1998; Vol 64: 144-1456. 39. Jahoda AE, Albala DM, Dries DJ, Kovacs EJ. Fibrin sealant inhibits connective tissue deposition in a murine model of peritoneal adhesion formation. Surgery 1999; Vol 125: 53-59. 40. Boris WJ, Gu J, McGrath LB. Effectiveness of fibrin glue in the reduction of postoperative intrapericardial adhesions. J Invest Surg 1996; Vol 9: 327-333. 41. de Virgilio C, Dubrow T, Sheppard BB, MacDonald WD, Nelson RJ, Lesavoy MA, Robertson JM. Fibrin glue inhibits intra-abdominal adhesion formation. Arch Surg 1990; Vol 125: 1378-1381. 42. Evrard VA, De Bellis A, Boeckx W, Brosens I A. Peritoneal healing after fibrin glue application: a comparative study in a rat model. Hum Reprod 1996; Vol 11: 1877-1880. 43. Rutkow IM, Robbins AW. Sistemas de clasificación y hernias inguinales. Clínicas Quirúrgicas de Norteamérica 1998 Vol 6: 1051-1060. 44. Nyhus L. Reparación de la Cintilla Ileopectinea en las hernias inguinal y crural. Acceso posterior (preperitoneal). Clínicas Quirúrgicas de Norteamérica 1993; Vol 3: 521-534. 45. Lichtenstein IL, Shulman AG, Amid PK. Causas, prevención y tratamiento de la hernia inguinal recurrente . Clínicas Quirúrgicas de Norteamérica 1993; Vol 3: 567-583. 94 46. Martín MS , Druker ZM. Hernia inguinal recidivante en un hospital general en México. Cirujano General 1996; Vol 18 (3): 186-189. 47. Zaga MI, Guzmán-Valdivia GG, Medina RO, Cadena MM, Romero AE. Plastía inguinal libre de tensión. Rev Med IMSS 1996; Vol 34 (3): 201-206. 48. Herrejon JM, Rescala E, González M. Experiencia de 5 años en reparación de hernia inguinal en el Hospital Juárez del Centro SSA. Abstracto. Trabajos libres II, Congreso Mundial de Hernia 1998. 49. Prieto -Díaz CHE. Estudio comparativo de la hernioplastía libre de tensión y hernioplastía convencional para la reparación de la hernia inguinal. Tesis de maestría no publicada. Universidad de Colima, Facultad de Medicina, Colima, México. 50. Robbins AW, Rutkow IM. Mesh Plug Hernioplasty: The minimally invasive operation. Cir Gral 1998; Vol 20 (1) Sup. 1: 12-16. 51. Amid PK. A simple stapling version of retromuscular repair of incisional hernias. Hernia 1999; Vol. 3: 47-51. 52. Kurzer M, Belsham PA, Kark AE. Reparación de Lichtenstein. Clínicas Quirúrgicas de Norteamérica 1998; Vol 6: 967-986. 53. Robbins AW, Rutkow IM. Reparación con tapón de malla y cirugía de hernia inguinal. Clínicas Quirúrgicas de Norteamérica 1998; Vol 6: 951-966. 54. Watkins FH, Drake DB, Holmdahl LE, Cox MJ, Fay MF, Edilch RF. Peritoneal healing with adhesion formation: Current comment. J Long Term Med Implants 1997; Vol 7: 139-154. 55. Silver FH, Wang MC, Pins GD. Preparation of fibrin glue: a study of chemical and physical methods. J Appl Biomater 1995; Vol 6: 175-183. 56. Schier F. Srour N, Waldschmidt J. Dura covered with fibrin glue reduces adhesions in abdominal wall defects. Eur J Pediatr Surg 1991; Vol 1: 343-345. 57. de Virgilio C, Elbassir M, Hidalgo A, Schaber B, French S, Amin S, Stabile BE. Fibrin glue reduces the severity of intra-abdominal adhesions in a rat model. Am J Surg 1999; Vol 178: 577-580. 95 58. Toosie K, Gallego K, Stabile BE, Scaber B, French S, de Virgilio C. Fibrin glue reduces intra-abdominal adhesions to synthetic mesh in a rat ventral hernia model. Am Surg 2000; Vol 66: 41-45. 59. Lichtenstein IL, Shulman A, Amid PK. Twenty questions about hernioplasty. The American Surgeon 1991; Vol 57: 730-733. 60. Rutkow IM. Open Versus Laparoscopic groin herniorrhaphy: Economic realities. Unpublished data. 61. Brooks DC. A prospective comparison of laparoscopic and tension-free open herniorrhaphy. Arch Surg 1994; Vol 129: 361-366. 62. Biffl W, Moore E, Moore F, Peterson V. Interleukin-6 in the injured patient. Marker of injury or mediator of inflammation?. Annals of Surgery 1996; Vol 224: 647-664. 63. Schilling J A. Wound healing. Surgical Clinics of Northamerica 1976; Vol 56: 859-1976. 64. Junqueira LC. Tejido Conjuntivo. En: Junqueira LC, Carneiro J. Histología Básica. 4ª edición; México D.F; editorial Masson–Salvat; 1996: 77-102. 65. Pohlman TH, Stanness KA, Beatty PG. An endothelial cell surface factor(s) induced local proliferation in vitro by lipopolysaccharide, interleukin 1, and tumor necrosis factor- alpha increases neutrophil adherence by CDw 18dependent mechanism. Journal of Immunology 1986; Vol 136: 4548. 66. Tonnesesn MG, Smedly GS, Henso n PM. interaction. Modulation of neutrophil Neutrohpil-endothelial cell adhesiveness induced by complements fragments C5a and C5a des arg and formyl-methionyl-leucylphenylalanine in vitro. Journal of Clinic Investigation1984; Vol 74: 1581. 67. Witte MB. Principios generales de la cicatrización. Clínicas Quirúrgicas de Norteamérica 1997; Vol 3: 515-533. 68. Änggárd E. Nitric oxide: mediator, murderer, and medicine. Lancet 1994; Vol 343: 1199-1206. 69. Robbins SL. Inflamación y reparación. En: Robbins SL, Angell M. Patología básica. Primera edición; México; Editorial Interamericana; 1973: 30- 62. 70. Fuentes-T S, Romero J. Citoquinas. Metab Nutr 1994; Vol 3 (1): 6 -10. 96 71. Baigrie RJ, Lamont PM, Kwatkowski D, Dallman MJ, Morris PJ. Systemic Cytokine response after major surgery. J Surg 1992; Vol 79: 757-760. 72. R&D Systems. Available at http://www.nrdsystems.com. 2001. 73. Fuentes-T S. Síndrome de respuesta inflamatoria sistémica (SIRS) en el apoyo metabólico nutricio de los estados hipercatabólicos. Metab Nutr 1996; Vol 5 (4): 135-140. 74. Nyhus L. The recurrent groin hernia: Therapeutic solutions. World J Sur 1989; Vol 12: 541-544. 75. De Cherney A, DiZerega G. El problema clínico de la formación de adherencias intraperitoneales después de cirugía general. Empleo de barreras antiadherencias. Clínicas Quirúrgicas de Norteamérica 1997; Vol 3: 671-687. 76. Amid P, Shulman A, Lichtenstein I. Experimental evaluation of a new composite mesh with the selective property of incorporation to the abdominal wall without adhering to the intestines. Journal of Biomedical Materials Research 1994; Vol 28: 373-375. 77. Milligan DW, Raftery AT. Observations on the pathogenesis of peritoneal adhesions: A light and electron microscopical study. Br J Surg 1974; Vol 61: 274-280. 78. Diamond M, Dechernery A. Pathogenesis of adhesion formation/reformation: application to reproductive pelvic surgery. Microsurgery 1987; Vol 8: 103-107. 79. Schwartz S. Hemostasis, surgical bleeding, and transfusion. En: Schwartz S, Shires T, Spencer F, Storer E. Principles of surgery. 4th edition; New York; MaGraw-Hill Book Company; 1984: 81-113. 80. Surgery Treatment updates 2000. The Evolving role of fibrin sealants in surgery. Medscape, Inc. Available at http://www.medscape.com 2001. 81. Matras H, Dinges HP, Mamoli B, Lassmann H. Non-sutured nerve transplantation. J Maxillofac Surg 1973; Vol 1: 37-39. 82. Spotnitz W, Falstrom J, Rodeheaver G. Suturas y sellador de fibrina en la cicatrización. Clínicas Quirúrgicas de Norteamérica 1997; Vol 3: 653-670. 97 83. Villegas J. Manual de la rata de laboratorio cepa Wistar. (1ª ed.). Universidad de Colima. Colima: Autor. 84. Chousleb A, Hernández MC, Carrasco A, Celaya R, Heredia N, Mondragón A et al. Anastomosis de cuernos uterinos por laparoscopía. Modelo experimental en la rata. Cirujano General 1997; Vol 19: 55-59. 85. Chousleb A, Hernández MC, Heredia N, Lasky D, Carrasco A, Celaya R et al. La Rata como modelo animal para la enseñanza e investigación de la cirugía laparoscópica. Cirujano General 1996; Vol 18: 221-227. 86. López F. Moléculas de adhesión, isquemia y cirugía. Cirujano General 1996; Vol 18: 283-287. 87. Olmos JR, Jasso R., Sotres A, Arreola JL, Gaxiola M, Vanda B et al. Utilización de pericardio de bovino tratado con glutaraldehido liofolizado, en la reparación de defectos abdominales en ratas. Cirujano General 1996; Vol 18: 161-165. 88. Mejía JM, Fajardo A, Gómez A, Cuevas ML, Hernández DM, et al. El Tamaño de muestra: Un enfoque práctico en la investigación clínica pediátrica. Bol Med Hosp. Infant Mex 1995; Vol. 52: 381- 391. 89. Diamond M, Daniell J, Feste J, Surrey M, McLaighlin D, Friedman S, Vaughn W, Martin D. Adhesion reformation and de novo adhesion formation after reproductive pelvic surgery. Fertility and Sterility 1987; Vol 47: 864-866. 90. Van Kruiningen DVM. Comparative tissue reactivity and suture absorption of USSC experimental polysorb. Lactomer XXVI. Personal Communication. 91. ER Mapper Available at http//www.ermapper.com 2002. 92. Sackett DL, Straus SE, Richardson WS, Rosenberg W, Haynes RB. (2000) Evidence-Based Medicine. Philadelphia: Harcourt Publishers. 93. Committee on cares and use of laboratory animals of the Institute of Laboratory Animal Resources Commission on Life Sciences.1985. Guide for the care and use of laboratory animals . Maryland: U.S. Department of Health and Human Services. 98 94. Hartel W. Becker HP. Natural history and patient-related factors. En: Schumpelick V, Kingsnorth A.N, Incisional hernia. 1st edition; Germany; Ed. Springer; 1999: 110-116. 95. Schier F, Srour N, Waldschmidt J. Dura covered with fibrin glue reduce adhesions in abdominal wall defects. Eur J Pediatr Surg 1991; Vol 1 (6): 343-5. 96. Jackson M. Tissue sealants; current status, future potential. Nature Med. 1996; Vol 2: 637-638. 97. Jackson MR, Gillespie DL, Longenecker EG, Goff JM, Fiala LA, O'Donnell SD, et al. Hemostatic efficacy of fibrin sealant (human) on expanded polytetrafluoroethylene carotid patch angioplasty: a randomized clinical trial. J Vasc Surg 1999; Vol 30 (3): 461-466. 98. Reece TB, Maxey TS, Kron IL. A prospectus on tissue adhesives. Am J Surg 2001; Vol 182(2 Suppl): 40S-44S. 99. Siedentop KH, Park JJ, Shah AN, Bhattacharyya TK, O'Grady KM. Safety and efficacy of currently available fibrin tissue adhesives. Am J Otolaryngol 2001; Vol 22(4): 230-235. 100. Akilov Kh, A.; Deviatov, A. V.; Ibadov, R. A.; Zainutdinov, U. I.; Ikramov, A. I. Use of the glue composition [TachoComb in forming the portosystemic anastomosis]. Vestn Khir Im I I Grek 2001; Vol 160 (2): 87-89 (Abstract). 101. Aitola P, Airo I, Matikainen M. Laparoscopic versus open preperitoneal inguinal hernia repair: a prospective randomized trial. Ann Chir Gynaecol 1998; Vol 87(1): 22-25. 102. Valleix D, Descottes B, Dixneuf B, Philippi D, Aubard Y. [Value of Tissucol in cervical anastomosis of esophagoplasty]. J Chir 1989; Vol 126: 471-472 (Abstract). 103. Shurkalin, B. K.; Gorskii, V. A.; Ettinger, A. P. [Can perforated ulcer be not sutured?] Vestn Khir Im I I Grek2001; Vol 160 (2): 81-86 (Abstract). 104. Yilmaz, H. G.; Odabasi, M.; Buyukbayram, H.; Bac, B. [Effectiveness of fibrin tissue adhesive for colocolic anastomosis reliability]. Ulus Travma Derg 2001; Vol 7: 87-90 (Abstract). 99 105. Noun R, Elias D, Balladur P, Bismuth H, Parc R, Lasser P, et al. Fibrin glue effectiveness and tolerance after elective liver resection: a randomized trial. Hepatogastroenterology 1996; Vol 43 (7): 221-224. 106. Sirpa A, Martti AO. Results of fibrin glue application therapy in testicular hydrocele. Eur Urol 1998; Vol 33 (5): 497 -499. 107. Mizuno H, Hitomi S, Nakamura T, Shimizu Y. [Clinical experience of the combined use of polyglycolide non-woven felt with fibrin glue to prevent postoperative pulmonary fistula]. Nippon Kyobu Geka Gakkai Zasshi 1995; Vol 43 (9):1559-1564 (Abstract). 108. Wong K, Goldstraw P. Effect of fibrin glue in the reduction of postthoracotomy alveolar air leak. Ann Thorac Surg 1997; Vol 64 (4): 979-81. 109. Kulakov VI, Gigauri VS, Adamian LV, Zhidkov IL, Mynbaev OA. [Use of fibrin glue in gynecologic operations]. Akush Ginekol 1990; Vol 11: 57-60 (Abstract). 110. Zieren J, Castenholz E, Baumgart E, Muller JM. Effects of fibrin glue and growth factors released from platelets on abdominal hernia repair with a resorbable PGA mesh: experimental study. J Surg Res 1999; Vol 85 (2): 267272. 111. Katkhouda, N.; Mavor, E.; Friedlander, M. H.; Mason, R. J.; Kiyabu, M.; Grant, S. W.; Achanta, K.; Kirkman, E. L.; Narayanan, K.; Essani, R. Use of fibrin sealant for prosthetic mesh fixation in laparoscopic extraperitoneal inguinal hernia repair. Ann Surg 2001; Vol 233 (1): 18-25. 112. Sheppard BB, de Virgilio C, Bleiweis M, Millken JC, Robertson JM. Inhibition of intra-abdominal adhesions: fibrin glue in a long term model. Am Surg 1993; Vol 59 (12): 786-790. 113. Chmielewski GW, Saxe JM, Dulchavsky SA, Diebel LN, Bailey JK. Fibrin gel limits intra-abdominal adhesions formation. Am Surg 1992; Vol 58 (9): 592-3. 114. Rajaram S, Rusia U, Agarwal S, Agarwal N. Autologous fibrin adhesive in experimental tubal anastomosis . Int J Fertil Menopausal Stud 1996; Vol 41 (5): 458-461. 115. Llovo -Taboada F, Lopez Diez E, Prieto Gomez O. Experimental study of renal sutures and fibrin adhesive. Arch Esp Urol 1996; Vol 49 (2): 93-98. 100 116. Elfeldt, R.; Leuze, D.; Thiede, A.; Seifert, J. [Experimental animal studies of the stability of colon anastomoses after supplementary fibrin glue sealing]. Z Exp Chir Transplant Kunstliche Organe 1990; Vol 23 (1): 47-50 (Abstract). 117. Martis G, Miko I, Szendroi T, Kathy S, Kovacs J, Hajdu Z. Results with collagen fleece coated with fibrin glue (TachoComb). A macroscopical and histological experimental study. Acta Chir Hung 1997; 36: 221-222. 118. Ivarsson ML, Bergstrom M, Eriksson E, Risberg B, Holmdahl L. Tissue markers as predictors of postoperative adhesions. British Journal of Surgery 1998; Vol 85 (11): 1549-1559. 119. Gilly FN, Francois Y, Sayag-Beaujard AC, Glehen O, Brachet A, Vignal J. Prevention of lymphorrhea by means of fibrin glue after axillary lymphadenectomy in breast cancer: prospective randomized trial. Eur Surg Res 1998; Vol 30 (6): 439-443. 120. Berger A, Tempfer C, Hartmann B, Kornprat P, Rossmann A, Neuwirth G, et al. Sealing of postoperative axillary leakage after axillary lymphadenectomy using a fibrin glue coated collagen patch: a prospective randomised study. Breast Cancer Res Treat 2001; Vol 67 (1): 9 -14. 121. Rutgeerts P, Rauws E, Wara P, Swain P, Hoos A, Solleder E, et al. Randomised trial of single and repeated fibrin glue compared with injection of polidocanol in treatment of bleeding peptic ulcer. Lancet 1997; Vol 350:692-696. 122. Zimmer T, Rucktaschel F, Stolzel U, Liehr RM, Schuppan D, Stallmach A, et al. Endoscopic sclerotherapy with fibrin glue as compared with polidocanol to prevent early esophageal variceal rebleeding. J Hepatol 1998; Vol 28 (2): 292297. 123. Canonico S, Sciaudone G, Pacifico F, Santoriello A. Inguinal hernia repair in patients with coagulation problems: prevention of postoperative bleeding with human fibrin glue. Surgery 1999; Vol 125 (3): 315-317.