Titulación
Anuncio

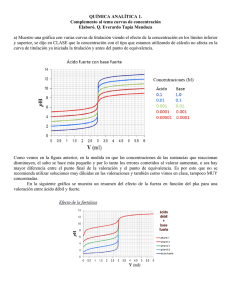
Ácido Fuerte – Base Fuerte Efecto de concentración en la titulación ácido fuerte/base fuerte 0.1 M 0.01 M 0.001 M Titulación Base fuerte con ácido fuerte: Curva imagen de espejo del caso anterior. Titulación de100 mL 0.100 M NaOH vs. 0.100 M HCl. Titulación ácido débil con base fuerte Titulación de 100.0 mL 0.100 M HAc con 0.100 M NaOH Efecto concentración titulación ácido débil con base fuerte: 1. Región amortiguadora es igual para 0.1 a 0.001 M. 2. pH punto equivalencia aumenta con aumento concentración. 0.1 M 0.01 M 0.001 M Curva titulación de 100.0 mL HAc con igual concentración de NaOH . A menor Ka menor el cambio en pH en el punto de equivalencia y más alcalino el pH en el punto equivalencia. Indicadores pueden usarse para ácidos con Ka > 10-6. Metro de pH brinda mayor precisión. Titulación bse débil-ácido fuerte: Curva inversa a titulación ácido débil-base fuerte. Curva titulación para 100.0 mL 0.100 M NH3 vs. 0.100 M HCl. A menor Kb, menor el cambio pH en el punto equivalencia y más ácido el pH en el punto de equivalencia. Indicadores visuales se usan para Kb > 10-6. Metro de pH brinda mayor precisión. Curva titulación mezcla de ácido fuerte y ácido débil con base fuerte: El ácido débil debe tener Ka > 10-5 para mayor cambio de pH en el segundo punto equivalencia. Los valores de Ka’ deben diferir por un factor de 103 o más para titular independiente cada ácido. Curva Titulación de 50.0 mL mezcla de 0.10 M HCl and 0.20 M HAc con 0.200 M NaOH. Efecto Ka en curva titulación especies polifuncionales H3PO4 Ácido Oxálico (H2C2O4) H2SO4 pH K a1 ≥ 105 Ka 2 K a1 ≈ 103 Ka 2 K a1 , fuerte K a ≈ 0.0102 2 Volumen NaOH (ml) Curva titulación de H2A con base fuerte: K amayor ≥ 1000se titula cada protón independiente menor Ka Curva de Titulación Base M2A Kb1 − − A22− + H 2O HA + OH Buffer (1) pH HA1er P. Eq. pH = pK a1 + pK a 2 2 Buffer (2) Kb 2 HA− + H 2O H 2 A + OH − H2A 2do P. Eq. [ H + ] = K a1CH 2 A Exceso HCl Volumen HCl (ml) Curva titulación base débil con ácido fuerte: K a1 = 4.46 x 10−7 K= b2 Kw = 2.24 x 10−8 K a1 K a 2 = 4.69 x 10−11 = K b1 50.0 mL 0.100 M Na2CO3 vs 0.100 M HCl. Línea entrecortada representa la curva luego de eliminar CO2 Kw = 2.13 x 10−4 Ka2 Titulación de mezclas Ácidos 1. H3PO4 2. H3PO4 + HCl Bases 1. Na2CO3 ΔV1 = ΔV2 2. HCO3- + NaOH ΔV1 > ΔV2 3. H3PO4 + H2PO4- 3. Na2CO3 + NaHCO3- ΔV1 < ΔV2