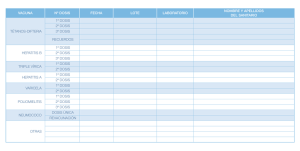
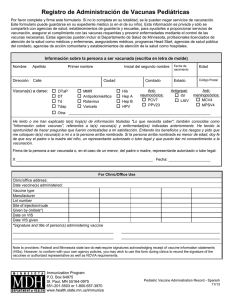
Descargar
Anuncio

PORTADA 1-10:PORTADA 11/05/10 16:29 Página 1 M E D I C I NA P R E V E N T I VA VOL. XVI Nº 1 2010 ESPECIAL CALENDARIO DE VACUNAS Sociedad Española de Medicina Preventiva, Salud Pública e Higiene TERCERA PARTE Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas, exposiciones, conductas de riesgo o situaciones especiales. Consenso 2009 Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene L. Salleras (Coordinador), M. Campins, J. Castrodeza, A. Domínguez, V. Domínguez, J. Fernández-Crehuet, S. Fernández, J. R. de Juanes, V. Pastor, MC. Sáenz Incluida en las bases de datos I.M.E. (Índice Médico Española), Índice Bibliográfico Español en Ciencias de la Salud (IBECS), Elsevier Bibliographic Databases, Medes, Latindex y Scopus 01Staff:01Staff 11/05/10 16:33 Página 1 Medicina Preventiva http:// www.sempsph.com Empresa Editorial EDIMSA Editores Médicos, S.A. C/ Alsasua, 16 Teléfono: 91 - 376 81 40 Fax: 91 - 373 99 07 E-mail: edimsa@edimsa.es 28023 Madrid Rafael de Casanovas, 1 Teléfono: 93 - 473 99 88 Fax: 93 - 473 95 05 E-mail: edimcat@edimsa.es 08950 Esplugues de Llobregat (Barcelona) Director General: Carlos Giménez Antolín Director Publicaciones: Adolfo Berzosa Blanco Directora Comercial: Raquel Morán Borjabad © 2010 Editores Médicos, S.A. Reservados todos los derechos de textos e iconografía. Se prohíbe la reproducción total o parcial, incluyendo fotocopias, grabaciones, etcétera, sin autorización escrita del editor. Las opinioneseditoriales o científicas que se emitan con firma, comprometen exclusivamente la responsabilidad del autor. SV 13-R-CM Fotocomposición: S.G.I., S.L. Imprime: Sprint, S.L. Depósito Legal: M-18903-1995 ISSN: 1135-2841 Director: V. Pastor y Aldeguer (H. U. La Princesa-Madrid) Comité Redacción: Dra. C. Bischofberger Valdés (N. H. S. Londres) Dr. S. Fernández Redondo (H. U. La Princesa-Madrid) Dra. A. Figuerola Tejerina (H. U. La Princesa-Madrid) Dra. C. Sanz Sebastián (H. U. La Princesa-Madrid) (Directora adjunta) Dr. J. R. Villagrasa Ferrer (H. U. La Princesa-Madrid) (Director adjunto) Comité Editorial: Dr. J. L. Arribas Llorente (H. U. Miguel Servet-Zaragoza) Dr. A. Chicharro Papiri (Edimsa-Madrid) Dr. V. Domínguez Hernández (H. U. Juan Canalejo-A Coruña) Dr. J. Fernández-Crehuet (H. U. Virgen de laVictoria-Málaga) Dr. V. Pastor y Aldeguer (H. U. La Princesa-Madrid) Dr. J. Rosselló Urgell (H. U. Marqués de Valdecilla-Santander) Dr. J. Vaqué Rafart (H. U. Vall d’Hebrón-Barcelona) Comité Científico: Dª. I. Albero Andrés (H. U. Vall d’Hebrón-Barcelona) Dr. J. M. Arévalo Alonso (H. de Tagorritxu-Vitoria) Dr. J. L. Arribas Llorente (H. U. Miguel Servet-Zaragoza) Dr. A. Asensio (H. U. Puerta de Hierro Majadahonda-Madrid) Dr. J. R. Banegas (Facultad de Medicina U. Autónoma-Madrid) Dr. J. M. Bayas Rodríguez (H. Clínic i Provincial-Barcelona) Dr. P. Blasco Huelva (Sevilla) Dr. F. Bolumar Montrull (Facultad de Medicina-Alcalá de Henares) Dr. F. Calbo Torrecillas (H. Regional U. Carlos Haya-Málaga) Dr. A. Cerrillo Cruz (H. de Mérida-Badajoz) Dr. M. Conde Herrera (H. U. Virgen del Rocío-Sevilla) Dr. A. Cueto Espinar (Facultad de Medicina-Oviedo) Dr. M. Delgado Rodríguez (Facultad de Medicina-Jaén) Dr. V. Domínguez Hernández (H. U. Juan Canalejo-A Coruña) Dr. V. Domínguez Rojas (Universidad Complutense-Madrid) Dr. J. Fereres Castiel (H. Clínico San Carlos-Madrid) Dr. J. Fernández-Crehuet Navajas (H. U. Virgen de laVictoria-Málaga) Dr. R. Fernández-Crehuet Navajas (H. U. Reina Sofía-Córdoba) Dr. R. Gálvez Vargas (Granada) Dr. J. García Caballero (H. U. La Paz-Madrid) Dr. J. J. Gestal Otero (H. Clínico Universitario-S. Compostela) Dr. A. Gil Miguel (Universidad Rey Juan Carlos-Madrid) Dr. J. I. Gómez López (Zaragoza) Dr. R. Herruzo (H. U. La Paz-Madrid) Dr. J. R. de Juanes Pardo (H. U. 12 de Octubre-Madrid) Dr. J. de la Lama López-Areal (Valladolid) Dr. P. López Encinar (Hospital Clínico-Valladolid) Dr. F. J. López Fernández (H. U. Puerta del Mar-Cádiz) Dr. J. M. Martín Moreno (Facultad de Medicina-Valencia) Dr. V. Monge Jodra (H. U. Ramón y Cajal-Madrid) Dr. J. Mozota Ortiz (H. U. Marqués de Valdecilla-Santander) Dr. V. Pastor y Aldeguer (H. U. La Princesa-Madrid) Dr. J. del Rey Calero (Madrid) Dr. F. Rodríguez Artalejo (Fac. Medicina U.Autónoma-Madrid) Dr. J. R. Sáenz Domínguez (San Sebastián) Dra. Ma C. Sáenz González (Fac. Medicina U. Salamanca) Dra. M. Sáinz Martín (H. Clínico San Carlos-Madrid) Dr. L. Salleras Sanmartí (Facultad de Medicina-Barcelona) Dr. J. Sánchez Payá (H. General Universitario-Alicante) Dr. Ll. Serra Majem (H. U. de Las Palmas de Gran Canaria) Dr. A. Sierra López (H. U. de Canarias-Santa Cruz de Tenerife) Dr. J. Vaqué Rafart (H. U. Vall d’Hebrón-Barcelona) Dr. J. L. Vaquero Puerta (H. U. Río Hortega-Valladolid) Dr. A. Vicente (H. de Móstoles-Madrid) Dr. J. J. Viñes Rueda (Pamplona) Dr. J. Yuste Grijalba (Madrid) Dr. J. Zafra Mezcua (H. U. Puerta del Mar-Cádiz) Dr. V. Zanón Viguer (H. U. Doctor Peset-Valencia) Sociedad Española de Medicina Preventiva, Salud Pública e Higiene Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 1 SUMARIO:002-SUMARIO.qxp 11/05/10 17:56 Página 3 Medicina Preventiva INDICE DE ARTÍCULOS Y AUTORES 14. Vacunaciones para pacientes trasplantados de progenitores hematopoyéticos (J. M. Bayas, M. Campins, C. Adell) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 15. Vacunaciones para adultos con insuficiencia renal crónica y en programas de hemodiálisis (J. M. Bayas, M. Campins) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 16. Vacunaciones para adultos asplénicos (M. Campins, J. M. Bayas). . . . . . . . . . . . . . . . . . . . 19 17. Vacunaciones en pacientes infectados por el virus de la inmunodeficiencia humana (M. C. Sáenz, A. Gil, P. Carrasco). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 23 18. Vacunaciones en mujeres en edad fértil y en embarazadas (A. Domínguez, V. Pastor, C. Sanz, L. Salleras) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 26 19. Vacunaciones frente a exposiciones laborales (M. C. Saénz, J. Castrodeza, J. R. de Juanes) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 20. Vacunaciones en viajeros internacionales (J. Fernández Crehuet, R. López) . . . . . . . . . . . . 41 21. Control de brotes epidémicos mediante la vacunación (A. Domínguez, V. Pastor, C. Sanz) . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62 22. El acto vacunal. El papel de enfermería (J. A. Forcada). . . . . . . . . . . . . . . . . . . . . . . . . . . . 66 23. Calendario de vacunaciones sistemáticas del adolescente y adulto recomendado por la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (Comité de Vacunas de la SEMPSPH). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 76 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 3 01-SEMPSPH:07a9-LA CULTURA(Firma) 04/05/10 8:46 Página 5 Medicina Preventiva Acuerdo de la Junta Directiva de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH) La Junta Directiva de la SEMPSPH ha decidido presentar Recurso Contencioso Administrativo contra la Resolución del 2 de Febrero de 2010, de la Dirección Gerencia del Servicio Extremeño de Salud (SES), publicada en el DOE nº 19 del 26 de Febrero de 2010 y por la que se aprueba la estructura funcional de la plantilla del personal estatutario del Organismo Autónomo (2010060439). Esta decisión está basada en la falta del requisito de Especialista en Medicina Preventiva y Salud Pública para optar a plazas singularizadas de esta especialidad, convocadas por aquella Comunidad Autónoma. Este requisito ha sido sustituido por la mera exigencia de Técnico Titulado Superior, con experiencia de dos años en Administración y Gestión Sanitaria. La Junta Directiva de la SEMPSPH entiende que entre sus fines fundacionales está la defensa de la especialidad “Medicina Preventiva y Salud Pública”, sus cometidos y la preparación de sus especialistas para optar a las plazas convocadas como “Medicina Preventiva y Salud Pública” (Artículo 3º: Fines, Estatutos de la SEMPSPH). Por todo ello, ha acordado emprender este recurso y estudiar cuantas acciones legales procedan ante los organismos competentes, en Madrid a 8 de Abril de 2010. Vicente Pastor y Aldeguer Presidente de la SEMPSPH Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 5 07-14 CAPITULO 14 04/05/10 8:42 Página 7 Medicina Preventiva Capítulo 14 VACUNACIONES PARA ADULTOS TRASPLANTADOS DE PROGENITORES HEMATOPOYÉTICOS J. M. Bayas1, M. Campins2, C. Adell3 Servicio de Medicina Preventiva y Epidemiología. Hospital Clínic Barcelona. 2Servicio de Medicina Preventiva y Epidemiología. Hospital Universitari Vall d’Hebrón. 3Servicio de Medicina Preventiva. Hospital de Vinarós. Castellón. 1 RIESGO DE PADECER DETERMINADAS ENFERMEDADES INMUNOPREVENIBLES O SUS COMPLICACIONES Las personas que han recibido un trasplante de progenitores hematopoyéticos (TPH) pueden sufrir, en grado variable, pérdidas en la inmunidad humoral y celular, frente a antígenos a los que habían sido previamente expuestos de forma natural (infección por microorganismos salvajes) o artificial (mediante vacunación). En el TPH se sustituye el sistema inmunitario del paciente debido a la eliminación casi completa de su sistema inmune mediante el tratamiento de acondicionamiento. La inmunización de pacientes trasplantados pretende corregir las deficiencias específicas surgidas como consecuencia del propio trasplante, así como conseguir un estatus vacunal correcto. La mayor parte de los centros que realizan trasplantes de progenitores hematopoyéticos en niños realizan programas de reinmunización postrasplante. En el caso de los adultos la situación es más heterogénea (1, 2). Según datos de una encuesta realizada en mayo de 1996 (3)por el Grupo Español de Trasplante Hematopoyético, la mayoría de los pacientes no recibía reinmunización post-TPH. Se han desarrollado guías específicas para receptores de TPH. Las primeras fueron las europeas, realizadas por el European Group for Blood and Marrow Transplantation (EBMT) en 1995 (4), las siguieron las recomendaciones nacionales “Inmunización postrasplante de progenitores hematopoyéticos: revisión y recomendaciones” publicadas en 1998 en Med Clin (Barc) (3) y realizadas por el Subcomité de Complicaciones Infecciosas del GETH (Grupo Español de Trasplante Hematopoyético) y la Sociedad Española de Medicina Preventiva Salud Pública e Higiene (SEMPSPH). En 2000, se han publicado las recomendaciones americanas elaboradas por el CDC (Centers for Disease Control), IDSA (Infectious Disease Society of America) y el ASBMT (American Society of Blood and Marrow Trasplantation) (5). Estas recomendaciones de vacunación (1, 2) pretenden compaginar los objetivos de alcanzar una respuesta inmune óptima (que aumenta con el tiempo transcurrido desde el trasplante), con la necesidad de protección en los momentos de mayor riesgo (el postrasplante inmediato). La dificultad para realizar ensayos clínicos controlados es de fácil comprensión. Por ello, en el mejor de los casos se dispone de estudios Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 observacionales, si bien con frecuencia las recomendaciones se basan en estudios descriptivos de series de casos y en opiniones de grupos de expertos. En este momento, las propuestas más cualificadas recomiendan el inicio de la revacunación entre los 6 y los 12 meses (EBMT) y a los 12 meses (CDC) del trasplante, excepto para las vacunas de virus atenuados (sarampión o triple vírica), que debe posponerse al menos hasta los 18-24 meses del trasplante. Las recomendaciones genéricas de vacunación para pacientes inmunodeprimidos no se pueden aplicar mecánicamente a los pacientes TPH (6). Las recomendaciones para éstos deben, además, ser matizadas, ya que dentro de los pacientes candidatos a trasplante de progenitores hematopoyéticos se incluyen enfermedades muy distintas con peculiaridades para las distintas vacunas (7). Todo ello hace necesario la existencia de programas de reinmunización postrasplante específicos para el TPH (7, 8). Los TPH se pueden clasificar en varias modalidades, atendiendo al tipo de donante, fuente de progenitores hematopoyéticos y tipo de acondicionamiento empleado. El término “trasplante de médula ósea” (TMO) se utiliza frecuentemente para referirse al TPH en general, aunque éste no se realice con médula ósea. De hecho, actualmente el trasplante con precursores de sangre periférica es de uso muy frecuente, particularmente en los trasplantes autólogos, donde ha desbancado a la médula ósea como fuente de progenitores. Cabe diferenciar el TPH alogénico y el autólogo, con diferencias importantes en términos de inmunosupresión y riesgo de infección. La enfermedad del rechazo del injerto-contra-huésped (EICH) especifica de los trasplantes alogénicos causa una afectación grave del sistema inmune que conduce a una inmunosupresión profunda. En general parece que los pacientes sometidos a trasplante autólogo, no padecen los periodos prolongados de inmunodeficiencia presentes en los trasplantes alogénicos. En algunos casos se ha podido documentar transferencia pasiva de inmunidad del donante seropositivo al receptor seronegativo (9), pero parece que esta inmunidad es poco duradera (10, 11) y los pacientes deben de nuevo ser reinmmunizados. Se ha sugerido además que la transferencia pasiva para ciertos antígenos requeriría que ambos, donante y receptor, estuvieran previamente inmunizados (12, 13). 7 07-14 CAPITULO 14 04/05/10 8:42 Página 8 Medicina Preventiva A pesar de las anteriores consideraciones, actualmente los protocolos de reinmunización de pacientes TPH no suelen distinguir entre el trasplante alogénico y el autólogo. Se exponen seguidamente las principales recomendaciones de inmunización. BENEFICIOS POTENCIALES DE LA VACUNACIÓN Tétanos En España, el tétanos sigue teniendo una incidencia relativamente alta (se estima en alrededor de 1 caso anual por millón de habitantes) (14), afectando predominantemente a la población adulta debido a su deficiente situación inmune. Por ello, la mayoría de los adultos que reciben un TPH, y sus donantes, pueden ser susceptibles. La pérdida de anticuerpos tras el transplante está bien documentada en el alo-TPH (15) y menos en el autotrasplante, aunque parece no haber diferencias significativas (16). Lum et al (17) demostraron que los pacientes que eran susceptibles antes del trasplante permanecían seronegativos a pesar del estado serológico del donante, y que no había diferencias en la capacidad para conservar la inmunidad entre los pacientes con o sin EICH. Por el contrario, según Molrine et al (18), la inmunización del donante antes de la obtención de la médula ósea puede aumentar la producción de anticuerpos en el receptor. En cuanto a la vacunación, en un programa de reinmunización con tres dosis de toxoide tetánico la respuesta era del 100% dos años después (15). Un estudio randomizado (19) comparó la respuesta de una pauta de vacunación de 3 dosis a los 6, 8 y 14 meses con otra a los 18, 20 y 26 meses después del trasplante y no se mostraron diferencias significativas entre la respuesta de los dos grupos (19). Chan et al (20) compararon la respuesta a la vacuna entre los dos tipos de trasplante (aloTPH y auto-TPH) y los niveles de anticuerpos eran significativamente más altos en los segundos. Estos resultados concuerdan con la más temprana recuperación de la inmunidad humoral de los trasplantes autólogos. La conclusión es que el TPH conlleva pérdida de inmunidad contra el tétanos y que la respuesta a la vacunación con toxoide tetánico tras varias dosis es casi del 100% (15, 16, 19), incluso en pacientes con EICH crónica (19). Esta alta respuesta a la vacuna está en concordancia con los resultados de un estudio realizado por Adell et al en pacientes históricos sometidos a TPH, cuya respuesta a la inmunización con pauta multidosis fue del 93,8% (21). Probablemente en estos pacientes no sería válida la recomendación general de ajustar el número de dosis a la edad; es decir, pauta de tres dosis (0, 1, 6 meses) de vacuna combinada tétanos-difteria (Td) en los presuntamente no vacunados, o booster cada 10 años en los ya primovacunados (22), siendo preferible la vacunación de novo en todos los pacientes. Difteria Parkkali et al (23) mostraron que sólo seis de 11 pacientes (54%) todavía tenían inmunidad contra la difteria un año después del TPH alogénico, con niveles de antitoxina que eran apenas protectores. Al menos un 50% de los pacientes pierden los anticuerpos al año del trasplante (24) y la respuesta inmune tras la pauta vacunal completa en el TPH según diversos estudios oscila entre el 67% (21) y el 86% (25). La inmunización contra la difteria en pacientes adultos se realiza con vacuna combinada Td. 8 Haemophilus influenzae tipo b En el trasplante alogénico, Haemophilus influenzae es la principal causa de neumonía a partir del tercer mes postrasplante (26), causando el 35% de los episodios de neumonía de etiología conocida y el 19% de todas las neumonías observadas tras esta fecha (27, 28). En los pacientes con trasplante autogénico, el riesgo de infección por este microorganismo está peor definido, aunque se han descrito infecciones graves. Las vacunas conjugadas frente a Haemophilus influenzae tipo b (Hib) han mostrado ser eficaces en los pacientes sometidos a trasplante, produciendo una respuesta del 56% tras una sola dosis y el 80% tras dos dosis de vacuna (12 y 24 meses) (29, 30). La respuesta no parece estar influida por la presencia de EICH crónica. La vacunación temprana (a partir del sexto mes) con 2 dosis ha demostrado ser eficaz (26). La inmunización del donante antes de la obtención de la médula ósea, parece que consigue inducir altos títulos protectores en el postrasplante precoz y aumentar la respuesta vacunal del receptor (18). Similares resultados se han obtenido inmunizando al paciente antes de la obtención de la médula ósea en el trasplante autólogo (31). Enfermedad neumocócica Streptococcus pneumoniae es la principal causa de infección en pacientes supervivientes de más de 6 meses postrasplante, debido a los bajos niveles de anticuerpos antineumococo y deficiente actividad opsonizante del suero (32, 33). Según los estudios publicados, la vacunación del donante no parece aumentar la respuesta de la vacunación postrasplante (34-36). Streptococcus pneumoniae es uno de los patógenos más importantes en el post-TPH, en particular en el TPH alogénico (37, 38) y tanto de forma temprana como tardía (39). El alarmante incremento a escala mundial de neumococos resistentes a la penicilina (40) hace todavía más necesaria la prevención de esta infección mediante la vacunación. La respuesta a la vacuna es muy pobre si se administra muy precozmente en el postrasplante, aunque si se administra muy tardíamente (>24 meses) para conseguir una mejor respuesta, muchos pacientes habrán sufrido ya infecciones por neumococo. La administración de la vacuna entre los 7 meses y los 2 años, que es el intervalo en el que existe mayor riesgo de infección por neumococo, no ha demostrado producir respuestas perceptiblemente diferentes (8). Por tanto, parece razonable iniciar la vacunación lo antes posible en este intervalo. La respuesta inmune no mejora significativamente con dos dosis de vacuna comparada con una dosis (29). La escasa inmunogenicidad de los polisacáridos capsulares ha sido mejorada mediante la unión covalente a proteínas transportadoras. Es posible que las vacunas antineumocócicas conjugadas sean en un futuro útiles para la protección de los pacientes sometidos a trasplante, al igual que con la vacuna del Hib. En pacientes sometidos a alotrasplante, la vacuna conjugada heptavalente demostró ser tan inmunógena como la 23-valente polisacárida (41). Pero la protección contra la enfermedad neumocócica con la vacuna conjugada dependerá de los serotipos circulantes en la comunidad. En todo caso, se necesitan más estudios para realizar recomendaciones al respecto. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 07-14 CAPITULO 14 11/05/10 16:37 Página 9 Medicina Consecuentemente, como en el receptor del trasplante el mayor riesgo de infección por bacterias capsuladas ocurre durante los primeros 1 ó 2 años postrasplante, las vacunas antineumocócicas al igual que las de Haemophilus influenzae tipo b, no deberían administrarse más tarde de 6-8 meses posttrasplante. Neisseria meningitidis Se desconoce si los pacientes con trasplante hemopoyético tienen mayor incidencia de infecciones por N. meningitidis que la población general. Tampoco existen estudios que valoren el grado de respuesta a la vacunación de los pacientes sometidos a trasplante. Por ello, es discutible la justificación de la vacunación de estos pacientes en nuestro medio. No obstante, ciertos autores recomiendan la vacunación con un esquema de 2 dosis (12 y 24 meses) (42). Los enfermos sometidos a trasplante pueden recibir la vacuna si las circunstancias epidemiológicas concretas así lo aconsejan. Sería el caso de contactos íntimos de casos de infección por meningococo C o viaje a países en los que las infecciones por serogrupos contenidos en las vacunas disponibles sean endémicas o epidémicas. Varicela Zóster La infección producida por el virus de la varicela zoster (VVZ) es muy frecuente tanto en el TPH autogénico como en el alogénico. El 52% de los pacientes desarrollan enfermedad por este virus durante los primeros 5 años post-TPH, aunque la mortalidad directamente atribuible es baja si se administra tratamiento adecuado (43). Saurbrei et al (44) administraron a 15 pacientes pediátricos la vacuna atenuada entre 12 y 23 meses después del TPH. La vacuna fue bien tolerada, sin reacciones adversas y no se observó varicela o herpes zóster en los 2 años posteriores a la inmunización. Las infecciones usualmente ocurren dentro de los 18 meses después del trasplante, periodo durante el cual la vacuna no puede ser administrada. El intervalo idóneo entre la inmunización y el trasplante no está bien establecido y los estudios realizados sobre primovacunación son limitados (44). Sin embargo, se podría considerar la vacunación dos años después del trasplante en pacientes sin EICH ni tratamiento inmunosupresor, de modo análogo a las recomendaciones para la vacuna triple vírica. Poliomielitis Los avances en la erradicación de la poliomielitis han sido destacados desde la resolución de la OMS de 1988 (45). Aunque las predicciones iniciales eran conseguir la erradicación para el año 2000, diversas razones han demorado el logro de este objetivo (46, 47). Las personas con inmunodeficiencias de células B tienen mayor riesgo de desarrollar infecciones por poliovirus, con periodos de incubación más prolongados y mayor letalidad que en individuos sin estas carencias (48). Los pacientes sometidos a trasplante pierden el 30-70% de anticuerpos tras el trasplante (24, 25, 49) manteniendo mejores títulos protectores los pacientes con autotrasplante respecto a los alogénicos (49). Pauksen et al (49) encontraron que alrededor del 20% de los pacientes sometidos a autotrasplante perdían sus anticuerpos al menos a un tipo de poliovirus un año después del TPH autólogo (49). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva La disminución de anticuerpos es tiempo-dependiente y progresa en el segundo y tercer año. Una alta proporción (83%) de los pacientes seronegativos respondieron a la reinmunización con tres dosis de vacuna inactivada (49). La vacuna del poliovirus inactiva (VPI) ha demostrado ser segura y eficaz en los receptores de trasplante, precisando dosis repetidas para obtener una respuesta óptima (24, 25, 49). Un estudio realizado con la finalidad de encontrar si la vacunación temprana era tan efectiva como la tardía, concluyó que una pauta de tres dosis de VPI era igualmente inmunogénica si se iniciaba a los 6 meses (6, 8 y 14 meses) que a los 18 meses (18, 20 y 26 meses) tras el trasplante alogénico (50). La EICH aguda acelera la pérdida de los niveles de anticuerpos a poliovirus antes de la vacunación, pero no perjudica la respuesta a la vacunación. Sarampión, rubéola y parotiditis Una proporción sustancial de receptores alo-TPH y también auto-TPH pierden la inmunidad después de un periodo de tiempo variable (51, 52). Las vacunas del sarampión, rubéola y parotiditis son de virus atenuados y no deben usarse en inmunodeprimidos graves, ya que la replicación del virus vacunal puede verse potenciada. En inmunocomprometidos se han producido casos graves de sarampión, incluso mortales, aunque el número de casos documentados en TPH es bajo (53). No se han comunicado casos graves de infección por los virus de la rubéola y de la parotiditis. En una serie de 64 pacientes receptores de TPH autológo (51), la pérdida de anticuerpos protectores después del primer año postrasplante fue de 12% para el sarampión, 18% frente a la rubéola y 6% frente a la parotiditis, siendo los pacientes adultos que habían pasado la infección natural los que permanecían seropositivos. En otro estudio con 57 pacientes de TPH alogénico, la pérdida de anticuerpos a los 2 años era del 49% en sarampión, 24% en rubéola y 58% en parotiditis (52). A largo plazo (5 años), un 73% aproximadamente de los pacientes previamente seropositivos se hacen seronegativos, independientemente de la serología del donante (54), y se concluyó, al igual que en otros estudios posteriores, que la pérdida de estos anticuerpos es significativamente mayor en los pacientes en los que el origen de los anticuerpos era vacunal, respecto a los que habían sufrido la infección natural (54, 55). En términos genéricos, las vacunas vivas están contraindicadas en los pacientes inmunodeprimidos (56). Sin embargo, varios estudios han probado que su administración es segura en los receptores de un TPH alogénico si han transcurrido al menos 18 meses desde el trasplante y el paciente no padece EICH ni recibe tratamiento inmunodepresor (51, 52, 57, 58). Tras la vacunación, los pacientes con alo-TPH muestran unas tasas de seroconversión del 71-77% (52, 58), mientras que la tasa de seroconversión estudiada en el autogénico es del 40% (51). En el estudio antes mencionado de Adell et al, la respuesta a la vacunación en pacientes históricos fue del 71%, 70% y 100% para sarampión, rubéola y parotiditis, respectivamente (21). Como ya ha sido indicado y aunque la experiencia es limitada, la vacuna podría ser administrada a pacientes trasplantados (alogénico y autogénico) a los 18-24 meses del trasplante si no están recibiendo terapia inmunosupresora y no han presentado enfermedad injerto contra huésped (57, 59, 60). 9 07-14 CAPITULO 14 04/05/10 8:42 Página 10 Medicina Preventiva Hepatitis B Los receptores de TPH, debido a la hemoterapia que reciben, especialmente en el primer mes postrasplante, tienen un mayor riesgo de infección por virus de la hepatitis B (VHB) y aunque con el cribado sistemático de sangre y hemoderivados ha disminuido el riesgo de infección, éste no se ha eliminado por completo (61, 62). En países como Italia, con una prevalencia poblacional de antígeno de superficie de la hepatitis B HBsAg del 3-4%, un 20% de los pacientes receptores de TPH alogénico presentaron positividad para el HBsAg antes (6%) o después del trasplante (14%) (61). Se han descrito reactivaciones fatales de VHB tras el TPH alogénico y autólogo y casos de eliminación de infección por el VHB en receptores HBsAg positivo pretrasplante, después de ser sometidos a un TPH alogénico con un donante inmune frente al VHB (63, 64). No se dispone de información sobre la eficacia de la inmunización pretrasplante de los receptores. La vacunación pretrasplante de hepatitis B a los donantes puede dar como resultado una trasferencia (65) de inmunidad adoptiva del receptor que puede ser de gran utilidad en el postrasplante temprano (66). Wimperis et al (13) demostraron que la transferencia de inmunidad del donante al receptor sólo se producía cuando ambos habían sido inmunizados. Los pacientes que tengan inmunidad frente al VHB por vacunación previa se deberán considerar no inmunes a medio plazo tras el trasplante, a pesar de que, como en el sarampión, la pérdida de anticuerpos postrasplante es significativamente mayor en los que se habían vacunado (70%) frente a los que tenían anticuerpos por haber sufrido la infección natural (14%) (67). Adell et al (21) hallaron tasas de seroconversión del 75% tras la primovacunación con pautas estándar de vacuna de la hepatitis B. En un estudio similar realizado también en España, con inicio más precoz de la vacunación (6 meses postrasplante), se observaron porcentajes de seroprotección del 81%, con un 54,5% de pacientes que respondieron tras la primera pauta vacunal completa, y del 55,6% en los no respondedores que recibieron una segunda pauta (68). Nagler et al (69) demostraron en 48 receptores de autotrasplante que una dosis pretrasplante y dos postrasplante (1 y 6 meses) inducía seroconversión (título de anti-HBs >10 mU/ml) en el 69% de los pacientes dentro de los primeros 40 días tras el TPH, momento de mayor riesgo de contagio. No obstante, los títulos obtenidos fueron bajos y el 37% de los enfermos perdieron los anticuerpos precozmente. En los pacientes inmunocomprometidos se aconseja genéricamente administrar dosis más altas de vacuna de la HB (6). El empleo de dosis de 40 μg de HBsAg puede mejorar la respuesta en los pacientes con TPH. Todos estos datos sugieren que la vacuna de la hepatitis B con dosis múltiples es necesaria. La vacunación del donante previamente al trasplante podría ser beneficiosa (70, 71) al permitir la transferencia de la inmunidad al receptor, consiguiendo anticuerpos a título protector durante el periodo temprano post-TPH, aunque al menos un 30% pierden sus anticuerpos durante el seguimiento (2-68 semanas) (72), con lo que es necesario vacunar también al receptor para obtener una respuesta inmune mantenida a largo plazo. Existe controversia sobre si la inmunización pretrasplante frente al VHB debe ser un procedimiento estándar en el trasplante de médula ósea autólogo (69). 10 Hepatitis A La susceptibilidad al virus de la hepatitis A (VHA) es alta en los países desarrollados, en relación con sus condiciones higiénico-sanitarias y socio-económicas. El incremento paulatino de población adulta susceptible, en la que la enfermedad es más grave y se presentan más formas de hepatitis fulminante (73), aconseja de modo genérico la protección mediante vacunación. En España, la prevalencia de anticuerpos frente al virus de la hepatitis A va disminuyendo progresivamente en todos los grupos de edad inferior a 50 años (74, 75), al igual que ocurre en otros países (76). Se dispone de poca información sobre las consecuencias de la enfermedad y la eficacia de la vacunación contra el VHA en los pacientes sometidos a trasplante hemopoyético. Probablemente la vacunación contra la hepatitis A (con vacunas monovalentes o combinadas hepatitis A+B) es una buena práctica clínica, aunque no se dispone de evidencias científicas para esta recomendación. Al tratarse de vacunas inactivadas, no deben esperarse problemas de seguridad. Gripe Los receptores de trasplante pueden adquirir infecciones por virus gripales durante las epidemias estacionales comunitarias (77, 78) e infecciones bacterianas secundarias incluida la neumonía, las cuales pueden tener graves consecuencias (79). Se han descrito casos graves de gripe (influenza A) en los enfermos sometidos a trasplante, algunos de ellos con neumonitis (78). Durante un brote comunitario de gripe se aisló el virus de la influenza A en el 29% de los pacientes hospitalizados que recibieron trasplante, desarrollando neumonía el 75% de los casos (77). Engelhard et al (80) evaluaron la eficacia de la vacuna en el TPH alogénico y autogénico y aproximadamente un 25% de los pacientes sometidos a trasplante desarrollan anticuerpos protectores tras la vacunación con una dosis y un 35% tras dos dosis. Aunque la eficacia protectora de la vacunación dentro de los 6 primeros meses del trasplante está muy cuestionada (80), a su vez no es lesiva y debe recomendarse si la temporada gripal es inminente. En otro caso es necesario determinar el tiempo óptimo de la vacunación. Se recomienda la inmunización durante el primer año después del TPH autogénico (81). En alo-TPH aproximadamente el 25% de los pacientes respondían cuando la dosis se daba entre los 6 meses y los dos años después del trasplante, mientras que más del 60% respondían cuando se daba a partir de los dos años del trasplante (80). No ha sido estudiado si la inmunización del donante (o de donante y receptor) antes del trasplante contribuye a conferir protección. En los pacientes trasplantados, la producción de anticuerpos puede no ser óptima y puede aparecer la gripe, pero las complicaciones de ésta podrían disminuir con la vacuna. Por ello, se aconseja la vacunación en la época anual correspondiente, independientemente del tiempo transcurrido desde el trasplante. Es altamente recomendable la vacunación del personal sanitario y convivientes de pacientes en riesgo de sufrir complicaciones por la gripe (82, 83). Se ha demostrado que esta estrategia reduce la mortalidad en los pacientes hospitalizados (84). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 07-14 CAPITULO 14 04/05/10 8:42 Página 11 Medicina Preventiva Tabla I. Calendario de vacunación de pacientes con TPH. SEMPSPH Tabla II. Recomendaciones de vacunión de pacientes con TPH Visita 1 Mes 6º Vacuna Visita 2 Mes 7º Vacunas • Td • Hepatitis A+ B • Polio Salk • Gripe* Vacunas • Td • Hepatitis A+ B • Polio Salk • H. influenzae b 1ª d 1ª d 1ª d 2ª d 2ª d 2ª d 1ªd Visita 3 Mes 8º Vacunas • Hepatitis A+ B 3ª d • H. influenzae b 2ªd • Neumocócica 23** Visita 4 Mes 18º Vacunas • Td • Polio Salk • Hepatitis A+ B Visita 5 Mes 24º Vacunas • Triple vírica 1ª d • Neumocócica 2ª Visita 6 Mes 25º Vacunas • Triple vírica 2ª d 3ª d 3ª d 4ª d Alogénico Autólogo Tiempo recomendado (meses post-TPH) Toxoide tetánico ++ ++ 12 Toxoide diftérico ++ ++ 12 Poliovirus inactivado ++ ++ 12 Sarampión (atenuada) NR NR No antes de 24 meses Rubéola (atenuada) NR NR No antes de 24 meses Parotiditis (atenuada) NR NR No antes de 24 meses Gripe + + 6 (en temporada gripal) Haemophilus influenzae b ++ + 4-6 Hepatitis B + + No especificado +/- +/- No especificado Neumocócica • * Si la vacuna no está disponible (periodo junio-septiembre) se administrará la vacuna antineumocócica 23. • ** Si la vacuna antineumocócica 23 ya fue administrada en la visita 1 se administrará ahora la vacuna antigripal. • Se puede considerar la conveniencia de estudiar niveles de anticuerpos (ver texto) antes, y sobre todo después (30-60 días) del proceso de reinmunización. • Debe considerarse la conveniencia de vacunar con vacuna varicelazóster (dos dosis separadas por un intervalo de 30-60 días), a los pacientes seronegativos a los 24 meses del trasplante, salvo que su estado inmunitario contraindique la vacunación. • La vacunación antigripal se repetirá anualmente en el periodo octubre –mayo (hemisferio norte) preferentemente al inicio del citado período. • Deberán adoptarse las medidas oportunas (vacunación y otras) para minimizar el riesgo de que las personas en estrecho contacto con los pacientes (convivientes, personal sanitario, etc.), puedan actuar como fuentes de infección de gripe, sarampión y varicela-zóster. RECOMENDACIONES DE ORGANISMOS OFICIALES Recomendaciones de la SEMPSPH Los pacientes que han recibido un trasplante de progenitores hematopoyéticos pierden los anticuerpos protectores frente a enfermedades prevenibles por vacunas. Aunque el perfil de seguridad y la eficacia de la mayoría de vacunas es alto, éstas son infrautilizadas y los programas varían ampliamente, dependiendo de los centros. Como ya se expuso al principio del presente capítulo, las directrices europeas recomiendan el inicio de la inmunización a partir del sexto mes del trasplante si no hay EICH (4). Por el contrario, las recomendaciones en EEUU (6) y Canadá (85) señalan el doceavo mes del trasplante como el momento de inicio de la vacunación. También se indicó que los diferentes calendarios Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 ++ (muy recomendado en todos los pacientes); + (recomendado); +/(recomendación individualizada); NR (no recomendada en general). pretenden compaginar los objetivos de alcanzar una respuesta inmune óptima (difícil en los primeros meses del trasplante) con la necesidad de protección cuando el riesgo es mayor. En 1998, la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene y Grupo Español de Trasplante Hematopoyético publicaron recomendaciones de vacunación en pacientes receptores de trasplantes de progenitores hematopoyéticos (3). Cómo en el calendario europeo, se diferenciaba la vacunación según tipo de trasplante (alogénico y autólogo). En 2005, la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene optó por recomendar un calendario “europeo” y simplificado (Tabla I), común a las diferentes modalidades, insistiendo en el examen de anticuerpos protectores, en aquellos casos en que el nivel protector esté bien establecido y sea posible su realización. Estas determinaciones de anticuerpos debieran hacerse al menos en dos momentos: al inicio del calendario de vacunación y al finalizar el mismo. De este modo, los potenciales defectos del “calendario europeo precoz” pueden verse compensados por la monitorización de la respuesta a los antígenos vacunales para poder actuar en consecuencia, por ejemplo, administrando dosis adicionales de vacunas. Se sugiere la determinación de anticuerpos contra tétanos, difteria, hepatitis B (además de HBsAg y antiHBc), hepatitis A, sarampión, rubéola, parotiditis y varicela-zóster. Se ha optado también por incluir la vacuna de la hepatitis A, administrada como vacuna combinada hepatitis A+B. Se aprovecha así la logística de la vacuna monovalente de la hepatitis B, aunque ciertamente ello no permite el empleo de dosis de 40 µg de HBsAg. 11 07-14 CAPITULO 14 04/05/10 8:42 Página 12 Medicina Preventiva Tabla III. Recomendaciones de vacunación del Grupo Español para Trasplante de Progenitores Hematopoyéticos (3) Meses post-TPH Alogénico Autólogo 1 Hepatitis B Hepatitis B 2 Hepatitis B Hepatitis B 6 Hepatitis B Haemophilus influenzae b Hepatitis B Haemophilus influenzae b 7 Haemophilus influenzae b Neumococo Haemophilus influenzae b Neumococo 12 Tétanos difteria Polio inactivada Tétanos difteria Polio inactivada 13 Tétanos difteria Polio inactivada Tétanos difteria Polio inactivada 18 Tétanos difteria Polio inactivada Tétanos difteria Polio inactivada ≥ 24 Sarampión Hepatitis B Hepatitis B De acuerdo con directrices del CDC, se incluyen dos dosis de vacuna antineumocócica 23 valente. La segunda de ellas no es un booster, es una “segunda oportunidad” para aquellos que no respondieron a la primera. Se incluye también una segunda dosis de vacuna triple vírica, también en concepto de “segunda oportunidad”. Protocolo de Vacunación de pacientes con trasplante de progenitores hematopoyéticos. SEMPSPH 2005 Comenzar la vacunación con un lapso mínimo de 6 meses desde el trasplante, cuando el estado inmunitario del paciente lo permita (ausencia de enfermedad de injerto contra el huésped) (Tabla I). RECOMENDACIONES DEL GRUPO EUROPEO PARA TRASPLANTE DE PROGENITORES HEMATOPOYÉTICOS (4) Inmunizaciones recomendadas para supervivientes a largo plazo después de un trasplante de médula ósea autólogo y alogénico (Tabla II). Recomendaciones de otros organismos y sociedades Se exponen a continuación los calendarios de inmunización y reinmunización propuestos por otros organismos y sociedades, GETH (Tabla III) y CDC (Tabla IV). Tabla IV. Recomendaciones del vacunación de los CDC para trasplante de progenitores hematopoyéticos (autólogo y alogénico) (5) Tiempo después del trasplante Vacuna Tétanos-difteria (≥ 7 años) Td Td Td BIII Haemophilus influenzae b Hib Hib Hib BIII Hepatitis B HB HB HB BIII Neumo 23 BIII Antineumocócica 23v Neumo 23 No recomendada rutinariamente Antihepatitis A Gripe Administración rutinaria de por vida, a partir de 6º mes del trasplante No recomendada rutinariamente Meningocócica Polio inactivada Rabia Enfermedad de Lyme IPV IPV IPV BII – No indicada – SRP Contraindicada BII – No recomendada rutinariamente Triple vírica, SRP Varicela – BIII EIII Categoría de evidencia: A: Buena evidencia para recomendar su uso; B: Moderada evidencia para recomendar su uso; C: pobre evidencia para recomendar o contraindicar su uso; D: Moderada evidencia para contraindicar su uso; E: Buena evidencia para contraindicar su uso. Grado de evidencia: I: Evidencia de al menos un ensayo clínico controlado; II: Evidencia de al menos un ensayo clínico no controlado, de estudios de cohortes o de casos y controles preferentemente en más de un centro, de múltiples estudios de series temporales o de contundentes (“dramatic”) resultados en experimentos no controlados; III: Evidencia de opiniones de autoridades basadas en experiencias clínicas, estudios descriptivos, o informes de comités de expertos 12 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 07-14 CAPITULO 14 11/05/10 16:39 Página 13 Medicina BIBLIOGRAFÍA 1. Ljungman P. Immunization of transplant recipients [editorial; comment] Comment on: Bone Marrow Transplant 1999;23:637-46. Bone Marrow Transplant 1999;23:635-6. 2. Henning KJ, White MH, Stepkowitz KA, Armstrong D. A national survey of immunization practices following allogenic bone marrow transplantation. JAMA 1997 9;227:1148-51. 3. De la Cámara R, Bischofberger C, Campins M, Carreras E. Inmunización postransplante de progenitores hematopoyéticos: revisión y recomendaciones. Med Clin (Barc) 1998;110:146-55. 4. Ljungman P, Cordonnier C, de Bock R, Einsele H, Engelhard D, Grundy J et al. Immunizations after bone marrow transplantation: results of a European survey and recommendations from the infectious diseases working party of the European Group for Blood and Marrow Transplantation. Bone Marrow Transplant 1995;15:455-60. 5. CDC. Guidelines for preventing oportunistic infections among hematopoietic stem cell transplant recipients: recommendations of CDC, the Infectious Disease Society of America, and the American Society of Blood and Marrow Transplantation. MMWR 2000;49 (No. RR-10):1-128. 6. CDC. Recommendations of the Advisory Committee on Immunization Practices (ACIP): Use of vaccines and immune globulins for persons with altered immunocompetence. MMWR 1993;42:1-19. 7. Ross DW. The immune system following bone marrow transplantation. Arch Pathol Lab Med 1996;120:885-6. 8. Somani J, Larson RA. Reimmunization after allogeneic bone marrow transplantation. Am J Med 1995;98:389-98. 9. Labadie J, van Tol MJ, Dijkstra NH, Zwaan FE, Vossen JM. Transfer of specific immunity from donor to recipient of an allogeneic bone marrow graft: evidence for donor origin of the antibody producing cells. Br J Haematol 1992;82:437-44. 10. Wahren B, Gahrton G, Linde A, Ljungman P, Lönnqvist B, Ringden O et al. Transfer and persistence of viral antibody-producing cells in bone marrow transplantation. J Infect Dis 1984;150:358-65. 11. Lum LG, Munn NA, Schanfield MS, Storb R. The detection of specific antibody formation to recall antigens after human marrow transplantation. Blood 1986:67:582-7. 12. Saxon A, Mitsuyaso R, Stevens R, Champlin R, Kimata H, Gale R. Transfer of specific immune responses after bone marrow transplantation. J Clin Invest 1986;78:959-67. 13. Wimperis J, Brenner M, Prentice H, Reittie J, Karayiannis P, Griffiths P et al. Transfer of a functioning humoral immune system in transplantation of T-lymphocyte-depleted bone marrow. Lancet. 1986;1:339-43. 14. Grupo de Trabajo de Vacunación en el Adulto. Sociedad Española de Higiene y Medicina Preventiva Hospitalarias. Guía de vacunación en el adulto, 1995. 15. Ljungman P, Wiklund Hammarsten M, Duraj V, Hammarström L, Lönnqvist B el al. Response to tetanus toxoid immunization after allogeneic bone marrow transplantation. J Infect Dis 1990;162:496-500. 16. Gerritsen EJ, Van Tol MJ, Van’t Veer MB, Wels JM, Khouw IM, Touw CR et al. Clonal dysregulation of the antibody response to tetanus-toxoid after bone marrow transplantation. Blood 1994;84:4374-82. 17. Lum LG, Noges JE, Beatty P, Martin PJ, Deeg J, Doney KC et al. Transfer of specific immunity in marrow recipients given HLA-mismatched, T cell-depleted, or HLA-identical marrow grafts. Bone Marrow Transplant 1998;3:399-406. 18. Molrine D, Guinan E, Antin J, Parsons SK, Weinstein HJ, Wheeler C. Donor immunization with Haemophilus influenzae type b (HIB)-conjugate vaccine in allogenic bone marrow transplantation. Blood 1996;87:3012-8. 19. Parkkali T, Olander RM, Ruutu T, Vuontela K, Volin L, Eskola J et al. A randomized comparison between early and late vaccination with tetanus toxoid vaccine after allogeneic BMT. Bone Marrow Transplant 1997;19:933-8. 20. Chan CY, Molrine DC, Antin JH, Wheeler C. Antibody responses to tetanus toxoid and Haemophilus influenzae type b conjugate vaccines following autologous peripheral blood stem cell transplantation (PBSCT). Bone Marrow Transplant. 1997;20:33-8. 21. Adell C, Bayas JM, Vilella A, Perales M, Vidal J, Bertran MJ et al. Vacunación de pacientes receptores de trasplante de progenitores hematopoyéticos. Med Clin (Barc) 2002;119:405-9. 22. Bayas JM, Vilella A, Bertran MJ, Vidal J, Batalla J, Asenjo MA et al. Immunogenity and reactogenicity of the adult tetanos-diphteria vaccine. How many doses are necessary? Epidemiol Infect 2001;127:451-60. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 23. Parkkali T, Ruutu T, Stenvik M, Kuronen T, Käyhty H, Hovi T et al. Loss of protective immunity to polio, diphteria and Haemophilus influenzae type b after allogenic bone marrow transplantation. APMIS 1996:104;383-8. 24. Ljungman P, Duraj V, Magnius L. Response to immunization against polio after allogenic marrow transplantation. Bone Marrow Transplant 1991;7:89-93. 25. Li VoltiS, Mauro L, Di-GregorioF, Romeo MA, Lupo L, Pizzarelli G et al. Immune status and immune response to diphteria-tetanus and polio vaccines in allogenic marrow transplanted thalassemic patients. Bone Marrow Transplant 1994;14:225-7. 26. Barra A, Cordonnier C, Preziosi M, Infrator L, Hessel L, Fritzell B et al. Immunogenity of Haemophilus influenzae type b conjugate Vaccine in allogenic bone marrow recipients. J Infect Dis 1992;166:1012-128. 27. Cordonnier C, Bernaudin J, Bierling P, Huet Y, Vernant J. Pulmonary complications occuring after allogeneic bone marrow transplantation: a study of 130 consecutive transplanted patients. Cancer 1986;58:1047-54. 28. Cordonnier C. Haemophilus influenzae infections after bone marrow grafting: from observation to prevention. Rev Pneumol Clin 1995;51:263-7. 29. Guinan EC, Molrine DC, Antin JH, Lee MC, Weinstein HJ, Sallan SE et al. Polysaccharide conjugate vaccine responses in bone marrow transplant patients.Transplantation. 1994;57:677-84. 30. Guinan E, Molrine D, Antin J, Wheeler C, Parsons Weithstein H. Haemophilus influenzae type b (HIB) conjugate immunization before bone marrow harvest in autologous bone marrow transplantation. Bone marrow transplant 1996;17:1149-55. 31. Molrine DC, Guinan EC, Antin JH, Wheeler C, Parsons SK, Weinstein HJ, et al. Haemophilus influenzae type b (HIB)-conjugate immunization before bone marrow harvest in autologous bone marrow transplantation. Bone Marrow Transplant 1996;17:1149-55. 32. Winston DJ, Schiffman G, Wang DC, Feig SA, Lin CH, Marso EL et al. Pneumococcal infections after human bone marrow transplantation. Ann Intern Med 1979;91:835-41. 33. Winston DJ, Ho WG, Schiffman G, Champlin RE, Feig SA, Gale RP. Pneumococcal vaccination of recipients of bone marrow transplants. Arch Intern Med 1983;143:1735-7. 34. Lortan JE, Vellodi J, Jurges ES, Hugh-Jones K. Class- and subclass-specific pneumococcal antibody levels and response to immunization after bone marrow transplantation. Clin Exp Immunol 1992;88:512-9. 35. Hammarström V, Pauksen K, Azinge J, Öberg G, Ljungman P. Pneumococcal immunity and response to immunization with pneumococcal vaccine in bone marrow transplant patients: the influence of graft versus host reaction. J.Supportive Care Cancer 1993;1:195-9. 36. Giebink GS, Warkentin PI, Ramsay NK, Kersey JH. Titers of antibody to pneumococci in allogeneic bone marrow transplant recipients before and after vaccination with pneumococcal vaccine. J Infect Dis. 1986;154:590-6. 37. Atkinson K, Storb R, Prentice R, Weiden PL, Witherspoon RP, Sullivan K et al. Analysis of late infections in 89 long-term suvivors of bone marrow transplantation. Blood 1979;53:720-31. 38. Schwella N, Schwerdtfeger R, Schmidt-Wolf I, Schmid H, Siegert W. Pneumococcal arthritis after allogeneic bone marrow transplantation. Bone Marrow Transplant 1993;12:165-6. 39. Engerlhard D, Cordonnier C, Shaw PJ, Parkalli T, Guenther C, Martino R et al. Early and late invasive pneumococcal infection following stem cell transplantation: a European Bone Marrow Transplantation survey. Br J Haematol 2002;117:444-50. 40. Baquero F. Epidemiology and management of penicillin-resistant pneumococci. Curr Opin Infect Dis 1996;9:299-300. 41. Storek J, Mendelman PM, Witherspoon RP. IgG response to pneumococcal polysaccharide-protein conjugate appears similar to IgG response to polysaccharide in bone marrow transplant recipients and healthy adults. Clin Infect Dis 1997;25:1253-5. 42. Ambrosino D, Molrine D. Critical appraisal of immunization strategies for prevention of infection in the compromised host. Hematol Oncol Clin North Am 1993;7:1027-50. 43. Han CS, Miller W, Haake R, Weisdorf D. Varicella zoster infection after bone marrow transplantation: incidence, risk factors and complications. Bone Marrow Transplant 1994;13:277-83. 44. Sauerbrei A, Prager J, Hengst U, Zintl F, Wutzler P. Varicella vaccination in children after bone marrow transplantation. Bone Marrow Transplant. 1997;20:381-3. 45. OMS. Global eradication of poliomielitis by the year 2000. Resolution WHA41-28. Geneva: WHO 1988. 13 07-14 CAPITULO 14 04/05/10 8:42 Página 14 Medicina Preventiva 46. John TJ. The final stages of the global eradication of polio. N Engl J Med 2000;343:806-7. 47. John J. Role of injectable and oral polio vaccines in polio eradication. Expert Rev Vaccines 2009;8:5-8. 48. Wyatt HV. Poliomyelitis in hipogammaglobulinemics. J Infect Dis 1973;128:802-6. 49. Pauksen K, Hammarstrom V, Ljungman P, Sjölin J, Oberg G, Lönnerholm G et al. Immunity to poliovirus and immunization with inactivated poliovirus vaccine after autologous bone marrow transplantation. Clin Infect Dis 1994;18:547-52. 50. Parkkali T, Stenvik M, Ruutu T, Hovi T, Volin L, Ruutu P. Randomized comparison of early and late vaccination with inactivated poliovirus vaccine after allogeneic BMT. Bone Marrow Transplant 1997;20:663-8. 51. Pauksen K, Duraj V, Ljungman P, Sjolin J, Oberg G, Lonnerholm G et al. Immunity to and immunization against measles, rubella and mumps in patients after autologous bone marrow transplantation. Bone Marrow Transplant 1992;9:427-32. 52. Ljungman P, Fridell E, Lonnqvist B, Bolme P, Böttiger M, Gahrton G et al. Efficacy an safety of vaccination of marrow transplant recipients with a live attenuated measles, mumps and rubella. J Infect Dis 1989;159:610-5. 53. Nakano T, Shimono Y, Sugiyama K. Clinical features of measles in immunocompromised children. Acta Paediatr 1996;38:212-7. 54. Ljungman P, Lewensohn-Fuchs I, Hammarstrom V, Aschan J, Brandt L, Bolme P et al. Long-term immunity to measles, mumps, and rubella after allogeneic bone marrow transplantation. Blood 1994;84:657-63. 55. Pauksen K, Linda A, Ljungman P, Bolme P, Lonnerholm G, Oberg G et al. Specific T and B cell imunity to measles after allogenic and autologous bone marrow transplantation. Bone Marrow Transplantation 1995;16:807-13. 56. Recomendation of the Immunization Practices Advisory Committee: measles prevention. MMWR 1987;36:409-25. 57. Ljungman P. Immunization in the immunocompromised host. En: Plotkin SA, Orenstein WA, eds. Vaccines (3ª ed). Filadelfia: W.B. Saunders Company, 1999; p. 98-110. 58. King S, Saunders E, Petric M, Gold R. Response to measles, mumps and rubella vaccine in paediatric bone marrow transplant recipients. Bone Marrow Transplantation 1996,17:633-6. 59. Pirofski LA, Casadevall A. Use of licensed vaccines for active immunization of the immunocompromised host. Clin Microbiol Rev 1998;11:1-26. 60. Machado C, Sumita L, da Rocha I, Pannuti C, de Souza V. Early measles vaccination in bone marrow transplant recipients. Int J Infect Dis 2002; 6 (suppl. 2):S38. 61. Locasciulli A, Alberti A, de Bock R, Cordonnier C, Einsele H, Engelhard D et al. Impact of liver disease and hepatitis infections on allogeneic bone marrow transplantation in Europe: a survey from the European Bone Marrow Transplantation (EBMT) Group-Infectious Diseases Working Party. Bone Marrow Transplant 1994;14:833-7. 62. Schreiber GB, Busch MP, Kleinman SH, Korelitz JJ. The risk of transfusion-transmitted viral infections. N Engl J Med 1996;334:1685-90. 63. Pariente EA, Goudeau A, Dubois F, Degott C, Gluckman E, Devergie A et al. Fulminant hepatitis due to reactivation of chronic hepatitis B virus infection after allogenic bone marrow transplantation. Dig Dis Sci 1988;33:1185-91. 64. Webster A, Brenner M, Pretice H, Grifiths P. Fatal hepatitis reactivation after autologous bone marrow transplantation. Bone Marrow Transplantation 1989;4:207-8. 65. Brugger SA, Oesterreicher C, Hofmann H, Kalhs P, Greinix HT, Muller C. Hepatitis B virus clearance by transplantation of bone marrow from hepatitis B immunised donor. Lancet 1997;349:996-7. 14 66. Dhedin N, Douvin C, Kuentz M, Saint Marc MF, Reman O, Rieux C et al. Reverse seroconversion of hepatitis B after allogeneic bone marrow transplantation: a retrospective study of 37 patients with pretransplant antiHBs and anti-HBc. Transplantation 1998;66:616-9. 67. Li Volti S, Di Gregorio F, Romeo MA, Cannella A, Pizzarelli G, Sciacca A. Inmune status and the immune response to hepatitis B virus vaccine in thalassemic patients after allogeneic bone marrow transplantation. Bone Marrow Transplant 1997;19:157-60. 68. Méndez L, Campins M, Ramos P, Ferrer E. Vacunación frente a la hepatitis B y trasplante de progenitores hematopoyéticos. Med Clin (Barc) 2003;121:37-8. 69. Nagler A, Ilan Y, Adler R, Or R, Naparstek E, Shouval D. Successful immunization of autologous bone marrow transplantation recipients against hepatitis B virus by active vaccination. Bone Marrow Transplant 1995;15:475-8. 70. Sighal S, Mehta J. Reimmunisation after transplantation. In: Barret AJ, Treleaven J (eds). The Clinical Practice of Stem Cell Transplantation. Isis Medical Media: Oxford, UK 1998: p. 745-56. 71. Lau GK, Lok AS, Liang RH, Lai CL, Chiu EK, Lau YL, Lam SK. Clearance of hepatitis B surface antigen after bone marrow transplantation: role of adoptive immunity transfer. Hepatology 1997;25:1497-501. 72. Shouval D, Ilan Y. Immunization agaisnt hepatitis B through adoptive transfer of immunity. Interviology 1995;38:41-6. 73. American Academy of Pediatrics. Committee on Infectious Diseases. Immunization of Adolescents: Recommendations of the Advisory Committee on Immunization Practices, the American Academy of Pediatrics, the American Academy of Family Physicians, and the American Medical Association. Pediatrics 1997;99:479-88. 74. Salleras L, Bruguera M, Vidal J. Cambio del patrón epidemiológico de la hepatitis A en España. Med Clin (Barc) 1992;99:87-9. 75. Pérez Trallero E, Cilla G, Urbieta M. Falling incidence and prevalence of hepatitis A in northern Spain. Scand J Infect Dis 1994;26:133-6. 76. Shapiro CN, Margolis HS. Worldwide epidemiology of hepatitis A virus infection. J Hepatol 1993;18 (Supl 2):11-4. 77. Whimbey E, Elting LS, Couch R, Lo W, Williams L, Champlin R. Influenza A virus infections among hospitalized adult bone marrow transplant recipients. Bone Marrow Transplant 1994;13:437-40. 78. Ljungman P, Andersson J, Aschan J, Barkholt L, Ehrnst A, Johansson M et al. Influenza A in immunocompromised patients. Clin Infect Dis 1993;17:244-7. 79. Zambon M, Bull T, Sadler CJ, Goldman JM, Ward KN. Molecular epidemiology of two consecutive outbreaks of parainfluenza 3 in a bone marrow transplant unit. J Clin Microbiol 1998;36:2289-93. 80. Engelhard D, Nagler A, Hardan I, Morag A, Aker M, Baciu H et al. Antibody response to a two-dose regimen of influenza vaccine in allogeneic T cell-depleted and autologous BMT recipients. Bone Marrow Transplant 993;11:1-5. 81. Ljungman P. Immunization of transplant recipients. Bone Marrow Transplant 1999;23:635-6. 82. CDC. Prevention and control of influenza. Recommendations of the Advisory Committee on Immunization Practices. MMWR 1996;45:1-24. 83. CDC. Immunization of health-care workers: recommendations of the Advisory Committee on Immunization Practices (ACIP) and the Hospital Infection Control Practices Advisory Committee (HICPAC). MMWR 1997;46(RR-18):1-35. 84. Potter J, Scott D, Roberts M, Elder A, O’Donnell B, Knight P. Influenza vaccination of health care workers in long-term-care hospitals reduce the mortality of elderly patients. J Infect Dis 1997;175:1-6. 85. Leger CS, Nevill TJ. Hematopoietic stem cell transplantation: a primer for the primary care physician. CMAJ 2004;170:1569-77. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 15-18 CAPITULO 15 03/05/10 11:17 Página 15 Medicina Preventiva Capítulo 15 VACUNACIONES PARA ADULTOS CON INSUFICIENCIA RENAL CRÓNICA Y EN PROGRAMAS DE HEMODIÁLISIS J. M. Bayas1, M. Campins2 Servicio de Medicina Preventiva y Epidemiología. Hospital Clínic Barcelona. 2Servicio de Medicina Preventiva y Epidemiología. Hospital Universitari Vall d’Hebrón. 1 RIESGO DE PADECER DETERMINADAS ENFERMEDADES INMUNOPREVENIBLES O SUS COMPLICACIONES Los pacientes con una función renal limitada pueden tener mayor riesgo de padecer determinadas procesos infecciosos y mayores complicaciones. Algunos de estos procesos son prevenibles mediante vacunación. Idealmente, la vacunación debiera realizarse en los inicios del declive de la función renal y, por supuesto, antes del comienzo del tratamiento con diálisis (1). El principal motivo de la vacunación precoz es adelantarse a la aparición de posibles complicaciones, así como lograr una mejor respuesta por parte de un sistema inmune mejor conservado. El riesgo de padecer enfermedades prevenibles mediante vacunación varía ampliamente en función del grado de insuficiencia renal. Por un lado, porque la insuficiencia avanzada comporta un mayor grado de deficiencia inmunológica. Por otro, porque la mayor instrumentación médica (por ejemplo, la asociada a hemodiálisis) puede favorecer la exposición a determinadas infecciones (hepatitis B, etc). Hepatitis B La introducción de la hemodiálisis para el tratamiento de la insuficiencia renal crónica fue acompañado de brotes de ictericia en pacientes y en personal sanitario (2, 3). Aunque la mayoría de estas infecciones no eran graves, una buena proporción de ellas evolucionaba hacia la cronicidad. Pronto se pudo establecer que el virus de la hepatitis B (VHB), a menudo adquirido a través de transfusiones, se propagaba con facilidad en las unidades de hemodiálisis a otros pacientes y a los sanitarios. La mayoría de los brotes de hepatitis B en unidades de diálisis se relacionaban con diversas formas de contaminación cruzada a través de superficies de trabajo, instrumental o equipo contaminado, viales multidosis de medicación, medicamentos inyectables preparados en áreas de manipulación de muestras de sangre o personal sanitario que atendía simultáneamente a pacientes infectados y susceptibles (4-8). Diversas recomendaciones (de los Centers for Disease Control and Prevention y de otros organismos)(9) , consiguieron ya en la era prevacunal una drástica reducción del VHB. Las referidas recomendaciones incluían, entre otras, vigilancia serológica de pacientes y sanitarios, aislamiento de los pacientes HBsAg positivo en unidades específicas, equipos específicos para pacientes infectados, así como aspectos Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 relacionados con la limpieza, desinfección y esterilización (material, superficies, equipos, etc.) o el uso de guantes. Un ya clásico estudio de seguimiento de Alter (10) en EEUU halló una disminución en la prevalencia de HBsAg en pacientes en hemodiálisis desde 3% en 1977 hasta 0,5% en 1982. El mismo estudio encontró que la proporción de portadores de HBsAg en el personal sanitario se redujo durante el mismo periodo de 2,6% a 0,5%. Otros estudios mostraron también una notable disminución en la incidencia de infección por VHB entre los pacientes en hemodiálisis (11). Actualmente, el riesgo de infección por VHB en las unidades de hemodiálisis es bajo. Las causas fundamentales son las menores oportunidades de exposición a sangre contaminada gracias al empleo de eritropoyetina recombinante, la aplicación consecuente de las precauciones estándar (12) y la vacunación de sanitarios y pacientes. Todos estos factores han contribuido a la existencia de una menor prevalencia de infectados y, por tanto, a una menor probabilidad de contacto con las fuentes de infección. No obstante, existe un riego residual, vinculado a trasgresiones de las precauciones estándar o a otras causas, por lo que resulta recomendable iniciar la vacunación antes de que la indicación de hemodiálisis haya sido establecida. Gripe Las personas con patologías crónicas que requieren cuidados médicos continuados, como la insuficiencia renal en sus diversos grados, pueden tener mayor riesgo de complicaciones cuando sufren procesos de tipo infeccioso. La infección por virus de la gripe puede exacerbar estas patologías (13). Como ya fue comentado en el capítulo sobre “Vacunaciones para adultos inmunocompetentes que padecen enfermedades crónicas”, la infección gripal favorece, además, el desarrollo de neumonías bacterianas, fundamentalmente por microorganismos capsulados (Streptococcus pneumoniae y otros). Enfermedad neumocócica Las personas con enfermedades de base, incluidos los diversos grados de disfunción renal, pueden tener mayor riesgo de desarrollar enfermedades neumocócicas, padecer formas más graves y sufrir mayores complicaciones. Aunque no se dispone de ensayos clínicos controlados que hayan cuantificado este riesgo, se recomienda la vacunación antineumocócica de estos pacientes (14). 15 15-18 CAPITULO 15 03/05/10 11:17 Página 16 Medicina Preventiva BENEFICIOS POTENCIALES DE LA VACUNACIÓN Hepatitis B. Eficacia y efectividad de la vacunación La inmunogenicidad de la vacuna de la hepatitis B en pacientes en hemodiálisis es menor que en adultos inmunocompetentes. Con tres dosis de vacuna, la tasa de seroprotección (antiHBs ≥ 10 mUI/ml) es de aproximadamente un 64% (rango 34%–88%) (15-17). Con pautas de cuatro dosis se alcanza un 86% (rango 40%–98%) (15, 18, 19). La infección concurrente por virus de la hepatitis C (VHC) no interfiere demasiado en la respuesta a la vacunación, si bien algunos estudios han hallado títulos de antiHBs menores en paciente VHC positivo (20, 21). La respuesta a la vacunación antihepatítica B es mejor cuando la función renal está más conservada. Es decir, cuando todavía no se ha iniciado la hemodiálisis (1, 22). Ensayos clínicos controlados en pacientes en hemodiálisis han hallado una eficacia protectora situada entre 53% y 78% (23, 24). No se han comunicado casos de infección por VHB en pacientes vacunados que mantienen títulos de antiHBs por encima de 10 UI/ml, lo cual ha sido fehacientemente demostrado en el curso de brotes en unidades de hemodiálisis (4). Un estudio de casos y controles demostró una reducción del riesgo de infección por VHB del 70% en pacientes en hemodiálisis que habían sido vacunados (25). En la Tabla I se muestran las pautas de vacunación recomendadas en pacientes adultos con insuficiencia renal crónica. En personas con un estado inmunitario normal que han respondido a la serie vacunal primaria, la protección contra la hepatitis B persiste incluso cuando el título de antiHBs se hace indetectable (26). En los pacientes en hemodiálisis que responden a la primovacunación, la pérdida de antiHBs puede permitir un retorno a la susceptibilidad (27). Por este motivo se recomienda vigilar periódicamente (p. ej. anualmente) la presencia de antiHBs y administrar una dosis booster cuando el título caiga por debajo de 10 mUI/ml (15). Un pequeño porcentaje de personas con un estado inmunitario normal no responden a la serie vacunal primaria. Una segunda tanda permite obtener respuesta en aproximadamente el 50%-75% de los casos (28). En pacientes en hemodiálisis, la proporción de no respondedores es mayor y proporcional al tiempo de evolución de la enfermedad renal. Tabla I. Dosis y pautas de vacunación contra la hepatitis B en pacientes con insuficiencia renal crónica (ver texto) Vacuna Engerix-B® (GSK) Fendrix® (GSK) HBvaxpro® (SP-MSD) Prediálisis Hemodiálisis 20 μg de HBsAg 1 ml 0, 1 y 6 meses 40 μg de HBsAg 2 dosis de 1 ml 0, 1, 2 y 6 meses 20 μg de HBsAg 1 ml 0, 1, 2 y 6 meses 20 μg de HBsAg 1 ml 0, 1 y 6 meses 40 μg de HBsAg 2 dosis de 1 ml 0, 1, 2 y 6 meses GSK: Glaxo SmithKline. SP-MSD: Sanofi Pasteur - Merck Sharp & Dohme. 16 Una segunda tanda, con pauta de 3 ó 4 dosis, origina respuesta protectora en alrededor de un 50% de vacunados (15). La administración de más dosis en los no respondedores a esta segunda tanda vacunal no parece deparar ningún beneficio adicional y no se recomienda de modo rutinario. Desde hace unos pocos años se dispone de una nueva vacuna antihepatitis B adyuvada con AS04C (Fendrix®). Se trata de un novedoso sistema adyuvante que combina el clásico hidróxido de aluminio con un lipopolisacárido detoxificado de la pared bacteriana de la Salmonella Minnesota: el monofosforil lípido A (MPL). La singularidad de este sistema adyuvante es que posee un efecto inmunomodulador inducido mediante la activación de receptores celulares de la inmunidad innata, tipo-Toll 4 (TLR4) (29). Este sistema adyuvante es también empleado en la vacuna Cervarix® frente al cáncer de cuello de útero y sus lesiones precursoras, donde ha mostrado alta inmunogenicidad y protección cruzada contra genotipos virales no incluidos en la vacuna (30). Esta vacuna adyuvada con AS04C favorece la respuesta inmune y el mantenimiento de la protección en pacientes con insuficiencia renal (31, 32). Actualmente está autorizada para pacientes en prediálisis y en hemodiálisis de edad ≥ 15 años, con pauta de 4 dosis (0, 1, 2 y 6 meses). Gripe. Eficacia y efectividad de la vacunación Se dispone de escasa información sobre la efectividad de la vacunación antigripal en personas no ancianas con insuficiencia renal. Un estudio publicado en 2005, realizado en Holanda en pacientes menores de 65 años afectos de diversas patologías asociadas a mayor riesgo de infección gripal o sus consecuencias, halló una reducción en el número de ingresos hospitalarios del 87% (IC 95%= 39-97%), y del 78% (IC 95%= 39-92%) en la mortalidad por cualquier causa (33). Se estima que la efectividad de la vacunación antigripal en pacientes con insuficiencia renal y otras patologías crónicas es similar a la observada en personas de la misma edad pero sin comorbilidad (34). Enfermedad neumocócica. Eficacia y efectividad de la vacuna antineumocócica 23-valente En el capítulo sobre “Vacunaciones para adultos inmunocompetentes que padecen enfermedades crónicas” y en la Tabla I de ese capítulo, se recogen diversos estudios observacionales realizados en pacientes adultos con afecciones diversas. La mayor parte de ellos han hallado protección frente a la enfermedad invasora en pacientes inmunocompetentes. Los pacientes con insuficiencia renal pueden responder adecuadamente a las vacunas de polisacáridos en los estadios iniciales de la enfermedad. RECOMENDACIONES DE ORGANISMOS OFICIALES Hepatitis B. Recomendaciones Hay acuerdo generalizado entre diversos y numerosos organismos oficiales y sociedades científicas en recomendar la vacunación antihepatítica B a los pacientes en hemodiálisis y a los candidatos a ella. Entre muchas otras entidades, la vacunación ha sido recomendada por los Centers for Disease Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 15-18 CAPITULO 15 03/05/10 11:17 Página 17 Medicina Control and Prevention (15) de EEUU, el Department of Health del Reino Unido (35) o el Viral Hepatitis Prevention Board en Europa (36). Con el fin de favorecer una mejor respuesta y prevenir precozmente el riesgo de infección, la vacunación debe iniciarse en la fase temprana de la enfermedad renal. Tras la primovacunación debe comprobarse la respuesta (título de antiHBs≥ 10 mUI/ml). En los respondedores debe realizarse examen serológico periódicamente y administrar una dosis booster si el título desciende por debajo del nivel señalado. Los pacientes en programa de trasplante y los ya trasplantados deben ser asimismo vacunados si no lo han sido con anterioridad. Gripe. Recomendaciones Numerosos organismos, servicios de Salud Pública y sociedades científicas de diferentes países recomiendan la vacunación antigripal a niños y adultos afectos de patología renal crónica (37). En Europa, el estudio Venice realizado en colaboración con el European Centre for Disease Prevention and Control (ECDC) en 2007 (38) encontró que la vacunación antigripal en los pacientes con insuficiencia renal es recomendada en 27 de los 29 países analizados. Enfermedad neumocócica. Recomendaciones Numerosos organismos, servicios de Salud Pública y sociedades científicas de diferentes países (14, 39, 40) recomiendan la vacunación antineumocócica a niños y adultos afectos de patología renal crónica. Como ya fue señalado en el capítulo sobre “Vacunaciones para adultos inmunocompetentes que padecen enfermedades crónicas”, los Centers for Disease Control and Prevention han emitido directrices sobre el grado de evidencia epidemiológica en la recomendación de la vacunación y de la revacunación (14). La recomendación de vacunación antineumocócica en paciente con fracaso renal crónico o síndrome nefrótico se encuadra en la categoría C (la vacunación se justifica por el alto riesgo de la enfermedad y potencial beneficio, aunque la efectividad no haya sido probada). En pacientes adultos se recomienda una única revacunación a los 5 años de la primera. CONCLUSIONES La vacunación contra la hepatitis B en sujetos susceptibles debe realizarse tan pronto se inicia el deterioro de la función renal y antes del inicio de la hemodiálisis. La aplicación sistemática de esta estrategia hace virtualmente imposible la infección por VHB en estos pacientes. Al beneficio individual hay que añadir el colectivo, al prevenirse así brotes en las unidades de diálisis por la existencia de la inmunidad de grupo. La vacunación antineumocócica con las vacunas no conjugadas, actualmente disponibles, debe realizarse asimismo precozmente, por los potenciales beneficios que depara. La vacunación antigripal debe realizarse anualmente con las vacunas recomendadas por la OMS. Como con cualquier persona, sana o enferma, deben evaluarse otras posibles necesidades de vacunación (tétanosdifteria, sarampión–rubéola-parotiditis, varicela, etc.), para proceder en consecuencia. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva BIBLIOGRAFÍA 1. Seaworth B, Drucker J, Starling J, Drucker R, Stevens C, Hamilton J. Hepatitis B vaccine in patients with chronic renal failure before dialysis. J Infect Dis 1988;157:332-7. 2. Jones PO, Goldsmith HJ, Roberts C, Wright FK, Watson DC. Viral hepatitis. A staff hazard in dialysis units. Lancet 1967;i:835-40. 3. Eastwood JB, Curtis JR, Wing AJ, de Wardener HE. Hepatitis in a maintenance haemodialysis unit. Ann Intern Med 1968;69:59-66. 4. Centers for Disease Control and Prevention. Outbreaks of hepatitis B virus infection among hemodialyis patients—California, Nebraska, and Texas, 1994. MMWR 1996;45:285-9. 5. Snydman DR, Bryan JA, Macon EJ, Gregg MB. Hemodialysis-associated hepatitis: report of an epidemic with further evidence on mechanisms of transmission. Am J Epidemiol 1976;104:563-70. 6. Carl M, Francis DP, Maynard JE. A common-source outbreak of hepatitis B in a hemodialysis unit. Dialysis & Transplantation 1983;12:222-9. 7. Alter MJ, Ahtone J, Maynard JE. Hepatitis B virus transmission associated with a multipledose vial in a hemodialysis unit. Ann Intern Med 1983;99:330-3. 8. Niu MT, Penberthy LT, Alter MJ, Armstrong CW, Miller GB, Hadler SC. Hemodialysis-associated hepatitis B: report of an outbreak. Dialysis & Transplantation 1989;18:542-6. 9. CDC. Hepatitis: control measures for hepatitis B in dialysis centers. Atlanta, GA: US Department of Health, Education, and Welfare, Public Health Services, CDC, 1977. HEW publication no. (CDC) 78-8358 (Viral Hepatitis Investigations and Control Series). 10. Alter MJ, Favero MS, Maynard JE. Impact of infection control strategies on the incidence of dialysis-associated hepatitis in the United States. J Infect Dis 1986;153:1149-51. 11. Najem GR, Louria DB, Thind IS, et al. Control of hepatitis B infection: the role of surveillance and an isolation hemodialysis center. JAMA 1981;245:153-7. 12. Garner JS and the Hospital Infection Control Practices Advisory Committee. Guideline for isolation precautions in hospitals. Infect Control Hosp Epidemiol 1996;17:53-80. 13. Centers for Disease Control and Prevention. Prevention and control of influenza: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2005; 54 (No. RR-8). 14. Centers for Disease Control and Prevention. Prevention of pneumococcal disease: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1997;46(No. RR-8):1-25. 15. Centers for Disease Control and Prevention. Recommendations for preventing transmission of infections among chronic hemodialysis patients. MMWR 2001;50(RR-5):1-46. 16. Stevens CE, Alter HJ, Taylor PE, Zang EA, Harley EJ, Szmuness W, and the Dialysis Vaccine Trial Study Group. Hepatitis B vaccine in patients receiving hemodialysis: immunogenicity and efficacy. N Engl J Med 1984;311:496-501. 17. De Graeff PA, Dankert J, de Zeeuw D, Gips CH, van der Hem GK. Immune response to two different hepatitis B vaccines in haemodialysis patients: a 2-year follow-up. Nephron 1985;40:155-60. Carletti P, Bibiano L, Boggi R, et al. HBV infection in hemodialysis patients: monitoring and prevention. Nephron 1992;61:269-70. 18. Bruguera M, Cremades M, Mayor A, Sánchez Tapias JM, Rodés J. Immunogenicity of a recombinant hepatitis B vaccine in haemodialyisis patients. Postgrad Med J 1987;63(Supp 2):155–8. 19. Bruguera M, Rodicio JL, Alcazar JM, Oliver A, Del Rio G, Esteban-Mur R. Effects of different dose levels and vaccination schedules on immune response to a recombinant DNA hepatitis B vaccine in haemodialysis patients. Vaccine 1990;8(Suppl):S47–9. 20. Navarro JF, Teruel JL, Mateos ML, Marcen R, Ortuño J. Antibody level after hepatitis B vaccination in hemodialysis patients: influence of hepatitis C virus infection. Am J Nephrol 1996;16:95-7. 21. Cheng C-H, Huang C-C, Leu M-L, Chiang C-YF, Wu M-S, Lai PC. Hepatitis B vaccine in hemodialysis patients with hepatitis C viral infection. Vaccine 1997;15:1353-7. 22. Fraser GM, Ochana N, Fenyves D, et al. Increasing serum creatinine and age reduce the response to hepatitis B vaccine in renal failure patients. J Hepatol 1994;21:450-4. 17 15-18 CAPITULO 15 03/05/10 11:17 Página 18 Medicina Preventiva 23. Crosnier J, Jungers P, Couroucé A-M, et al. Randomised placebocontrolled trial of hepatitis B surface antigen vaccine in French haemodialysis units: II, haemodialysis patients. Lancet 1981;1:797-800. 24. Desmyter J, Colaert J, De Groote G, et al. Efficacy of heat-inactivated hepatitis B vaccine in haemodialysis patients and staff: double-blind placebo-controlled trial. Lancet 1983;2:1323-8. 25. Miller ER, Alter MJ, Tokars JI. Protective effect of hepatitis B vaccine in chronic hemodialysis patients. Am J Kidney Dis 1999;33:356-60. 26. Mahoney FJ, Stewart K, Hu H, Coleman P, Alter MJ. Progress toward the elimination of hepatitis B virus transmission among health care workers in the United States. Arch Intern Med 1997; 157:2601-5. 27. Stevens CE, Alter HJ, Taylor PE, Zang EA, Harley EJ, Szmuness W, and the Dialysis Vaccine Trial Study Group. Hepatitis B vaccine in patients receiving hemodialysis: immunogenicity and efficacy. N Engl J Med 1984;311:496-501. 28. Averhoff F, Mahoney F, Coleman P, Schatz G, Hurwitz E, Margolis H. Immunogenicity of hepatitis B vaccines: implications for persons at occupational risk of hepatitis B virus infection. Am J Prev Med 1998;15:1-8. 29. Giannini SL, Hanon E, Moris P, Van Mechelen M, Morel S, Dessy F et al. Enhanced humoral and memory B cellular immunity using HPV16/18 L1 VLP vaccine formulated with the MPL/aluminium salt combination (AS04) compared to aluminium salt only. Vaccine 2006; 24:5937-49. 30. Paavonen J, Naud P, Salmerón J, Wheeler CM, Chow SN, Apter D, et al. Efficacy of human papillomavirus (HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types (PATRICIA): final analysis of a double-blind, randomised study in young women. Lancet 2009;374:301-14. 18 31. Boland G, Beran J, Lievens M, Sasadeusz J, Dentico P, Nothdurft H, Zuckerman JN, Genton B, Steffen R, Loutan L, Van Hattum J, Stoffel M. Safety and immunogenicity profile of an experimental hepatitis B vaccine adjuvanted with AS04. Vaccine 2004;23:316-20. 32. Kong NC, Beran J, Kee SA, Miguel JL, Sánchez C, Bayas JM et al. A new adjuvant improves the immune response to hepatitis B vaccine in hemodialysis patients. Kidney Int 2008;73:856-62. 33. Hak E, Buskens E, van Essen GA, de Bakker DH, Grobbee DE, Tacken MA et al. Clinical effectiveness of influenza vaccination in persons younger than 65 years with high-risk medical conditions: the PRISMA study. Arch Intern 2005;165:274-280. 34. Fukuda K, Cox NJ, Bridges CB, Levandowski RA. Influenza Vacccine- Inactivated. In: Plotkin S, Orenstein WA, editors. Vaccines. Philadelphia, PA: Saunders, 2004; p. 339-70. 35. http://www.cmo.wales.gov.uk/content/work/communicabledisease/renal-dialysis-transplantation-e.pdf 36. Viral Hepatitis Prevention Board. Hepatitis B vaccination: How to reach risk groups. Viral Hepatitis Prevention Board meeting, Ghent, Belgium, March 15-16, 2001. Viral Hepatitis 2001; 10.1. 37. Centers for Disease Control and Prevention. Recommended Adult Immunization Schedule—United States, October 2004–September 2005. MMWR 2004;53:Q1-4. 38. National Seasonal Influenza Vaccination. Survey in Europe, 2007. Collaboration between VENICE project and ECDC. http://venice.cineca.org/Influenza Study Report v1.0.pdf 39. http://www.phac-aspc.gc.ca/publicat/ccdr-rmtc/04vol30/acs-dcc-4/index.html 40. http://www.who.int/vaccines-documents/PP-WER/wer7423.pdf Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 19-22 CAPITULO 16 03/05/10 11:21 Página 19 Medicina Preventiva Capítulo 16 VACUNACIONES PARA ADULTOS ASPLÉNICOS M. Campins1, J. M. Bayas2 1 Servicio de Medicina Preventiva y Epidemiología. Hospital Universitari Vall d’Hebrón. 2Servicio de Medicina Preventiva y Epidemiología. Hospital Clínic Barcelona. RIESGO DE PADECER DETERMINADAS ENFERMEDADES INMUNOPREVENIBLES O SUS COMPLICACIONES El bazo es un órgano del sistema reticuloendotelial, que contiene aproximadamente el 25% de la masa linfoidea total y gran número de macrófagos. Desempeña un papel importante en la defensa del huésped frente a la infección, al actuar como filtro de bacterias circulantes y de parásitos intracelulares, y facilitar la fagocitosis de bacterias capsuladas mediante su opsonización. En la Tabla I se indican las principales causas o enfermedades asociadas con asplenia. Las personas con asplenia anatómica o funcional son más susceptibles a padecer infecciones bacterianas graves, de letalidad elevada (1). Un subgrupo especial, lo constituyen los enfermos con drepanocitosis, cuya predisposición a las infecciones es elevada y se debe a varios factores (2): 1. Aumento del turnover de la médula ósea, a consecuencia de la anemia hemolítica crónica: riesgo de infecciones por parvovirus. 2. Disfunción y baja perfusión esplénica, con disminución de la capacidad de opsonización de bacterias capsuladas y parásitos intracelulares. Aunque en ausencia de bazo, el hígado puede realizar esta función; se requieren concentraciones elevadas de anticuerpos específicos circulantes y un sistema del complemento intacto. 3. Escasa perfusion ósea con predisposición a la isquemia y a los infartos óseos que dan lugar a un mayor riesgo de osteomielitis. Tabla I. Causas de asplenia 1. Congénita: síndrome de Ivemark. 2. Posquirúrgica: traumatismos, tumores, enfermedades hematológicas. 3. Funcional (hipoesplenismo funcional): – Drepanocitosis. – Talasemia mayor. – Esferocitosis. – Púrpura trombocitopénica idiopática. – Anemia hemolítica autoinmune. – linfoproliferativa: linfomas, leucemias crónicas... – Lipidosis. – Hipertensión portal. – Trasplante progenitores hematopoyéticos. – Miscelánea: enfermedad celíaca, enfermedad inflamatoria intestinal, dermatitis herpetiforme. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 4. Necesidad de transfusiones frecuentes de sangre, lo que aumenta el riesgo de infecciones víricas de transmisión sérica, como la hepatitis B o la hepatitis C. 5. Sobrecarga de hierro debido a las transfusiones, que aumenta la susceptibilidad a las infecciones por Yersinia enterocolitica. S. pneumoniae sigue siendo el agente causal más frecuente de sepsis y de meningitis en los pacientes con asplenia anatómica o funcional, a pesar de la disponibilidad de vacunas efectivas para la prevención de las formas invasoras de esta infección y de la profilaxis antibiótica sistemática (3). Los serotipos más frecuentes son el 6, 14, 18, 19 y 23, que son los responsables del 74% de las bacteriemias en estos enfermos en los EE.UU. (4). Entre el 50-90% de los episodios de sepsis fulminante (overwhelming postsplenectomy infection) están ocasionados por este microorganismo y su letalidad es superior al 50% (4, 5). Por el contrario, el riesgo de sepsis y meningitis por Haemophilus influenzae tipo b (6-8% del total) ha disminuido considerablemente en muchos países gracias a la inmunización sistemática y a la reducción secundaria de la circulación de este microorganismo en la población. La frecuencia de infección por Neisseria meningitidis no supera el 3-4% (5). La frecuencia real de sepsis en estos enfermos no se conoce con exactitud, debido a la ausencia de estudios de seguimiento adecuados. Sin embargo, el riesgo de infección probablemente persiste durante toda la vida, y se estima en una frecuencia alrededor del 5% (6). La mayoría de infecciones ocurren en los dos primeros años después de la esplenectomía y hasta un tercio se manifiestan en los 5 años siguientes, aunque se han descrito casos de sepsis fulminante hasta 20 años después (4). Este riesgo es superior en los pacientes con enfermedades de base hematológicas o inmunológicas que en los traumáticos, con cifras de incidencia según diferentes estudios de 0,7 a 4 casos por 1.000 pacientes-año en los primeros y de 0,3 a 2,7 por 1.000 en los últimos (7-9). En los pacientes afectos de drepanocitosis, el riesgo es superior y de aparición muy precoz (a partir de los 3 meses de vida); la incidencia de sepsis oscila entre 1,6 y 9,7 por 100 personas-año, dependiendo de la edad (5,8-8 en niños menores de 5 años, 1,1 en los de 5 a 9 años y 0,6 en los mayores de 10 años) (10). En los últimos años, diversas publicaciones han llamado la atención sobre la relevancia de las complicaciones infecciosas en estos enfermos y la importancia de las medidas preventivas, que incluyen la profilaxis antibiótica, la inmunización y la educación sanitaria de los pacientes. Sin embargo, y a pesar de que muchas de estas infecciones pueden prevenirse de forma 19 19-22 CAPITULO 16 11/05/10 16:40 Página 20 Medicina Preventiva eficaz mediante la vacunación, y de que esta estrategia preventiva es aceptada de forma unánime por los comités internacionales de expertos (11-15), las coberturas vacunales siguen siendo bajas, como muestran datos de diferentes estudios publicados (Tabla II). En España, Galán y Oliva han realizado una revisión de la profilaxis antiinfecciosa en pacientes esplenectomizados de Menorca en el periodo de 1978 a 2000 y han observado que sólo el 62,7% han recibido la vacuna antineumocócica, el 32,8% la anti-Hib y el 7,5% la antimeningocócica (16). Estudios similares realizados en diversas regiones de Europa, Estados Unidos, Canadá y Australia detectan resultados similares, con porcentajes que oscilan entre el 32 y el 74%, con tendencia a incrementarse en los últimos años, aunque la mayoría de pacientes recibieron las vacunas después de la esplenectomía y sólo en el 15% de los casos constaba esta información en las historias clínicas (17-22). Waghorn ha analizado el cumplimiento de las medidas preventivas en una serie de 77 pacientes con asplenia que padecieron una sepsis fulminante, con una mortalidad del 50%, y observa que sólo el 31% había recibido la vacuna antineumocócica (4). Según datos de los pacientes esplenectomizados entre 1995 y 2002 en un hospital de tercer nivel de Barcelona, la cobertura para la vacuna antineumocócica fue del 63,6% y las de Hib y antimeningocócica de sólo el 19,6% y el 11,3%, respectivamente (Campins, comunicación personal). Es necesario, por tanto, poner en marcha programas vacunales específicos para estos pacientes que incluyan registros informatizados de las vacunas administradas, listas de comprobación (checklist) y sistemas de alerta, tanto para el profesional como para el propio paciente, para conseguir incrementar las coberturas actuales. BENEFICIOS POTENCIALES DE LA VACUNACIÓN Aunque existen pocos estudios controlados que demuestren la eficacia de las vacunas indicadas en estos enfermos, la capacidad de un paciente asplénico de desarrollar una adecuada respuesta de anticuerpos tras la administración de una vacuna se relaciona más con la edad en el momento de la esplenectomía y con la presencia de enfermedades inmunosupresoras, que con la asplenia por sí misma. En los pacientes esplenectomizados a causa de un traumatismo, la inmunogenicidad vacunal es similar a la observada en controles sanos (23). Sin embargo, Molrine y colaboradores sugieren que los pacientes con asplenia presentan una respuesta posvacunal de tipo IgM inferior a la de los controles sanos, hecho observado tanto con la vacuna antineumocócica como con la anti-Hib (24). Además, las concentraciones de anticuerpos con capacidad opsonizante son inferiores en los vacunados en los 7 primeros días postesplenectomía que en los inmunizados 14 días después (23). Dos estudios realizados en Dinamarca, uno que incluye 280 niños y otro 200 adultos, sugieren porcentajes elevados de efectividad de la vacuna antineumocócica 23-valente con ausencia de casos de sepsis fulminante; los 4 casos de sepsis neumocócica que se produjeron en un periodo de seguimiento de 13 años fueron debidos a serotipos no incluidos en la vacuna (25, 26). Un estudio más reciente, realizado también en Dinamarca, en una cohorte de 561 pacientes esplenectomizados entre 1984 y 1993, muestra también una reducción significativa del riesgo de bacteriemia de cualquier etiología en los vacunados (efectividad: 75%; IC95%: 37-90) (27). Butler y colaboradores han sugerido que la efectividad de esta vacuna es superior en los enfermos con asplenia (efectividad: 77%; IC95%: 14-95) que en los afectos de otras enfermedades crónicas en las que está recomendada la inmunización (28). En la Tabla III se resumen los estudios de efectividad de la vacunación antineumocócica publicados hasta estos momentos. La disponibilidad de las vacunas conjugadas, de mayor inmunogenicidad y eficacia, puede representar un paso notable en la prevención de estas infecciones en los enfermos con asplenia. Un trabajo reciente evalúa la seguridad e inmunogenicidad de la vacuna antineumocócica conjugada 7-valente y de la revacunación con vacuna 23-valente en niños con drepanocitosis comparadas con las observadas en niños sanos y no detecta diferencias significativas en la respuesta entre ambas cohortes de niños, con un incremento importante y significativo de las concentraciones de anticuerpos frente a los serotipos incluidos en la vacuna 7-valente después de la Tabla II. Principales estudios sobre coberturas vacunales en esplenectomizados Cobertura vacunal (%) Autor País Año Neumocócica Anti-Hib Meningocócica Galán España 1978-2000 62,7 32,8 7,5 Kyaw Escocia 1988-98 88 70 1 Kind EE. UU. 1988-91 73,3 – – Brigden Canadá 2000 68 – – Siddins Australia 1990 60 – – Ejstrud Dinamarca 1984-93 62 – – Kinnersley Inglaterra 1975-90 16 – – 1986-90 35,5 – – 1995-02 63,6 19,6 11,3 Campins 20 España Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 19-22 CAPITULO 16 03/05/10 11:21 Página 21 Medicina Preventiva Tabla III. Estudios de efectividad de la vacunación antineumocócica en pacientes con asplenia Autor (país, año) Tipo de estudio Población (N) Vacuna Efectividad % (IC 95%) Konradsen et al (Dinamarca, 1991) Cohortes Niños <15 a. (280) 23-v No calculada Butler et al (EE. UU., 1993) Caso-control Adultos (N) 23-v 77% (14-95) Abilgaard et al (Dinamarca, 1994) Cohortes Adultos (200) 23-v No calculada Ejstrud et al (Dinamarca, 2000) Cohortes Todas las edades (561) 23-v 75%(37-90) revacunación con 23-valente (29). Vernacchio et al observan resultados similares en un grupo de pacientes de entre 4 y 30 años, con concentraciones superiores de anticuerpos en los primovacunados con 7-valente y revacunados con 23-valente que en aquellos que sólo habían recibido vacuna no conjugada (30). Según un ensayo clínico reciente, la revacunación con vacuna conjugada heptavelente después de un intervalo mínimo de 3 años tras la primovacunación con vacuna polisacarídica 23-valente, induce una respuesta significativamente superior (31). El estudio que incluye un mayor número de pacientes adultos con asplenia inmunizados con vacuna conjugada es el realizado por Stanford et al (32) con una buena inmunogenicidad y seguridad. Se requieren, sin embargo, más estudios que evalúen la respuesta y seguridad de la vacuna antineumocócica 7-valente en pacientes primovacunados con 23-valente, la persistencia en el tiempo de concentraciones adecuadas de anticuerpos, así como la capacidad de generar memoria inmunitaria para determinar la necesidad y el momento óptimo de administración de dosis de recuerdo de vacuna 23-valente en estos enfermos En relación a las vacunas antimeningocócicas, se dispone de un único estudio de inmunogenicidad de la vacuna C conjugada en pacientes con asplenia, con resultados comparables a los obtenidos en personas sanas (33). RECOMENDACIONES DE ORGANISMOS OFICIALES Se han publicado dos guías de consenso internacionales para la inmunización de estos pacientes: • Guía para la prevención de las infecciones en pacientes con asplenia anatómica o funcional y grado de evidencia de las recomendaciones (Working Party of the British Committee for Standards in Haematology Clinical Haematology Task Force) (11, 12). • Protocolo de inmunizaciones y profilaxis antinfecciosa en las personas con drepanocitosis (American Academy of Pediatrics) (13). Las recomendaciones vacunales son las siguientes: 1. Vacunación antineumocócica (evidencia A, B): en adultos y niños mayores de 5 años, la vacuna indicada es la polisacarídica no conjugada 23-valente. En niños menores de esta edad se usará la vacuna conjugada heptavalente con revacunación a partir de los 2 años de edad con vacuna 23-valente. Los esquemas recomendados son los siguientes: • Si el paciente se va a someter o se ha sometido a esplenectomía quirúrgica, vacunar en los 15 días previos o lo antes posible después de la intervención, y siempre antes del alta hospitalaria. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 • Si el paciente está recibiendo tratamiento inmunosupresor, esperar hasta los 6 meses de su finalización y realizar profilaxis con penicilina oral durante este periodo. • Revacunación con vacuna 23-valente a los 5 años de la primera dosis, o a los 3 años en los pacientes con enfermedades inmunosupresoras o con drepanocitosis. 2. Vacunación frente a Haemophilus influenzae tipo b (evidencia A, B): aunque es una vacuna sistemática en la infancia, indicada en todos los niños menores de 5 años, las personas con asplenia mayores de esta edad no vacunadas previamente, deberán recibir una dosis de vacuna conjugada anti-Hib. 3. Vacunación antimeningocócica (evidencia B): en España, la vacuna antimeningocócica C conjugada es sistemática en la infancia. Las personas con asplenia no vacunadas, independientemente de su edad, deberán recibir esta vacuna. La revacunación no se recomienda por el momento. 4. Vacunación antigripal (evidencia B): se recomienda la vacunación anual para disminuir el riesgo de infecciones bacterianas secundarias. En general, la asplenia per se no contraindica la administración de ninguna vacuna, ni inactivada ni atenuada. La reactogenicidad vacunal es comparable a la observada en personas sanas. CONCLUSIONES Las personas con asplenia anatómica o funcional tienen un riesgo elevado de padecer infecciones por bacterias capsuladas, de elevada letalidad. Las medidas de control más importantes para la prevención de las infecciones en estos pacientes son la vacunación, la profilaxis antibiótica y la educación sanitaria. La evidencia científica y los comités de consenso nacionales e internacionales recomiendan la vacunación antineumocócica, anti-Hib y antimeningocócica en los pacientes con asplenia. La vacunación antigripal anual es también una medida adicional indicada. Se requieren programas vacunales específicos y estrategias de inmunización para lograr incrementar las coberturas actuales en estos enfermos. BIBLIOGRAFÍA 1. Bisharat N, Omari H, Lavi I, Raz R. Risk of infection and death among post-splenectomy patients. J Infect 2001;43:182-6. 2. Wing-Yen Wong. Prevention and management of infection in children with sickle cell anemia. Pediatr Drugs 2001;3:793-801. 3. Jenks PJ, Jones E. Infections in asplenic patients. Clin Microbiol Infect 1996; 1:266-272. 21 19-22 CAPITULO 16 03/05/10 11:21 Página 22 Medicina Preventiva 4. Waghorn DJ. Overwhelming infection in asplenic patients: current best practice preventive measures are not being followed. J Clin Pathol 2001;54:214-8. 5. Holdsworth RJ, Irving AD, Cuschieri A. Postsplenectomy sepsis and its mortality rate: actual versus perceived risks. Br J Surg 1991;78:1031-8. 6. Lynch AM, Kapila R. Overwhelming postsplenectomy infection. Infect Dis Clin North Am 1996;10:693-707. 7. Styrt BA. Risk s of infection and protective strategies for the asplenic patient. Infect Dis Clin Pract 1996;5:94-100. 8. Aavistland P, Froholm LO, Hoiby EA, Lystad A. Risk of pneumococcal disease in individuals without a spleen. Lancet 1994;344:1504. 9. Cullingford GL, Watkins DN, Watts AD, Mallon DF. Severe late postsplenectomy infection. Br J Surg 1991;78:716-21. 10. Overturf GD. Infections and immunizations of children with sickle cell disease. Adv Pediatr infect Dis 1999;14:191-218. 11. Working Party of the British Committee for Standards in Haematology Clinical Haematology Task Force. Guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. BMJ 1996;312:430-4. 12. Davies JM, Barnes R, Milligan D. British Committee for Standards in Haematology. Working Party of the Haematology/Oncology Task Force. Update of guidelines for the prevention and treatment of infection in patients with an absent or dysfunctional spleen. Clin Med 2002;2:440-3. 13. American Academy of Pediatrics. Health supervision for children with sickle cell disease. Pediatrics 2002;109:526-35. 14. Davidson RN, Wall RA. Prevention and management of infections in patients without a spleen. Clin Microbiol Infect 2001;7:657-60. 15. Price VE, Blanchette VS, Ford-Jones EL. The prevention and management of infections in children with asplenia or hyposplenia. Infect Dis Clin North Am 2007;21:697-710. 16. Galán P, Oliva E. Revisión de la profilaxis infecciosa en pacientes esplenectomizados en la isla de Menorca. Med Clin (Barc) 2001;117:771-2. 17. Ejstrud P, Hansen JB, Andreasen DA. Prophylaxis against pneumococcal infection after splenectomy: a challenge for hospitals and primary care. Eur J Surg 1997;163:733-8. 18. Kind EA, Craft C, Fowles JB et al. Pneumococcal vaccine administration associated with splenectomy: missed opportunities. Am J Infect Control 1998;26:418-22. 19. Siddins M, downie J, Wise K, O’Reilly M. Prophylaxis against postsplenectomy pneumococcal infection. Austr N Z surg 1990;60:183-7. 22 20. Brigden ML, Pattullo A, Brown G. Pneumococcal vaccine administration associated with splenectomy: the need for improved education, documentation, and the use of a practical checklist. Am J Hematol 2000;65:25-9. 21. Kyaw MH, Holmes EM, Chalmers J, Jones IG, Campbell H. A survey of vaccine coverage and antibiotic prophylaxis in splenectomised patients in Scotland. J Clin Pathol 2002;55:472-4. 22. Kinnnersley P, Wilkinson CE, Srinivasan J. Pneumococcal vaccination after splenectomy: survey of hospital and primary care records. BMJ 1993;307:1398-9. 23. Shatz DV, Romero-Steiner S, Elie CM, Holder PF, Carlone GM. Antibody responses in postsplenectomy trauma patients receiving the 23- postoperatively. J Trauma 2002;53:1037-42. 24. Molrine DC, Siber GR, Samra Y, et al. Normal IgG and impaired IgM responses to polysaccharide vaccines in asplenic patients. J Infect Dis 1999;179:513-7. 25. Konradsen HB, Henrichsen J. Pneumococcal infections in splenectomized children are preventable. Acta Pediatr Scan 1991;80:423-7. 26. Abilgaard N, Nielsen JL. Pneumococcal septicemia and meningitis in vaccinated splenectomised adult patients. Scan J Infect Dis 1994;26:615-7. 27. Ejstrud P, Kristensen B, Bach Hansen J, Meldgaard K, Schonheyder HC, Sorensen HT. Risk and patterns of bacteraemia after splenectomy: a population-based study. Scand J Infect Dis 2000;32:521-5. 28. Butler JC, Breiman RF, Campbell JF, Lipman HB, Broome CV, Facklam RR. Pneumococcal polysaccharide vaccine efficacy. An evaluation of current recommendations. JAMA 1993;270:1826-31. 29. O’Brien KL, Swift AJ, Winkelstein JA et al. Safety and immunogenicity of heptavalent pneumococcal vaccine conjugated to CRM197 among infants with sickle cell disease. Pediatrics 2000;106;965-72. 30. Vernacchio L, Neufeld EJ, MacDonald K et al. Combined schedule of 7valent pneumococcal conjugate vaccine followed by 23-valent pneumococcal vaccine in children and young adults with sickle cell disease. J Pediatr 1998;133:275-8. 31. Smets F, Bourgois A, Vermylen C, Brichard B, Slamuylders P, Leyman S et al. Randomised revaccination with pneumococcal polysaccharide or conjugate vaccine in asplenic children previously vaccinated with polysaccharide vaccine. Vaccine 2007;25:5278-82. 32. Stanford E, Print F, Falconer M, Lamden K, Ghebrenhewet S, Phin N et al. Immune response to pneumococcal conjugate vaccination in asplenic individuals. Hum Vacc 2009;5:85-91. 33. Balmer P, Falconer M, McDonald P, Andrews N, Fuller E, Riley C. Immune response to meningococcal serogroup C vaccine in asplenic individuals. Infect Immun 2004;72:332-7. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 23-25 CAPITULO 17 11/05/10 16:42 Página 23 Medicina Preventiva Capítulo 17 VACUNACIONES EN PACIENTES INFECTADOS POR EL VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) M. C. Sáenz, A. Gil, P. Carrasco Universidad Rey Juan Carlos. Hospital Clínico. Salamanca RIESGO DE PADECER DETERMINADAS ENFERMEDADES INMUNOPREVENIBLES O SUS COMPLICACIONES A finales del año 2007, el número estimado de personas que vivían con el virus de la inmunodeficiencia humana (VIH) en todo el mundo era de 33,2 millones. Cada día, más de 6.800 personas contraen la infección por el VIH y más de 5.700 fallecen a causa del SIDA, en su mayoría por un acceso deficiente a servicios de prevención y tratamiento. La pandemia de VIH sigue siendo la más grave de las enfermedades infecciosas a las que se enfrenta la salud pública (1). La infección por VIH sigue siendo un problema de salud pública relevante en nuestro país. Desde el inicio de la epidemia en España se han notificado un total de 76.386 casos de SIDA. Tras alcanzar su nivel más alto a mediados de la década de los 90, el número de casos notificados de SIDA ha experimentado un progresivo declive. En el año 2007 se notificaron 1.176 casos diagnosticados. A pesar del marcado descenso de la incidencia de SIDA en España desde la extensión de los nuevos tratamientos antirretrovirales, el nuestro sigue siendo uno de los países con mayor incidencia de SIDA en Europa Occidental (2). En el año 2006 se produjeron en España un total de 371.478 fallecimientos de los cuales 1.315 (3,5 por 1000) fueron por VIH/SIDA. De éstos, 1.036 (78,8%) se produjeron en hombres y 279 (21,2%) en mujeres. La tasa de mortalidad global por VIH/SIDA fue de 3,01 por 100.000 habitantes (3). Hay otros datos epidemiológicos importantes, como son los 20.000 ingresos hospitalarios anuales que produce la enfermedad, o el coste que supuso la utilización de antirretrovirales en el año 2000, que fue de 50 mil millones de las antiguas pesetas. A pesar de todo esto, en España actualmente los niveles de transmisión del VIH son mucho menores que en épocas pasadas, aunque la transmisión sexual sigue siendo elevada, ha habido un descenso importante de la incidencia y mortalidad por SIDA y una estabilización del número de personas vivas infectadas y además las infecciones por VIH no diagnosticadas impiden una mayor efectividad de la terapia actual. A la vista de estos datos, la lucha contra el VIH tiene que estar permanentemente activa y en ella la vigilancia epidemiológica va a ser clave teniendo una función vital en el apoyo a las actividades de lucha contra el VIH/SIDA como son las Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 intervenciones de prevención y la planificación de recursos asistenciales y sociales, lo que permite priorizar estrategias de actuación de acuerdo a la realidad y necesidades de cada lugar, conducir de forma eficiente los recursos limitados existentes y evaluar los resultados obtenidos con las intervenciones. Una de estas medidas va a ser la vacunación, que va a jugar un papel esencial para evitar la aparición de enfermedades, la progresión de otras y el mantenimiento de un estado de salud lo más saludable posible en estos pacientes. En este contexto conviene destacar que el hecho de ser portador del VIH no supone una contraindicación para la vacunación, si bien hay que tener en cuenta ciertas consideraciones. Estos pacientes, debido al deterioro de su función inmune, tienen baja respuesta inmunológica tras la administración de los preparados vacunales, por ello una vacunación temprana adquiere gran relevancia en estos enfermos, sobre todo teniendo en cuenta que una de las complicaciones más comunes de los pacientes VIH + son los procesos infecciosos. BENEFICIOS POTENCIALES DE LA VACUNACIÓN Las vacunas atenuadas están generalmente contraindicadas, a excepción de la vacuna triple vírica, ya que el riesgo de sufrir complicaciones debidas al sarampión es superior al de la inmunización (4-7). Según las últimas recomendaciones del CDC’s Advisory Committee on Immunization Practices (ACIP), solo se administraría 1 ó 2 dosis de la vacuna a personas infectadas con un número de linfocitos CD4 ≥ 200 cel/μL. En lo relativo a la vacuna frente a varicela, actualmente estaría contraindicada solamente en aquellos pacientes con un número de linfocitos CD4 <200 cel/μL (7). Aunque la tuberculosis sea una enfermedad frecuente en estas personas, no está indicada en ningún caso la vacuna BCG. En general, el resto de las vacunas vivas (fiebre tifoidea, fiebre amarilla, polio…) están contraindicadas. Conviene destacar para la vacunación frente a polio, que todos los adultos que están sin vacunar o cuyo estado de vacunación no está documentado, incluidas las personas con VIH, deben recibir una serie primaria de vacunación con VPI; sobre todo, aquellas personas que convivan con pacientes VIH+ deberán ser vacunadas con la vacuna de polio inactivada (VPI) (5, 6, 8). 23 23-25 CAPITULO 17 03/05/10 11:24 Página 24 Medicina Preventiva En cuanto a la administración de vacunas inactivadas, podemos señalar que son generalmente seguras y beneficiosas para este tipo de pacientes (6, 7, 9). Por las propias características de la vacuna del tétanos, difteria y tos ferina acelular (Td/Tdap), al ser inactivada y seguramente inocua, podría recomendarse su administración tanto en VIH sintomáticos como asintomáticos (7). Los adultos que no puedan comprobar que han recibido la serie completa de la vacunación primaria con toxoides diftérico y tetánico o que no la han completado, deben comenzar a recibir la serie primaria o completarla. La serie primaria para adultos abarca 3 dosis de vacunas (0,1 y 6-12 meses), la primera dosis preferiblemente con Tdap. Sustituya con una dosis única de Tdap la vacuna de refuerzo de Td; después administre refuerzos con la Td cada 10 años. La gripe puede causar graves complicaciones en los individuos infectados por el VIH, incrementándose el número de hospitalizaciones y la mortalidad. Diversos estudios señalan que la vacuna antigripal, aunque no induce cambios significativos en la respuesta inmunológica, es bien tolerada y puede ser beneficiosa para muchos pacientes afectados por la enfermedad, recomendando su vacunación (10, 11). Se recomienda una dosis anual. La elevada incidencia de infecciones ocasionada por Streptococcus pneumonie entre los VIH+ y los riesgos asociados a las mismas hacen recomendable la protección frente al la neumonía en estos pacientes (12). Recientes investigaciones sobre la experiencia clínica y la efectividad de la vacuna antineumocócica polisacarídica 23-valente en individuos VIH+ realizadas en distintas poblaciones y bajo la administración de terapia antirretroviral intensa, recomiendan la vacunación con dicha vacuna para reducir el riesgo de infección (13, 14). De hecho las indicaciones del ACIP recomiendan vacunar tan pronto como sea posible después de un diagnóstico de VIH (7). Los pacientes con VIH presentan un elevado riesgo frente a la enfermedad meningocócica. No existen muchos datos publicados sobre la seguridad y efectividad de las vacunas antimeningocócicas en adultos infectados con VIH. La vacuna antimeningococo C o la meningocócica cuatrivalente ACYW-135 forma parte de los calendarios vacunales en los países desarrollados. En los adultos jóvenes (<18 -25 años) que no han sido previamente vacunados, estaría recomendada la vacunación, incluidos los individuos infectados por VIH (15). Es frecuente la infección producida por el VHB entre los afectados por el VIH, debido a que comparten vías de transmisión común. En estos pacientes, la replicación del virus es mayor y la tendencia a la cronificación de la Hepatitis B es más elevada. Hay que indicar también que los pacientes con bajo recuento de linfocitos CD4 presentan baja respuesta tras la administración de la vacuna frente a hepatitis B (16). Se recomienda la vacunación rutinaria con pautas 0,1 y 6 meses. Considerar un booster cuando la concentración de anti-HBs sea < 10mlU/ml (6). Sin embargo, la respuesta inmunológica tras la administración de la vacuna frente a Hepatitis A, es buena apareciendo títulos de anticuerpos protectores en un porcentaje elevados en pacientes VIH+ (17). Se administrará con pauta de 2 dosis. Su eficacia protectora posiblemente es para toda la vida, aunque se considera la revacunación cuando los CD4 sean >500 células/mm (3, 6, 7). Se recomienda la administración de la vacuna contra el virus del papiloma humano o VPH a todas las mujeres entre los 11 y 26 años de edad (se puede aplicar desde los 9 años) que no hayan recibido toda la serie de vacunas. La serie completa comprende 3 dosis. La segunda dosis debe administrarse 2 meses después de la primera dosis; la tercera dosis debe administrarse 6 meses después de la primera dosis (7). En la Tabla I se muestran las pautas vacunales de las vacunas recomendadas en los pacientes adultos VIH+. No podemos olvidar que el grado de inmunocompromiso de cada paciente individual determinará en gran medida la respuesta a la vacunación. Pero siempre hay que tener en cuenta en estos pacientes una serie de riesgos que comienzan en la propia vacunación y acaban en las complicaciones derivadas de las enfermedades (4). Tabla I. Pauta vacunal para las vacunas inactivadas recomendadas en los adultos con infección por VIH Pauta vacunal Vacunas inactivadas Número de linfocitos T CD4+ ≥ 200 células/μL <200 células/μL Tétanos, difteria, tos ferina (Td/Tdap) Sustituya con una dosis única de Tdap la vacuna de refuerzo de Td; después administre refuerzos con la Td cada 10 años. Vacuna antigripal 1 dosis TIV anualmente Vacuna antineumocócica polisacarídica 1 dosis anualmente (revacunar a los 5 años) Vacuna antimeningococo C o cuatrivalente ACYW-135 1 única dosis Hepatitis B 3 dosis (0,1 y 6 meses) Hepatitis A 2 dosis (0 y 6 meses) Virus del papiloma humano (HPV) 3 dosis a mujeres entre 11 y 26 años de edad 24 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 23-25 CAPITULO 17 03/05/10 11:24 Página 25 Medicina RECOMENDACIONES DE ORGANISMOS OFICIALES Las recomendaciones para la vacunación en personas infectadas por el VIH se basan en las características especiales que condicionan su respuesta a las vacunas. Desde organismos como el CDC’s Advisory Committee on Immunization Practices (ACIP) y el Ministerio de Sanidad y Consumo no se recomienda la administración de vacunas vivas en estos pacientes (18). En el caso de la vacuna triple vírica, debido a la baja incidencia de la enfermedad y el nivel de anticuerpos protectores en la población adulta, la persona VIH asintomática y sin evidencias de inmunosupresión grave, puede ser vacunada. La vacuna frente a varicela estaría contraindicada solamente en aquellos pacientes con un número de linfocitos CD4 <200 cel/μL (7). Se recomiendan las principales vacunas inactivadas mostradas en la Tabla I. CONCLUSIONES Destacamos que el hecho de ser portador del VIH no supone una contraindicación para la vacunación, aunque debemos considerar el grado de inmunocompromiso de cada paciente que determinará su respuesta a la vacuna. Las vacunas vivas, a excepción de la triple vírica, están contraindicadas, pero las vacunas inactivadas son generalmente seguras y beneficiosas para este tipo de pacientes. BIBLIOGRAFÍA 1. UNAID. The Joint United Nations Programme on HIV/AIDS. Situación de la epidemia de Sida Informe anual del ONUSIDA 2007. Disponible en http://data.unaids.org/pub/Report/2008/jc1535_annual_report07_es.pdf 2. Ministerio de Sanidad y Consumo. Instituto de Salud Carlos III. Vigilancia epidemiológica del SIDA en España Registro nacional de casos de SIDA actualización a 30 de junio de 2008. Informe semestral nº 1, año 2008 Registros autonómicos de casos de SIDA. Centro Nacional de Epidemiología. http://www.isciii.es/htdocs/centros/epidemiologia/pdf/SPNS_Informe_semestral.pdf 3. Ministerio de Sanidad y Consumo. Instituto de Salud Carlos III. Mortalildad por VIH/SIDA en España. Año 2006. Evolución 1981-2006. Disponible http://www.isciii.es/htdocs/pdf/mortalidad.pdf 4. Moss WJ, Halsey NA. Vaccination of Human Immunodeficiency VirusInfected Persons. En: Plotkin-Orenstein. Vaccines, Fourth edition. Philadelphia, Pennsylvania Saunders, 2004. p. 169-178. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 5. Pancharoen C, Ananworanich J, Yhisyakorn U. Immunization for persons infected with human immunodeficiency virus. Curr HIV Res 2004;2:293-9. 6. Rivas P, Herrero MD, Puente S, Ramírez-Olivencia G, Soriano. Immunizations in HIV-Infected Adults. AIDS Rew 2007;9:173-87. 7. Centers for Disease Control and Prevention. Recommended Adult Immunization Schedule United States, 2009. MMWR 2008;57(53). 8. Centers for Disease Control and Prevention. Polyomielitis prevention in the United States. Updates Recommendations of the Advisory Committee on Immunization practices (ACIP). MMWR 2000;49(RR05);1-22. 9. De Juanes JR, Arrazola MP. Vacunaciones en pacientes inmunodeprimidos. En: Salleras L, editor. Vacunaciones Preventivas. Principios y aplicaciones. 2ª ed. Barcelona: Masson; 2003. p. 877-87. 10. Zanetti AR, Amendola A, Besana S, Boschini A, Tanzi E. Safety and immunogenicity of influenza vaccination in individuals infected with HIV. Vaccine 2002; 20 Suppl 5:B29-32. 11. Fiore AE, Shay DK, Broder K, Iskander JK, Uyeki TM, Mootrey G, Bresee JS, Cox NS. Centers for Disease Control and Prevention (CDC): Advisory Committee on Immunization Practices (ACIP). Prevention and control of influenza: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2008. MMWR Recomm Rep 2008;57(RR7):1-60. 12. Feikin DR, Feldman C, Schuchat A, Janoff EN. Global strategies to prevent bacterial pneumonia in adults with HIV disease. Lancet Infect Dis 2004;4:445-55. 13. Hung CC, Chen MY, Hsieh SM, Hsiao CF, Sheng WH, Chang SC. Clinical experience of the 23-valent capsular polysaccharide pneumococcal vaccination in HIV-1-infected patients receiving highly active antiretroviral therapy: a prospective observational study. Vaccine 2004;22:2006-12. 14. Subramaniam KS, Segal R, Lyles RH, Rodriguez-Barradas MC, Pirofski LA. Qualitative change in antibody responses of human immunodeficiency virus-infected individuals to pneumococcal capsular polysaccharide vaccination associated with highly active antiretroviral therapy. J Infect Dis 2003;187:758-68. 15. Centers for Disease Control and Prevention (CDC): Advisory Committee on Immunization Practices (ACIP). Revised recommendations of the Advisory Committee on Immunization Practices (ACIP) to Vaccinate all Persons Aged 11-18 years with Meningococcal Conjugate Vaccine. MMWR 2007;56:797-795. 16. Rey D, Krantz V, Partisani M, Schmitt MP, Meyer P, Libbrecht E, Wendling MJ, Vetter D, Nicolle M, Kempf-Durepaire G, Lang JM. Increasing the number of hepatitis B vaccine injections augments anti-HBs response rate in HIV-infected patients. Effects on HIV-1 viral load. Vaccine 2000;18:1161-5. 17. Costa-Mattioli M, Allavena C, Poirier AS, Billaudel S, Raffi F, Ferre V. Prolonged hepatitis A infection in an HIV-1 seropositive patient. J Med Virol 2002;68:7-11. 18. Dirección General de Salud Pública. Enfermedades Vacunables. Vacunación en adultos. Recomendaciones año 2004. Ministerio de Sanidad y Consumo, http://www.msc.es/enfermedadesLesiones/enfTrasmisi/enfVacunables/pdf/recoVacunasAdultos.pdf 25 26-30 CAPITULO 18 11/05/10 16:45 Página 26 Medicina Preventiva Capítulo 18 VACUNACIONES EN MUJERES EN EDAD FÉRTIL Y EN EMBARAZADAS A. Domínguez1, 2, V. Pastor3, C. Sanz3, L. Salleras1, 2 Departamento de Salud Pública. Universidad de Barcelona 2CIBER Epidemiología y Salud Pública. Instituto de Salud Carlos III 3Servicio de Medicina Preventiva. Hospital la Princesa-UAM. Madrid 1 RIESGO DE PADECER DETERMINADAS ENFERMEDADES INMUNOPREVENIBLES O SUS COMPLICACIONES Las enfermedades inmunoprevenibles que pueden afectar al feto o al neonato son el tétanos, la rubéola, la varicela, la parotiditis, el sarampión, la gripe y la tosferina. Tétanos El tétanos neonatal es una forma generalizada de enfermedad que ocurre sólo en niños nacidos de madres inadecuadamente inmunizadas (1). Habitualmente se produce a consecuencia de procedimientos obstétricos inadecuados, cuidados posnatales deficientes o por la aplicación de determinadas prácticas culturales como aplicación de heces de animales o de tierra sobre la herida umbilical. Aunque en los países desarrollados no es problema, en los países en vías de desarrollo sí lo es, sobreviniendo la muerte por bronconeumonía o hemorragia pulmonar principalmente, aunque también trastornos como hepatitis, onfalitis, hemorragia cerebral y trombosis pueden provocar la muerte. Los recién nacidos que sobreviven a la enfermedad desarrollan daño cerebral (2). Rubéola El virus de la rubéola tiene capacidad para afectar todos los órganos del feto, variando, en función del momento del embarazo en que se produce la infección, el tipo de lesiones producidas (3, 4). Si la infección se produce en las doce primeras semanas de embarazo la frecuencia de anormalidades es muy superior que si se produce después (Tabla I) (5). Evaluando conjuntamente las series de diversos autores (Tabla II), se observa que si la infección se produce en las semanas 13 a 16 de embarazo, el 16,7% de los niños presenta lesiones, pero cuando la infección se produce entre las semanas 17 a 20, sólo el 5,9% las presenta y si es después de la semana 20, el porcentaje disminuye al 1,7% (6). Las lesiones que presentan los niños que nacen de madres que han padecido la infección, constituye el síndrome de rubéola congénita, caracterizado por retrasos importantes en el crecimiento y desarrollo, microcefalia, cataratas, hepatoesplenomegalia, defectos cardiacos, sordera y meningoencefalitis, entre otros signos y síntomas. En la Tabla III se muestra la distribución de las lesiones presentes en casos con el síndrome de rubéola congénita en diversos estudios (7). 26 Tabla I. Edad de gestación cuando se produce la infección por virus de la rubéola y anormalidades observadas Mes de embarazo 1 2 3 4 Peso < 2.500 g 9/21 9/21 10/18 0/2 Embarazo < 38 s 5/21 2/21 4/18 0/2 Retraso crecimiento 7/21 5/20 7/17 0/2 Defectos oculares 14/21 9/21 9/18 0/2 Defectos cardiacos 17/21 13/21 6/18 0/2 Sordera 8/18 10/18 11/17 2/2 Retraso mental 7/20 7/20 8/10 0/2 Microcefalia 3/18 2/19 4/17 0/2 Fuente: Plotkin et al (5). Tras el nacimiento la sordera puede empeorar y puede aparecer glaucoma, cataratas, desprendimiento de retina y problemas esofágicos (8), así como también diabetes y tiroiditis (8, 9). Algunos autores también relacionan la infección por virus de la rubéola durante el embarazo con el autismo (10). Varicela Puesto que la mayoría de adultos tienen anticuerpos frente a la varicela, la incidencia de varicela en el embarazo es baja. La varicela adquirida durante el embarazo puede tener graves consecuencias para la madre y para el feto. Puede ocurrir aborto espontáneo, muerte fetal y parto prematuro, pudiendo también aparecer el síndrome de varicela congénita. El mayor riesgo de embriopatía grave se sitúa en las primeras 20 semanas de embarazo, y su frecuencia es inferior al 2% (11). Si la infección de la madre está en fase más avanzada del embarazo, las lesiones consisten en cicatrices cutáneas, atrofia de extremidades, defectos oculares unilaterales, alteraciones del sistema nervioso central y trastornos del tracto urinario y gastrointestinal (12). Aunque se han comunicado algunos casos de anormalidades fetales si una mujer embarazada padece herpes zóster, no hay evidencia de que la recurrencia de infección por el virus de la varicela cause síndrome de varicela congénita o neonatal. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 26-30 CAPITULO 18 03/05/10 12:17 Página 27 Medicina Tabla II. Incidencia de efectos provocados por la rubéola en niños infectados en el útero después del primer trimestre según edad gestacional Meckham 13-16 semanas 17-20 semanas > 20 semanas 7/73 (10%) 4/40 (10%) 1/11 (9,1%) 0/4 1/14 (7%) 1/16 (6,2%) 9/26 (35%) 0/10 0/53 Vejtorp and Mansa Muller et al 4/17 (23%) 2/54 (3,7%) 0/35 20/20 (16,7%) 7/118 (5,9%) 2/115 (1,7%) Grillner et al TOTAL Fuente: Best et al (6). Tabla III. Frecuencia de manifestaciones clínicas en niños con síndrome de rubéola congénita en diversos estudios Nº de estudios Nº de sujetos estudiados (%) Daño auditivo 10 68/113 (60) Defectos cardiacos 9 45/100 (45) Microcefalia 3 13/49 (27) C 3 16/65 (25) Peso < 2.500 g 2 5/22 (23) Manifestación clínica Hepatoesplenomegalia 6 13/67 (19) Púrpura 5 11/65 (17) Retraso mental 2 2/15 (13) Meningoencefalitis 3 5/49 (10) Huesos radiolúcidos 3 3/43 (7) Retinopatía 3 2/44 (5) Fuente: Reef et al (7). Si la varicela materna ocurre en los últimos cinco días de la gestación o en los dos primeros días de vida, el riesgo de que el recién nacido presente varicela neonatal es elevado (tasa de ataque del 20%) (13, 14). En estos niños se presenta varicela generalizada, con una letalidad que alcanza el 30%. Parotiditis La infección por el virus de la parotiditis durante el primer trimestre del embarazo se ha asociado a mortalidad fetal. En un estudio de casos y controles se puso de manifiesto que en el 27,3% de las mujeres que habían padecido parotiditis se produjeron muertes fetales frente al 13% en las mujeres que no padecieron la infección (15). Además, el virus de la parotiditis se ha aislado en los productos de abortos espontáneos (16). La infección por el virus de la parotiditis también se ha relacionado con la fibroelastosis endocardiaca (17). Aunque éste ha sido un tema discutido (18), en más del 70% de pacientes con dichas lesiones mediante técnicas de PCR se ha detectado la presencia del virus (19). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva Igualmente, el virus se ha aislado en niños nacidos de madres con parotiditis, presentando lesiones que pueden ser leves, como inflamación de la parótida (20), o más graves, como la neumonía o el distress respiratorio (21). Sarampión La infección por el virus del sarampión durante el embarazo está asociada a aborto espontáneo y muerte fetal (22), así como bajo peso al nacer (23). El sarampión congénito parece que es extremadamente raro, aunque se ha asociado a la panencefalitis esclerosante subaguda (24). En las mujeres que padecen sarampión en la fase tardía del embarazo, los niños pueden presentar exantema congénito (25) o lo desarrollan durante los diez primeros días de vida (26). La neumonía es una complicación frecuente en la embarazada que padece el sarampión (23). Gripe La infección por virus de la gripe en embarazadas, especialmente cuando se hallan en su tercer trimestre de embarazo, se ha asociado a un mayor riesgo de hospitalización por problemas cardiorrespiratorios que en mujeres no embarazadas (27). Este mayor riesgo se explica por el aumento del consumo de oxígeno, la disminución de capacidad pulmonar y los cambios en la función inmunológica (28). Respecto al daño que puede producir la infección en el feto, algunos estudios señalan que puede producir retraso en el crecimiento fetal y bajo peso al nacer (29). También se ha sugerido que la infección por virus de la gripe durante el embarazo podría ocasionar aborto espontáneo y muerte fetal (30). Algunos autores relacionan la infección gripal durante el embarazo con la esquizofrenia (31). En neonatos, la infección por virus de la gripe puede ser grave, ocasionando sepsis, neumonía y arritmia cardiaca (32, 33). Además, hay que tener en cuenta que dicha infección puede presentarse en forma de brotes nosocomiales (34). También se ha relacionado con la muerte súbita (35). Tos ferina La tos ferina es una enfermedad transmisible endémica que presenta una contagiosidad muy elevada que típicamente antes de introducir la vacunación ocasionaba picos epidémicos cada 2-5 años (36, 37). La introducción de la vacunación en los calendarios infantiles no parece haber variado la presentación epidémica de la enfermedad, lo cual sugiere que la circulación del virus en la comunidad no se ha visto afectada por los programas de vacunación (38). La contagiosidad de la enfermedad es muy elevada: 90% de los convivientes de un caso que son susceptibles contraen la infección. En personas que han padecido la enfermedad, se han descrito segundos ataques de la enfermedad tanto en la era prevacunal (39), como más recientemente (40). Los estudios realizados en mujeres embarazadas no muestran una mayor morbilidad ni mortalidad respecto a mujeres no embarazadas, ni tampoco han evidenciado muertes fetales ni alteraciones en el desarrollo fetal. Sin embargo, el riesgo de muerte o de enfermedad grave es muy elevado en los niños menores de 6 meses y permanece elevado hasta que los niños no han recibido las dos primeras dosis de vacuna antipertúsica (41). 27 26-30 CAPITULO 18 03/05/10 12:17 Página 28 Medicina Preventiva Por otro lado, a partir de la década de los 70 los padres y especialmente las madres, se han identificado como la fuente más importante de tos ferina en lactantes (42). Modelos matemáticos han sugerido que la vacunación del 90% de contactos convivientes de los recién nacidos junto a la vacunación del 75% de los adolescentes de la población podría prevenir el 75% de los casos de tos ferina en menores de 2 años (43). La vacunación de los padres y del niño antes de salir del hospital podría prevenir casi el 40% de casos y muertes en lactantes (44). BENEFICIOS POTENCIALES DE LA VACUNACIÓN Vacunación antitetánica Para reducir la incidencia y letalidad del tétanos neonatal se han adoptado diversas estrategias: a) educar a las mujeres embarazadas en relación al peligro de utilizar material contaminado para cortar el cordón umbilical y cubrir la herida umbilical; b) formar a las comadronas en la aplicación de técnicas asépticas; c) inmunizar a todas las mujeres en edad fértil, y d) inmunizar a las mujeres embarazadas cuando la inmunización universal no es posible. Para prevenir el tétanos neonatal, la mejor estrategia preventiva es la vacunación universal, y si ello no es posible, la inmunización de mujeres en edad fértil o embarazadas (45). Estudios realizados por la Organización Mundial de Salud han demostrado que dicha inmunización conlleva una reducción considerable de la incidencia de tétanos neonatal (46). Los niños nacidos de madres que han sido inmunizadas durante el embarazo tienen niveles adecuados de anticuerpos circulantes y están protegidos frente a la enfermedad. Las madres que han recibido dos dosis de toxoide tetánico durante el embarazo transfieren niveles elevados de antitoxina tetánica a los recién nacidos (47). Por ello, la OMS recomienda que todas las mujeres embarazadas deben haber recibido, por lo menos, dos dosis de vacuna (48). En la actualidad, los CDC recomiendan la administración de una dosis de recuerdo de vacuna antitetánica y antidiftérica a todas las embarazadas que no hayan recibido una dosis durante los últimos 10 años. A las embarazadas que no están completamente vacunadas frente al tétanos, les recomiendan completar la serie primaria. Aunque no hay evidencia de que los toxoides diftérico y tetánico sean teratógenos, se recomienda esperar al segundo trimestre de embarazo para la vacunación (49). Vacunación antirubéola El principal beneficio que supone la vacunación de las mujeres en edad fértil seronegativas al virus de la rubéola es prevenir la infección por el virus de la rubéola durante el embarazo y, consecuentemente, el síndrome de rubéola congénita o el aborto. La vacunación antirubéola induce una respuesta inmunitaria que es similar a la que produce la infección natural (50). La necesidad de una segunda dosis de vacuna no está probada, aunque los títulos de anticuerpos disminuyen tras la primovacunación. 28 Sin embargo, dado que para el sarampión sí se ha demostrado que con una segunda dosis mejora sensiblemente la protección, que se utiliza la vacuna triple vírica habitualmente, que la segunda dosis es inocua y que las estrategias nacionales para eliminar la rubéola con programas de dos dosis han mostrado éxito, es aconsejable la administración de dos dosis de vacuna triple vírica durante la infancia (51). La vacuna triple vírica, al igual que sus componentes, no debe administrarse a mujeres embarazadas, debiéndose tomar precauciones para evitar el embarazo durante los 28 días siguientes a la vacunación (52, 53). Anteriormente, debido a un caso de transmisión del virus salvaje a un feto que fue concebido 7 semanas después de la vacunación antirubéola se estableció la recomendación de esperar 3 meses tras la vacunación para quedar embarazada (54). Sin embargo, el paso transplacentario del virus vacunal es un hecho muy raro y, lo que es más importante, no se ha demostrado ningún caso de síndrome de Rubéola Congénita en más de mil embarazadas que recibieron la vacuna (51). Por estas razones, la vacunación antirubéola a una embarazada ya no se considera una indicación para el aborto (55, 56). En la actualidad, los CDC recomiendan que aquellas mujeres que no están vacunadas reciban una dosis de vacuna triple vírica y que se les aconseje evitar el embarazo durante las 4 semanas siguientes. Si la embarazada es susceptible, debería vacunarse tan pronto como sea posible en el periodo posparto (49). Vacunación antivaricela Aunque no existe evidencia de que se hayan producido casos de varicela congénita debidos al virus vacunal (57), la vacunación antivaricela está contraindicada durante el embarazo. En un estudio en el que se incluyeron 58 mujeres embarazadas seronegativas que recibieron la vacuna durante el primer o segundo trimestre, no hubo ningún caso de varicela congénita (58). En la actualidad, los CDC consideran que si una embarazada recibe inadvertidamente la vacuna antivaricela, no está indicado al aborto. Las mujeres embarazadas seronegativas que han estado expuestas al virus de la varicela deberían recibir immunoglobulina específica antivaricela (49). Vacunación antiparotiditis La vacuna antiparotiditis se administra como vacuna triple vírica. No debe administrarse a mujeres embarazadas por el riesgo teórico de que se produzca daño fetal. Sin embargo, no hay evidencia de que el componente antiparotiditis pueda causar malformaciones en humanos (51). Las mujeres en edad fértil que se vacunan deberían adoptar precauciones para evitar el embarazo durante las 4 semanas que siguen a la vacunación. Una sola dosis de vacuna antiparotídica proporciona protección adecuada frente al virus de la parotiditis. Sin embargo, como que dosis adicionales son inocuas, lo habitual en muchos países es administrar dos dosis de vacuna triple vírica en la edad infantil. A cualquier edad se pueden administrar dos dosis de vacuna triple vírica separadas por un intervalo de 28 días. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 26-30 CAPITULO 18 03/05/10 12:17 Página 29 Medicina Vacunación antisarampión El virus atenuado del sarampión que se utiliza para la vacunación, a diferencia de los virus atenuados de la rubéola y de la parotiditis, no se ha demostrado que pueda atravesar la placenta y ocasionar daño fetal (59). Sin embargo, como cualquier vacuna atenuada, está contraindicada en mujeres embarazadas. Las mujeres en edad fértil que se vacunen deberían evitar el embarazo durante los 28 días que siguen a la vacunación. Para las mujeres embarazadas que inadvertidamente se vacunen o que quedan embarazadas antes de que transcurran 28 días, no está indicado el aborto (49). Los calendarios de vacunaciones sistemáticas de muchos países incluyen dos dosis de vacuna antisarampión en la edad infantil. Los adultos susceptibles deberían recibir dos dosis separadas por un intervalo de 28 días (60). Vacunación antigripal La recomendación de que se administre la vacuna antigripal inactivada a las mujeres embarazadas aunque no tengan ninguna condición de riesgo que las hiciera candidatas a la vacunación es relativamente reciente, por lo que se dispone de pocos trabajos que ilustren el beneficio de dicha práctica (61). Sin embargo, la inocuidad de la vacuna inactivada para el feto por un lado y el riesgo de complicaciones cardiacas y pulmonares de la madre a las que se ha hecho referencia por otro lado, avalan la recomendación de vacunar (62-65). Inicialmente la recomendación se limitó a las mujeres que estuvieran en su segundo o tercer trimestre de embarazo durante la temporada gripal (66, 67), pero los últimos informes de los CDC recomiendan la vacunación de las mujeres que estén embarazadas durante la temporada gripal, pudiendo administrarse la vacuna inactivada en cualquier trimestre del embarazo (28, 49, 68). La vacuna atenuada de la gripe está contraindicada en el embarazo (69). Un estudio publicado recientemente estima la efectividad de la vacunación de la madre para prevenir la gripe en niños menores de 6 meses en un 63% (70). Vacunación antipertussis Antes de licenciar la vacuna Tdpa (en el año 2005), no se realizaron estudios en embarazadas, pero los estudios posteriores realizados con los registros de reacciones adversas no han detectado ningún problema relevante. Por el contrario, sí que se tiene constancia de reacciones locales frecuentes (algunas graves) en embarazadas con la administración de vacuna de células enteras (42). El papel protector de los anticuerpos transferidos por la vía placentaria está discutido. Los estudios realizados en la era prevacunal concluían que los niños no tenían inmunidad adquirida y que eran susceptibles desde el momento del nacimiento, con la única excepción de que la madre hubiera tenido tos ferina durante el embarazo. El paso transplacentario de anticuerpos podría explicar por qué la mortalidad en niños menores de un mes era inferior a la de los niños de más edad, pero una explicación alternativa sería que los padres evitaran más la exposición a casos de enfermedad en el primer mes de vida (71).También se ha señalado que la vacunación de las embarazadas podría aumentar el título de anticuerpos en el recién nacido durante los 6 primeros meses de vida y conferir una cierta protección, aunque esos anticuerpos interferirían la respuesta de Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva la vacunación en los niños. Por ello, en la actualidad, si no la han recibido previamente, se recomienda administrar una dosis de vacuna acelular en el posparto inmediato con el objetivo de que la madre contraiga la infección y la transmita a su hijo (42, 72). Correspondencia: Ángela Domínguez Departamento de Salud Pública C/ Casanova 143 08036 Barcelona e-mail: angela.dominguez@ub.edu BIBLIOGRAFÍA 1. Brook I. Clostidium tetani (Tetanus). En: Long SS, Pickering LK, Prober CG, editores. Principales and Practice of Pediatric Infectious Diseases. 3rd ed. New York: Churchill Livingstone; 2008. p. 956-9. 2. Barlow JL, Mung'Ala-Odera V, Gona J, Newton CR. Brain damage after neonatal tetanus in a rural Kenyan hospital. Trop Med Int Health 2001;6:305-8. 3. Grillner L, Forggren M, Barr B, Bottiger M, Danielsson L, De Verdier C. Outcome of rubella during pregnancy with special reference to the 1724th weeks of gestation. Scand J Infect Dis 1983;15:321-5. 4. South MA, Sever JL. Teratogen update: the congenital rubella syndrome. Teratology 985;31:297-307. 5. Plotkin SA, Cochran W, Lindquist JM, Cochran GG, Schaffer DB, Scheie HG, et al. Congenital rubella syndrome in late infancy. JAMA 1967;200:435-41. 6. Best JM, Banatvala JE, Rubella EN, Zuckerman AJ, Banatvale JE, Pattison JR, et al. Principles and practice of Clinical Virology: Chichester. John Wiley & Sons; 2004. p. 427-57. 7. Reef SE, Plotkin S, Cordero JF, Katz M, Cooper L, Schwartz B, et al. Preparing for elimination of congenital rubella syndrome (CRS): summary of a workshop on CRS elimination in the United States. Clin Infect Dis 2000;31:85-95. 8. O’Donnell N. History of congential rubella syndrome. J Vocational Rehabil 1996;6:149-57. 9. Torner Y, Davies TF. Infection, thyroid disease and autoimmunity. Endoc Rev 1993;14:107-20. 10. Muhle R, Trentacoste SV, Rapin I. The genetics of autism. Pediatrics 2004;113:e472-86. 11. Grose C. Varicella-zoster virus. Pathogensis of primary infection. En: Arvin AM, Gershon AA, editores. Varicella-zoster virus: virology and clinical practice. Cambridge: Cambridge University Press; 2000. p. 105-13. 12. Arvin AM. Varicella-zoster virus. En: Long SS, Pickering LK, Prober CG, editores. Principales and Practice of Pediatric Infectious Diseases. 3rd ed. New York: Churchill Livingstone; 2008. p. 1021-9. 13. Brunell PA, Kotchmar GSJ. Zoster in infancy: failure to maintain virus latency following intrauterine infection. J Pediatr 1981;98:71-3. 14. Prober CG, Gershon AA, Grose C, Mccracken GH, Nelson JD. Consensus: varicella-zoster infections in pregnancy and the perinatal period. Pediatr Infect Dis J 1990;9:865-9. 15. Siegel M. Congenital malformations following chickenpox, measles, mumps, and hepatitis. Results of a cohort study. JAMA 1973;24;226:1521-4. 16. Kurtz JB, Tomlinson AH, Pearson J. Mumps virus isolated from a fetus. Br Med J 1982;284:471. 17. Gersony WM, Katz SL, Nadas AS. Endocardial fibroelastosis and the mumps virus. Pediatr 1966;37:430-4. 18. Gutierrez K. Mumps virus. En: Long SS, Pickering LK, Prober CG, editores. Principles and Practice of Paediatric Infectious Disease. 3rd ed. New York: Churchill Livingstone; 2008. p. 1108-12. 19. Ni J, Bowles NE, Kim YH, Demmler G, Kearney D, Bricker JT, Towbin JA. Viral infection of the myocardium in endocardial fibroelastosis: molecular evidence for the role of mumps virus as an etiologic agent. Circulation 1997;95:133-9. 20. Jones JF, Ray CG, Fulginiti VA. Perinatal mumps infection. J Pediatr 1980;96:912-4. 21. Groenendaal F, Rothbarth PH, van den Anker JN, Spritzer R. Congenital mumps pneumonia: a rare cause of neonatal respiratory distress. Acta Paediatric Scand 1990;79:1252-4. 29 26-30 CAPITULO 18 11/05/10 16:46 Página 30 Medicina Preventiva 22. Jenkerson SA, Beller M, Middaugh JP, Erdman DD. False positive rubeola IgM tests. N Engl J Med 1995;332:1103-4. 23. Chiba ME, Saito M, Suzuki N, Honda Y, Yaegashi N. Measles infection in pregnancy. J Infect 2003;47:40-4. 24. Cruzado D, Masserey-Spicher V, Roux L, Delavelle J, Picard F, Haenggeli CA. Early onset and rapidly progressive subacute sclerosing panencephalitis after congenital measles infection. Eur J Pediatr 2002;161:438-41. 25. Nakata Y, Nakayama T, Ide Y, Kizu R, Koinuma G, Bamba M. Measles virus genome detected up to four months in a case of congenital measles. Acta Paediatr 2002;91:1263-5. 26. Darmstradt GL, Halsey NA. Measles in mother-infant pairs. Pediatr Infect Dis J 1992;11:492-3. 27. Neuzil KM, Meed GW, Mitchel EF, Simonsen L, Griffin MR. Impact of influenza on acute cardiopulmonary hospitalization pregnant women. Am J Epidemiol 1998;148:1094-102. 28. Centers for Disease Control and Prevention. Prevention and Control of Influenza MMWR 2004;53(RR-6):1-40. 29. Wright P, Takei N, Rifkin L, Murray RM. Maternal influenza, obstetric complications, and schizophrenia. Am J Psychiatry 1995;152:1714-20. 30. Stanwell-Smith R, Parker AM, Chakraverty P, Soltanpoor N, Simpson CN. Possible association of influenza A with fetal loss: investigation of a cluster of spontaneous abortions and stillbirths. Commun Dis Rep CDR Rev 1994:4;R28-32. 31. Boog G. Obstetrical complications and further schizophrenia of the infant: a new medicolegal threat to the obstetrician? J Gynecol Obstet Biol Reprod 2003;32:720-7. 32. Van den Dungen FA, van Furth AM, Fetter WP, Zaaijer HL, van Elburg RM. Fatal case of influenza B virus pneumonia in a preterm neonate. Pediatr Infect Dis J 2001;20:82-4. 33. Steininger C, Holzmann H, Zwiauer KF, Popow-Kraupp T. Influenza A virus infection and cardiac arrhythmia during the neonatal period. Scand J Infect Dis 2002;34:782-4. 34. Sagrera X, Ginovart G, Raspall F, Rabella N, Sala P, Sierra M, et al. Outbreaks of influenza A virus infection in neonatal intensive care units. Pediatr Infect Dis J 2002;21:196-200. 35. Bajanowski T, Rolf B, Jorch G, Brinkmann B. Detection of RNA viruses in sudden infant death (SID). Int J Legal Med 2003;117:237-40. 36. Edwards KM, Decker MD. Pertusis vaccines. En: Plotkin SA,Orentstein W, Offit P, editores. Vaccines 5th ed. Philadelphia: Saunders Elsevier 2008; p. 467-517. 37. Cherry JD, Heininger U. Pertussis and other bordetella infections. In: Textbook of Pediatric Infectious Diseases, 6th ed, Feigin, RD, Cherry, JD, Demmler-Harrison, GJ, Kaplan, SL (Eds), Saunders, Philadelphia, 2009. p. 1683-706. 38. Fine PEM, Clarkson JA. Reflections on the efficacy of pertussis vaccines. Rev Infect Dis 1987;9:866-83. 39. Lambert HJ. Epidemiology of a small pertussis outbreak in Kent county, Michigan. Public Health Rep 1965;80:365-9. 40. Cherry JD, Beer T, Chartrand SA, Deville J, Beer E, Olsen MA. Comparison of values of antibodies to Bordetella pertussis antigen in young German and American men. Clin Infect Dis 1995;20:1271-4. 41. Tanaka M, Vitek CR, Pascual FB, Bisgard KM, Tate JE, Murphy YV. Trends in pertussis among infants in the United States, 1980-1999. JAMA 2003;290:2968-75. 42. Murphy TV, Slade BA, Broder KR, Kretsinger K, Tiwari T, Joyce MP, et al. Prevention of pertussis, tetanus and diptheria among pregnant and postpartum women and their infants. MMWR 2008;57(RR-4):1-51. 43. Van Rie A, Hethcote HW. Adolescenty and adult pertussis vaccination. Computer simulations of five new strategies. Vacccine 2004;22:3154-65. 44. Scuffham PA, McIntre PB. Pertussis vaccination strategies for neonates- an exploratory cost-effectiveness analysis. Vaccine 2004;22:2953-64. 45. Cherry JD, Harrison RE. Tetanus. En: Feigin RD, Cherry JD, Demmaler GJ, Kaplan SL, editores. Textbook of Pediatric Infectious Diseases. 6th ed. Philadelphia: Saunders; 2009. p. 1870-80. 46. Stanfield JP, Galazka A. Neonatal tetanus in the world today. Bull World Health Organ 1984;62:647-69. 47. Sangpetchsong V, Vichaikummart S, Vichitnant A, Podhipak A. Transfer rate of transplacental immunity to tetanus from non-immunized and immunized mothers. Southeast Asian J Trop Med Public Health 1984;15:275-80. 30 48. Global Advisory Group: Expanded Program on Immunixation. Global Advisory Group-Part II. Achieving the major disease control goals. Wkly Epidemiol Rec 1994;69:29-31. 49. Centers for Disease Control and Prevention. Guidelines for vaccinating pregnant women. http://www.cdc.gov/nip/publications/preg_guide.pdf (consultado 29-XI-04). 50. Furesz J. Antibody response of school children to liver attenuated rubella virus vaccines as measured with various serologic methods. Am J Epidemiol 1972;95:536-41. 51. Plotkin SA, Reef S. Rubella vaccine. En: Plotkin SA, Orenstein WA,Offit P editors. Vaccines. 5th ed. Philadelphia: Elsevier; 2008. p. 73471. 52. Centers for Disease Control and Prevention. Revised ACI recommendation for avoiding pregnancy after receiving a rubella-containing vaccine. MMWR 2001;50:1117. 53. Gruslin A, Steben M, halperin S, Money DM, Yudin MH. Immunization in pregnancy. J Obst Gynecol Can 2008;30:1149-54. 54. Fleet WF Jr, Benz EW Jr, Karzon DT, Lefkowitz LB, Herrmann KL. Fetal consequences of maternal rubella immunization. JAMA 1974;227:621-7. 55. Sheppard S, Smithells RW, Dickson A, Holzel H. Rubella vaccination and pregnancy: preliminary report of a national survey. Br Med J 1986;292:727. 56. Centers for Disease Control. Rubella vaccination during pregnancy. United States, 1971-1986. MMWR 1987;36:457-61. 57. Gershon AA, Takanashi M, Seward J. Varicella vaccine. En: Plotkin SA, Orenstein WA, Offit P editores. Vaccine-5th ed. Philadelphia: Elsevier; 2008. p. 915-58. 58. Shields KE, Galil K, Seward J, Sharrar RG, Cordero JF, Slater E. Varicella vaccine exposure during pregnancy: data from the first 5 years of pregnancy registry. Obstet Gynecol 2001;98:14-9. 59. Strebel PM, Papania MJ, Dayan G, Halsey NA. Measles vaccine. En: Plotkin SA, Orenstein WA, Offit P, editors. Vaccines. 4th ed. Philadelphia: Elsevier; 2008. p. 353-98. 60. Centers for Disease Control. Measles eradication. Recommendations from a meeting cosponsored by the World Health Organization, The Pan American Health Organization and CDC. MMWR 1997;46(R11):1-20. 61. Naleway AL, Smith WJ, Mullooy JP. Delvering influenza vaccine to pregnant women. Epidemiol Rev 2006;28:47-53. 62. Subbarao K. Influenza viruses. En: Long SS, Pickering LK, Prober CG, editores. Principles and Practice of Paediatric Infectious Diseases. 3rd ed. New York: Churchill Livingstone; 2008. p. 1130-8. 63. Dodos L, McNeil SA, Fell DB, Allen VM, Coombs A, Scott J, McDonald N. Impact of influenza exposure on rates of hospital admissions and physician visits because of respiratory illness among pregnant women. CMAJ 2007;176:463-8. 64. Schanzer D, Langley JM, Tam TWS. Influenza-attributed hospitalization rates among pregnant women in Canada 1994-2000. J Obstet Gynecol Can 2007;29:622-9. 65. Gall SA. Vaccines for pertussis and influenza: recommendations for use in pregnancy. Clin Obstet Gynecol 2008;51:486-97. 66. Centers for Disease Control and Prevention. Recomendations of the Advisory Committee in Immunization Practices (ACIP). MMWR 1997;46(RR-9):5-6. 67. Glezen WP, Alpers M. Maternal immunization. Clin Infect Dis 1999;28:219-24. 68. Centers for Disease Control and Prevention. Prevention and control of influenza. MMWR 2008;57:RR-7. 69. Centers for Disease Control and Prevention. Using live, attenuated influenza vaccine for prevention and control influenza. Supplemental Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2003;52(RR13):5. 70. Zaman K, Roy E, Arifeen SE, Rahman M, Raqib R, Wilson E et al. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med 2008;359:1555-64. 71. Gramstrom G, Sterner G, Nord CE, Granstrom M. Use of erythromycin to prevent pertussis tin newborns of mother with pertussis. J Infect Dis 1987;155:1210-4. 72. Centers for Disease Control and Prevention. Recommended adult immunization schedule-United statees, 2009. MMWR 2009;57(53). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 31-40 CAPITULO 19 11/05/10 16:47 Página 31 Medicina Preventiva Capítulo 19 VACUNACIONES FRENTE A EXPOSICIONES LABORALES M. C. Sáenz1, J. Castrodeza2, J. R. de Juanes3 Servicio de Medicina Preventiva. Hospital Clínico de Salamanca 2Servicio de Medicina Preventiva. Hospital Clínico de Valladolid 3Servicio de Medicina Preventiva. Hospital 12 de Octubre. Madrid 1 INTRODUCCIÓN Las enfermedades infecciosas constituyen una causa importante de morbilidad en el ambiente laboral, recogiéndose un 2,5% de casos del total de las enfermedades profesionales en la población trabajadora en España y constituyendo el 1,5% de las muertes por enfermedad laboral (1). Entre las diversas medidas para el control de infección en el trabajo, aquellas dirigidas a la protección del trabajador susceptible incluyen la quimioprofilaxis, la administración de inmunoglobulinas (inmunización pasiva) y de vacunas (inmunización activa). En el momento actual, la vacunación del profesional se considera la medida más efectiva de prevención primaria. Por tanto, la vacunación de los profesionales en la empresa tiene una justificación tanto económica como sociosanitaria, basándose en las políticas en materia de salud y prevención de riesgos laborales. MARCO LEGISLATIVO En ejecución del mandato contenido en el artículo 40.2 de la Constitución Española dirigido al desarrollo de una política de protección de la salud de los trabajadores mediante la prevención de los riesgos derivados de la exposición laboral, se elabora la Ley de Prevención de Riesgos Laborales (Ley 31/1995, de 8 de Noviembre) (2), que en su artículo 15 establece los principios de las acciones preventivas en el trabajo. En el ámbito sanitario, la Ley 14/1986 de 25 de abril, Ley General de Sanidad, en su artículo 21 recoge los aspectos que integran la actuación sanitaria en el ámbito de salud laboral, principio al que se refiere el artículo 10 de la Ley de Prevención de Riesgos Laborales. En su Capítulo IV, dedicado a la Salud Laboral, establece los criterios fundamentales con cuyo desarrollo se logrará alcanzar sus objetivos: la prevención de los riesgos laborales y la promoción de la salud física y mental de los trabajadores. La Ley de Prevención de Riesgos Laborales se desarrolla entre otros por: – Real Decreto 39/1997, de 17 de enero por el que se aprueba el Reglamento de los Servicios de Prevención y modificación posterior. – Real Decreto 664/1997 de 12 de mayo (3), sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo. Establece las disposiciones mínimas aplicables a las actividades en las que los trabajadores estén o puedan estar expuestos a agentes biológicos debido a la Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 naturaleza de su actividad laboral. Del mismo modo, en el anexo VII del apartado 3 del artículo 14, se recoge las “Recomendaciones prácticas para la vacunación” en relación con la protección de los trabajadores frente a riesgos biológicos en el trabajo. A este respecto establece que cuando la evaluación a la que se refiere en su artículo 4 demuestre la existencia de un riesgo por exposición a agentes biológicos contra los que existan vacunas eficaces, el empresario deberá ofrecer dicha vacunación, sin cargo para el trabajador. Además, según éste, deberá informarse al trabajador sobre las ventajas e inconvenientes tanto de la misma como de la no vacunación, y la posibilidad de elaborarse un certificado de vacunación. – Real Decreto 1215/1997, de 18 de julio, donde se establecen las disposiciones mínimas de seguridad y salud para el uso de los equipos de trabajo. – Directiva 2000/54/CE del Parlamento Europeo y del Consejo de 18 de septiembre de 2000, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo (séptima directiva específica con arreglo al apartado 1 del artículo 16 de la directiva 89/391/CEE). En ella se establecen diferentes colectivos de riesgo y agentes biológicos del empresario y procedimientos de actuación ante exposiciones (4). Posteriormente, la Ley de Cohesión y Calidad del Sistema Nacional de Salud (Ley 16/2003 de 28 de mayo) considera la promoción y protección de la salud en el trabajo como una prestación de salud pública, y la Ley del Estatuto Marco del personal estatutario de los servicios de salud (Ley 55/2003 de 16 de diciembre) refiere que el trabajador tiene derecho a recibir una protección en los diferentes aspectos relacionados con seguridad y salud en el trabajo. Finalmente, mediante la Ley 54/2003 de 12 de diciembre, se modifica la regulación de la Ley de Prevención de Riesgos Laborales, incidiendo directamente en la integración de la prevención de riesgos laborales en la empresa, estableciendo la obligación por parte del empresario de garantizar la seguridad y la salud de los trabajadores en todos los aspectos relacionados con el ambiente laboral. GRUPOS DE RIESGO PARA EXPOSICIÓN OCUPACIONAL A AGENTES BIOLÓGICOS Un riesgo biológico en el trabajo se define como la exposición laboral a microorganismos capaces de originar algún tipo de infección, alergia o toxicidad. Estos riesgos 31 31-40 CAPITULO 19 11/05/10 16:48 Página 32 Medicina Preventiva biológicos pueden ser causa de enfermedades transmisibles consideradas como enfermedades profesionales según el Real Decreto 1995/1978 de 12 de mayo (BOE 25/08/78) (5). Dada su antigüedad, recientemente se ha elaborado el Real Decreto 1299/2006 de 10 de noviembre, por el que se aprueba el nuevo Cuadro de Enfermedades Profesionales en el Sistema de la Seguridad Social, que ha entrado en vigor el día 1 de Enero de 2007. Dentro del grupo 3 (Enfermedades profesionales causadas por agentes biológicos) se incluyen como novedades las enfermedades infecciosas y parasitarias no contempladas en otro apartado, como son las micosis y la legionelosis. En el ámbito laboral, la transmisión de las enfermedades inmunoprevenibles puede ocurrir por diversas vías: – Transmisión por inhalación: gripe, varicela, sarampión… – Transmisión por gotas respiratorias, vía de adquisición de infecciones como la tos ferina e infección meningocócica. – Transmisión feco-oral, como es el caso de la infección por el virus de la hepatitis A tras el contacto con heces del paciente, o de la infección por poliovirus. – Transmisión parenteral o por contacto con mucosas o fluidos corporales, transmisión característica de los virus de hepatitis B, virus de hepatitis C y virus de la inmunodeficiencia humana. Teniendo en cuenta estos conocimientos epidemiológicos, se establecen diferentes colectivos sometidos a exposiciones con mayor riesgo de adquirir cualquiera de las enfermedades definidas en la legislación vigente como enfermedades profesionales. Los colectivos que, en función de todos estos requisitos, deberían ser vacunados, incluyen aquellos trabajadores expuestos a riesgos biológicos, los que precisan viajar a zonas geográficas endémicas en alguna enfermedad inmunoprevenible y los profesionales que trabajan en colectivos cerrados, lo que hace que algunas enfermedades sean más fácilmente transmisibles. En resumen, se pueden englobar como población diana las siguientes profesiones: personal sanitario, personal de laboratorio, servicios públicos, personal de residencias de deficientes mentales o ancianos, veterinarios o cuidadores de animales, agricultores y ganaderos y por último, aquellos trabajadores en contacto con alimentos, residuos y basuras (Tabla I) (4, 6). Una vez establecidos dichos colectivos de riesgo, se pueden elaborar programas de prevención, con el fin de conseguir, no sólo la protección de los trabajadores frente a determinadas enfermedades infecciosas, sino también evitar que se conviertan en fuente de infección para otros trabajadores o para la población general, proteger a aquellos trabajadores que padezcan alguna inmunodepresión, evitar el absentismo laboral y la evolución a enfermedad crónica o muertes consecuencia de algunas de ellas. Entre las medidas encaminadas hacia la prevención se incluye la vacunación de los trabajadores expuestos a infecciones de las que se dispone de vacunas eficaces, y que ocasionalmente pueden producir complicaciones potencialmente graves si se contraen en la edad adulta. Otras medidas importantes son la existencia de un servicio de salud accesible, evaluación de trabajadores con enfermedades contagiosas para su debido tratamiento y restricciones laborales, seguimiento periódico de los trabajadores expuestos para una posible profilaxis (virus de la hepatitis B) y, finalmente, educación sanitaria centrada en las recomendaciones universales para el control de la infección, así como Tabla I. Colectivos profesionales expuestos a riesgos biológicos (6) Colectivos expuestos a riesgos biológicos Principales vías de transmisión Personal sanitario, laboratorios clínicos e investigación microbiológica Transmisión de persona a persona Transmisión a través de objetos o material contaminado Servicios públicos con trabajos claves en la comunidad: bomberos, policía, protección civil Transmisión de persona a persona Trabajadores de instituciones cerradas: cárceles, geriátricos, centros de discapacitados psíquicos… Transmisión a través de objetos o material contaminado Transmisión de persona a persona Trabajadores no sanitarios expuestos a sangre, pinchazos u otros fluidos corporales: manicuras, tatuajes, piercings… Transmisión de persona a persona Transmisión a través de objetos o material contaminado Trabajadores docentes, especialmente de guarderías y parvularios Transmisión de persona a persona Transmisión a través de objetos o material contaminado Personal limpieza, lavandería y recogida de residuos, alcantarillados, vigilancia y saneamiento ambiental Transmisión a través de objetos o material contaminado Trabajadores en centros de producción o manipulación de alimentos Transmisión de animal a persona (zoonosis) Transmisión a través de objetos o material contaminado Trabajadores en contacto con animales salvajes Transmisión de animal a persona (zoonosis) Trabajadores que por motivos laborales viajen a zonas endémicas Transmisión a través de objetos o material contaminado Trabajadores inmigrantes insuficiente o incorrectamente vacunados Transmisión a través de objetos o material contaminado Transmisión de persona a persona 32 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 31-40 CAPITULO 19 03/05/10 12:30 Página 33 Medicina adiestramiento adecuado con el fin de evitar las infecciones adquiridas por vía parenteral o bien para la prevención de tuberculosis. VACUNACIONES EN LOS COLECTIVOS DE RIESGO A la hora de desarrollar un programa de vacunación en una empresa se debe incluir tanto la vacunación que se debe aplicar de forma general a todos los profesionales (vacunación sistemática), como aquellas vacunas específicas para determinadas profesiones o situaciones de exposición laboral (Tabla II) (7, 8, 9). Vacunación sistemática Toda la población en edad laboral debe estar correctamente inmunizada frente a tétanos y difteria, si bien existen ciertas situaciones laborales en los que esta vacunación está especialmente indicada: profesionales de los sectores agropecuarios y construcción, trabajadores en contacto con animales, aguas residuales, depuradoras, basuras, tierra, o trabajadores con posibilidad de producirse lesiones cutáneas por pequeñas que sean (bomberos, policía, protección civil, trabajadores sanitarios…). Si no están vacunados, se debe comenzar en el momento de su ingreso en la empresa, y en caso de estar previamente vacunados, administrar una dosis de recuerdo cada 10 años. Vacunaciones específicas de profesionales ante determinadas exposiciones Existen profesionales sometidos a la exposición de ciertos agentes biológicos frente a los que se dispone de vacunas eficaces: – Vacuna de la gripe: actualmente no se recomienda como vacunación sistemática a todos los trabajadores a pesar del gran absentismo laboral que ocasiona. Sólo está indicada en grupos de riesgo de padecer complicaciones o en profesionales que puedan transmitirla a personas de alto riesgo de las mismas (enfermedades crónicas, inmunodepresiones…): – Trabajadores en activo mayores de 50 años (como en población general) (9). – Personal sanitario (médicos, D.U.E., auxiliar de clínica..) y otro personal que atienda a personas de alto riesgo tanto en el medio intra como extrahospitalario. – Personal de geriátricos o centros de cuidados de enfermos crónicos que tengan contacto directo con los residentes. – Personas que proporcionan cuidados domiciliarios a pacientes de alto riesgo. – Trabajadores que prestan servicios comunitarios esenciales: policías, bomberos, protección civil… – Vacuna triple vírica (sarampión, rubéola, parotiditis): la administración de la vacuna triple vírica está recomendada en trabajadores no vacunados o sin historia previa de enfermedad y sobre todo, trabajadores sanitarios susceptibles, personal en contacto con población infantil (guarderías y parvularios) y, en especial, mujeres en edad fértil no inmunizadas frente a rubéola. – Vacuna frente a varicela: se recomienda la vacunación al personal sanitario y a profesionales docentes susceptibles Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva con el fin de evitar la transmisión a pacientes de alto riesgo en el primer caso, y casos de varicela en adultos con riesgo de complicaciones graves en el segundo. – Vacunación de tos ferina: la recomendación de la vacuna y las pautas de vacunación en el medio laboral coinciden con las de la población adulta general, si bien en España se recomienda al personal sanitario que atiende a recién nacidos y prematuros ingresados, así como a aquellos trabajadores en contacto con niños. – Vacuna antimeningocócica: recomendada en personal que trabaja en países de alta endemicidad o en aquellos en los que se describen epidemias. En este caso, la vacuna empleada debería ser la vacuna polisacárida de los grupos A y C. – Vacuna de la hepatitis A: la vacunación frente al virus de la hepatitis A se recomienda en algunos colectivos, debido al cambio epidemiológico en la seroprevalencia de antiVHA en adultos en España: – Cuidadores en contacto directo con pacientes con hepatitis A. – Personal implicado en catástrofes (bomberos, protección civil, policía…) – Trabajadores en contacto con aguas residuales. – Trabajadores de guarderías y parvularios. – Personal de laboratorio que manipula virus de hepatitis A, o trabaja con animales infectados. – Trabajadores en centros de producción o manipulación de alimentos, con el fin de evitar convertirse en fuente de infección y provocar brotes alimentarios. – Profesionales que se desplazan a zonas rurales o de condiciones higiénico-sanitarias deficientes de países de media o alta endemicidad, preferentemente nacidos después de 1966. Se administrará dos dosis por vía intramuscular con intervalo de 6 meses (Havrix®1440). – Vacuna frente a hepatitis B: en España, la infección por el virus de la hepatitis B se considera enfermedad profesional según el RD 1995/1978 de 12 de mayo. La vacunación frente a la misma se recomienda a los siguientes colectivos con edades superiores a 30 años, dado que en España, la vacunación sistemática se introduce en el adolescente en 1996: – Personal sanitario y parasanitario, incluido personal en formación que tenga contacto con sangre o instrumentos contaminados con sangre. – Personal que emplea técnicas que impliquen punción percutánea de piel o mucosas: acupuntura, tatuajes, piercings, manicura, pedicura… – Personal de instituciones penitenciarias o instituciones cerradas con deficientes mentales o menores acogidos. – Trabajadores de primeros auxilios o con trabajos de servicio a la comunidad: policía, bomberos… – Personal que trabaja en limpieza de jardines, parques, recogida de basuras. – Vacuna de la tuberculosis: dada su limitada eficacia, se recomienda a trabajadores con tuberculina negativa que trabajan en áreas con elevada prevalencia de M. tuberculosis multirresistente en casos de no ser posible medidas de aislamiento. – Vacuna de la rabia: las indicaciones en el medio laboral se limitan a personal de laboratorio que trabaje con el virus de la rabia y a profesionales cuya actividad laboral 33 31-40 CAPITULO 19 11/05/10 16:50 Página 34 Medicina Preventiva Tabla II. Recomendaciones de vacunaciones de los adultos con determinadas exposiciones laborales (9) Vacuna Tipo Indicaciones Vía Posología Consideraciones Enfermedad meningocócica Trabajadores que viajan a zonas de alto riesgo Trabajadores laboratorio e investigación – V. no conjugada A,C – V. no conjugada A,C,Y,W135 – V. conjugada C 1 dosis IM o SC No evaluada en embarazadas. Utilizar si alto riesgo Fiebre tifoidea Personal de laboratorio microbiología – V. atenuada (Ty21a) VA – V. inactivada VA: 3 comp (días alternos) VI: 1 dosis VA (oral) VI (IM) VA: contraindicada en embarazo e inmunodeprimidos Gripe Personal sanitario Trabajadores instituciones cerradas Trabajadores primeros auxilios o trabajadores para la comunidad (socorristas, militares..) – Virus fraccionados – Subunidades de virión – V. adyuvadas con MF59 – V. adyuvadas con virosomas 1 dosis anual IM Hepatitis A Trabajadores laboratorios de investigación Trabajadores instituciones cerradas Personal de limpieza en contacto con residuos Trabajadores de parvularios y guarderías Trabajadores de centros de producción o manipulación de alimentos – Virus enteros inactivados – V. de virus enteros inactivados adyuvadas con virosomas 2 dosis 0,6-12 m IM No cribado prevacunal en menores de 40 años Utilizar vacunas combinadas A-B si se precisan ambas Hepatitis B Personal sanitario Trabajadores de laboratorio clínico y de investigación Trabajadores instituciones cerradas Trabajadores primeros auxilios o trabajadores para la comunidad (socorristas, militares...) Personal de limpieza en contacto con residuos Trabajadores expuestos a sangre, pinchazos accidentales u otros fluidos (manicura, pedicura, acupuntura…) – V. recombinante 3 dosis (0,1,6 m) 4 dosis (0,1,2,12 m) (0,7, 21 d., y 12 m) IM Comprobar respuesta en personal de riesgo Poliomielitis Trabajadores de laboratorio que trabajan con poliovirus – V. inactivada 1 dosis SC o IM Rabia Trabajadores en contacto con animales salvajes, espeleólogos, zoologos Trabajadores de laboratorio que trabajan con el virus de la rabia – V. inactivada 3 dosis (0,7,21 d.) IM Rubéola Personal sanitario susceptible (mujer en edad fértil y personal en contacto con embarazadas) – Triple vírica (atenuada) 1 dosis SC Contraindicada en embarazo e inmunodeprimidos Sarampión Todo el personal sanitario susceptible – Triple vírica (atenuada) 2 dosis (0,1) SC Contraindicada en embarazo e inmunodeprimidos Tétanos/difteria Todos los adultos (vacuna sistemática) – Toxoide Primovacunación: 3 dosis (0,1,6-12 m) 1 dosis de recuerdo cada 10 años IM Tos ferina Personal de guardería, personal sanitario de servicios pediátricos – V. combinada (dTpa) 1 dosis IM No evaluada en embarazo Tuberculosis Trabajadores PPD negativo que trabajan en zonas de elevada prevalencia de TBC multirresistente y sin posibilidades de aplicar medidas de aislamiento – V. atenuada (BCG) 1 dosis Intradérmica Contraindicada en embarazo e inmunodeprimidos Varicela Personal sanitarios susceptible Trabajadores docentes susceptibles (guarderías, parvularios) – V. atenuada 2 dosis (0,1 m) SC Contraindicada en embarazo e inmunodeprimidos Viruela Trabajadores de laboratorio que manipulen Orthopoxvirus – V. atenuada 1 dosis SC (intradérmica) Contraindicada en embarazo e inmunodeprimidos SC: subcutánea. IM: intramuscular. 34 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 31-40 CAPITULO 19 03/05/10 12:30 Página 35 Medicina implica algún riesgo: zoólogos, geólogos, personas que trabajan en centros de protección animal, sobre todo de animales salvajes, o personal que se desplaza a zonas endémicas de rabia. Se debe tener en cuenta la profilaxis postexposición, que debe ser realizada igualmente, si bien el número de dosis será inferior a los no vacunados previamente. – Vacunas para trabajadores que manipulan específicamente el agente infeccioso: algunas vacunas sólo se recomiendan a personal de laboratorio que trabaja con determinados microorganismos o bien trabajadores de zonas endémicas que puedan estar en íntimo contacto con la fuente de infección de las mismas como parte de sus tareas rutinarias: vacuna de fiebre tifoidea, poliomielitis, peste, fiebre amarilla y viruela. VACUNACIÓN EN EL PERSONAL SANITARIO El personal sanitario se define como cualquier persona cuya actividad implique contacto con pacientes o con fluidos orgánicos de pacientes en un servicio sanitario, o un laboratorio. Si bien se han comentado brevemente las vacunaciones indicadas en el personal sanitario, conviene incidir en las mismas, dado el elevado riesgo que presentan, por su actividad profesional, de padecer alguna de las enfermedades inmunoprevenibles. Además, el desconocimiento de nuevas legislaciones sobre la adopción de medidas de prevención por las empresas, las bajas coberturas vacunales en el adulto, la excesiva confianza del trabajador que normalmente trabaja con enfermos y su entorno, y la escasa formación sobre vacunaciones y sus beneficios, son factores que determinan tanto la probabilidad de contagios como de accidentes con riesgo biológico inmunoprevenibles. Respecto a la prevención de infecciones inmunoprevenibles en el ambiente sanitario se han establecido tres grupos de vacunaciones indicadas en el personal sanitario (Tabla III): a) Vacunaciones generales del adulto: actualmente, todo adulto debe estar vacunado frente a tétanos y difteria (Td, 3 dosis 0,1, 6-12 meses) recomendándose por el momento dosis de recuerdo cada 10 años. Dado que se está observando un desplazamiento de los casos de tos ferina hacia la adolescencia y edad adulta en países como España, la ACIP recomienda sustituir la primera dosis de Td que corresponda a adultos de 19 a 64 años por una dosis de dTpa (difteria, tétanos, tos ferina acelular), siempre y cuando hayan sido vacunados correctamente en la infancia (calendario vacunas infantil desde 1964) y recibido la última dosis de Td 10 ó más años antes (10). Puesto que recientemente se han descrito casos de transmisión nosocomial de tos ferina a partir de personal sanitario infectado (11), la ACIP (Advisory Committee on Immunization Practices, CDC) recomienda recibir una dosis de vacuna dTpa en el trabajador sanitario en contacto con prematuro, recién nacidos o niños, con el fin de evitar la transmisión a los mismos, debiendo haber transcurrido al menos dos años desde la última dosis de Td recibida (10, 12, 13). Asimismo, deben vacunarse con una dosis de vacuna polisacárida 23-valente frente a neumococo, los trabajadores sanitarios que cumplan los criterios de indicación del resto de la población general: mayores de Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 65 años, patologías crónicas, infección por VIH, enfermedades hematológicas…(9). b) Vacunaciones en función de la susceptibilidad del trabajador sanitario: algunas de las vacunas recomendadas para el personal sanitario van a depender de determinados factores individuales. Se recomienda la vacunación frente a la hepatitis A con una pauta de dos dosis separadas 6-12 meses, previo estudio serológico, a trabajadores de los servicios de neonatología, pediatría, infecciosas, geriatría y digestivo, al personal de comedores, cafeterías, laboratorios de investigación, personal de limpieza, gestión de residuos y servicios de mantenimiento. En caso de no estar vacunado frente al virus de la hepatitis B se considerará administrar la vacuna combinada A+B (14). En caso de exposición a alimentos contaminados o contacto con heces de paciente infectado, la profilaxis postexposición en personal no inmunizado está indicada sólo en casos de contactos en brotes. Se recomienda la vacunación en los primeros 7 días y una dosis de inmunoglobulina intramuscular en los 14 días posteriores al contacto de riesgo, en inmunodeprimidos o con respuesta incompleta a la vacunación (14). La vacuna de la poliomielitis (tres dosis 0,1, 6 meses con vacuna inactivada de potencia aumentada) debe administrarse a personal sanitario susceptible en estrecho contacto con personas que pueden estar eliminando virus, circunstancia extraordinaria, ya que Europa fue considerada libre de polio en 2002, y a personal de laboratorio que maneja muestras sospechosas(15). Dado que la principal medida de prevención de la meningitis meningocócica es la quimioprofilaxis en los contactos próximos, sólo se recomienda la vacunación antimeningocócica en personal sanitario con elevado riesgo de enfermedad invasora: esplenectomizados, individuos con déficit del complemento o bien sanitarios que viajan al cinturón subsahariano de la meningitis. La inmunización debe realizarse con una dosis de la vacuna polisacárida A+C, administrando dosis de recuerdo cada 3-5 años, si persiste el riesgo (16). La vacunación frente a la fiebre tifoidea está indicada a personal de laboratorio que manipula muestras de Salmonella typhi. Consiste en la administración de tres dosis a días alternos (vacuna oral) o una dosis intramuscular (vacuna parenteral), con revacunaciones cada 3-5 años para la primera y cada tres años para la segunda, si persiste el riesgo. La recomendación de otras vacunas como la BCG, antirrábica o la vacuna frente a Haemophilus influenzae b, se realizará en función de otros factores o riesgos individuales como son viajes a zonas con brotes de tuberculosis multirresistente o donde existe gran probabilidad de contagio, manipulación de Rabdovirus, o inmunodeficiencias, respectivamente. Se debe tener en cuenta que en el personal sanitario con inmunodeficiencias pueden estar contraindicadas las vacunas vivas, o estar indicada la administración de vacunas con mayores dosis de antígenos y evaluación serológica de la respuesta inmune tras la vacunación. c) Vacunaciones indicadas por mayor riesgo en personal sanitario: estas vacunaciones deben aplicarse a todos los trabajadores sanitarios, tanto al personal con responsa- 35 31-40 CAPITULO 19 11/05/10 16:51 Página 36 Medicina Preventiva Tabla III. Vacunación en el personal sanitario Vacunaciones generales del adulto Vacunaciones según susceptibilidad individual Vacunaciones indicadas por mayor riesgo Enfermedad/vacuna Indicación* Administración Pauta vacunal Tétanos/difteria (Td)/(dTpa)1 Todos los adultos IM Primovacunación: 3 dosis (0,1,6-12 m) 1 dosis de recuerdo cada 10 años Enfermedad neumocócica Vacuna polisacárida 23-valente Adultos > 65 años o con mayor riesgo de complicaciones por enfermedades de base IM.- SC 1 dosis Revacunación si indicada Hepatitis A Vacuna inactivada Personal de laboratorio que trabaja con VHA o animales infectados Personal neonatología, pediatría, infecciosas, personal de comedores, limpieza, gestión de residuos IM Dos dosis (0,6-12 m) Fiebre tifoidea Inactivada (VPI) Atenuada (Ty21a) Personal de laboratorio que manipula muestras con patógeno IM VO 1 dosis , con dosis recuerdo cada 3 años (parenteral) 3 dosis días alternos y revacunación cada 3-5 años (oral) Polio (VPI potencia aumentada) (VPO, polio oral)2 Personal de laboratorio que maneja muestras con sospecha de virus Personal sanitario en estrecho contacto con paciente que esté eliminando virus IM 3 dosis (0,1,6 m) Enfermedad meningocócica Polisacárida (A+C) Personal sanitario con riesgo de enfermedad invasora o que viaja a zonas de elevada endemicidad IM 1 dosis Revacunación cada 3-5 años Tuberculosis BCG (Calmette-Guérin) Sanitarios en zonas con alta frecuencia de multirresistencia o grandes probabilidades de contagio Intradérmica 1 dosis Rabia/ V. inactivada Personal en contacto con animales salvajes Personal de laboratorio que trabaja con Rabdovirus IM 3 dosis (0,7,21d) Antigripal Todo personal sanitario IM 1 dosis anual Sarampión, rubéola, parotiditis Triple vírica Todo el personal sanitario no inmunizado SC 2 dosis (0,1 m)3 Antivaricela Todo el personal sanitario no inmunizado4 SC 2 dosis (0,1 m) Hepatitis B Todo el personal sanitario no inmunizado4 IM 3 dosis ( 0,1,6 m) No necesario dosis de refuerzo * Se deben tener en cuenta las contraindicaciones, reacciones adversas y precauciones generales de las vacunas. 1 En personal que atiende a niños prematuros y recién nacidos que requieren hospitalización. 2 Sólo indicada en caso de brotes. 3 Una dosis en >40 años. 4 Se recomienda determinación serológica previa. bilidad en la atención del enfermo (médicos, D.U.Es, auxiliares, fisioterapeutas, personal de emergencias y urgencias, estudiantes, …), como aquel sin contacto directo con el paciente (servicios ambientales, personal de seguridad, servicios de limpieza…). 1. Vacuna de la gripe: se han descrito brotes hospitalarios de gripe a partir de enfermos que ingresan por procesos gripales o bien a través de personal sanitario infectado que actúa como fuente de infección. El 36 principal objetivo de la vacunación anual frente al virus de la gripe en el profesional sanitario es la reducción de la transmisión de los virus influenza en el medio sanitario. Las recomendaciones de vacunación de los CDC incluyen médicos, enfermeras y otro personal hospitalario de atención a pacientes ambulatorios o ingresados, empleados de geriátricos, centros de larga estancia, estando especialmente indicada en aquellos servicios cuyos pacientes presentan elevado Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 31-40 CAPITULO 19 03/05/10 12:30 Página 37 Medicina riesgo de complicaciones. Además, la vacunación disminuye una causa importante de absentismo laboral y ha demostrado ser coste-efectiva (17, 18). En caso de brote extrahospitalario, debe recomendarse la vacunación de todo el personal sanitario y la quimioprofilaxis durante dos semanas para el personal recientemente vacunado que desarrolle su labor asistencial con pacientes de alto riesgo, así como la profilaxis de todo el personal si la cepa es diferente a las presentes en la vacuna de ese año. Por último, se puede considerar el uso de amantadina, rimantadina (influenza A) o zanamivir y oseltamivir (influenza A y B) en personal no vacunado tras la exposición, si bien se desconoce por el momento la eficacia de estos últimos en profilaxis pre y postexposición y, por otro lado, suelen presentar efectos adversos que en ocasiones obligan a suspender el tratamiento. 2. Vacuna triple vírica (parotiditis, sarampión, rubéola): las tres infecciones constituyen un riesgo para el personal sanitario, dada su transmisión por gotitas o vía aérea (sarampión), la contagiosidad de las mismas durante el periodo de incubación y el hecho de que el antecedente previo de haber padecido alguna de ellas no es fiable, por lo cual muchos trabajadores creen ser inmunes y realmente son susceptibles. En España, desde 1981 se dispuso de la vacuna triple vírica con la introducción de la segunda dosis en 1988 (a los 11 años) y posteriormente a los 3-6 años. A pesar del descenso observado tras su empleo, se describen aún casos, algunos de ellos en el medio sanitario en el que están implicados trabajadores sanitarios y que ocasionalmente pueden tener una importante trascendencia: caso de sarampión en una unidad de inmunodeprimidos o rubéola congénita… Por ello, actualmente en personal sanitario nacido antes de 1966, que posiblemente posean inmunidad natural, se recomienda una dosis de triple vírica a aquellos sin antecedentes clínicos de cuadro sugerente y/o serológicos. En cambio, el trabajador sanitario nacido después de 1966, sin constancia de vacunación y sin antecedentes clínicos, debe ser vacunado con dos dosis separadas 1 mes (9, 19). No está indicado el seguimiento serológico tras la vacunación. No existe una profilaxis postexposición efectiva, por lo que el personal susceptible y expuesto debe ser apartado de la atención sanitaria (al menos hasta 21 días después de la última exposición o hasta 5-7 días tras la aparición del exantema), y seguir las precauciones universales para evitar la transmisión por gotas (rubéola, parotiditis) o por vía aérea (sarampión). 3. Vacuna antivaricela: aunque suele ser una enfermedad leve en la edad infantil y prácticamente el 95% de la población mayor de 14 años está inmunizada, los casos de varicela en embarazadas, neonatos, inmunodeprimidos o adultos pueden tener graves complicaciones (1-2% de los adultos requieren hospitalización). Por otro lado, con frecuencia se ha descrito transmisión hospitalaria, tanto a partir de pacientes como de personal o por visitantes. Dada la importancia de la infección y la posibilidad de transmisión aérea sin contacto directo con el paciente índice, se debe asegurar la Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva inmunización natural o por vacunación de todo el personal sanitario (21). Se recomienda la determinación serológica previa de anticuerpos, medida probablemente coste-efectiva en individuos sin antecedentes de haber padecido una varicela o historia dudosa, y posterior vacunación con dos dosis a intervalo mínimo de un mes, al personal sanitario susceptible con especial interés en mujeres de edad fértil. Se debe evitar el embarazo en los tres meses posteriores y, si bien es rara la aparición de un exantema posvacunal y el riesgo de transmisión de la cepa vacunal es bajo, en caso de aparecer, ese trabajador debe ser retirado temporalmente (aproximadamente cinco días) de la asistencia sanitaria, fundamentalmente en los servicios de atención a inmunodeprimidos o pacientes con elevado riesgo de varicela diseminada (22). Tras la exposición al virus en personal no inmunizado, dicho personal se considera contagioso desde el día 10 al 21 postexposición, por lo que debe ser retirado de la atención sanitaria. Puede administrarse una dosis de vacuna lo antes posible, dado que dicha vacunación en los 3-5 días postexposición puede modificar el curso natural de la infección. No obstante, la respuesta es sólo parcialmente efectiva, siendo además difícil diferenciar, en caso de la presencia de exantema, una varicela posvacunal o adquirida tras el contacto con la fuente de infección. De cualquier forma, se recomienda la vacunación aunque sea posterior al quinto día, ya que la exposición no indica infección, con lo que el trabajador queda inmunizado para posteriores contactos. Dado que la administración de inmunoglobulina específica no es totalmente eficaz y puede prolongar el periodo de incubación de la infección, sólo se recomienda en personal susceptible expuesto con alto riesgo (leucemias, inmunodeficiencias congénitas, VIH) en las primeras 72 horas, desconociéndose su eficacia si se administra por encima de las 96 horas. Finalmente, en caso de padecer una infección por virus varicela-zóster, se recomienda el tratamiento antiviral en las primeras 72 horas desde que se inicia la clínica (valaciclovir, fanciclovir o aciclovir) (21). 4. vacuna de la hepatitis B: según la legislación vigente, la infección por el virus de la hepatitis B se considera enfermedad profesional por su mayor riesgo en el medio sanitario (RD 1995/1978 de 12 de mayo) (5). La transmisión del virus de la hepatitis B (VHB) supone un gran riesgo para el personal sanitario (seroprevalencia 10 veces mayor que en población general en los años 70), y continúa siendo frecuente debido a varios motivos: a) el frecuente contacto percutáneo con sangre en la actividad asistencial; b) la elevada estabilidad del virus en ambiente seco (1 semana a 25ºC y 42% de humedad); c) la transmisibilidad notablemente mayor que la del VIH y virus de la hepatitis C, con tasas entre un 6% y un 30% tras lesión percutánea con aguja contaminada, siendo menor en caso de exposición a piel intacta o mucosas; d) el desconocimiento por parte del personal del estado infectivo del paciente, y finalmente, e) las coberturas vacunales variables entre el personal sanitario. 37 31-40 CAPITULO 19 11/05/10 16:53 Página 38 Medicina Preventiva Estos hechos, junto con la descripción de brotes hospitalarios por transmisión a partir de personal sanitario infectado y, dada la efectividad demostrada por la vacunación sistemática del personal sanitario en el descenso de la prevalencia de infección, en la actualidad hace muy recomendable la inmunización sistemática de todo trabajador sanitario, mayor de 30 años, susceptible frente a VHB, inicialmente con la pauta estándar de 3 dosis (0,1,6 meses). Se debe realizar un estudio serológico posterior de seroconversión entre 1 y 2 meses tras la administración de la última dosis. Si el título de antiHBs (anticuerpos frente al antígeno de superficie de VHB) es igual o superior a 10 mUI/ml, se considerará respondedor (algunos autores consideran baja respuesta si está entre 10 y 100 mUI/ml) y no serán necesarias dosis de recuerdo, ni controles posteriores (22). En caso de no alcanzar dicho título, se repetirá la pauta vacunal, con una probabilidad de 30-50% de respuesta a esta segunda serie. Si no existe respuesta (AntiHBs<10 mUI/ml), se considerará “no respondedor”, no indicándose nuevas dosis, aunque no estará inmunizado. PROFILAXIS POSTEXPOSICIÓN A PATÓGENOS DE TRANSMISIÓN PARENTERAL Los accidentes con riesgo biológico son el principal problema de los trabajadores sanitarios y, dentro de ellos, fundamentalmente los de transmisión sanguínea: VIH, VHB y VHC. La OMS estima que el personal sanitario sufre alrededor de 2 millones de pinchazos con agujas anualmente, que resultan en infecciones por VHB, VHI, y VHC, cifras probablemente subestimadas debido a la falta de sistemas de vigilancia y subregistro de las lesiones (23). Debido al elevado riesgo de transmisión, se debe concienciar al personal sanitario sobre la importancia de la Exposición accidental Declaración del accidente a Servicio de Riesgos Laborales, Medicina de Empresa Detección de anti-VHC FUENTE Detección de anti-VHC RECEPTOR NEGATIVO NEGATIVO No seguimiento de receptor POSITIVO Determinación de ARN viral de fuente positiva POSITIVO (fuente infecciosa) Estudios de transaminasas y anti-VHC a receptor cada 2-3 meses Positividad para anti-VHC en los 6 meses POSITIVO Derivar a servicios médicos NEGATIVO Se descarta infectividad Negatividad anti-VHC a los 6 meses (12 meses en caso de coinfección por VIH) Estudio de ARN viral No transmisión de la infección por VHC POSITIVO NEGATIVO Infección por VHC Derivar a servicios médicos Infección autolimitada Figura 1. Conducta a seguir tras exposición accidental al VHC. 38 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 31-40 CAPITULO 19 03/05/10 12:30 Página 39 Medicina prevención de transmisión de patógenos hemáticos y el uso de equipos de protección individual cuado se prevea el contacto con sangre u otros fluidos potencialmente infecciosos. En el ámbito sanitario se considera exposición ocupacional a patógenos de transmisión sanguínea a cualquier lesión percutánea (pinchazo o corte con un objeto punzante) o el contacto con mucosas o piel (no intacta, contacto prolongado o que implica áreas extensas) con sangre, tejidos o fluidos orgánicos potencialmente infecciosos (semen, secreciones vaginales, líquidos estériles…) aunque se desconoce el riesgo de transmisión a partir de los mismos. Otros, como heces, secreciones nasales, saliva, esputo, vómitos, lágrimas u orina no se consideran potencialmente infecciosos. En caso de exposición de riesgo, existen varios factores que deben considerarse para evaluar la conducta a seguir: – Tipo de exposición: percutánea, mucosas o piel no intacta – Tipo y cantidad de líquido o tejido: sangre, fluidos potencialmente infecciosos. – Estado infeccioso de la fuente: determinar, siempre que sea posible, la presencia de AgHBs, VIH y VHC. – Situación inmunológica de la persona expuesta: vacunación frente a VHB, respuesta inmune a la misma e inmunidad frente a otros patógenos de transmisión parenteral. Puesto que actualmente no existe inmunoprofilaxis para la exposición percutánea frente a VIH y VHC, la principal estrategia para reducir la infección consiste en la elaboración de protocolos escritos para la rápida notificación, investigación, asesoramiento, tratamiento y seguimiento de las exposiciones que puedan poner en riesgo al personal sanitario. En el caso de exposición percutánea con sangre de fuente VIH positiva, el riesgo medio de transmisión es 0,3%, aunque este riesgo puede verse aumentado si la exposición implica gran volumen de sangre o existe carga viral elevada en enfermo fuente (24). En exposiciones de mucosas y piel es de 0,1% y <0,1% respectivamente (25, 26). Preventiva Se debe disponer de antirretrovirales para ser administrados inmediatamente (pautas de dos o tres fármacos, según el caso), ya que el retraso en su administración disminuye la eficacia de la profilaxis postexposición, además de otros factores como carga viral, volumen sanguíneo y duración inapropiada de la quimioprofilaxis (menos de 4 semanas). Por otro lado, se recomienda el seguimiento serológico durante al menos 6 meses (momento de exposición, 6 semanas, 3 meses y 6 meses postexposición), advirtiendo de las precauciones a tomar para prevenir la transmisión secundaria. El riesgo medio de seroconversión en exposición percutánea con fuente de hepatitis C positiva varía entre un 1,8% y 10% según estudios (24). El Comité Asesor sobre Prácticas de Inmunización (ACIP) concluye que en el momento actual no se justifica el uso de inmunoglobulinas en la profilaxis tras la exposición, debido, entre otros motivos, a ausencia de respuesta inmune protectora tras la infección por VHC (25). Además, no existen ensayos clínicos sobre la eficacia de interferón o rivabirina en la profilaxis, no estando aprobados por la FDA para esta indicación. En ausencia de profilaxis, la conducta clínica correcta corresponde a la identificación lo más rápidamente posible de la infección crónica, mediante seguimiento serológico (al menos 6 meses) y niveles de transaminasas hepáticas, ya que teóricamente la administración de antivíricos en el momento de detección de la viremia podría evitar la infección crónica. Por ello, algunos autores recomiendan realizar también carga viral a las 2-4 semanas. No obstante, no existen datos sobre la eficacia del tratamiento en la infección aguda (ARN positivo desde hace menos de 6 meses y niveles normales de transaminasas), teniendo en cuenta que entre el 15% y 20% de las infecciones agudas evolucionan hacia la curación (Figura 1) (25). Si tras los 6 meses del contacto no existe seroconversión (anti-VHC negativo), se considerará que no ha existido Tabla IV. Profilaxis recomendada tras exposición al virus de la hepatitis B (25) Situación inmunológica de personal expuesto Estado de fuente de infección No vacunado Vacunado respondedor1 AgHBs positivo 1 dosis de IgHB3 Inicio de vacunación AgHBs negativo Vacunado no respondedor Estado inmunológico desconocido Revacunado2 No revacunado No tratamiento IgHB (2 dosis) IgHB (1 dosis) Inicio revacunación Determinación de AcHBs Si ≥10 mUI/ml: No tratamiento Si <10 mUI/ml: IgHB (1 dosis) y dosis de recuerdo Inicio de vacunación No tratamiento No tratamiento Inicio revacunación No tratamiento Desconocido alto riesgo Inicio de vacunación No tratamiento IgHB (2 dosis) IgHB (1 dosis) Inicio revacunación Determinación de AcHBs Si ≥10 mUI/ml: No tratamiento Si <10 mUI/ml: dosis de recuerdo y serología 1-2 meses después Desconocido bajo riesgo Inicio de vacunación No tratamiento No tratamiento Inicio revacunación AntiHBs ≥ 10 mUI/ml. Revacunación: nueva pauta de 3 dosis administrada tras la serie primaria. Dosis de 0,06 ml/kg intramuscular. IgHB: inmunoglobulina específica para hepatitis B. AgHB: antígeno de superficie del virus de la hepatitis B. AcHBs: anticuerpo frente al antígeno de superficie del virus de la hepatitis B. 1 2 3 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 39 31-40 CAPITULO 19 11/05/10 18:21 Página 40 Medicina Preventiva Tabla V. Información incluida en los registros vacunales del Servicio de Prevención (salud laboral) Nombre del trabajador Número de identificación del trabajador Fecha de nacimiento/edad Fecha de vacunación Vacuna administrada, fabricante, número de lote Lugar de vacunación Complicaciones (si las hubiera) Nombre, cargo del que administra la vacuna Consentimiento informado por escrito transmisión, pero si se positiviza, debe realizarse una carga viral y niveles de transaminasas. Si el ARN es indetectable, se interpreta como infección autolimitada por VHC. En cambio, en caso de carga positiva, se interpretará como infección por VHC y se derivará para valoración clínica. El seguimiento serológico se prolongará al año si la fuente era también seropositiva para VIH, ya que la coinfección puede retrasar la aparición de anti-VHC. El riesgo de exposición percutánea con fuente positiva para el VHB en personal no inmunizado oscila entre el 2% (si el paciente fuente es HBeAg- y HBsAg +) y el 40% (paciente fuente con patrón HBeAg +, HBsAg +) (24). La conducta a seguir, dado que existe una profilaxis tanto pre como postexposición eficaz, va a variar sobre todo según la situación inmune de individuo expuesto y el estado de la fuente de infección (Tabla IV) (25). En cualquier caso, la administración de inmunoglobulina específica y/o dosis vacunal debe realizarse tan pronto como sea posible, preferiblemente en las primeras 24 horas tras el contacto, y no posterior a una semana, teniendo en cuenta que la administración simultánea de ambas (siempre en lugares anatómicos diferentes) no disminuye la eficacia de la vacuna. REGISTROS VACUNALES Como sucede en el caso de la vacunación sistemática infantil vigente, en el RD664/1997 se especifica la obligatoriedad de dejar constancia escrita del ofrecimiento y aceptación de la vacunación, previa información de ventajas e inconvenientes de la misma o de la no vacunación. Dentro de los planes de inmunización en el colectivo expuesto se incluye el establecimiento de un registro individual y colectivo de las vacunas administradas y las reacciones adversas. Este registro permite conocer toda la información sobre el estado de inmunización de todos los trabajadores y debe permanecer en el servicio de salud laboral de la institución a la que pertenece (Tabla V) BIBLIOGRAFÍA 1. García AM, Gadea R. Estimación de la mortalidad y morbilidad por enfermedades laborales en España. Arch Prev Riesgos Labor 2004;7:3-8. 2. Ley 31/95 de 8 de Noviembre de Prevención de Riesgos Laborales. 3. Real Decreto 664/1997, de 12 de mayo, sobre la protección de los trabajadores contra los riesgos relacionados con la exposición a agentes biológicos durante el trabajo. 4. Directiva Europea 2000/54/CE del Parlamento Europeo y del Consejo de 18 de septiembre de 2000, sobre la protección de los trabajadores contra los 40 riesgos relacionados con la exposición a agentes biológicos durante el trabajo (séptima directiva específica con arreglo al apartado 1 del artículo 16 d ela directiva 89/391/CEE. 5. Real Decreto 1995/1978, de 12 de mayo, sobre la consideración de Hepatitis B como enfermedad profesional. 6. NTP384: La Inmunización activa: una herramienta de prevención. Instituto Nacional de Seguridad e Higiene en el Trabajo. Ministerio de Trabajo y Asuntos Sociales, 2007. 7. Immunization Program, Section II-Immunization Schedules. Immunization Manual. CDC, 2007: http://www.bccdc.org/content.php?item=193. 8. Immunization of health and childcare workers. Immunization Program, Section III-Immunization of special populations. CDC, 2007: http://www.bccdc.org/content.php?item=193. 9. Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. Vacunas 2006;7 (supl 1):1-173. 10. CDC. Preventing Tetanus, diphteria, and Pertussis among adults: Use of tetanus, toxoid, reduced diphteria toxoid and acelular pertussis vaccine recommendations of the Advisory Committee on Immunization Practices (ACIP) and recommendations of ACIP, supported by the Healthcare Infection Control Practices Advisory Committee (HICPAC), for use of Tdpa among Health Care Personnel. MMWR 2006;55:1-33. 11. Summary of notifiable diseases, United States, 2000. MMWR 2002;49;1-100. 12. Cortese MM, Baughman AL, Brown K, Srivastava P. A “new age” in pertussis prevention new opportunities through adult vaccination. Am J Prev Med 2007;32:177-185 13. Salleras l, Bayas JM, Calbo F, Campins M, Castrodeza J, Cerrillo A, Conde M, Domínguez A, Domínguez V, Forcada JA, Gil A, de Juanes JR, Saenz MC. Vacunación anti-tos ferina de los adolescentes y adultos. Puesta al día. Vacunas 2007;1:38-47. 14. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). CDC. MMWR Recomm Rep 2006;55(RR-7):1-23. 15. Poliomyelitis prevention in the United States. Updated recommendations of the Advisory Committee on Immunization Practices (ACIP). CDC. MMWR Recomm Rep 2000;49(RR-5):1-22. 16. Prevention and control of meningococcal disease. Recommendations of the Advisory Committee on Immunization Practices (ACIP).National Center for Infectious Diseases, Centers for Disease Control and Prevention (CDC). MMWR Recomm Rep 2005;54(RR-7):1-21. 17. Prevention of control of influenza: Recommendations of the Advisory Committee on Immunization Practices (ACIP). CDC. MMWR 2007;56 (RR06):1-54. 18. Nichol KL, Lind A, Margolis KL, Murdoch M, McFadden R, Hauge M, Magnan S, Drake M. The effectiveness of vaccination against influenza in healthy, working adults. N Engl J Med 1995;333:889-93. 19. Grupo de trabajo de vacunación de adultos de la ponencia de programas y registro de vacunaciones. Vacunación en adultos, recomendaciones. Ministerio de Sanidad y Consumo Eds., 2005:38-43. 20. Measles, mumps, and rubella-vaccine use and strategies for elimination of measles, rubella, and congenital rubella syndrome and control of mumps: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm Rep 1998;47(RR-8):1-57. 21. Prevention of varicella: Recommendations of the Advisory Committee on Immunization Practices (ACIP), CDC. MMWR 2007;56 (RR04):1-40. 22. Puro V, De Carli G, Cicalini S, Soldani F, Balslev U, Begovac J, Boaventura L, Campins Martí M, Hernández Navarrete MJ, Kammerlander R, Larsen C, Lot F, Lunding S, Marcus U, Payne L, Pereira AA, Thomas T, Ippolito G. The European Occupational Post-Exposure Prophylaxis Study Group. European recommendations for the management of healthcare workers occupationally exposed to hepatitis B virus and hepatitis C virus. Euro Surveill 2005;10:260-4. 23. Wilburn SQ, Eijkemans G. La prevención de pinchazos con agujas en el personal de salud. Int J Occup Environ Health 2004;10:451-6. 24. Prüss-Üstün A, Rapiti E, Hutin Y. Sharps injuries: global burden of disease from sharps injuries to health-care workers. World Health Organization, 2003 (WHO Environmental Environmental Burden of Disease Series, No. 3) 25. Updated US. Public Health Service Guidelines for the Management of Occupational Exposures to HBV, HCV, and HIV and Recommendations for Postexposure Prophylaxis. MMWR 2001;50(RR-11):1-42. 26. Updated US. Public Health Service Guidelines for the Management of Occupational Exposures to HIV and Recommendations for Postexposure Prophylaxis. MMWR 2005;54;RR(9);1-11. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 41 Medicina Preventiva Capítulo 20 VACUNACIONES EN VIAJEROS INTERNACIONALES J. Fernández Crehuet, R. López Hospital Universitario de la Victoria, Málaga INTRODUCCIÓN El número de personas que realizan viajes internacionales crece de forma continua, tanto por razones de turismo, humanitarias, profesionales, peregrinaciones, migraciones… Los desplazamientos son cada vez más largos y rápidos. Crece también el número de viajeros con mayores riesgos: personas de edades avanzadas, lactantes y niños pequeños, inmigrantes que regresan a sus países de origen para visitar a sus familiares… Los viajeros internacionales, que se desplazan desde zonas con niveles de protección sanitaria elevados a zonas más desprotegidas, deberían adoptar una serie de medidas de prevención antes, durante y después del viaje (1, 2). Las vacunas constituyen una herramienta básica en la prevención de numerosos riesgos sanitarios derivados del viaje. Las consultas a los centros especializados en la atención a los viajeros deben realizarse con una antelación suficiente (al menos de 4 a 6 semanas) y las recomendaciones han de ser personalizadas. En España existen Centros de Vacunación Internacional de titularidad estatal (dependientes de la Dirección General de Salud Pública y Sanidad Exterior) y otros dependientes de las CCAA o administraciones locales, que ejercen la competencia estatal mediante encomienda de gestión. Las vacunas destinadas a la inmunización de los viajeros que se desplazan a regiones con riesgos sanitarios diferentes al país de residencia pueden agruparse en tres apartados (1): 1. Vacunas que pueden ser obligatorias en determinados países: a. Fiebre amarilla b. Meningitis meningocócica (sólo en peregrinos a Arabia Saudí) c. Polio (en viajeros a Arabia Saudí) 2. Vacunas que pueden ser recomendables por razón de viaje: a. Cólera b. Encefalitis Japonesa c. Encefalitis Centro-Europea d. Fiebre Amarilla e. Fiebre Tifoidea f. Hepatitis A/ Hepatitis A+B g. Meningitis meningocócica h. Rabia 3. Vacunas de rutina: a. Difteria-tétanos-tosferina b. Gripe estacional c. Hepatitis B d. Haemophilus influenza tipo b e. Neumocócica f. Polio Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 g. Papilomavirus humano h. Rotavirus i. Triple vírica (Sarampión-Rubéola-Parotiditis) j. Tuberculosis k. Varicela Vacunas que pueden ser obligatorias en determinados países: La única vacunación obligatoria establecida en el Reglamento Sanitario Internacional (RSI-2005), elaborado por la Organización Mundial de la Salud (OMS), es la que se hace frente a la fiebre amarilla, y se establece por dos razones: a. Para proteger a las personas en áreas donde existe riesgo de transmisión de la enfermedad. b. Para proteger a los países vulnerables de la importación del virus de la fiebre amarilla. Sin embargo, algunos países establecen exigencias particulares, como Arabia Saudí, que exige la vacunación frente a la enfermedad meningocócica a los peregrinos que visitan anualmente La Meca o Medina (Hajj y/o Umrah). Igualmente, Arabia Saudí requiere que los viajeros procedentes de países con situación endémica de poliomielitis (o que han notificado recientemente casos) acrediten una vacunación antipoliomielítica con al menos 6 semanas de antelación a la entrada en el país. Vacunas que pueden ser recomendables por razón de viaje: Se recomendarán en base al riesgo individual de cada viajero, considerando: • El riesgo de exposición a la enfermedad (geográfico, estacional, duración del viaje, tipo de alojamiento, conductas de riesgo…) • Edad, estado de salud, historia vacunal y tiempo disponible (desde la consulta hasta el viaje). • Alergias o reacciones previas a vacunas • Riesgo de infectar a otros, y • Coste Vacunas de rutina La mayor parte de las vacunas administradas en el calendario de vacunación infantil requieren dosis de recuerdo para mantener niveles efectivos de protección en los adultos. Es muy frecuente el descuido en las dosis de refuerzo tras el calendario vacunal, particularmente cuando el riesgo de infección percibido es bajo, así como la posibilidad de que las personas de mayor edad no hayan sido vacunadas nunca. Los viajes son una buena ocasión para revisar el estado de inmuni- 41 41-61 CAPITULO 20 03/05/10 13:02 Página 42 Medicina Preventiva zación de los viajeros, con independencia de la edad. A los viajeros no vacunados o vacunados de manera incompleta se les debe ofrecer las vacunas habituales en los calendarios de vacunación del país de residencia, además de las específicas para el viaje. Es importante ser conscientes de que enfermedades como la difteria y la poliomielitis, que son excepcionales en la mayoría de los países industrializados, pueden estar presentes en los países visitados por los viajeros. VACUNA FRENTE A LA FIEBRE AMARILLA La Fiebre Amarilla es una enfermedad hemorrágica viral producida por un arbovirus del género Flavivirus, trasmitida por la picadura de mosquitos (sobre todo Aedes aegypti), que constituye un importante problema de Salud Pública en numerosos países y se estima que causa 200.000 casos y 30.000 muertes en el mundo cada año. La enfermedad cursa de forma variable, desde simple fiebre a ictericia asociada a hemorragias difusas, que produce un 20-50% de mortalidad en los casos graves. Desde 1980 es considerada una enfermedad reemergente en las regiones de África Subsahariana, donde se producen el 80% de los casos notificados y en Sudamérica, cuyos últimos brotes epidémicos se han producido en 2008 y 2009. No existe tratamiento antiviral específico y la vacunación frente a la Fiebre Amarilla (FA) es la medida más importante en la prevención de la enfermedad. La vacunación es obligatoria en 19 países con independencia de la procedencia del viajero y en 103 países si se procede de países con riesgo de trasmisión de FA. En 2009, la OMS reconoce que existe riesgo de transmisión en 22 países africanos y en 11 sudamericano (1). La FA constituye un riesgo importante para más de 3 millones de viajeros que se desplazan cada año a zonas de riesgo. En las personas no vacunadas que penetran en zonas epidémicas de África se estima un riesgo de contraer la FA de 1/267 y de muerte por FA de 1/1.333 para una estancia de 2 semanas en la zona, aunque el riesgo varía estacionalmente; las cifras para Sudamérica son casi 10 veces menores. Vacunas En la década de 1930 se desarrollaron dos vacunas vivas atenuadas: la vacuna francesa, obtenida por pases del virus humano en cerebro de ratón (elaborada en 1927 en el Instituto Pasteur de Dakar), y la vacuna 17D, obtenida por pases de virus humano (160 pases) en huevos de gallina embrionados. La primera de ellas ampliamente utilizada en el África occidental, produjo una gran reducción de la enfermedad desde 1940 a 1952, pero también encefalitis en menores de 10 años, por lo que se abandonó la vacunación en niños y dejó de producirse en 1980. La vacuna 17D se elaboró en 1937 y mostró menos reacciones adversas y una protección del 95% en un estudio llevado a cabo en Brasil en 1938. Durante 1951 y 1952 se registraron varios casos de encefalitis en lactantes por lo que se desaconsejó el uso de la vacuna en menores de 6 meses. En 1957, el Comité de Expertos en Fiebre Amarilla de la OMS concluyó que la elección de la cepa viral utilizada para la vacunación debería estar bajo el control de las autoridades sanitarias, expresando la necesidad de poseer lotes de siembra primarios y secundarios controlados para su fabricación. En 1976, la OMS estableció los test de seguridad a los que debe someterse la vacuna y las pruebas de 42 estabilidad. En 1988 la OMS/UNICEF propuso la incorporación de la vacuna de FA en los programas de vacunación sistemática de los países con riesgo de dicha enfermedad. Se dispone, por tanto, desde hace más de 70 años de la vacuna 17D (elaborada a partir de un virus salvaje aislado en Ghana en 1927, la cepa Asibi) (3). La vacuna de FA es segura y muy eficaz, capaz de producir anticuerpos neutralizantes en el 90% de los vacunados en 10 días y en el 99% en 30 días; es recomendada por la OMS para los residentes de áreas afectadas y los viajeros a zonas con riesgo. La inmunidad se suele prolongar durante decenios (3035 años), aunque la validez del certificado oficial de vacunación de FA es de 10 años. El virus vacunal atenuado se presenta en dos formas: la subcepa 17D-204 y la 17DD, cuyas secuencias son homólogas en un 99,9%. La diferencia entre el virus salvaje de la cepa Asibi y los virus vacunales atenuados se reduce a 20 aminoácidos, lo que conlleva modificaciones en la envoltura del virus, de tal forma que el virus vacunal no es transmisible por los mosquitos. Composición de la vacuna disponible en España La vacuna actualmente comercializada (Stamaril®,Sanofi Pasteur MSD) contiene: Principio activo: virus de la Fiebre Amarilla cepa 17D cultivados en embriones de pollo libres de patógenos específicos (especialmente de virus de la leucosis aviar) igual o superior a 1.000 unidades DL50 ratón. Medio estabilizante: lactosa, sorbitol, clorhidrato de Lhistidina, L-alanina, cloruro sódico, cloruro potásico, fosfato disódico, fosfato monopotásico, cloruro cálcico, sulfato magnésico. Excipientes del disolvente: cloruro sódico (0,4 %), agua para inyectables. Pauta de administración Se administra en una sola dosis de 0,5 ml., por vía subcutánea (preferible) o intramuscular. La pauta de vacunación es igual para niños y adultos. No interfiere con otras vacunas administradas con jeringuillas diferentes en lugares distintos; sin embargo, las vacunas vivas atenuadas por vía parenteral deben administrarse simultáneamente o con un mes de diferencia (antes o después) con respecto a la vacuna de FA. Esta recomendación se hace en base a la hipótesis de que el interferón liberado en respuesta a la primera vacunación podría tener un efecto inhibidor temporal sobre las vacunas posteriores de virus vivos. El Reglamento Sanitario Internacional y el Certificado Internacional de Vacunación que debe acompañar a toda vacunación de FA, establecen la protección 10 días después de su administración y dosis de recuerdo cada 10 años. En España, la vacunación frente a la fiebre amarilla se debe realizar en un centro autorizado por la Dirección General de Salud Pública del Ministerio de Sanidad y Política Social. Seguridad de las vacunas contra la fiebre amarilla y efectos adversos Se han administrado al menos 400 millones de dosis de vacuna antiamarílica con una seguridad excelente. Se han registrado efectos adversos banales en el 10-30% de los vacunados: cefaleas (en las que es frecuente el dolor retroor- Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 43 Medicina bitario), mialgias, astenia, fiebre, malestar… Las reacciones adversas graves son extremadamente raras y pueden agruparse en tres tipos: 1. Reacciones de hipersensibilidad La frecuencia de reacciones alérgicas graves, sobre todo reacciones anafilácticas, es muy baja. La vacuna está contraindicada en personas con antecedentes de intolerancia oral al huevo o reacciones alérgicas a los productos con huevo. En caso de alergia a las proteínas de huevo, las reacciones alérgicas generalizadas son posibles, aunque raras. La sensibilidad a la gelatina, utilizada para estabilizar la vacuna, puede explicar algunos casos. 2. Enfermedad posvacunal neurotrópica Desde 1945 se conocen al menos 26 casos de encefalitis posvacunal, de los cuales 16 se han presentado en menores de 7 meses. Entre los 26 casos, 24 se recuperaron sin secuelas. Un virus vacunal aislado en el encéfalo de un niño de 3 años que falleció, era portador de mutaciones que afectaban a las proteínas de la envoltura y mostró un aumento de la neurovirulencia en estudios animales. Se ignora si los otros casos presentaban mutaciones comparables de la cepa vacunal. Otro fallecimiento ocurrió en un adulto inmunodeprimido infectado por VIH. 3. Enfermedad posvacunal viscerotrópica Se conocen al menos 7 casos de enfermedad viscerotrópica asociados a la vacuna frente a la FA, de los cuales fallecieron 6; también hay descritos 11 casos probables, de los que dos fallecieron. El estudio de los 7 primeros casos conduce a pensar que la gravedad de las reacciones es debida en mayor medida a una especial susceptibilidad del huésped y no a una inestabilidad genómica del virus vacunal atenuado. El riesgo de reacción viscerotrópica a la vacuna frente a la FA se limita a la primovacunación. La frecuencia se estima en un caso por cada 10 millones de dosis, considerando todos los grupos de edad; entre los adultos en general alcanza un caso entre 200.000-300.000 vacunados y entre los mayores de 60 años, un caso de cada 40.000-50.000 personas vacunadas. La OMS vigila desde 2001 la seguridad de las vacunas antiamarílicas, con particular atención a las formas viscerotrópica y neurotrópica de la enfermedad asociadas a dicha vacuna. Ya se había notificado anteriormente que la edad avanzada (superior a los 60 años) era un factor de riesgo para las formas viscerotrópica y neurotrópica de la enfermedad. Se ha reconocido recientemente que las enfermedades del timo son un posible factor de riesgo independiente para la forma viscerotrópica de la fiebre amarilla. No obstante, dada su baja incidencia, se tiene poca información sobre otros factores de riesgo de la forma viscerotrópica de la enfermedad. Se considera que es preciso disponer de mejor información para pronosticar el riesgo, predecir qué grupos de población son más vulnerables y qué factores aumentan el riesgo de sufrir los dos tipos de acontecimientos adversos graves tras la vacunación. La OMS ha señalado también que existe una cuestión crítica, y aún no resuelta, relativa a la inocuidad y eficacia del uso de la vacuna antiamarílica en personas infectadas por el VIH. El Comité de expertos de FA de la OMS reitera que es preciso tener un cuidado especial en administrar la vacuna únicamente a los viajeros que estén expuestos a un riesgo cierto de exposición al virus natural de la fiebre amarilla. Además, los médicos que prescriben las vacunas deben ponderar cuidadosamente los riesgos y las ventajas de la administración de la vacuna antiamarílica a viajeros de edad Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva avanzada y deben preguntar siempre, con independencia de su edad, si el paciente ha padecido alguna enfermedad del timo; si es así, deben considerarse otras medidas de prevención. Contraindicaciones de la vacunación La vacuna frente a la fiebre amarilla no debe administrarse en niños menores de 6 meses, y salvo situaciones de alto riesgo, tampoco entre los 6 y 8 meses. Igualmente se contraindica en personas con alergia al huevo y también en casos de inmunosupresión grave. La vacuna 17D no se recomienda teóricamente durante el embarazo, pero las mujeres embarazadas pueden ser vacunadas si el riesgo de infección es elevado. En caso de embarazo inadvertido, no está justificado el aborto. Se recomienda evitar el embarazo hasta 30 días después de recibir la vacuna. Es relativamente fácil evitar la vacunación en menores de 9 meses y en personas con alergia conocida al huevo, sin embargo, las contraindicaciones durante el embarazo o por inmunodeficiencias (congénitas o adquiridas), presentan frecuentes problemas prácticos. Afortunadamente, algunos casos publicados de infección congénita por el virus 17D no se han asociado a anomalías fetales. Los viajeros internacionales infectados por VIH y asintomáticos, con niveles de CD4+>200 mm3 podrían ser vacunados en caso de no poder evitar el viaje a zonas de riesgo de FA. En el caso de niños nacidos de madres VIH positivas es necesario obtener la confirmación de la situación VIH del niño. La transferencia de anticuerpos IgG anti-VIH maternos a través de la placenta no permite la interpretación serológica del niño hasta aproximadamente los 9-10 meses de edad (la persistencia de anticuerpos maternos ha sido detectada hasta los 14 meses): – Si el niño no está infectado: la vacuna puede administrarse de forma normal. – Si el niño está infectado: consultar al equipo pediátrico especialista para la evaluación del cociente beneficioriesgo de la vacunación. Dado que existe un riesgo teórico de transmisión del virus al neonato a través de la lactancia materna, ésta constituye una contraindicación, especialmente si el neonato tiene menos de 4 meses de edad. Sin embargo, se puede considerar la vacunación de una mujer durante el periodo de amamantamiento cuando los beneficios sean superiores a los riesgos asociados (4). VACUNA FRENTE A LA ENFERMEDAD MENINGOCÓCICA Neisseria meningitidis es una causa importante de meningitis y otras enfermedades invasivas en todo el mundo. N. meningitidis dispone de una cápsula polisacárida que constituye el mayor factor de virulencia de este microorganismo, ya que le protege de la fagocitosis, de la opsonización y de la actividad bactericida del suero. Los meningococos que carecen de ella y que se encuentran habitualmente en la orofaringe como comensales, muy rara vez causan una enfermedad invasiva. La composición bioquímica de esta cápsula determina el serogrupo. Se han descrito 13 serogrupos distintos, aunque 5 (A, B, C, W-135 e Y) son los responsables de más del 90% de las meningitis y sepsis. La cápsula de estos serogrupos está compuesta de ácido 43 41-61 CAPITULO 20 03/05/10 13:02 Página 44 Medicina Preventiva polisiálico, unida a glucosa o galactosa, excepto la del serogrupo A, que está constituida por N-acetilmanosamina-1fosfato. Los meningococos también se clasifican en serotipos y serosubtipos en función de la reactividad inmunológica de las proteínas de membrana externa, PorB y PorA, respectivamente. La mayoría de los casos de enfermedad meningocócica están causadas por los serogrupos A, B y C, con menos frecuencia Y (emergente en Estados Unidos), W135 (particularmente frecuente en Burkina Faso, y también descrito en Arabia Saudí) y recientemente el serogrupo X, que ha sido notificado en Nigeria. El serogrupo predominante en las epidemias africanas es el tipo A. La transmisión se produce por contacto directo de persona a persona, por aerosoles o gotitas de la faringe o nariz de personas infectadas, bien pacientes o bien portadores asintomáticos. No existe reservorio animal ni vectores. La susceptibilidad a la enfermedad meningocócica disminuye con la edad, aunque se produce un ligero incremento entre adolescentes y adultos jóvenes. Se producen casos esporádicos en todo el mundo durante todo el año; en las zonas templadas suelen ocurrir durante los meses de invierno, y se describen brotes en situaciones de hacinamiento o espacios cerrados en los que conviven numerosas personas (cuarteles militares, residencias de estudiantes…). En África tienen lugar grandes brotes y epidemias durante la temporada seca, de noviembre a junio en la zona conocida como “Cinturón africano de la meningitis” que agrupa a la franja de países entre Senegal y Etiopía; en esta zona, el serogrupo A causa la mayor parte de las epidemias graves. La meningitis endémica y epidémica por meningococos del grupo A sigue siendo una importante causa de morbilidad y mortalidad en el África subsahariana, pese a la disponibilidad de la vacuna de polisacáridos de meningococos del grupo A, que es barata y segura y proporciona protección en todos los grupos de edad cuando se administra de forma correcta (5). A nivel mundial se estima que la enfermedad ocasiona 1,2 millones de casos. Incluso con un tratamiento óptimo, la meningitis meningocócica tiene una tasa de letalidad del 10% y produce lesiones del sistema nervioso central en alrededor de un 15% de los pacientes (6). Arabia Saudí exige la vacunación contra la enfermedad meningocócica a las personas que peregrinan a las ciudades sagradas de La Meca y Medina, donde se congregan, en algunas ocasiones, más de dos millones de musulmanes de todo el mundo produciéndose una situación de hacinamiento que favorece la transmisión de enfermedades por contacto de persona a persona. Se debe considerar la vacunación frente a la enfermedad meningocócica en sus distintos serogrupos, en los viajeros (1): – A los países industrializados con casos esporádicos; se producen brotes de enfermedad por meningococo C en escuelas, universidades, cuarteles, campamentos… donde conviven adolescentes y adultos jóvenes. – A los países del cinturón subsahariano donde son frecuentes los brotes de enfermedad del serogrupo A y, en los últimos años, también el serogrupo W135, durante los meses de la estación seca (entre noviembre y junio). El riesgo es mayor si el contacto con la población local es habitual y la duración de la estancia prolongada. – A los peregrinos a La Meca o Medina. Tras diversos brotes como el producido por el serogrupo A en 1987, 44 comenzó a exigirse la vacuna antimeningocócica bivalente A-C. Más recientemente, en 2000 y 2001 se detectaron brotes de enfermedad producidos por el serogrupo W135, por lo que Arabia Saudí, desde el año 2002 hasta la actualidad, exige la vacuna antimeningocócica tetravalente ACYW135 a los peregrinos de la Hajj o de la Umrah; sin la certificación de esta vacunación no es posible obtener el visado de entrada para los peregrinos. Las autoridades sanitarias saudíes exigen que, antes de la peregrinación, los viajeros hayan recibido al menos una dosis de esta vacuna en los tres años anteriores, si son mayores de 2 años, o dos dosis separadas (con un intervalo de 2 meses) en los menores de esta edad. Al margen de los viajes, la vacunación antimeningocócica se considera recomendable en pacientes con asplenia anatómica o funcional, en aquellos que tienen déficit de properdina o fracciones terminales del complemento (C5-C9) y en casos con enfermedad de Hodgkin u otras neoplasias hematológicas. En las últimas décadas, los avances en la inmunoprofilaxis de la enfermedad meningocócica han sido espectaculares. Se dispone de diferentes vacunas frente a los serogrupos más prevalentes de N. meningitidis, y se ha conseguido en bastantes ocasiones un control muy efectivo de los brotes epidémicos (5). Vacunas Las vacunas frente a la enfermedad meningocócica actualmente comercializadas en el mundo son: 1. OVacunas de polisacáridos simples: i. Vacuna bivalente AC ii. Vacuna trivalente ACW135 iii. Vacuna tetravalente ACYW135 2. Vacunas de polisacáridos conjugados: i. Vacuna monovalente A conjugada ii. Vacuna monovalente C conjugada iii. Vacuna tetravalente ACYW135 conjugada 1. Vacunas polisacarídicas Están compuestas por polisacáridos capsulares liofilizados, purificados y termoestables de los respectivos serogrupos de meningococos. Las primeras vacunas polisacarídicas simples frente a los serogrupos A y C aparecieron hace casi 40 años en respuesta a brotes epidémicos en jóvenes residentes en academias militares norteamericanas. La inmunogenicidad de las vacunas de polisacáridos varía según el serogrupo. La vacuna con el polisacárido A, aunque puede administrarse a partir de los 3 meses de edad, produce una respuesta inmunitaria inferior y de menor duración en los menores de 2 años respecto a la observada en niños mayores y en los adultos. El polisacárido C, incluido en las primeras vacunas bivalentes, no genera prácticamente ninguna respuesta inmunitaria en los menores de 18 a 24 meses, pero, al igual que el anterior, mejora la respuesta a medida que aumenta la edad de los vacunados; la segunda dosis no conlleva un aumento de las concentraciones de anticuerpos con respecto a las obtenidas en la primovacunación. Además, con las revacunaciones repetidas con el componente C y, en menor medida, con el A, puede observarse una menor respuesta inmunológica parcial o tolerancia inmune, cuyo significado clínico no está claro. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 45 Medicina La inmunogenicidad de los serogrupos W135 e Y es buena por encima de los 2 años de edad y se observa una importante elevación de los anticuerpos bactericidas y buen efecto protector; en edades inferiores está menos estudiada. La corta duración de la protección y la ausencia de impacto sobre el estado de portador nasofaríngeo de N. meningitidis (por lo que carece de efecto en la cadena de transmisión), así como la posible hiporrespuesta en revacunaciones, han contribuido al hecho de que no se haya recomendado el uso sistemático de la vacuna polisacárida bivalente A+C en los calendarios infantiles. Desde el punto de vista de los viajeros, la vacuna más ampliamente recomendada y obligatoria en algunas ocasiones es la vacuna de polisacáridos tetravalente A,C,Y,W135 (Mencevax ACYW135® producida por GSK y Menomune ACYW135® de Sanofi Pasteur MSD). Se encuentra disponible (habitualmente Mencevax ACYW135®) en los Centros de Vacunación Internacional españoles, a través del Servicio de Medicamentos Extranjeros (Agencia Española del Medicamento) del Ministerio de Sanidad y Política Social, y por el momento no se encuentra comercializada en farmacia. Si existe opción entre las vacunas polisacarídicas bivalentes (A, C) o tetravalentes (A,C,Y,W135), en el caso de los viajeros, la elección debe recaer sobre las vacunas tetravalentes. Composición de las vacunas polisacarídicas ACYW135 y pauta de administración La vacuna tetravalente contiene 50 μg de cada serogrupo, con una solución isotónica de cloruro sódico y se aplica en una dosis única de 0,5 ml, tras la inmediata reconstitución con el disolvente, por vía subcutánea o intramuscular. El diluyente en la presentación de los viales de 10 dosis contiene 0,25% de fenol como conservante. La producción anual de esta vacuna se limita aproximadamente a 13 millones de dosis y está destinada sobre todo a los viajeros que peregrinan a La Meca y a aquellos cuyo destino sea alguno de los países incluidos en el “cinturón africano de la meningitis”. En los países centroafricanos con elevada incidencia de enfermedad meningocócica, sería conveniente recomendar la vacunación universal con el polisacárido del meningococo del grupo A, dos veces durante la lactancia, seguida de la administración de la vacuna tetravalente a los niños de 2 y 6 años; dicha recomendación se fundamenta en la eficacia de los polisacáridos capsulares de los grupos A, C, W135 e Y, lo que permitiría disminuir la enfermedad, tanto epidémica como endémica, y preparar el terreno para el uso de vacunas conjugadas cuando estén disponibles. La vacuna trivalente A,C,W135 producida por GSK en colaboración con distintas fundaciones, comenzó a utilizarse en la temporada epidémica de 2003 en Burkina Faso y los datos de seguridad, de inmunogenicidad y de efectividad publicados hasta la fecha están en sintonía con los de otras vacunas polisacáridas. Desde entonces, se ha utilizado en otros países africanos, como Chad, Guinea, Sudán, Uganda y Kenia. Su uso ha estado restringido al control de la enfermedad meningocócica en los países del «cinturón africano de la meningitis» causada por los serogrupos incluidos en esa vacuna. El coste, de 1 euro/dosis, es el doble de la vacuna bivalente polisacárida y su producción se encuentra muy limitada debido a que se suministra a los países previo pago del importe. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva La respuesta protectora de estas vacunas de polisacáridos aparece aproximadamente de 10 a 14 días después de la administración y se prolonga durante tres años en el 85-95% de los vacunados, aunque en los niños menores de 4 años los niveles de anticuerpos específicos descienden rápidamente al cabo de 2-3 años. La validez de los certificados de meningitis tetravalente exigidos por Arabia Saudí, comienza 10 días tras la aplicación de la vacuna y se prolonga durante 3 años, si bien la duración de la protección en adultos se estima de 3 a 5 años. Seguridad y efectos adversos de vacunas polisacarídicas Las vacunas a base de polisacáridos son seguras y de escasa reactogenicidad; solo ocasionalmente producen reacciones locales leves (eritema y dolor local en el punto de inyección durante 1 ó 2 días) y en raras ocasiones, hasta en un 2% de vacunados, fiebre. Al igual que con otras vacunas, excepcionalmente pueden presentarse reacciones de hipersensibilidad. La seguridad y la inmunogenicidad son las mismas en vacunas de polisacáridos bivalentes, trivalentes o tetravalentes. Contraindicaciones de la vacunación Las precauciones y contraindicaciones son las mismas de las vacunas inactivadas, es decir: reacción anafiláctica a dosis previas de la vacuna, hipersensibilidad a algún componente, rango de edad fuera de lo establecido o enfermedad aguda, sin que existan contraindicaciones específicas. 2. Vacunas conjugadas Se obtienen mediante la conjugación del polisacárido con una proteína portadora de alto peso molecular, lo que induce una respuesta inmunitaria dependiente de las células T, y conlleva mayor inmunogenicidad en los lactantes y mayor duración de la protección. Las vacunas conjugadas monovalentes frente al meningococo del serogrupo C, se conjugan bien con toxoide diftérico (Meningitec® de Wyetf Farma y Menjugate® de Novartis Vaccines), bien con toxoide tetánico (NeisVac-C® de Baxter), y se encuentran incorporadas a los calendarios vacunales en numerosos países, tras su autorización en 1999, ya que a diferencia de las vacunas polisacarídicas del mismo serogrupo ocasionan respuestas en niños lactantes vacunados a los 2, 3 y 4 meses de edad. La vacuna conjugada tetravalente A,C,W135,Y (Menactra ®, Sanofi Pasteur), se conjuga con el toxoide tetánico, y se encuentra autorizada en EEUU desde el año 2005, tras la detección de un incremento de casos producidos por el serogrupo Y, indicándose en adolescentes y adultos (11-55 años) y niños de 2 a 10 años en situaciones de riesgo. En Canadá se autorizó en 2007, con indicación en niños mayores de 2 años y adolescentes. La vacuna contiene 4µg de cada serogrupo y se administra por vía intramuscular. Se está estudiando la posible relación causal de la vacuna tetravalente conjugada con toxoide tetánico con el Síndrome de Guillain-Barré, aunque por el momento no es evidente. En Europa aún no se encuentra comercializada ninguna vacuna tetravalente conjugada; durante el año 2010, se prevé la autorización de una vacuna ACYW-CRM (Menveo ® , Novartis), compuesta por 10 μg de polisacárido A y 5 µg de C, Y, W135 ligados covalentemente a un mutante no reactivo del toxoide diftérico CRM197 mediante una conjugación química 45 41-61 CAPITULO 20 03/05/10 13:02 Página 46 Medicina Preventiva selectiva. Los ensayos en Fase III han mostrado que tres dosis (en los 2, 4 y 6-12 meses de edad) proporcionan respuestas inmunitarias más elevadas en edades más tempranas (7). Cuando por diversas razones se combinan las vacunas de polisacáridos simples con las conjugadas, se tendrá en cuenta que el intervalo óptimo entre ambas varía según cuál haya sido la primera vacuna administrada: • Si se ha administrado primero la vacuna de polisacáridos, deben transcurrir 6 meses para administrar la vacuna conjugada. • Si se ha administrado primero la conjugada, 2 semanas después ya puede administrarse la vacuna de polisacáridos simples. VACUNA FRENTE A LA POLIOMIELITIS La poliomielitis es una enfermedad aguda del sistema nervioso central ocasionada por tres enterovirus (poliovirus 1, 2 y 3), que se propagan sobre todo de persona a persona por vía fecal-oral y menos frecuentemente por agua y alimentos contaminados; tras un período de incubación de 3 a 14 días, ocasiona fiebre y malestar, y en una pequeña proporción invade el sistema nervioso central ocasionando parálisis en grado variable (la parálisis fláccida aparece en menos del 1% de las infecciones por poliovirus). La iniciativa de erradicación surge en 1988 cuando la enfermedad había sido eliminada de los países más desarrollados, y sin embargo, en los países menos desarrollados la enfermedad se presentaba sobre todo en niños menores de 3 años (65-75% de los casos) o de 5 años (95% de los casos). Se ha avanzado bastante en la erradicación mundial de la poliomielitis; en el año 1988 al menos 125 países eran considerados endémicos, mientras que en el año 2008 tan sólo en 4 países (Afganistán, India, Nigeria y Pakistán) circulan ininterrumpidamente los poliovirus salvajes. En el año 2006 la transmisión del poliovirus tipo 2 se había interrumpido en todo el mundo y sólo los de tipo 1 y tipo 3 persisten en un número limitado de países (8). El número de casos de polio notificados durante 2007 en todo el mundo fue de 1.387 (de ellos, 874 en la India y 353 en Nigeria) y durante 2008 se confirmaron 1.738 (de ellos, 559 en la India y 867 en Nigeria) A lo largo del año 2008 y durante la primera mitad de 2009, algunos países previamente libres de la enfermedad, es decir que no habían presentado casos en al menos 12 meses (Angola, Chad, Etiopía, Ghana, Níger, República Democrática del Congo y Sudán) han importado poliovirus salvajes de tipo 1 y 3, y notificado casos. Estos países tienen coberturas vacunales frágiles e infraestructuras sanitarias deficientes (8). La infección y la parálisis pueden afectar a personas no inmunes de cualquier edad, lo que debe ser tenido en cuenta en los viajeros que se dirigen a países endémicos. Mientras no se alcance la erradicación mundial, existirá riesgo tanto para los viajeros que se desplacen a zonas infectadas, como de reintroducción de la enfermedad en zonas libres de polio mediante viajeros infectados que procedan de países endémicos (9). Todos los viajeros que se dirigen a zonas infectadas por poliovirus y todos los que proceden de estas zonas deben tener actualizada la vacunación contra la poliomielitis con arreglo a la política de vacunación nacional. Para limitar la propagación internacional de los virus poliomielíticos a zonas libres de polio, los viajeros procedentes de los países endémicos deben comprobar la pauta completa de vacunación o recibir una dosis 46 de vacuna, como mínimo, antes de salir del país de residencia. Algunos países libres de polio pueden exigir a los viajeros procedentes de países endémicos un certificado de vacunación para obtener el visado de entrada. Desde el año 2005 Arabia Saudí exige a todos los viajeros menores de 15 años que lleguen a Arabia desde países afectados por poliomielitis un certificado de vacunación con la vacuna oral (VPO) 6 semanas antes de solicitar el visado de entrada en el país. Además, desde el año 2006 todos los viajeros procedentes de Afganistán, Pakistán, India y Nigeria, independientemente de la edad y de la historia vacunal previa, reciben la vacuna VPO en los puntos de entrada a Arabia Saudí. Los países considerados por Arabia Saudí como reinfectados en el año 2009 son: Angola, Benín, Burkina Faso, Eritrea, Etiopia, Nepal, Níger, República centroafricana, República Democrática del Congo, Somalia, Sudan, Chad y Yemen (10). Vacunas El desarrollo de vacunas efectivas para evitar la polio paralítica ha sido uno de los grandes logros del siglo XX; disponemos de dos tipos de vacuna: • La vacuna oral viva atenuada, desarrollada por el Dr. Albert Sabin en 1961 (VPO), que se administra oralmente, y • La vacuna inactivada, desarrollada por el Dr. Jonas Salk en 1955 (VPI), que se administra de forma inyectada. Ambas vacunas son muy efectivas sobre los tres tipos de poliovirus. Vacuna de polio oral (VPO) Se prepara con cepas de virulencia atenuada de los tres tipos de virus, obtenidas por pases sucesivos en cultivos celulares de células diploides (WI38), con cinco del serotipo 1, uno del serotipo 2 y tres del serotipo 3. Tras la administración de tres dosis, produce una elevada inmunidad humoral de larga duración, e inmunidad en la mucosa intestinal que reduce la infección efectiva de los poliovirus salvajes y la hace muy apropiada para interrumpir la transmisión persona-persona en situaciones de epidemia, reduciendo en gran manera la circulación del virus salvaje. Es barata y puede ser administrada sin necesidad de equipos de inyección, por lo que constituye la vacuna de elección para la erradicación de la polio. Aunque es una vacuna muy segura y efectiva, en raras ocasiones (1 caso por cada 2,5 millones de dosis) puede producir parálisis: “poliomielitis asociada a la vacuna (PAV)” en los niños vacunados o en personas en contacto estrecho con los vacunados; esto es debido a cambios genéticos en el virus vacunal por mutación o recombinación que ocasionan la recuperación de la neurovirulencia. Es excepcional, pero ha ocurrido en algunas ocasiones en las que se ha observado la circulación de estos virus, produciendo brotes de virus de polio derivados de la vacuna VPO. Los síntomas son similares a los de la enfermedad natural, con períodos de incubación de 4 a 24 días en los vacunados y de 11 a 58 días en los contactos de los vacunados. Vacuna de polio inactivada (VPI) Las primeras vacunas inactivadas se prepararon por propagación de los tres serotipos de poliovirus en cultivos celulares de riñón de mono, posteriormente inactivados por Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 47 Medicina formol y altamente concentrada, por lo que su coste es más elevado que la VPO. La menor potencia inmunógena, respecto a la VPO, condujo a finales de los años 70 a la búsqueda de una VPI de mayor potencia inmunogénica. Las vacunas inactivadas de potencia aumentada se desarrollan sobre líneas celulares VERO de riñón de mono verde africano, purificando los poliovirus inactivados por formaldehído; cada dosis contiene 40 U del tipo 1, 8 U del tipo 2 y 32 U del tipo 3. Tras la administración de tres dosis de VPI de potencia aumentada se observa al cabo de 2 meses una seroconversión del 95-100% y una protección muy duradera. Actualmente, todos los países que utilizan la VPI lo hacen con la de potencia aumentada y se ha abandonado el uso de las primeras vacunas inactivadas. Ambas vacunas, VPO y VPI de potencia aumentada son muy inmunógenas (estudios recientes apuntan que quizás es superior para la VPI). En España se sustituyó la VPO por la VPI en los calendarios vacunales en el año 2004, formando parte de las vacunas combinadas. Los Centros de Vacunación Internacional españoles disponen de una VPI a través del servicio de Medicamentos Extranjeros (Imovax Polio® de Sanofi Pasteur MSD). Es la vacuna de elección para los viajeros a zonas de riesgo, sin historia de uso de la VPO, inmunocomprometidos o sus contactos. Composición de la VPI (Imovax Polio®) Contiene una suspensión de 0,5 ml de los tres poliovirus inactivados altamente purificada, inyectable por vía subcutánea (preferiblemente) o intramuscular, en la región medio-lateral del muslo en lactantes y niños, y en la región deltoidea en adolescentes y adultos. Como excipientes contiene formaldehído, 2 fenoxietanol y medio M-199 de Hanks (con varios aminoácidos, entre ellos fenilalanina); además, puede contener trazas de estreptomicina, neomicina y polimixina, lo que puede ocasionar cuadros de hipersensibilidad en personas alérgicas a los aminoglucósidos (11). Pauta de administración En los adultos no inmunizados consiste en administrar 2 dosis de 0,5 ml con un intervalo de al menos 1 mes y preferible de 2 meses, y una dosis de refuerzo a los seis meses o un año después; la primovacunación en niños requiere tres dosis sucesivas con intervalos de 1 a 2 meses, y el refuerzo de la cuarta dosis al año. En los adultos que se desplazan a zonas de riesgo de poliomielitis se administran dosis de refuerzo cada 10 años. Inocuidad y efectos adversos Generalmente es bien tolerada y presenta escasos efectos secundarios. Contraindicaciones La vacunación con VPI se contraindica en caso de alergia a los componentes de Imovax polio® o reacciones anafilácticas en dosis anteriores y debe ser diferida si existe enfermedad aguda con fiebre. No está contraindicada durante el embarazo, pero es aconsejable evitar la vacunación durante el primer trimestre, con el fin de minimizar los posibles riesgos teóricos. En personas con trastornos del sistema inmunitario (VIH, procesos malignos, radioterapia, quimioterapia…) VPI produce una respuesta inmunitaria variable, por lo que debe administrarse en caso de riesgo, ya que puede proporcionar cierta protección. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva VACUNA FRENTE AL CÓLERA Enfermedad causada por Vibrio cholerae (serogrupos O1 y O139) producida por la ingestión de alimentos o agua contaminada, tras un periodo de incubación variable, desde unas horas hasta 5 días. El cólera se caracteriza por un comienzo brusco, diarrea acuosa, indolora y profusa, vómitos ocasionales, deshidratación rápida, acidosis y colapso circulatorio. Afecta sólo a las personas, sin que existan insectos vectores ni reservorios animales. Se detecta, no obstante, un alto porcentaje de casos leves o inaparentes de gran trascendencia epidemiológica, dado que los enfermos con manifestaciones clínicas leves o asintomáticos pueden comportarse como fuente de infección. Clásicamente no se ha relacionado con la diarrea del viajero, pero estudios recientes ponen de manifiesto que V. cholerae se asocia con cuadros típicos de diarrea en viajeros a países menos desarrollados o con infraestructuras sanitarias deficientes. El 80% de las personas que presentan síntomas tienen episodios leves o de gravedad moderada; el 10-20% restante sufre diarrea acuosa con signos de deshidratación. Sin tratamiento, hasta uno de cada dos afectados puede morir. Con el tratamiento adecuado, la tasa de mortalidad debería permanecer por debajo del 1%. De los 73 serogrupos conocidos actualmente de V. cholerae, sólo uno, el O1 causa cólera, el resto se denominan V. cholerae no-O1. Existen dos biotipos de V. cholerae serogrupo O1: clásico y El Tor; ambos ocasionan un cuadro clínico semejante. Estos dos biotipos se subdividen antigénicamente en dos serotipos principales: Ogawa e Inaba, y raramente se encuentra un tercer serotipo, el Hikojima, con antígenos de ambos serotipos. En 1961 se declaró en Indonesia la séptima ola pandémica de cólera, que se propagó rápidamente a otros países de Asia, Europa, África y, finalmente, en 1991, a América Latina, que había estado libre de la enfermedad durante más de un siglo. La enfermedad se propagó rápidamente en esa región, causando casi 400.000 casos notificados y más de 4.000 defunciones en 16 países de las Américas durante ese año. En octubre de 1992 se presentaron simultáneamente en la India varios brotes de cólera; las cepas aisladas no mostraban aglutinación con los antisueros O1 ni pudieron ser tipificadas con ninguno de los 138 antisueros diferentes de V. cholerae que integran la batería habitual de laboratorio, por lo que se denominó V. cholerae O139 Bengala. Esta nueva cepa es capaz de producir la exotoxina y, por tanto, el cuadro clínico de cólera. V. cholerae O139 ha aparecido en más de 11 países asiáticos y constituye una amenaza potencial de nueva pandemia, por lo que requiere una vigilancia internacional permanente (12). V. cholerae predomina en India, Indonesia y Bangladesh. Entre agosto de 2008 y mayo de 2009 se han registrado en Zimbabue al menos 98.424 casos de cólera, de los que 4.276 fueron mortales. Durante el año 2007, el número de casos notificados a la OMS fue de 177.963, entre los que fallecieron 4.031 personas. Se calcula que sólo una pequeña proporción de los casos –menos del 10%- se notifican a la OMS; en consecuencia, la verdadera carga de la enfermedad sin duda es muchísimo mayor. Los casos importados por países capaces de detectarlos durante 2007 fueron 74, sin embargo, es cada vez más conocido que sólo se diagnostican cuando la diarrea que ocasiona es grave y requiere atención hospitalaria. 47 41-61 CAPITULO 20 03/05/10 13:02 Página 48 Medicina Preventiva Vacunas frente al cólera La antigua vacuna anticolérica parenteral ha dejado de utilizarse y ya no se produce, debido a su baja eficacia protectora y a la elevada incidencia de reacciones adversas graves. Numerosos países exigieron en el pasado una certificación de dicha vacuna, sin la que no era posible entrar en ellos. Desde 1973, los certificados internacionales de vacunación (modelo establecido en el RSI) incorporaron un apartado en el que se mencionaba la no obligatoriedad de presentar certificado de vacunación alguno frente al cólera. Los modelos actuales de Certificado de vacunación (anexo 6 del RSI-2005) ya no contienen dicha aclaración. Hasta la actualidad, se ha dispuesto de tres vacunas anticoléricas orales, que han demostrado ser inocuas, inmunógenas y eficaces. Están autorizadas en numerosos países y se administran fundamentalmente a viajeros: – Vacuna WC/rBS – Variante de la vacuna WC/rBS (sólo autorizada en Vietnam) – Vacuna CVD 103-HgR (no se produce en la actualidad) La única vacuna de la que se dispone actualmente frente al cólera en la mayor parte del mundo es WC/rBS (Whole Cell/recombinant B Subunit), Dukoral®, producida por SBL. Composición de WC/rBS Dukoral® – Vibrio cholerae O1 Inaba, biotipo clásico inactivado por calor. – Vibrio cholerae O1 Inaba, biotipo El Tor inactivado por formalina. – Vibrio cholerae O1 Ogawa, biotipo clásico inactivado por calor. – Vibrio cholerae O1 Ogawa, biotipo El Tor inactivado por formalina. – Subunidad B de la toxina del cólera recombinante (1 mg), producida en la cepa 213 de V. cholerae O1 Inaba, biotipo Clásico. La vacuna actúa induciendo la formación de anticuerpos tanto frente a componentes bacterianos como frente a la toxina (TCB). Los anticuerpos frente a las bacterias impiden que éstas se fijen a la pared intestinal y así evitan la colonización por V.cholerae O1. Los anticuerpos frente a la toxina impiden que la toxina colérica se una a la superficie mucosa del intestino, de forma que previenen los síntomas de diarrea causados por las toxinas. Numerosos estudios ponen de manifiesto que, en base a la conocida semejanza entre la toxina CTB (toxina B no tóxica) de Vibrio cholerae y la toxina LT, toxina lábil de ETEC (Escherichia coli enterotoxigénica), la vacuna frente al cólera WC/rBS (Dukoral)®, además de una elevada protección frente al cólera proporciona también una protección variable frente a la diarrea de los viajeros, ya que ETEC es responsable de la mayor parte de los casos de diarrea entre los viajeros. La semejanza en aspectos estructurales, funcionales y de respuesta inmunitaria entre ambas toxinas es responsable de la reacción cruzada desde el punto de vista inmunológico. Existe otra vacuna de producción vietnamita, muy semejante en la composición, de células enteras de V. cholerae inactivadas, pero carece de la subunidad B de la toxina colérica. Esto la hace más barata (puesto que son las cantidades relativamente elevadas de toxina colérica contenida en Dukoral®, las que elevan el coste la producción) pero 48 también menos efectiva. La utilización de esta vacuna se limita a unos pocos países en Asia. La protección frente al cólera es algo inferior y no estaría indicada para la prevención de la diarrea del viajero por la ausencia de la subunidad B. La tercera vacuna oral que ha estado disponible en años recientes es la vacuna CVD 103-HgR (Orochol® Berna) que contiene una cepa O1 viva, atenuada y genéticamente modificada de V. cholerae para administración oral. Presenta la ventaja de requerir una dosis única, y las contraindicaciones de las vacunas vivas, pero actualmente no se produce. La vacuna WC/rBS (Dukoral®) se encuentra comercializada en gran número de países occidentales (más de 60), entre los que se encuentran Canadá, Australia, Nueva Zelanda y los países de la Unión Europea (UE), con Noruega e Islandia. La indicación varía según los países, pudiendo estar autorizada sólo para la prevención del cólera o para el cólera y la diarrea del viajero por ETEC, como ocurre en la mayoría de los países; sin embargo, en Australia y los países de la UE, la indicación de la ficha técnica es, por el momento, para la prevención del cólera. En España, Dukoral® está indicada para la inmunización activa frente al cólera en adultos y niños mayores de 2 años que tienen previsto visitar áreas endémicas o epidémicas de cólera. Hay que recordar que la vacunación frente al cólera no debe reemplazar a las medidas protectoras sobre agua y alimentos, que deberán llevarse a cabo en todo momento con independencia de la vacunación. La vacuna WC/rBS es inocua y eficaz (eficacia del 85-90% a los seis meses en todos los grupos de edad; desciende al 62% al año en los adultos). Diversos estudios muestran que la vacuna provoca respuestas de IgA frente a la toxina colérica a nivel intestinal en el 70-100% de los individuos vacunados y se observan anticuerpos séricos vibriocidas frente a los componentes bacterianos en el 33-55% de los sujetos vacunados y anticuerpos frente a la toxina en el 78-87% de dichos individuos. Una dosis de recuerdo ocasiona una respuesta anamnésica indicativa de la presencia de memoria inmunitaria, cuya duración se ha estimado en al menos dos años en los adultos. La eficacia de WC/rBS frente a ETEC se estudió en un ensayo de campo en un área endémica, en Bangladesh (1987), sobre 90000 personas mayores de 2 años, observándose una eficacia protectora frente a ETEC-LT (LT solo o LT y ST, pero no sobre ETEC-solo ST) del 67% durante al menos los tres meses del seguimiento. En un estudio posterior (1991) sobre 615 turistas fineses que se desplazaron a Marruecos, se observó una reducción de la diarrea de los viajeros en general del 23%; la diarrea producida por ETEC se redujo en el 52% y la asociada a ETEC-LT en el 60%. Es curioso en este estudio que si la diarrea está ocasionada por una combinación de ETEC y otro patógeno la eficacia protectora de la vacuna alcanza el 72%, y si nos centramos en la asociación ETEC y Salmonella la protección observada se eleva al 82%. En 1992 se llevó a cabo un tercer estudio en 502 estudiantes americanos que se desplazaron a Méjico durante los meses de verano, y se observó una eficacia protectora frente a ETEC del 50%. Sin embargo, este estudio adolece de limitaciones, debido a que la vacunación fue administrada en destino (Méjico) y no como se considera adecuado, de forma que la segunda dosis sea recibida al menos 7 días antes del viajar al país de riesgo. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 49 Medicina Desde la autorización en España de Dukoral®, en el año 2005, se han llevado a cabo varios estudios en viajeros mayores de 18 años, atendidos en los Centros de Vacunación Internacional y vacunados frente al cólera. En estos viajeros a zonas de riesgo de cólera a los que se recomendó la vacuna WC/rBS, se estudió mediante encuesta al regreso la incidencia de diarrea del viajero durante el viaje o en los 7 días posteriores al retorno. Los resultados de todos los estudios mencionados son consistentes y se observa una reducción de la incidencia de diarrea por cualquier causa del 40-45% aproximadamente, en todos ellos, lo que puede ser debido a la protección frente a gran parte de las ETEC (Escherichia coli enteroxigénica) y frente diarreas ocasionadas por Vibrio cholerae que son habitualmente leves y para las que el viajero vacunado presenta una protección elevada. Igualmente se comprueba una reducción en la duración de las diarreas, disminuyendo de un promedio de 4 días a sólo 1-2 días. Se está intentando establecer un consenso de indicación de WC/rBS y numerosos autores establecen la recomendación de la vacunación a diferentes grupos de viajeros: 1. La indicación de WC/rBS (Dukoral®) para vacunar frente al cólera a turistas, cooperantes y trabajadores o emigrantes que visiten zonas donde el cólera es endémico o epidémico. Es especialmente recomendable entre los profesionales sanitarios y viajeros en general que prevean pobres condiciones higiénicas durante el viaje (militares, VRF –visiting friends and relatives–, mochileros). 2. La indicación frente a la diarrea producida por ETEC deberá ser considerada en: 2.1. Viajeros con predisposición (aquellos con disminución o ausencia de la barrera ácida gástrica, con inmunosupresión y con tendencia a padecer diarreas de manera recurrente). 2.2. Viajeros en los que la diarrea podría evolucionar de forma grave (insuficiencia renal crónica, insuficiencia cardiaca, diabetes, tratamientos diuréticos…). 2.3. Niños viajeros (la vacuna está autorizada para los mayores de 2 años). 2.4. Viajeros de mayor edad, en los que las diarreas podrían producir deshidrataciones más graves. 2.5. Viajeros que prevean dificultades en el consumo de agua y alimentos seguros, así como estancias prolongadas. Por todo ello, se considera que la vacuna WC/rBS se debe indicar frente al cólera en los viajeros a zonas de riesgo, y frente a la diarrea por ETEC cuando se estime un incremento del riesgo de diarreas o cuando exista posibilidad de que ésta evolucione de forma grave debido a otros factores. El uso de las vacunas anticoléricas en situaciones de emergencia se acepta, pero sigue siendo una tarea difícil. Hasta la fecha, no existen indicaciones concretas para su empleo en situaciones endémicas, y se están llevando a cabo estudios de intervención para comprobar su eficacia como instrumento de salud pública. Pauta de administración de Dukoral® 1. Vacunación primaria El ciclo de vacunación primaria estándar frente al cólera consiste en administrar oralmente dos dosis en los adultos y niños mayores de 6 años. Los niños de 2 a 6 años deben recibir Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva tres dosis. Las dosis se deben administrar separadas por intervalos de al menos 7 días. Si han transcurrido más de seis semanas entre dos dosis, se debe reiniciar el ciclo primario de inmunización. La inmunización debe haberse realizado por completo al menos una semana antes de la exposición potencial al V. cholerae O1. La vacuna es lábil al ácido. Los alimentos y las bebidas aumentarán la producción de ácido en el estómago, lo que puede disminuir el efecto de la misma, por lo tanto, debe evitarse la ingestión de alimentos y bebidas una hora antes y una hora después de la administración de la vacuna, así como de cualquier otra vacuna oral o fármaco durante este periodo. La presentación contiene 2 sobres con bicarbonato sódico y dos viales con la suspensión vacunal. El bicarbonato sódico se presenta en forma de granulado efervescente, que debe disolverse en un vaso de agua fría (aprox. 150 ml). La suspensión que contiene la vacuna debe mezclarse entonces con la solución de bicarbonato sódico e ingerirse en un plazo máximo de dos horas. Niños de 2 a 6 años: la mitad de la solución de bicarbonato sódico se desecha y la parte que queda (aprox. 75 ml) se mezcla con el contenido íntegro del vial que contiene la vacuna. 2. Dosis de recuerdo Para conseguir una protección continuada contra el cólera, se recomienda administrar una única dosis de recuerdo al cabo de dos años en el caso de adultos y niños a partir de los 6 años, y a los 6 meses en niños de edades comprendidas entre los 2 y los 6 años. No existen aún datos clínicos sobre la eficacia de administrar dosis de recuerdo de forma repetida. No obstante, los datos inmunológicos sugieren que, si han transcurrido hasta dos años desde la última vacunación, se debería administrar una única dosis de recuerdo. En caso de que hayan transcurrido más de dos años desde la última vacunación, se debería repetir el ciclo primario. Se ha administrado Dukoral ® a niños de edades comprendidas entre 1 y 2 años en estudios de evaluación de la seguridad e inmunogenicidad, pero su eficacia protectora no se ha estudiado en este grupo de edad. Por lo tanto, no se recomienda el uso de esta vacuna en niños de edad inferior a 2 años. En los países con la doble indicación de uso de WC/rBS para cólera y para diarrea por ETEC, la forma de administración es idéntica, pero la duración de la protección frente a ambos agentes es diferente, de forma que se prolonga durante dos años cuando se trata de cólera y sólo tres meses en el caso de ETEC. Inocuidad y efectos adversos La seguridad y la inmunogenicidad de Dukoral® están bien establecidas y los efectos secundarios más frecuentes se describen como alteraciones gastrointestinales de carácter leve. También se describen en la ficha técnica efectos como: diarrea, dolor abdominal, retortijones abdominales, borboteo gástrico/abdominal (gas), molestias abdominales y cefalea. Se dispone de pocos datos acerca de la inmunogenicidad y seguridad de la vacuna en las personas infectadas por el VIH, por lo que se desconoce la eficacia protectora de la vacuna. La inmunización en estos pacientes podría dar lugar a incrementos transitorios de la carga viral. Es posible que WC/rBS no induzca la producción de niveles protectores de anticuerpos en personas con enfermedad por VIH avanzada. 49 41-61 CAPITULO 20 03/05/10 13:02 Página 50 Medicina Preventiva Contraindicaciones Se contraindica en el caso de hipersensibilidad a los principios activos o a alguno de los excipientes. Se debe posponer la administración de la vacuna en las personas que padezcan una enfermedad gastrointestinal o febril aguda. Durante el proceso de fabricación se emplea formaldehído y es posible que se encuentren trazas del mismo en el producto final. Se debe evitar en individuos con hipersensibilidad conocida al formaldehído. VACUNA FRENTE A LA ENCEFALITIS JAPONESA (EJ) La Encefalitis Japonesa es una enfermedad inflamatoria aguda que afecta al cerebro y a la médula espinal, rara en nuestro medio y muy frecuente en los países asiáticos, que está causada por un arbovirus del género Flavivirus perteneciente a la familia Flaviviridae, conocido como Virus de la Encefalitis Japonesa (VEJ). Se transmite por la picadura de diferentes mosquitos del género Culex, principalmente Culex tritaeniorhynchus, que se hacen infectivos al picar a cerdos domésticos y aves silvestres (reservorios principales). La mayoría de las infecciones son asintomáticas. Los casos sintomáticos (aproximadamente el 1%) presentan una gravedad variable. Las infecciones leves se caracterizan por dolor de cabeza con fiebre o meningitis aséptica. Los casos graves (1 de cada 300 infecciones) provocan encefalitis, con aparición y progresión rápida de fiebre alta, dolor de cabeza, rigidez de nuca, desorientación, coma y parálisis espástica. Aproximadamente el 25% de los casos clínicos graves son mortales y son comunes las secuelas neuropsiquiátricas permanentes en más de un 50% de los que sobreviven. La susceptibilidad a la enfermedad es mayor en niños menores de 10 años y en ancianos. La infección por encefalitis japonesa contraída durante el primer o segundo trimestre del embarazo puede provocar infección intrauterina y aborto, sin embargo, las infecciones que se producen en el tercer trimestre de embarazo no se han asociado con reacciones adversas en los recién nacidos. La Encefalitis Japonesa es endémica en zonas del Sudeste Asiático, Subcontinente Indio y algunas regiones del Norte de Asia (China y Siberia). También ocurre, pero con menos frecuencia, en Japón, Taiwán, Singapur, Hong Kong, el Este de Rusia y Australia. En todas las áreas es sobre todo una enfermedad rural, especialmente en zonas de arrozales y muy influenciada por las lluvias y las prácticas agrícolas. En numerosas áreas, la transmisión es estacional (sobretodo entre los meses de mayo a octubre), dependiendo de las lluvias (1). En 2006 se produjeron epidemias en Nepal (al menos 200 casos con 22 fallecidos en Terai Plain), en India (donde se comunicaron más de 20 fallecidos en el estado de Assan) y China (437 casos, de los cuales 40 fallecieron, en la provincia de Henan y 19 fallecidos en la provincia de Shanxi). En el primer semestre de 2009 la India ha registrado el fallecimiento por esta enfermedad de 38 personas, en el Estado de Uttar Pradesh, en el norte del país. Vacunas Hasta el año 2009 se disponía de tres tipos de vacunas que se producían a gran escala: la vacuna inactivada derivada de cerebro de ratón, la vacuna inactivada derivada de cultivos 50 celulares, y la vacuna viva atenuada derivada del cultivo celular SA 14-14-2. Con todas ellas se han observado, ocasionalmente, reacciones alérgicas a los componentes de la vacuna, y las vacunas derivadas de cerebro de ratón han producido en raras ocasiones efectos neurológicos secundarios graves, lo que ha dado lugar al desarrollo de nuevas vacunas como la recién autorizada Ixiaro , que se encuentra disponible desde agosto de 2009 en los Centros de Vacunación Internacional. El riesgo de infección de los viajeros al sudeste asiático que visitan áreas urbanas es bajo, por el contrario, los que van a vivir en áreas rurales endémicas con actividades agrícolas, durante periodos de tiempo prolongado, tienen un riesgo elevado (las estimaciones sugieren que el riesgo de EJ en zonas altamente endémicas durante la estación de transmisión puede alcanzar 1 por 5.000 viajeros y por mes de exposición). A la hora de recomendar la vacunación se deben tener en cuenta factores como la incidencia de EJ de la zona, la estación del año, las condiciones de alojamiento, la naturaleza de las actividades, la duración de la estancia o la edad avanzada. Los CDC realizan recomendaciones de uso de la vacuna frente a la EJ en julio de 2009 y consideran indicación para la vacunación: – Viajeros con estancias inferiores a 1 mes en áreas endémicas durante los períodos de transmisión estacional, si el viaje incluye zonas rurales o no urbanas y se prevé un incremento del riesgo de EJ (exposición durante el atardecer y la noche en zonas rurales o agrícolas, alojamientos sin medidas de protección frente a mosquitos, camping, senderismo, ciclismo, caza, pesca…). – Viajeros a áreas en las que se está produciendo una epidemia de EJ. – Viajeros a áreas endémicas en los que la duración del viaje, los destinos específicos o las actividades a desarrollar no están programadas. En todo caso y con independencia de la vacunación, se recomienda a los viajeros que adopten precauciones personales para reducir la exposición a las picaduras de mosquito. Vacuna contra la Encefalitis Japonesa Ixiaro® Novartis Esta vacuna contiene la Cepa SA14-14-2 inactivada del virus de la encefalitis japonesa (6 μg por dosis), producida en células Vero y adsorbida en hidróxido de aluminio hidratado. La vacuna debe administrarse mediante inyección intramuscular en el músculo deltoides. En casos especiales, puede administrarse también por vía subcutánea en los pacientes con trombocitopenia o trastornos hemorrágicos (13, 14). Pauta de administración La primovacunación consiste en dos dosis de 0,5 ml cada una, separadas cuatro semanas. No se dispone de información sobre la necesidad o no de administrar dosis de refuerzo. Se ha observado una seroconversión del 29,4% diez días después de la primera dosis y del 97,3% una semana después de la segunda. Por consiguiente, la primovacunación debe haberse completado al menos una semana antes de la posible exposición al virus de la encefalitis japonesa. La duración de la protección a largo plazo está todavía en período de observación. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 51 Medicina Seguridad Por el momento no está recomendado su uso en niños y adolescentes debido a la ausencia de datos sobre su seguridad y eficacia. La indicación actual de la vacuna se limita a mayores de 18 años. También debe evitarse su uso durante el embarazo y los periodos de lactancia. La seguridad de la vacuna se ha evaluado en diferentes ensayos clínicos controlados, en los que participaron más de 4.715 adultos sanos, de los cuales 3.558 recibieron Ixiaro®. Cabe esperar que aproximadamente el 40% de los vacunados experimenten reacciones adversas leves que generalmente ocurren en los tres días siguientes a la vacunación. Las más frecuentes fueron dolor de cabeza y mialgias, que afectaron aproximadamente al 20% y al 13% de los sujetos, respectivamente; suelen desaparecer al cabo de pocos días. No se ha observado ningún aumento del número de efectos secundarios entre la administración de la primera y de la segunda dosis (15). VACUNA FRENTE A LA ENCEFALITIS PRIMAVERO-ESTIVAL RUSA O CENTRO-EUROPEA (TBE Tick Borne Encephalitis) La enfermedad está causada por un Arbovirus de la familia Flaviviridae, Virus de la encefalitis por garrapatas (TBEV), del que se conocen tres subtipos: Europeo, Extremo Oriente (responsable de la encefalitis primavera-estival rusa) y Siberiano. La transmisión se produce por mordedura de garrapatas (Ixodes) o por consumo de leche de animales infectados, y sólo excepcionalmente existe transmisión directa entre personas (por transfusiones). Dos tercios de las infecciones son asintomáticas. El período de incubación medio es de 8 días (rango 4 a 28) si la transmisión se produce por garrapatas y de 3-4 días si se produce por consumo de leche. El cuadro clínico cursa, en la primera fase, con sintomatología inespecífica de tipo gripal (mialgias, fatiga, cefaleas…), de la que se recuperan completamente dos tercios, y en la segunda fase pueden presentar fiebre (10% de los casos) y meningitis aséptica, encefalitis o mielitis, que dan lugar a parálisis, secuelas o muerte. Se observa una relación directa entre la edad y la severidad de la enfermedad (sobre todo mayores de 50 años) y también que el subtipo de Extremo Oriente causa enfermedad con mayor gravedad (20-40% de casos mortales) y mayor probabilidad de ocasionar secuelas que el subtipo Europeo (< 2% de mortalidad) y el Siberiano (2 a 3% de casos fatales). La enfermedad ocasiona anualmente un número estimado de 10.000 casos en Rusia y de 3.000 casos en países europeos (Austria, norte de Suiza, sur de Alemania, Finlandia, Suecia, Noruega, Estonia, Letonia, Lituania, Polonia, República Checa, Eslovaquia, Eslovenia, Hungría). El subtipo de Extremo Oriente se extiende desde el noreste de Europa hasta China y Japón y el subtipo Siberiano desde el norte de Europa hasta Siberia. Los casos se producen con mayor frecuencia entre los meses de abril a noviembre; se estima que el riesgo de adquisición de la enfermedad por los viajeros no vacunados que visitan áreas endémicas en períodos de transmisión es de 1 caso por 10.000 personas y mes de exposición, si bien la eficacia de los sistemas de vigilancia y diagnóstico son muy variables según los países. Las áreas boscosas por debajo de 1.400 metros de altitud y las actividades como caza, pesca, Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva senderismo, recolectores de setas, fresas, flores …, los viajeros que realizan acampadas, los trabajadores forestales o los militares en estas áreas son factores predictores del riesgo de infección. Vacunas A mediados del siglo XX se desarrollaron en la URSS vacunas eficaces frente a la TBE cultivadas en cerebro de ratón, pero con reactogenicidad vinculada a la presencia de mielina murina en la vacuna, responsable de numerosos efectos adversos. Actualmente se dispone en Europa de dos vacunas inactivadas, seguras y efectivas en formulaciones pediátricas (FSME-INMUN 0,25ml Junior de laboratorio Baxter) y de adultos (Ticovac 0,5 ml® de Laboratorio Baxter); en España se suministran, a través del servicio de medicamentos extranjeros, a los centros de vacunación internacional. Cada dosis de 0,5 ml de Ticovac Adultos® contiene 2,4 microgramos de TBEV inactivados de la cepa Neudörfl cultivados en células de embrión de pollo y las dosis de 0,25 ml de FSME Junior contienen 1,2 microgramos del mismo virus. Ambas contienen también hidróxido de aluminio, albúmina humana, y trazas de formaldehído, neomicina, gentamicina y sulfato de protamina. Ticovac Adultos ® se indica en personas de 16 años o mayores por vía intramuscular en la región deltoidea y FSME junior, entre 1 y 16 años. La pauta de administración de las dos vacunas requiere una primera dosis, la segunda entre 1 y 3 meses tras la primera y la tercera, de 5 a 12 meses después de la segunda dosis. En los viajeros a zonas de riesgo sin tiempo suficiente para la pauta anterior es posible y muy frecuente utilizar pautas aceleradas: 0, 7, 21 días más una cuarta dosis a los 12-18 meses. Las dosis de refuerzo se deben llevar a cabo cada 3-5 años en función de la situación epidemiológica y de la edad de vacunación, de forma que en los mayores de 60 años se recomienda la revacunación cada 3 años. La inmunogenicidad es muy elevada, especialmente en niños (4). Los efectos adversos son poco frecuentes (0,4%) y con más frecuencia locales que sistémicos. Entre los niños pequeños, la frecuencia de reacciones adversas, como fiebre, cansancio y cefaleas, pueden llegar al 20%. Las contraindicaciones son comunes a las vacunas inactivadas en general: reacciones anafilácticas a dosis previas, hipersensibilidad a los componentes de vacuna, enfermedad febril aguda… No está bien establecida la seguridad durante el embarazo y la lactancia, por lo que en estas situaciones se deberá valorar el nivel de riesgo y la posibilidad de adoptar otras medidas preventivas. VACUNAS FRENTE A LA FIEBRE TIFOIDEA La fiebre tifoidea es una enfermedad sistémica de gravedad variable causada por una enterobacteria patógena: Salmonella enterica subespecie enterica serotipo Typhi, abreviada, S. typhi. El reservorio lo constituyen los seres humanos y, habitualmente, la transmisión se produce por vía fecal-oral, por la ingestión de alimentos o agua contaminados con heces u orina de enfermos o portadores asintomáticos de la bacteria (16). 51 41-61 CAPITULO 20 03/05/10 13:02 Página 52 Medicina Preventiva Los síntomas de la enfermedad son múltiples: fatiga, malestar general, cefalea intensa, fiebre, dolor abdominal, anorexia, bradicardia relativa, esplenomegalia y estreñimiento en niños mayores y adultos, mientras que la diarrea es más frecuente en niños pequeños. En los casos graves, la fiebre tifoidea puede provocar disfunción cerebral, delirio, shock, perforaciones intestinales o hemorragias. Estos síntomas son poco específicos y pueden confundirse con paludismo, dengue, gripe y otras enfermedades febriles. Las personas inmunodeprimidas o con aclorhidria son más sensibles a dosis infectivas más bajas de S. typhi y tienen un mayor riesgo de enfermedad grave. Normalmente, padecer la enfermedad confiere una inmunidad de por vida y las reinfecciones son raras, al menos en los casos los que la primoinfección no es interrumpida por una antibioterapia precoz. La mejora de las condiciones de vida y la aparición de los antibióticos en la década de los cuarenta supuso una disminución considerable de la morbilidad y de la mortalidad debida a la fiebre tifoidea en los países industrializados. En cambio, en los países en desarrollo de Asia, África y América Latina, la enfermedad constituye un importante problema de salud pública. En el año 2004, la morbilidad mundial de esta enfermedad se estimó en 21 millones de casos, con una mortalidad de 216.000 a 600.000 casos (1-4%), principalmente en niños y en Asia (90% de los fallecimientos). En algunas regiones, particularmente en África, las estimaciones son limitadas por falta de datos. En el año 2006 se han registrado epidemias en China, Hong Kong, India, Kyrguistán, Islas Marshall. Papúa Nueva Guinea, Filipinas y en numerosos países africanos. La aparición, en los años 1970 y 1980, de cepas de S. typhi multirresistente (resistentes a los tres antibióticos de primera línea: el cloranfenicol, la ampicilina y el cotrimoxazol) en el sur y sudeste de Asia, Oriente medio y el nordeste de África, constituye un problema creciente. La infección por estas cepas se asocia a una enfermedad más grave y a unas tasas de complicaciones y de mortalidad más elevadas, sobre todo en niños menores de dos años. Por otro lado, comparadas con la enfermedad causada por cepas sensibles, la tasa de portadores asintomáticos tras el tratamiento es diez veces más elevada en las infecciones por S. typhi multirresistente. La existencia de estas cepas ha conducido a la generalización del uso de fluoroquinolonas, como cirpofloxacino y ofloxacino en los países donde la multirresistencia constituye un problema. Durante la década de 1990 se declararon en Tadjikistan y Vietnam epidemias de fiebre tifoidea producidas por cepas bacterianas con sensibilidad reducida a las fluoroquinolonas y en el año 2005 se detectaron en Pakistán, y más recientemente en India, cepas de S. typhi que presentaban una resistencia total a ciprofloxacino. Las recientes epidemias de fiebre tifoidea multirresistente ocurridas en numerosos países de África indican que estas cepas están muy extendidas. Por estas razones, el uso de la vacuna antifoidea se recomienda en las zonas de alto riesgo y a los viajeros que se desplazan a ellas. Todos los viajeros a zonas endémicas tienen riesgo potencial de adquirir la enfermedad, siendo especialmente elevado en el subcontinente indio. Además de ser vacunados, los viajeros deben adoptar las medidas para evitar el consumo de alimentos y agua potencialmente contaminados, ya que las vacunas no confieren un 100% de protección. 52 Vacunas En la actualidad se encuentran comercializados dos tipos de vacunas frente a la fiebre tifoidea: una inyectable de polisacáridos Vi (inactivada) y otra oral Ty21a (viva atenuada) que han reemplazado a la vacuna de microorganismos enteros inactivados por calor, fenol o acetona más reactogénica y aún disponible en muchos países en desarrollo. Vacuna polisacárida Vi (Typhim Vi Pasteur/Tyhperix® GSK) Esta vacuna fue autorizada por primera vez en Estados Unidos en 1994. Está constituida por polisacáridos capsulares Vi de la cepa Ty2 de S. typhi (25 μg por dosis) e induce inmunidad 7 días después de la inoculación; produce una respuesta de IgG independiente de los linfocitos T, que no es reforzada por dosis suplementarias. Se administra por vía subcutánea o intramuscular. Es estable durante seis meses a 37ºC y durante dos a 22ºC, aunque la temperatura de conservación recomendada se encuentra entre 2 y 8ºC. Esta vacuna está indicada en niños mayores de dos años (en niños más pequeños la respuesta inmunitaria es insuficiente, al igual que con otras vacunas polisacarídicas) y en adultos. Una sola dosis proporciona protección durante aproximadamente 7 años, sin embargo, para mantener una protección elevada es recomendable recibir una dosis de refuerzo cada tres años. La vacuna de polisacáridos Vi se puede administrar con otras vacunas recomendables en los viajeros internacionales, como fiebre amarilla, rabia, meningitis, hepatitis A y B, etc., y con las vacunas de los programas sistemáticos de los niños. La vacuna inyectable produce una respuesta de IgG sérica en el 85-95% de los adultos y niños mayores de dos años 15 días después de la administración. Se recomienda una concentración sérica de anticuerpos anti Vi de al menos 1,0 μg/ml como indicador serológico de protección contra la fiebre tifoidea. La eficacia estimada es de un 70-80%, y su duración es de 2-3 años, aunque en diversos estudios realizados en África del Sur, Nepal y China, se han encontrado concentraciones protectoras de anticuerpos hasta 10 años después de la vacunación. Las reacciones adversas, tanto sistémicas leves (mialgias, cefalea o febrículas) como locales (dolor, eritema e induración en el lugar de la inyección) son poco frecuentes. Se puede administrar en personas con alteraciones del sistema inmunológico. En pacientes con infección por el VIH, la inducción de anticuerpos protectores es directamente proporcional al número de linfocitos CD4. Sólo está contraindicada en personas con hipersensibilidad a alguno de sus componentes o al medio de crecimiento de las bacterias. Vacuna Ty21a (Vivotif® Berna) Esta vacuna fue autorizada en Europa en 1983 y en Estados Unidos en 1989. Está constituida por bacilos de la cepa Ty21a de S. typhi vivos y atenuados. Se administra por vía oral. La vacuna se encuentra disponible en dos formas: cápsulas entéricas (recubiertas de una solución orgánica que le proporciona resistencia contra el medio ácido del estómago) y suspensión líquida. Las primeras se utilizan en viajeros que van a países en desarrollo, mientras que la suspensión líquida se emplea en los programas de salud pública en los países en desarrollo ya que puede administrarse desde los dos años. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 53 Medicina En España sólo se encuentra comercializada la presentación de tres cápsulas (VIVOTIF® Berna). Esta formulación se recomienda a partir de los seis años. La pauta de administración consiste en tomar tres cápsulas, una cada 48 horas o en días alternos (en Estados Unidos y Canadá la vacuna contiene cuatro cápsulas, para cuatro dosis). En Europa y Australia se recomienda tomar la vacuna cada tres años en las personas que vivan en áreas endémicas bajo condiciones de repetidas o continuas exposiciones a Salmonellas y cada año en personas que vivan en países no endémicos y viajen a otros que sí lo son. En EEUU, la revacunación se recomienda a los 5 años y en Canadá, cada siete años. Puede administrarse al mismo tiempo que otras vacunas. La vacuna produce protección aproximadamente 7 días después de la administración de la última dosis y se mantiene en un 67% de los vacunados después de los tres años y en un 62% a los siete años en los residentes en zonas endémicas. La vacuna Ty21a es bien tolerada y la tasa de manifestaciones indeseables es baja. La aparición de reacciones secundarias es poco frecuente y estas consisten en molestias gastrointestinales, como dolor abdominal, nauseas y vómitos. La febrícula se presenta en menos del 5% de los vacunados y es de corta duración. Diversos estudios realizados en Chile e Indonesia han puesto de manifiesto que la frecuencia de diarreas, vómitos, fiebre y erupciones cutáneas no es sensiblemente diferente entre los grupos vacunados y los grupos control. La administración de fármacos antimicrobianos o antipalúdicos como proguanil o mefloquina debe evitarse durante los tres días antes y los tres siguientes a la vacunación. La administración deberá posponerse en niños con diarrea. No está indicada en casos de inmunodeficiencia congénita o adquirida, incluyendo tratamientos con medicación inmunosupresora y antimicótico o infección intestinal aguda. Puede ser administrada sin peligro en pacientes VIH positivos asintomáticos si el recuento de linfocitos CD4 es >200/mm3. La vacuna Ty21a protege en un 56% de los casos contra la infección por Salmonella enterica subespecie enterica serotipo Paratyphi B. Tal como propone la OMS, se debe recomendar la vacuna contra la fiebre tifoidea a los viajeros que se dirigen a países donde el riesgo de la enfermedad es alto, como norte y oeste de África, sur de Asia, sobre todo India y Pakistán, y Perú. Dicha recomendación es especialmente importante si la estancia es mayor de un mes, se prevé que los viajeros estarán expuestos a malas condiciones higiénicas, o en los viajeros que visitan el subcontinente indio y destinos donde pueden existir microorganismos resistentes a los antibióticos. Todos los viajeros que se desplacen a zonas endémicas están expuestos a un riesgo potencial de fiebre tifoidea, aunque es más bajo en los centros turísticos y grandes ciudades, donde las normas de alojamiento, saneamiento e higiene alimentaria suelen ser adecuadas. Dada la elevada morbilidad de la fiebre tifoidea, la creciente resistencia antimicrobiana de S. typhi y la inocuidad, eficacia, disponibilidad y bajo coste de las dos vacunas homologadas (Vi y Ty21a), los países deberían considerar el uso en sus programas de vacunación de estas vacunas antitifoideas. La elección de la estrategia de vacunación dependerá de factores locales como la incidencia por edades, los subgrupos más expuestos, la tasa de escolarización y de las regiones más afectadas (conocimiento de la situación epidemiológica local). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva VACUNAS FRENTE A LA HEPATITIS A y B Dado que se estudian separadamente en capítulos anteriores, sólo señalaremos que estas vacunas deben ser consideradas para todos los viajeros a zonas con riesgo de infección y se deben recomendar a todas las personas con alto riesgo de contraer la enfermedad, independientemente de su destino (1, 2). Hepatitis A Las personas de países desarrollados nacidas antes de 1945 son probablemente inmunes por haberse infectado durante la infancia. Aunque la hepatitis A suele ocasionar un cuadro clínico banal en niños, produce la muerte en el 2% de las personas de más de 40 años que la padecen y del 4% en los mayores de 60 años. Estos datos, junto la elevada circulación del virus de la hepatitis A en gran parte de los países en desarrollo, hacen de la vacuna frente a ella una vacuna prácticamente sistemática para los viajeros, siendo especialmente recomendable en niños y adultos jóvenes. Las vacunas actuales son todas ellas de virus inactivados y son seguras y altamente eficaces. Pueden administrarse a partir de 12 meses de edad. Los anticuerpos protectores son detectables dos semanas después de la administración de la primera dosis y la segunda dosis se administra al menos 6 meses después (de 6 a 24 meses) para conferir protección a largo plazo. No se recomiendan dosis de recuerdo, ya que se estima una protección durante 25 años o más. Se contraindica en caso de hipersensibilidad a dosis anteriores y las reacciones adversas son muy escasas, leves y de corta duración. Hepatitis B El riesgo para los viajeros dependerá de la prevalencia de infección del virus de la hepatitis B en los países de destino, del tipo de viaje, duración, conductas de riesgo o contacto con los sistemas asistenciales. Entre los riesgos más frecuentes se encuentran la asistencia médica, dental, acupuntura, tatuajes, recibir transfusiones… Las vacunas frente a la hepatitis B deben ser consideradas en todos los viajeros no inmunes que se desplacen a zonas con riesgo de infección moderado o alto. Pueden administrarse desde el momento del nacimiento. Son seguras y eficaces. La serie completa consta de tres dosis, que normalmente se administra en pauta de o, 1, 6-12 meses, proporcionando una protección durante al menos 15 años y probablemente permanente. En los viajeros suelen administrarse en pautas aceleradas: – Rápida: tres dosis a los 0,1 y 2 meses, con dosis de recuerdo a los 6-12 meses. – Muy rápida: tres dosis a los 0, 7 y 21 días, con una dosis adicional a los 12 meses. Están disponibles en el mercado vacunas combinadas de hepatitis A+B para niños (Twinrix pediátrico®) y adultos (Twinrix adultos®), con pautas semejantes a la hepatitis B. Dichas presentaciones resultan muy útiles en los viajeros que requieren ambas vacunas. VACUNA FRENTE A LA RABIA La rabia es una enfermedad zoonótica producida por un rhabdovirus del género Lyssavirus, que afecta a numerosos animales domésticos y mamíferos salvajes, incluidos los 53 41-61 CAPITULO 20 03/05/10 13:02 Página 54 Medicina Preventiva murciélagos. Se han identificado más de 80 serotipos en función de los antígenos de superficie, sin embargo, sólo 7 son capaces de afectar al hombre. La infección en las personas se produce por mordedura de animales infectados, ya que el virus se encuentra presente en la saliva y, con menos frecuencia, por arañazos o lameduras sobre piel o mucosas rasgadas. Ocasiona una encefalomielitis vírica aguda con elevada mortalidad, que comienza con malestar, sensación de angustia, cefaleas, fiebre y cambios sensitivos alrededor de la mordedura. Son frecuentes alucinaciones, espasmos fóbicos, excitabilidad, delirios y convulsiones; la muerte suele ser consecuencia de la parálisis de los músculos respiratorios. El riesgo de rabia para los viajeros a zonas endémicas deriva del contacto con mamíferos. Aunque la rabia está presente en todos los continentes, numerosos países como Bangladesh, Bolivia, Camboya, China, Ecuador, Colombia, El Salvador, Guatemala, Etiopía, Méjico, India, Nepal, Sri Lanka, Filipinas, Indonesia, Vietnam, Laos, Tailandia… tienen un riesgo alto de transmisión de la enfermedad; tan sólo en India se producen anualmente 30.000 muertes por rabia, transmitida por mordedura de perros en la mayor parte de los casos, afectando sobre todo a varones menores de 15 años. La información sobre la rabia en África es escasa. La OMS estima que anualmente se producen más de 55.000 muertes por esta enfermedad, de las que el 30-50% ocurren en menores de 15 años y el 95% se producen en Asia y África. En los últimos años, la rabia de los murciélagos ha reaparecido como problema de salud pública en las Américas y en Europa. En 2003, en Sudamérica murieron por primera vez más personas de rabia por mordedura de animales salvajes (sobre todo murciélagos) que de perros. La medida más coste-efectiva para evitar la enfermedad en las personas es la vacunación de los animales; gran parte de los países con elevada incidencia están desarrollando esfuerzos en este sentido, porque la vacunación de las personas postexposición (tras sospecha o conocimiento de exposición al virus de la rabia) supone un coste elevado. Para los viajeros en los que es previsible una elevada exposición: larga exposición rural, viajes en bicicleta o ciclomotor, trabajadores en granjas, cazadores, mochileros… en países con riesgo de transmisión de rabia elevado, es recomendable la vacunación preexposición (antes del posible riesgo de exposición al virus de la rabia). Vacunas Las vacunas de primera generación disponibles para uso humano, se elaboran a partir de tejido nervioso de animales y se inactivan con fenol, radiaciones ultravioletas o betapropiolactona; requieren numerosas inyecciones por vía subcutánea y suelen presentar reacciones adversas graves debidas a la presencia de antígenos neuronales en el 0,1 a 5 por 1.000 vacunados. La OMS ha recomendado el cese de su producción. Las vacunas de segunda generación se preparan con virus obtenidos de cultivos celulares: diploides humanas (HDCV), células Vero, todas ellas están altamente purificadas y libres de proteínas heterólogas; inducen una buena respuesta inmune y son bien toleradas, lo que las hace muy eficaces. Son las vacunas recomendadas actualmente por la OMS 54 Vacuna de rabia Rabipur® Novartis Vaccine Composición: Virus de rabia inactivados de la cepa Flury LEP (3) 2,5 UI producidos en células embrionarias de pollo purificadas. Contiene como excipientes: TRIS-(hidroximetil)aminometano, Cloruro sódico, Edetato disódico (Titriplex III), L-glutamato potásico, Poligelina, y Sacarosa. La posología recomendada para todos los grupos de edad es de 1 ml por vía intramuscular en el músculo deltoides y en niños en la región antero-lateral del muslo; no debe inyectarse en el músculo glúteo ni por vía intravascular (si la vacuna se administra inadvertidamente en un vaso sanguíneo existe el riesgo de reacciones adversas graves, incluyendo el shock). En la medida de lo posible, y en función de la disponibilidad de la vacuna, se recomienda la utilización de una vacuna del mismo tipo de cultivo celular durante todo el ciclo de inmunización pre o post-exposición. No obstante, en el tratamiento post-exposición, se considera de capital importancia la adherencia a las pautas recomendadas, aun cuando deba usarse una vacuna de otro tipo de cultivo celular. Profilaxis pre-exposición Inmunización primaria En personas no vacunadas previamente, el ciclo inicial de profilaxis preexposición consiste en 3 dosis (de 1 ml cada una) los días 0, 7 y 21 ó 28. Dosis de recuerdo La experiencia demuestra que, generalmente, se necesitan dosis de refuerzo cada 2-5 años. Sin embargo, puede ser necesario evaluar las distintas situaciones: • Se recomienda habitualmente la determinación de anticuerpos neutralizantes a intervalos de 6 meses si el riesgo de exposición es alto (p. ej., personal de laboratorio que trabaja con el virus de la rabia). • En personas consideradas en riesgo continuo de exposición a la rabia (p. ej. veterinarios y sus ayudantes, trabajadores en contacto con animales salvajes, cazadores), en general deberán someterse a un análisis serológico al menos cada 2 años; se reducirá dicho intervalo si se considera adecuado en función del grado de riesgo percibido. • En los casos citados previamente, se debe administrar una dosis de recuerdo si el título de anticuerpos es inferior a 0,5 UI/ml. • Alternativamente, en función del riesgo percibido, se pueden administrar dosis de recuerdo a los intervalos recomendados oficialmente sin la evaluación serológica previa. Rabipur® se puede utilizar como vacuna de recuerdo tras la inmunización previa con vacuna antirrábica cultivada en células diploides humanas. Contraindicaciones Esta vacuna no se debe administrar a personas con antecedentes de reacción de hipersensibilidad grave a cualquiera de los componentes de la vacuna. La vacuna puede contener poligelina, trazas de neomicina, clortetraciclina, anfotericina B y proteínas de pollo. Se debe retrasar la vacunación en los sujetos que padezcan una enfermedad febril aguda. Las infecciones menores no representan una contraindicación para la vacunación. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 55 Medicina Tratamiento post-exposición La inmunización postexposición debe comenzar lo antes posible después de la exposición y debe acompañarse de las medidas terapéuticas locales en el punto de inoculación para reducir el riesgo de infección. Se deben respetar las recomendaciones oficiales relativas a las medidas concomitantes adecuadas que deben adoptarse para prevenir la aparición de una infección. Contraindicaciones No existen contraindicaciones para la vacunación cuando está indicado el tratamiento post-exposición. No obstante, los sujetos con riesgo de una reacción de hipersensibilidad grave deben recibir una vacuna antirrábica alternativa si se dispone de un producto adecuado. Los antecedentes de alergia al huevo o una prueba cutánea positiva a ovoalbúmina no indican necesariamente que el paciente sea alérgico a Rabipur®. No obstante, las personas con antecedentes de reacción de hipersensibilidad grave a los huevos o a sus derivados no deben recibir la vacuna como profilaxis preexposición. Dichas personas no deben recibir la vacuna para el tratamiento post-exposición a menos que no se disponga de una vacuna adecuada alternativa, en cuyo caso, todas las inyecciones deben administrarse bajo estrecha vigilancia en dependencias dotadas para el tratamiento de emergencia. Otras recomendaciones Tras el contacto con animales sospechosos de ser portadores de la rabia (según la OMS 1997) es recomendable: a) Tratamiento inmediato de la herida: Para eliminar el virus de la rabia, limpiar inmediatamente la herida con jabón e irrigarla con bastante agua. A continuación, tratar con alcohol (70%) o solución de yodo. En la medida de lo posible, las lesiones por mordedura no deben suturarse o sólo suturarse para asegurar la aposición. b) Vacunación antitetánica y administración de la inmunoglobulina antirrábica Si es necesario, se administrará profilaxis antitetánica. Si está indicada la inmunización pasiva, se administrará en el interior y alrededor de la Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva herida, tan profundamente como sea posible, la mayor cantidad anatómicamente posible del total de la dosis recomendada de inmunoglobulina antirrábica humana. El resto de la inmunoglobulina se debe inyectar por vía intramuscular en un lugar separado del punto de vacunación, preferentemente en el glúteo. BIBLIOGRAFÍA 1. WHO. International Travel and Health. Situation as on 1 january 2009. 2009. 2. CDC. CDC Health Information for International Travel 2010. : Elsevier, Inc; 2009. 3. Salleras L. Vacunaciones Preventivas. Principios y aplicaciones. 2ª ed.: Masson; 2003. 4. Comité asesor de vacunas de la AEP. Manual de vacunas en pediatría. 4ª ed.: Sociedad Española de Pediatría; 2008. 5. Navarro-Alonso J. Vacunas antimeningocócicas. Enferm Infecc Microbiol Clin 2007;25(Supl 4):20-28. 6. WHO. The pediatric bacterial meningitis surveillance Network in WHO`s African Region 2001-2008. Weekly Epidemiological Record 2009 15 mai;20. 7. Pace D, Pollard AJ, Messonier NE. Quadrivalent meningococcal conjugate vaccines. Vaccine 2009;27(SUPPL. 2):B30-B41. 8. WHO. Progress towards poliomyelitis eradication in Afganistan and Pakistan, 2008. Weekly Epidemiological Record 2009 6 March;10. 9. WHO. Performance of acute flaccid paralysis surveillance, 2008. Weekly Epidemiological Record 2009 March 2009;13. 10. WHO. Health conditions for travelers to Saudi Arabia for the pilgrimage to Mecca (Hajj). Weekly Epidemiological Record 2008 14-nov;46. 11. Sanofi Pasteur. Inativated Poliomyelitis Vaccine (Vero cell Origin). Product monograph IMOVAX Polio. 2007 jan. 12. WHO. Cholera 2007. Weekly Epidemiological Record 2008 August 2008;31. 13. Duggan ST, Plosker GL. Japanese encephalitis vaccine (inactivated, adsorbed) [IXIARO®]. Drugs 2009;69:115-22. 14. Tauber E, Kollaritsch H, Korinek M, Rendi-Wagner P, Jilma B, Firbas C, et al. Safety and immunogenicity of a Vero-cell-derived, inactivated Japanese encephalitis vaccine: a non-inferiority, phase III, randomised controlled trial. Lancet 2007;370:1847-53. 15. Schuller E, Jilma B, Voicu V, Golor G, Kollaritsch H, Kaltenböck A, et al. Long-term immunogenicity of the new Vero cell-derived, inactivated Japanese encephalitis virus vaccine IC51. Six and 12 month results of a multicenter follow-up phase 3 study. Vaccine 2008;26:4382-6. 16. WHO. Typhoid vaccines: WHO position papers. Week. Epidem. Rec. 2008;83:49-60. 55 41-61 CAPITULO 20 11/05/10 18:05 Página 56 Medicina Preventiva Mapas de distribución de Fiebre Amarilla, Cólera, Bucefalitis Japonesa, Hepatitis A, Hepatitis B, Meningitis meningocócica, Poliomelitis, Rabia y áreas de riesgo de Fiebre Amarilla. 56 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 57 Medicina Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 57 41-61 CAPITULO 20 03/05/10 13:02 Página 58 Medicina 58 Preventiva Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 59 Medicina Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 59 41-61 CAPITULO 20 03/05/10 13:02 Página 60 Medicina 60 Preventiva Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 41-61 CAPITULO 20 03/05/10 13:02 Página 61 Medicina Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 61 62-65 CAPITULO 21 11/05/10 17:16 Página 62 Medicina Preventiva Capítulo 21 CONTROL DE BROTES EPIDÉMICOS MEDIANTE LA VACUNACION A. Domínguez1, 2, V. Pastor3, C. Sanz3 Departamento de Salud Pública. Universidad de Barcelona. 2CIBER Epidemiología y Salud Pública (CIBERESP). Instituto de Salud Carlos III. 3Servicio de Medicina Preventiva. Hospital La Princesa-UAM. Madrid. 1 Puesto que no todas las personas susceptibles reciben la vacuna antes de que se produzca un brote de una enfermedad inmunoprevenible, la vacunación puede contemplarse también como una actividad de control en situación de brote epidémico (1). Los términos “epidemia” y “brote epidémico” a menudo se utilizan de forma intercambiable, pero pueden establecerse ciertas diferencias entre ellos. La definición de brote epidémico es siempre un término relativo (debe conocerse la situación basal para poder detectar un brote), siendo una definición de brote muy aceptada la que se contempla en el Diccionario de Epidemiología: “una epidemia que se limita a un aumento localizado de la incidencia de la enfermedad”, mientras que la “epidemia” se define como “la ocurrencia en una comunidad o región de casos de una enfermedad claramente en exceso respecto a los valores esperados” (2). El número de casos que indica la existencia de una epidemia varía según el agente infeccioso, el tamaño y características de la población expuesta y la experiencia previa de la población frente al agente en cuestión. Un único caso de una enfermedad que ha estado ausente de una población durante un largo período de tiempo o un caso de una enfermedad que no estaba presente en un área geográfica determinada requiere una investigación inmediata y dos casos de la misma enfermedad relacionados en el tiempo y en el espacio constituyen una evidencia suficiente de que existe transmisión en un territorio como para que se considere una epidemia (3). De las distintas vacunas disponibles para utilización en el adulto, existe evidencia de que son útiles para frenar la progresión de brotes epidémicos la vacuna antihepatitis A, la vacuna antimeningocócica y la vacuna triple vírica. INDICACIONES PARA LA VACUNACIÓN EN BROTES DE HEPATITIS A La disponibilidad de una vacuna que ha demostrado una elevada eficacia (4, 5) y efectividad (6-9) y el relativamente largo periodo de incubación de la enfermedad (de 15 a 50 días tras la exposición) hizo pensar que pudiera utilizarse la vacuna para evitar la enfermedad en personas no inmunizadas. Los datos disponibles obtenidos en estudios de inmunogenicidad (10), estudios realizados en animales (11, 12), así como también estudios de intervención realizados en personas expuestas al virus (13) indicaban ya que la vacuna antihepatis A cuando se administraba en los días siguientes a haberse producido la exposición al virus podía evitar la 62 enfermedad. Los resultados de estos estudios que, aunque no eran ensayos clínicos randomizados, se consideraron indicativos de que la efectividad de la vacuna en esta situación no era inferior a la de las inmunoglobulinas inespecíficas, llevaron a que diversas administraciones recomendaran la vacunación como opción de profilaxis post exposición en personas no vacunadas (14, 15). En Estados Unidos, seguían recomendando la profilaxis postexposición con inmunoglobulinas (16, 17). Sin embargo, sí que recomendaban la vacunación para el control de brotes epidémicos comunitarios (16). Diversas experiencias demostraban que en comunidades en las que el virus circulaba ampliamente, con la vacunación masiva de niños y adolescentes se disminuía sensiblemente la incidencia de la enfermedad (5, 18-23). Por ello, los CDC ya en 1999 recomendaron la vacunación de la población como medida de control de los brotes epidémicos (16). Victor et al (24) publicaron en 2007 los resultados de un ensayo clínico aleatorizado en el que se estudiaron un total de 4.525 contactos de casos de hepatitis A confirmados por laboratorio, a los que se les asignó aleatoriamente la vacuna o la inmunoglobulina inespecífica antes de que transcurrieran 15 días. La incidencia de hepatitis A tanto en los que recibieron la vacuna como en los que recibieron inmunoglobulina fue siempre inferior al 5%. Aunque las tasas de incidencia fueron ligeramente superiores en los que habían recibido la vacuna, el riesgo de hepatitis A no fue nunca más de 1,5% en los que recibieron la vacuna que en los que recibieron la inmunoglobulina. No se comparó la vacuna frente a un placebo porque no se consideró ético, dado que estaba demostrada la eficacia preventiva de la inmunoglobulina. Asumiendo una eficacia de la inmunoglobulina del 90% para prevenir la hepatitis A en situación de postexposición, la eficacia de la vacuna en la misma situación resultó ser del 86% (IC95%: 73%-93%). Los autores de este importante estudio concluyeron que aunque la eficacia de la vacuna era ligeramente inferior a la de la inmunoglobulina, la vacuna debía recomendarse como una opción válida para la profilaxis postexposición. Las bases que sustentan la recomendación son las siguientes: 1. La protección que confiere la vacuna es permanente frente a una protección muy limitada en el tiempo de la inmunoglobulina. 2. El volumen de inmunoglobulina que debe administrarse es muy grande y por ello su administración es dolorosa. 3. La producción de inmunoglobulinas es muy limitada. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 62-65 CAPITULO 21 03/05/10 13:27 Página 63 Medicina Posteriormente, tras considerar estos razonamientos, así como también el hecho de que la vacuna era de más fácil administración y que su coste era similar al de las inmunoglobulinas, el Advisory Committee on Immunization Practices (ACIP) de los Estados Unidos, concluyó que la vacuna utilizada para profilaxis postexposición en: a) Niños de 12 meses y adultos menores de 40 años sanos si se administraba antes de 14 días de que se hubiera producido la exposición. En estas personas, si bien se ha demostrado que una dosis es suficiente para prevenir la enfermedad (25) es recomendable administrar una segunda dosis entre 6 y 12 meses más tarde (26). a) En inmunodeprimidos, pacientes con hepatopatía crónica y personas para las que la vacuna está contraindicada, la inmunoglobulina continuaba siendo la opción recomendada. Además, la vacuna se recomienda para otras circunstancias como son: b) Personal de guarderías cuando ocurre algún caso de hepatitis A entre los niños o entre el personal. c) Personal de guarderías cuando se detectan casos en dos o más familias de los niños que acuden al centro. d) Miembros de familias que tienen niños con pañales cuando se detectan casos en tres o más familias. e) Contactos estrechos de un caso si la investigación epidemiológica demuestra que ha habido transmisión en una escuela o en un centro sanitario. El tema de la vacunación en brotes asociados a manipuladores de alimentos también se ha discutido. Aunque resulta muy difícil, dada la variabilidad y rango del periodo de incubación poder detectar estos brotes, se han descrito varios brotes de hepatitis A asociados a comer en restaurantes en los que el caso índice ha sido un manipulador de alimentos (2731). Los estudios económicos de la vacunación entre el colectivo de los manipuladores de alimentos no han mostrado por el momento que la vacunación sea una medida eficiente (32). Por ello, en la actualidad la vacunación postexposición en situación de brote asociado a un restaurante solo se recomienda cuando el caso índice es un manipulador que hubiera elaborado platos que no requirieran tratamiento térmico, se observan deficiencias en su higiene o tiene diarrea y no han transcurrido más de 14 días desde la exposición (3). En estas circunstancias debería vacunarse a: a) Compañeros de un manipulador de alimentos. b) Los clientes del establecimiento sólo deberían vacunarse si el manipulador enfermo no respetaba las normas de higiene debidamente y no han transcurrido más de 14 días desde la exposición. En brotes comunitarios, la vacunación de los sujetos susceptibles debe hacerse con la primera dosis lo antes posible y alcanzar coberturas de por lo menos el 70%. Lógicamente, la planificación de esta actividad debe hacerse teniendo en cuenta los programas previos de vacunación en la comunidad (3). INDICACIONES PARA LA VACUNACIÓN EN BROTES DE ENFERMEDAD MENINGOCÓCICA La enfermedad meningocócica continúa siendo un problema muy importante en salud pública y una de las infecciones más temidas debido a su rápida progresión y a su capacidad para originar brotes y epidemias (33). En España, la enfermad es endémica, con episodios de hiperendemia (presencia constante de la enfermedad en todos los grupos de Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva edad y elevada incidencia) que se suceden a intervalos variables de tiempo. El serogrupo predominante es el B, pero en 1996-1997 se produjo una epidemia por el serogrupo C que motivó la puesta en marcha en diversas comunidades autónomas de un programa de vacunación de los niños y adolescentes entre 2 y 18 años con la vacuna antimeningocócica polisacárida A+C. Aunque las coberturas fueron variables según comunidades (90% en Galicia y 60% en Cataluña), los resultados fueron buenos y la epidemia se mantuvo controlada en los dos años siguientes. La efectividad de la vacunación ajustada por edad transcurridos dos años se estimó en 94% (IC 95% 78-98) (34). Se observaron descensos en todas las comunidades en las que habían hecho la campaña de vacunación masiva, pero los descensos fueron claramente superiores en las comunidades que habían vacunado (35). Pasado este período se volvió a observar un incremento de casos de enfermedad meningocócica por serogrupo C, hecho que motivó que a finales del año 2000 se iniciara la vacunación con vacuna antimeningocócica C conjugada (36, 37) y que a partir de 2001 se introdujera en los calendarios de vacunaciones sistemáticas en todas las comunidades, siendo los resultados muy favorables (38). La decisión de iniciar campañas de vacunación masivas para controlar brotes requiere una previa valoración de la situación epidemiológica, ya que son intervenciones caras y que tensionan en gran medida los efectivos de los servicios de Salud Pública. Las experiencias en diversos países europeos y de América del Norte en relación a situaciones de brotes de enfermedad meningocócica ha motivado que se definiera qué se entiende por situación epidémica. Los CDC de Atlanta (39) consideran que existe una situación epidémica si se producen tres o más casos de enfermedad meningocócica en un periodo inferior o igual a tres meses entre personas residentes en una misma área que no tienen relación entre ellos y que no pertenecen a una misma institución, si la tasa de ataque primaria es de por lo menos 10 casos/100.000 personas. Para calcular esta tasa de ataque primaria deben contabilizarse sólo los casos producidos por el mismo serogrupo y deben excluirse los casos secundarios (casos que aparecen transcurridas 24 horas del caso primario y que tienen relación estrecha con éste) y los coprimarios (casos que aparecen antes de 24 horas del caso primario y que tiene relación estrecha con éste). Estos casos secundarios y coprimarios deben considerarse como un único episodio de actividad del microorganismo. Obviamente, para valorar las tasas de ataque resultantes hay que valorar la validez de los casos del numerador. Por su parte, la Organización Panamericana de la Salud (3) considera que el umbral epidémico debe establecerse con alguna de estas situaciones: – Una tasa de incidencia de 10 casos/100.000 habitantes. – Un incremento del 100% del número de casos en tres semanas consecutivas. – Una tasa de 15/100.000 o la aparición de dos casos en personas refugiadas o desplazadas. Una vez tomada la decisión de iniciar una vacunación masiva para controlar una epidemia hay que definir el grupo de edad que se va a vacunar, para lo cual debe tenerse en cuenta la epidemiología de la enfermedad en el momento. En la actualidad, la vacunación con vacuna antimeningocócica polisacárida en situación de brote comunitario o epidemia, los CDC la recomiendan para las personas comprendida entre 2 y 29 años, ya que por debajo de los 2 años 63 62-65 CAPITULO 21 03/05/10 13:27 Página 64 Medicina Preventiva la vacuna polisacárida no protege y por encima de los 30 años los casos de enfermedad meningocócica son poco frecuentes (39). En todo caso, debe ser la epidemiología local la que marque los grupos de edad a los que hay que vacunar. En brotes institucionales (tres o más casos de enfermedad por el mismo serogrupo en menos de tres meses en personas de la institución), la recomendación de vacunar debe hacerse a las mismas personas a las que se administra quimioprofilaxis, porque se considera que están en riesgo. Dado que el efecto protector de la vacuna está presente a las 2 semanas de su administración y dura unos años, al administrar la vacuna además de la quimioprofilaxis, la duración de la protección es mucho mayor. Se recomienda la vacunación con dos dosis de vacuna en las personas susceptibles nacidas después de 1966, si bien el año de corte puede variar en función de la política de vacunación que se haya seguido en la comunidad autónoma. Si no existen limitaciones en el número de vacunas disponibles, debería vacunarse a todos los nacidos después de 1966 (el punto de corte puede variar según comunidades autónomas). Si hay limitación en el número de vacunas disponibles debería priorizarse la vacunación de los profesionales sanitarios (51, 52) (por su papel como agentes difusores en los centros sanitarios) además de la población infantil (la transmisión de la enfermedad es mucho mayor y compromete más su eliminación cuando se afectan niños que cuando se afectan adultos) (53-57). INDICACIONES PARA LA VACUNACIÓN EN BROTES DE SARAMPIÓN Clásicamente se ha venido recomendando la vacunación como medida de profilaxis postexposición individual si no han transcurrido más de 72 horas desde la exposición (1, 3, 40, 41). Los estudios que sustentan esta recomendación son estudios muy antiguos (42-44) y desafortunadamente no se dispone de estudios más recientes que demuestren la efectividad de la medida. Se trata de una medida que logísticamente plantea muchas dificultades para poder ser implementada por lo reducido del intervalo de tiempo para actuar. Además, algunos autores la han puesto en entredicho basándose en sus propias experiencias (45, 46). Sin embargo, lo que no plantea dudas es que ante la aparición de cadenas de transmisión sostenidas en una comunidad con elevadas coberturas, la vacunación masiva de todos los sujetos susceptibles porque aún no tenían la edad para ser vacunados (habitualmente 12-15 meses) o porque no habían sido vacunados aunque la tuvieran, está recomendada (1, 3). Tal como se ha señalado en el capítulo correspondiente, a pesar de los grandes avances en el incremento de coberturas vacunales y de la vigilancia agresiva del sarampión, en los últimos años se han detectado brotes que han afectado a diversos grupos de edad en diversas comunidades autónomas de nuestro país y de otros países en los que se había llegado a interrumpir la transmisión del sarampión a partir de casos primarios producidos en población inmigrante o viajeros procedentes de países en los que el virus circula muy ampliamente (47, 48). Dadas las características de muy elevada transmisibilidad del virus del sarampión en población susceptible (49), la detección precoz de los casos juega un papel fundamental en el control de los brotes. Una vez detectado un caso, debe llevarse a cabo el seguimiento de los contactos durante los 18 días siguientes a la exposición con el fin de que se detecte lo antes posible la existencia de cadenas de transmisión y se adopten las medidas adecuadas para controlar el brote (50). La vacunación para el control de brotes comunitarios debe hacerse a todas las personas que no acrediten haber recibido dos dosis de vacuna separadas por un intervalo mínimo de 28 días después del año de edad, a no ser que acrediten tener anticuerpos frente a la enfermedad o que se disponga de un documento clínico que acredite haber padecido la enfermedad. La vacunación debe realizarse en el tiempo más breve posible. Y, además, tener en cuenta que cuando se administra una dosis de vacuna a niños menores de un año, cuando cumplen esta edad debe administrárseles de nuevo una dosis de vacuna y administrarle una segunda dosis cuando corresponda según calendario. Correspondencia: Ángela Domínguez Departamento de Salud Pública C/ Casanova, 143 08036 Barcelona e-mail: angela.dominguez@ub.edu 64 BIBLIOGRAFÍA 1. American Academy of Pediatrics. Report of the Committee on Infectious Diseases. 28th edition. Elk Grove Village, IL: American Academy of Pediatrics, 2009. 2. Porta M, editor. A dictionary of Epidemiology. 5th edition. Oxford: Oxford University Press, 2008. 3. Heyman DL, editor. Control of Communicable Disease Manual. 19th edition. Washington: American Public health Association, 2008. 4. Innis BL, Snitbhan R, Kunasol P, Kaorakpongset T, Poopatanakool W, Kozik CA, et al. Protection against hepatitis A by an inactivated vaccine. JAMA 1994;271:1328-34. 5. Werzberger A, Mensch B, Kuter B, Brown L, Lewis J, Sitrin R, et al. A controlled trial of a formalin-inactivarted hepatitis A vaccine in healthy children. N Engl J Med 1992;327:453-7. 6. Wasley A, Samandari T, Bell BP. Incidence of hepatitis A in the United States in the era of vaccination. JAMA 2005;294:194-201. 7. Dagan R, Leventhal A, Anis E, Slater P, Ashur Y, Shouval D. Incidence of hepatitis A in Israel following universal vaccination of toddlers. JAMA 2005;294:202-10. 8. Domínguez A, Oviedo M, Carmona G, Batalla J, Bruguera M, Salleras L, Plasència A. Impact and effectiveness of a mass hepatitis A vaccination programme of preadolescents seven years after introduction. Vaccine 2008;26:1737-41. 9. Domínguez A, Oviedo M, Carmona G, Batalla J, Jansà JM, Borràs E, et al. Epidemiology of hepatitis A before and after the introduction of a universal vaccination programme in Catalonia, Spain. J Viral Hepat 2008;15:51-6. 10. Shouval D, Ashur Y, Adler R, Lewis JA, Armstrong ME, Davide JP, et al. Singlew and booster dose response to an inactivated hepatitis A virus vaccine: comparison with immune serum globulin prophylaxis. Vaccine 1993;11 (suppl 1):S9-14. 11. Roberston BH, D’Hont E, Spelbring J, Tian H, Krawcynski K, Margolis HE. Effect of postexposure vaccination in a chimpanzee model of hepatitis A virus infection. J Med Virol 1994;43:294-51. 12. D’Hont E, Purcell RH, Emersun SU, Wong DC, Shapiro M, Govindarajan S. Efficay of an inactivated hepatitis A vaccine in pre and postexposure conditions. J Infect Dis 1995;171 (Supl 1):S40-S43. 13. Sagliocca L, Bianco E, Amoroso P, Quarto M, Richichi I, Tosti ME, et al. Feasibility of vaccination in preventing secondary cases of hepatitis A virus infection. Vaccine 2005;23:910-4. 14. Crowcroft NS, Walsh B, Davison KL, Gungabisoon U. Guidelines for the control of hepatitis A virus infection. Commun Dis Public Health 2001;4:213-27. 15. National Advisory Committee on Immunizations (NACI). Supplementary statement on hepatitis A vaccine. Can Commun Dis Rep 2000;26:12-8. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 62-65 CAPITULO 21 11/05/10 17:17 Página 65 Medicina 16. Centers for Disease Control and Prevention. Prevention of Hepatitis A Through Active or Passive Immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 1999;48:RR-12. 17. Centers for Disease Control and Prevention. Prevention of Hepatitis A Through Active or Passive Immunization. Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55:RR-7. 18. Werzberger A, Kuter B, Nalin D. Six years’ follow-up after hepatitis A vaccination [Letter]. N Engl J Med 1998;338:1160. 19. McMahon BJ, Beller M, Williams J, Schloss M, Tanttila H, Bulkow L. A program to control an outbreak of hepatitis A in Alaska by using an inactivated hepatitis A vaccine. Arch Pediatr Adolesc Med 1996;150:733-9. 20. Bonnani P, Colombai R, Franchi G, Lo Nostro A, Commodo N, Tiscione E. Experience of hepatitis A vaccination during an outbreak in a nursey school of Tuscany, Italy. Epidemiol Infect 1998;121:377-80. 21. Averhoff F, Shapiro CN, Bell BO, Hyams I, Burd L, Deladisma S et al. Control of hepatitis A through routine vaccination of children. JAMA 2001;286:2968-73. 22. Craig AS, Sockwell DC, Schaffner W, Moore WL, Skinner JT, Williams IT et al. Use of hepatitis A vaccine in a communitywide outbreak of hepatitis A. Clin Infect Dis 1998:27:531-5. 23. Prikazsky V, Olear V, Cernoch A, Safary A, Andre F. Interruption of an outbreak of hepatitis A in two villages by vaccination. J Med Virol 1994;44:457-9. 24. Victor JC, Monto AS, Surdina TY, Suleimenova SZ, Vaughan G, Nainan OV, et al. Hepatitis A Vaccine versus Immune Globulin for Postexposure Prophylaxis. N Engl J Med 2007;357:1685-94. 25. Kohl I, Nemecek V, Summerová M, Chlíbek R, Nadová K, Mináriková O. Long-term protective effect of post-exposure HavrixTM administration during viral hepatitis Type A outbreaks. Eur J Epidemiol 2006;21:893-9. 26. Centers for Disease Control and Prevention. Update: Prevention of Hepatitis A after Exposure to Hepatitis A Virus and in International Travelers. Updated Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2007;56:1080-84. 27. Prickachiclov SA, Balayan MS. Shifts in the rates and levels of antibody to hepatitis A virus associated with hepatitis A infection in children’s communities. Eur J Epidemiol 1987;3:370-6. 28. Perrett K. HNIG prophylaxis management of hepatitis A in a food handler at a London secondary school. Commun Dis Public Health 2003;6:259. 29. Centers for Disease Control and Prevention. Foodborne transmission of hepatitis A Massachusetts, 2001. MMWR 2003;52:565-7. 30. Nicholls M, Bruce M, Thomas J. Management of hepatitis A in a food handler at a London secondary school. Commun Dis Public Health 2003;6:26-9. 31. Honish L, Bergstrom K. Hepatitis A infected food handler at an Edmonton, Alberta retail food facility: public health protection strategies. Can Commun Dis Rep 2001;27:177-80. 32. Meltzer MI, Shapiro CN, Mast EE, Arcari C. The economics of vaccinating restaurant workers against hepatitis A. Vaccine 2001;19:2138-45. 33. Apicella MA. Neisseria meningitidis. En: Mandell Gl, Bennett JE, Dolin R, editors. Principle and practice of Infectious Diseases. 6th ed. Philadelphia: Elsevier, 2005; 2:499-513. 34. Salleras L, Domínguez A, Prats G, Parrón I, Muñoz P. Dramatic decline of serogroup C meningococcal disease incidence in Catalonia (Spain) 24 months after a mass vaccination program of children and Young people. J Epidemiol Community Health 2001;55:283-7. 35. Salleras A, Domínguez A, Cardeñosa N. Impact of mass vaccination with polysaccharide conjugate vaccine against serogroup C meningococcal disease in Spain. Vaccine 2003;21:725-8. 36. Vázquez JA. Evaluación de la campaña de inmunización frente a meningococo de serogrupo C en España. An Esp Pediatr 2002;57 (supl 1):S3-6. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 37. Larrauri A, Cano R, García M, de Mateo S. Impacto and effectiveness of meningococcal C conjugate vaccine following its introduction in Spain. Vaccine 2005;23:4097-100. 38. Martínez A, Domínguez A, Oviedo M, Minguell S, Jansà JM, Codina G, et al. Changes in the evolution of meningococcal disease, 2001-2008, Catalonia (Spain). Vaccine 2009;27:3496-8. 39. Centers for disease Control and Prevention. Prevention and Control of meningococcal disease. MMWR 2005;54:(RR7). 40. Maldonado YA. Rubeola virus (measles and subacute sclerosing panendephalitis). En: Long SS, Pickering LK, Prober CG, editors. Principles and Practice of Pediatric Infectious Disease. 3rd ed. Piladelphia: Churchill Livingstone, 2008: 1120-6. 41. Gershon AA. Measles virus (Rubeola). En. Mandell GL, Bennett JE, Dolin R, editors. Principlesand practice of infectious diseases. 6th ed. Philadelphia: Elsevier 2005, 2031-8. 42. Watson GI. Protection after exposure to measles by attenuated vaccine without gamma-globulin. BMJ 1963;1:860-61. 43. Ruuskanen O, Salmi TT, Halionen P. Measles vaccination after exposure to natural measles. J Pediatr 1978;93:43-6. 44. Kempe Ch, Fulginiti VA. The pathogenesis of measles virus infection. Arch Gesamte Virusforch 1965; 16:103. 45. King GE, Markowitz LE, Patriarca PA, Dales LG. Clinical efficacy of measles vaccine during the 1990 measles epidemic. Pediatr Infect Dis J 1991;10:883-7. 46. Rice P, Young Y, Cohen B, Ramsay M. MMR immunization after contact with measles virus. Lancet 2004;363: 569-70. 47. Peña-Rey I, Martínez de Aragón V, Mosquera M, de Ory F, Echevarría JE, Grupo de trabajo del Plan de Eliminación del Sarampión en Espanya. Measles risk groups in Spain: Implications for the European measleselimination target. Vaccine 2009;27:3927-34. 48. Parker AA, Stags W, Dayan G, Ortega I, Rota PA. Owe L et al. Implications of a 2005 measles outbreak in Indiana for sustained elimination of measles in United States. N Engl J Med 2006;355:447-55. 49. Anderson RM, May RM. Immunisation and hard immunity. Lancet 1990;335:641-5. 50. Ramírez R, García-Comas L, Ordobás M, Rodero I. Actuaciones ante un brote de sarampión. En: Dominguez A, Borrás E, editores. El sarampión. 7ª monografía de la Sociedad Española de Epidemiología. Madrid: Sociedad Española de Epidemiología, 2008. 51. Centers for Disease Control and Prevention. Recommended adult immunization schedule-United States, 2009.MMWR 2009;57:(53). 52. Weber DJ, Rutala WA. Vaccines for health workers. En: Plotkin S, Orenstein W, Offit P, editors. Vaccines. 5th ed. Philadelphia: Saunders 2008; 1453-77. 53. Schlenker TL, Bain C, Baughman AL, Hadler SC. Measles herd-immunity: the association of attack rates with immunization rates in preschool children. JAMA 1992;267:823-6. 54. Chen RT, Goldbaum M, Wassilak GF, Markowitz LE, Orenstein WD. An explosive point-source measles outbreak in a highly vaccinated population. Am J Epidemiol 1989;129:173-82. 55. Calvert N, Cutts F, Miller E, Brown D, Munro J. Measles in secondary school children: implication for vaccination policy. Com Dis Rep Rev 1994;4:R70-73. 56. Stein-Zamir C, Zentner G, Agbramson N, Shoob H, Aboudy Y, Shulman L, Mendelson E. Measles outbreak affecting children in Jewish ultra-orthodox communities in Jerusalem. Epidemiol Infect 2008;136:207-14. 57. Orenstein WA, Strebel PM, PapaniaM, Suttter RW, Bellini WJ, Cochi SL. Measles eradication: is it in our future? Am J Public Health 2000;90:1521-5. 65 66-74 CAPITULO 22 03/05/10 13:48 Página 66 Medicina Preventiva Capítulo 22 EL ACTO VACUNAL J. A. Forcada1 Enfermero. Coordinador de los Grupos de Trabajo en Vacunaciones y en Riesgo Biológico. Consejo de Enfermería de la Comunidad Valenciana. Comunidad Valenciana. España 1 INTRODUCCIÓN Todas las decisiones sanitarias, es decir, las que adoptan los profesionales de la salud, son en realidad procesos de gestión, por lo que las personas que toman esas decisiones tienen entre sus funciones la de gestionar sus recursos. Se puede definir la gestión clínica como la utilización adecuada de los recursos para la mejor atención de los pacientes. Esto supone que los profesionales que toman decisiones clínicas lo hacen en el marco de una autoridad delegada y pactada; además, asumen la responsabilidad de sus propias decisiones (1). La Medicina y la Enfermería basadas en la Evidencia, son un enfoque metodológico orientado a la revisión de la práctica y la evaluación sistemática de ésta de cara a realizar solamente aquellas prácticas de contrastada efectividad (McPherson 1994). En cuanto a la Protocolización, no es más que la sistematización de prácticas realizadas con pacientes similares en circunstancias similares, para de esta manera evitar altas cotas de variabilidad innecesarias. El proceso de atención de enfermería, no es más que un protocolo en el que se definen las respuestas de una persona o grupo a una situación, precisando la responsabilidad y actuación de enfermería para cada una de ellas (1). Podríamos definir el Acto Vacunal como el conjunto de procesos, protocolos y técnicas que se aplican desde el momento en que se recibe a un usuario del sistema sanitario demandante de una actuación en relación con las vacunaciones, hasta el momento en que se ha completado esta actuación. El Acto Vacunal no se ciñe de forma exclusiva al hecho de la administración del preparado vacunal, sino que comprende una serie de procesos diferenciados como son, entre otros, la comprobación del documento vacunal, la anamnesis, la elección y preparación del producto biológico, la asepsia de la piel, la elección de vía y lugar de inyección, la correcta eliminación de residuos, la prevención de exposiciones ocupacionales accidentales, la prevención de eventos adversos, el registro vacunal, etc. Son mayoritariamente los profesionales de enfermería los responsables de la actuación en relación al acto vacunal, y es por ello necesario incrementar la formación e información en este colectivo, con objeto de conseguir la excelencia y mayor calidad en la actuación profesional y la mayor calidad en la atención prestada a los usuarios del sistema sanitario. Para conseguir esta calidad es imprescindible la unificación de criterios y la protocolización de los procesos: trabajar por protocolos. Un protocolo define un plan explícito y detallado de cómo se debe actuar a la hora de llevar a cabo una técnica, un tratamiento o una determinada evaluación en un paciente. Nuestros clientes esperan (2): 66 • Poder obtener un estado de inmunización eficaz • Que se les proporcione un trato personalizado y amable • Que siempre se les informe de los procedimientos y cuidados que se les van a aplicar • Que demostremos nuestra alta competencia y eficacia en la práctica clínica • Que evitemos riesgos en la aplicación de los cuidados y se realicen en óptimas condiciones • Que exista una correcta coordinación entre los profesionales implicados en la atención • Que los equipos materiales se empleen adecuadamente y que funcionen correctamente • Que el profesional tenga una respuesta rápida ante situaciones imprevistas. ALMACENAMIENTO, TRANSPORTE Y CONSERVACIÓN El almacenamiento, el transporte y la conservación son elementos fundamentales para el correcto desarrollo de los programas de vacunaciones. Las vacunas son productos termolábiles que requieren un mantenimiento adecuado en las temperaturas de referencia (+2 - +8 º C). La rotura en cualquier momento de este rango de temperaturas puede producir efectos negativos en las vacunas, principalmente la pérdida de su capacidad antigénica y, en ocasiones, aumento de su capacidad reactogénica, ligada a reacciones adversas locales. Hoy en día, el transporte desde el laboratorio fabricante hasta los puntos de distribución no acarrea problemas, pues se utilizan transportes isotérmicos, tiempos de entrega preestablecidos y controladores de temperatura en todos los envíos. A pesar de ello, en todos los centros receptores desde los laboratorios se controlan estos parámetros según protocolos de control establecidos. El transporte interno entre los centros locales de distribución y los puntos finales de utilización (puntos de vacunación), también está protocolizado a través de instrucciones de las correspondientes Consejerías y Direcciones de Salud Pública. Aun así, y contando con profesionales expertos en estas actividades, hay que extremar precauciones y cumplir estos protocolos, para detectar cualquier posible anomalía que se hubiera producido durante este transporte, y a partir de los datos obtenidos, tomar las decisiones sobre utilidad de las vacunas. Es la conservación en los puntos de vacunación donde radican las mayores dificultades logísticas. Los puntos básicos que debe conocer cualquier sanitario que trabaje en las vacunaciones son: • Los frigoríficos de vacunas sólo son para las vacunas y deben estar en perfecto estado de conservación. Si es posible, se debería contar con un sistema alternativo de suministro eléctrico. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 66-74 CAPITULO 22 03/05/10 13:48 Página 67 Medicina • Debe existir un sistema de alerta en caso de superarse los rangos de temperatura establecidos, un sistema de control permanente de temperatura y éste debe ser comprobado dos veces al día. Los frigoríficos sólo deben ser abiertos en caso necesario. • Las vacunas deben colocarse en los frigoríficos en el orden establecido según protocolos. Las más antiguas siempre deben estar más accesibles para ser utilizadas en primer lugar. Nunca deben ser colocadas en las puertas. • Las vacunas son especialmente sensibles a la congelación, por lo que cualquier descenso de la temperatura por debajo de 0ºC deberá ser especialmente tenido en cuenta. • Las vacunas caducadas o que deban ser desechadas por problemas de conservación, deberán seguir el proceso de eliminación establecido por protocolo en su comunidad autónoma. REGISTROS Comprobar el estado vacunal El primer paso a seguir en el momento de la recepción de un usuario es la comprobación de su estado vacunal, a través de la documentación que aporta. El carnet vacunal es un documento individual en el que los profesionales sanitarios anotan las vacunas administradas, que permite conocer el estado de vacunación del ciudadano. Evita la especulación sobre posibles vacunaciones anteriores y los riesgos de exceso de dosis (3). Las vías de acceso más usuales a la vacunación son: • Por indicación y derivación desde la consulta médica • Por captación a través de la consulta de enfermería • Por seguimiento de un calendario previamente indicado • Por propia iniciativa En el caso de que el usuario acceda por el seguimiento de un calendario previamente indicado habremos conocido con anterioridad su estado vacunal y la actuación se deberá limitar a la constatación de que la fecha es la correcta que se le indicó para seguir con el seguimiento de las dosis a administrar. También en el caso de proceder derivado desde la consulta médica existen altas posibilidades de que su estado vacunal figure en la historia clínica. En caso de que su estado no figure, deberá iniciarse la anotación en la historia. En los otros casos, la posibilidad de que se aporten documentos vacunales es incierta, pues dependerá mucho de la edad del usuario y del motivo del acceso a la vacunación. La carencia de este documento es generalizada, pero cada vez cobra mayor relevancia, pues constituye una verdadera biografía inmunitaria del sujeto (3). El interrogatorio al usuario es poco probable que aporte datos fiables en el caso de vacunación frente a tétanos y difteria, un poco más probable en vacunación frente a HB y bastante más probable en la vacunación antigripal y antineumocócica. La insistencia del profesional sanitario sobre el posible recuerdo de algún evento adverso relacionado con la vacunación puede ayudar a identificar alguna vacuna recibida, así como la asistencia a servicios de urgencias tras haber sufrido algún tipo de accidente. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva Registrar la vacunación Es deber del profesional sanitario que efectúa la vacunación el constatar mediante un documento que se ha producido el hecho, y las características de éste. Actualmente esta constatación se efectúa en muchos lugares de forma informatizada, por lo que queda constancia en la historia clínica y en los registros vacunales comunitarios. Además, se debe anotar en el carnet vacunal de cada usuario, para que pueda ser utilizado fuera del ámbito de influencia de ese registro informatizado. Las ventajas que aportan los registros informatizados es que pueden ser consultados desde cualquier punto del área de influencia de éste al que se haya desplazado el usuario. En las Comunidades Valenciana y Andaluza y en la Región de Murcia se puede acceder al registro vacunal de cualquier persona desde cualquier terminal autorizado a través del Registro Nominal Vacunal. En otras comunidades autónomas se están desarrollando registros de similares características, que garantizan el acceso a la información necesaria. En los lugares en los que no se utilizan todavía sistemas informatizados, sigue siendo necesario la anotación en fichas o en la historia clínica, además de en el carnet del usuario. Es, por tanto, necesario que el usuario aporte su carnet en cada momento asistencial en el que pudiera ser necesaria la comprobación vacunal, pues en la mayoría de las ocasiones su registro en ficha o Hª Cª no estará ubicado en el mismo lugar en el que se efectúa la asistencia. Los ítems que debe contemplar el registro son los siguientes (4): • Identificación personal: apellidos y nombre, fecha de nacimiento, sexo, DNI o pasaporte, datos postales (domicilio, localidad, provincia, código postal, teléfonos), fuente de entrada en el registro y motivo de exclusión del registro. • Identificación sanitaria: código de identificación personal en el sistema sanitario, número de tarjeta sanitaria, médico de adscripción, centro sanitario de atención primaria de adscripción. • Identificación de las vacunas: vacuna administrada, fecha de administración, fabricante, lote, persona que introduce la dosis, indicación de la vacuna, reacciones adversas. • Explotación de datos (en registros informatizados): cartas de presentación del Programa de vacunaciones; recordatorios para los mal vacunados; listados de mal vacunados; cálculos de coberturas; controles de distribución y existencia de vacunas en almacén. Otros datos a tener en cuenta en el registro deben ser las vacunaciones en situaciones especiales, las contraindicaciones permanentes a una vacuna (antígeno o componente vacunal) y la situación o patología que motiva esta contraindicación. Asimismo, debe existir constancia en el documento de todas las reacciones adversas acaecidas, con los datos de fecha, tipos de vacunas, descripción de la reacción y determinación de si constituye una contraindicación excluyente o el tipo de precauciones a adoptar en dosis siguientes (5). Así pues, el mantener registrados todos los actos vacunales y aportar estos datos a un registro centralizado aporta siempre beneficios (4): • Para las familias • Para la comunidad • Para el sistema sanitario asistencial • Para la Salud Pública 67 66-74 CAPITULO 22 11/05/10 17:18 Página 68 Medicina Preventiva ANAMNESIS El segundo paso en la protocolización del acto vacunal debe ser la realización de una anamnesis sobre algunas situaciones que puedan identificar alguna contraindicación referida a la vacunación, tanto de carácter general como específica. • Las cuestiones mínimas a investigar sobre el usuario a vacunar serían (6): – ¿Padece alguna enfermedad aguda febril? – ¿Es alérgico a medicamentos, alimentos o a alguna vacuna? – ¿Ha tenido alguna reacción importante a alguna vacuna? – ¿Ha sufrido convulsiones tras alguna dosis de vacuna? – ¿Tiene cáncer, leucemia, infección por VIH u otro problema del sistema inmunitario? – ¿Ha tomado corticoides, o recibido quimioterapia o radioterapia en los últimos tres meses? – ¿Ha recibido una transfusión sanguínea o de productos hemáticos o ha recibido inmunoglobulinas durante el último año? – ¿Ha recibido alguna vacuna durante las cuatro últimas semanas? – En mujeres en edad fértil, ¿está embarazada o existe la posibilidad de embarazo en las próximas cuatro semanas? Algunas de estas cuestiones pueden haber sido anotadas en el carnet vacunal del usuario, pero aun así es conveniente realizar la anamnesis completa, pues se pueden dar circunstancias no anotadas. Es necesario disponer de estos cuestionarios de forma impresa, y en francés e inglés como mínimo, pues ante el aumento de inmigrantes y su acceso a los sistemas sanitarios, estas dos lenguas nos acercan a una gran mayoría de ellos. Teniendo en cuenta las zonas de origen de los inmigrantes de nuestra zona geográfica, será en ocasiones necesario disponer de estos cuestionarios en otros idiomas (rumano, chino, árabe, alemán, ruso, etc.). • Las contraindicaciones permanentes que se deben descartar en este proceso son: – Alergia severa (anafilaxia) a una dosis previa o a un componente de la vacuna – Encefalopatía posterior a la administración de vacuna antipertúsica • Las contraindicaciones temporales serán: – Embarazo (valorar riesgo) – Enfermedad aguda o grave – Alteraciones inmunitarias (vacunas vivas atenuadas) – Administración de inmunoglobulinas y sangre o derivados Otro parámetro a tener en cuenta es la aplicación de vacunas fuera del rango de edad contemplado en la Ficha Técnica. Esta contempla la autorización de la administración en base a los estudios presentados por las empresas fabricantes, por lo que su utilización fuera de estos rangos de edad puede acarrear, además de las posibles complicaciones propias del preparado vacunal, algún problema de carácter legal en el caso de que apareciera alguna de estas posibles reacciones adversas. SELECCIÓN DEL PRODUCTO BIOLÓGICO Quizás pueda parecer obvio, pero es muy importante la selección correcta de la vacuna a administrar, pues frecuentemente se producen errores en la elección del producto. Antigripal: dependerá de la edad del usuario a vacunar la elección de la vacuna antigripal a utilizar, pues disponemos de vacunas de virus enteros, virus fraccionados, subunidades, adyuvadas (MF59.C1) y virosomas. Es necesario, en el caso de cada vacuna, la comprobación de su ficha técnica para conocer las indicaciones de autorización según edades. Como norma general debemos seguir el siguiente esquema (7) (Tabla I). (a) La fraccionada incluye la vacuna fraccionada, la de subunidades y la virosomal (b) Se recomiendan dos dosis cuando la reciben por primera vez. La vía de administración es intramuscular La vacunación antigripal frente al virus pandémico AH1N1 en nuestro país se efectúa con dos vacunas adyuvadas: Focetria® (Novartis), antígenos de superfície, adyuvante MF59C.1 Pandermix® (GSK), vírus fraccionados, adyuvante AS03 Una tercera vacuna autorizada en estos momentos pero de la que no se dispondrá en España, denominada Celvapan (Baxter), contiene virus enteros inactivados desarrollados en células Vero. (No contiene adyuvante). Focetria® Dos dosis de 0’5 ml. a partir de los 6 meses de edad. A partir de los 18 años, una sola dosis de 0’5 ml. El intervalo entre dos dosis deberá ser de 3 semanas. Administración intramuscular. Puede administrarse concomitantemente con una vacuna antigripal estacional no adyuvada. En caso de haber recibido una dosis de vacuna antigripal estacional adyuvada, deberá retrasarse 3 semanas, lo mismo que con otras vacunas. No hay estudios de utilización en embarazadas. Pandemrix® De 6 meses a 9 años, dos dosis de 0’25 ml. Una sola dosis de 0’5 ml hasta los 60 años de edad. A partir de esa edad, dos dosis de 0’5 ml. El intervalo entre dos dosis deberá ser de 3 semanas. Administración intramuscular. No existen datos de Tabla I. Pautas de administración de la vacuna antigripal 68 Edad Tipo de vacuna (a) Cantidad Nº de dosis Intervalo (semanas) 6-35 meses Fraccionada 0,25 1 o 2 (b) 4 3-8 años Fraccionada 0,50 1 o 2 (b) 4 9-12 años Fraccionada 0,50 1 - > 12 años Entera o fraccionada 0,50 1 - Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 66-74 CAPITULO 22 03/05/10 13:48 Página 69 Medicina co-administración con vacunas antigripales estacionales. Con otras vacunas deberá respetarse el intervalo de 3 semanas. No hay estudios de utilización en embarazadas. Para la inmunización de mujeres embarazadas, se está a la espera de la autorización de una vacuna denominada Panenza® (Sanofi Pasteur MSD), vacuna inactivada que no contiene adyuvante. Antihepatitis A y B: dado que disponemos de distintas presentaciones (Antihepatitis A, Antihepatitis B o Antihepatitis A+B) y, dentro de éstas, presentación infantil y de adultos, deberá verificarse convenientemente cuál es la indicación de vacunación y qué vacuna utilizaremos, dependiendo de la administración a un adulto o a un adolescente. Antitetánica, antidiftérica y antipertúsica: en cuanto a esta vacuna, la disponibilidad de la combinación tétanos-difteria (Td) y la combinación tétanos-difteria-pertusis-adyuvada (Tdpa) deben ser tenidas en cuenta, pues la vacuna Tdpa tan sólo se deberá utilizar como dosis de recuerdo en la revacunación cada 10 años de Td. En estos momentos no se recomienda utilizarla en la primovacunación (8). Antineumocócica: esta vacuna no presenta problemas a la hora de su posible selección, pues la vacuna antineumocócica de polisacáridos 23-valente está indicada a partir de los 2 años de edad hasta la edad adulta, por lo que en vacunación de adultos y adolescentes no existe posibilidad de equivocación. Antimeningocócica C: la podemos encontrar en tres presentaciones; C, A+C y A+C+W135+Y, dependiendo de los serotipos frente a los que protegen. Anti Haemophilus influenzae tipo B: Se puede encontrar en diversas combinaciones vacunales, pero en vacunación de adultos, la encontraremos monovalente. Antivaricela: tan sólo en presentaciones monovalentes. En un futuro, se espera la combinación con Triple Vírica. La vacuna Varilrix® (GSK) está indicada para la inmunización con dos dosis a partir de los 13 años de edad, con un intervalo de 8 semanas (6 semanas mínimo). La vacuna Varivax® (Sanofi Pasteur MSD) está indicada con dos dosis a partir de los 13 años de edad, con un intervalo de 4-8 semanas. No existen datos de la eficacia protectora, ni de la respuesta inmune en personas seronegativas mayores de 65 años. Triple Vírica (antisarampión, antirubéola y antiparotiditis): en estos momentos se dispone de esta combinación vacunal triple sin posibilidad de combinación con otros antígenos, por lo que no puede existir problema en su selección. En un futuro, se espera la combinación con Varicela. También, en la elección del producto deberemos tener en cuenta la observación de la conservación correcta de producto antes de su administración. En este punto hay que hacer mención a la gestión de la cadena del frío. La persona responsable de la gestión vacunal de cada centro sanitario deberá realizar una comprobación diaria de los rangos de temperatura máxima y mínima de la nevera o cámara donde se conservan las vacunas. Estos rangos deberán estar siempre comprendidos entre +2º y +8º C. Cualquier alteración de estos rangos deberá ser puesta en conocimiento de las personas responsables de los programas de vacunaciones del Área de Salud y aplicar los protocolos establecidos a tal efecto. Es necesario que el personal implicado en el almacenamiento, transporte y administración de las vacunas conozca las características específicas de cada vacuna (3). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva Se deberá comprobar que el preparado líquido no presente turbulencias o cuerpos extraños y que la fecha de caducidad no haya superado el límite establecido. En las vacunas absorbidas se debe observar siempre su aspecto externo y es útil realizar el test de agitación para ver si hay floculación (presencia de partículas granulosas o flóculos), que en caso de positividad nos indicaría que la vacuna ha superado el límite de la congelación. ASEPSIA DE LA PIEL La asepsia de la piel es un elemento fundamental en la prevención de la infección de carácter nosocomial. En primer lugar debemos tener en cuenta que la zona de piel a aplicar la inyección debe ser una zona en la que no existan heridas ni efracciones, ni ningún tipo de alteración cutánea. La piel deberá estar limpia de suciedad y materia orgánica. En caso de que presente suciedad, deberá procederse al lavado de la zona con agua y jabón. Tras el lavado, se deberá secar totalmente. Tradicionalmente se ha venido utilizando el alcohol de 70º de forma rutinaria en la asepsia de la piel para inyecciones. En el caso de las vacunas, la posible interferencia del alcohol cuando no ha secado de forma total con las vacunas vivas atenuadas ha hecho que se deban buscar alternativas, ya que la utilización de otro desinfectante de forma exclusiva para estas vacunas ha hecho que se produjeran numerosos errores en la administración. Si bien la recomendación general para la asepsia de la piel en la administración de inyectables señala la solución alcohólica de clorhexidina al 0,5%, nos encontramos con la problemática señalada anteriormente (9). La povidona iodada sería el antiséptico sustitutivo. El problema es la coloración del compuesto iodado, que no nos permitirá observar las posibles complicaciones locales (10). Actualmente disponemos de preparados de clorhexidina acuosa que unen su gran capacidad antiséptica a la desaparición de los problemas mencionados anteriormente. Aun así, podemos optar por los sustitutivos más sencillos y que eliminan igualmente estos problemas, como será la utilización de agua oxigenada o, sencillamente, la limpieza de la piel con agua estéril (6). La técnica para proceder a la desinfección de la piel es la siguiente: aplicar el antiséptico sobre una torunda de algodón, colocarla en el centro de la zona elegida y con un movimiento en espiral hacia fuera barrer los gérmenes hacia el exterior de esa zona de la piel unos 5 cm. Si el movimiento es de arriba hacia abajo o de derecha a izquierda, no se consigue este barrido. Tras la inyección de la vacuna se deberá proceder nuevamente a realizar esta desinfección con una torunda nueva impregnada en el antiséptico. El profesional sanitario debe lavarse las manos antes y después de administrar cada vacuna (o utilizar soluciones alcohólicas como sustitutivo cuando no exista materia orgánica o suciedad). En caso de presentar lesiones en la piel de las manos, deberá utilizar siempre guantes, procediendo a su cambio en cada acto vacunal. Existen recomendaciones a favor y en contra de la utilización rutinaria de guantes. La posibilidad de sufrir una exposición accidental tras la vacunación no es desdeñable, por 69 66-74 CAPITULO 22 03/05/10 13:48 Página 70 Medicina Preventiva lo que la introducción en los protocolos de la utilización rutinaria de guantes debería tenerse en cuenta. Lo realmente importante es la correcta utilización de los guantes; utilizarlos en los casos necesarios en los que exista un riesgo de exposición y no utilizarlos cuando, además de ser innecesarios, supongan una fuente de diseminación de microorganismos y un riesgo de transmisión de infecciones nosocomiales. ELECCIÓN DE VÍA Y PUNTO DE INYECCIÓN Vías y puntos de inyección Las vacunas deben administrase por la vía recomendada por el fabricante, pues utilizar una vía distinta podría reducir su eficacia e incrementar las reacciones adversas. Las vías de administración de vacunas son: oral y parenteral (intramuscular, subcutánea e intradérmica). La vía de administración oral se utiliza en vacuna polio oral (VPO), fiebre tifoidea Ty21a y cólera (CDV 103-HgRliofilizado). Deben administrase inmediatamente después de extraerlas del frigorífico. La vía de administración intramuscular (IM) se utiliza en las siguientes vacunas: hepatitis A, hepatitis B, hepatitis A+B, T, Td, Tdpa, gripe, Hib, neumococo, rabia (VCDH, VRA), fiebre tifoidea-AgVi, encefalitis centroeuropea y encefalitis japonesa. Estas vacunas deben dejarse atemperar durante 5-10 minutos antes de su administración. Las zonas de administración de medicamentos de forma intramuscular en el adulto son: dorsoglútea, deltoidea, ventroglútea y cara externa del muslo. La zona de elección para vacunas intramusculares en adultos y adolescentes es la zona deltoidea. La administración intramuscular supone la adición del preparado en la masa muscular profunda, a través de la piel y del tejido celular subcutáneo. La inyección en masa muscular profunda pretende conseguir una rápida absorción del preparado. El punto correcto de inyección está situado en el espacio delimitado por el triángulo de base en el borde inferior del acromion y el vértice, debajo del lugar de inserción del músculo deltoides. El ángulo de inserción de la aguja debe ser de 90% (perpendicular a la piel) y ésta se debe efectuar con un movimiento firme y seguro en un solo acto (como un dardo). El sistema de inserción se recomienda cerrado (aguja y jeringa conectadas). Se debe aspirar para descartar la vía venosa. En caso afirmativo, se debe extraer el agua e inyectar en otro lugar. La inyección se debe efectuar de forma lenta y uniforme. Tras finalizar la inyección, esperaremos unos diez segundos antes de retirar la aguja, con suavidad y rapidez, procediendo a continuación a una nueva desinfección del punto de inyección. La utilización de la zona dorsoglútea supone el riesgo de lesión del nervio ciático y el riesgo de estar inyectando en tejido celular subcutáneo, con el consiguiente déficit de absorción del preparado vacunal y el aumento de la reactogenicidad de la vacuna, así como la disminución de su inmunogenicidad. La inyección de una vacuna en la grasa subcutánea, en la que la mala vascularización puede comportar una mala movilización y procesamiento del antígeno, produce fracasos en la vacunación, como ocurre con la HB, rabia y gripe (11). 70 Las inyecciones clásicas en la zona dorsoglútea con la aguja más usual (38 mm) se estudiaron mediante TAC en 213 personas adultas. Menos del 5% de las mujeres y del 15% de los varones recibieron la inyección IM dentro del músculo glúteo. En la mayoría de las ocasiones la inyección se deposita en el tejido graso (12). La vía IM debe ser evitada en hemofílicos y personas con otros trastornos sanguíneos. Si no puede evitarse, se deberá utilizar una aguja fina y mantener la presión sobre el punto de inyección sin frotar durante 2 minutos. La vía de administración subcutánea se utiliza en las vacunas: triple vírica (sarampión, rubéola y parotiditis), polio inactivada (VPI), meningococo, varicela, neumococo, fiebre amarilla, Fiebre tifoidea-AgVi. Estas vacunas también deberán atemperarse durante 5-10 minutos antes de su administración. Las zonas de administración de medicamentos de forma subcutánea en adultos son: 1/3 medio de la cara externa del muslo, 1/3 medio y superior de la cara externa del brazo, cara anterior del abdomen y zona superior de la espalda. La zona de elección para vacunas subcutáneas en adultos y adolescentes es el 1/3 medio y superior de la cara externa del brazo. La administración subcutánea supone la adición del preparado en el tejido celular subcutáneo, a través de la piel y sin que llegue a la masa muscular. La inyección en tejido celular subcutáneo pretende conseguir una lenta absorción del preparado. El ángulo de inserción de la aguja debe ser de 45% y ésta se debe efectuar con un movimiento firme y seguro en un solo acto. El sistema de inserción se recomienda cerrado (aguja y jeringa conectadas). Se debe aspirar para descartar la vía venosa. En caso afirmativo, se debe extraer el agua e inyectar en otro lugar. La inyección se debe efectuar de forma lenta y uniforme. Tras finalizar la inyección, esperaremos unos diez segundos antes de retirar la aguja, con suavidad y rapidez, procediendo igualmente a la desinfección del punto de inyección. La administración de las vacunas indicadas de administración subcutánea en tejido muscular probablemente no alterará la respuesta, por lo que si esto ocurre no se deberá proceder a su repetición (13). La vía de administración intradérmica se utiliza en las vacunas BCG y rabia (VCDH). Deben atemperarse 5-10 minutos antes de su administración. Está próxima a su comercialización una vacuna intradérmica antigripal. La zona de elección para vacunas intradérmicas en adultos y adolescentes es el 1/3 medio de la cara externa del brazo. La administración subcutánea supone la adición del preparado en la dermis. La inyección en la dermis pretende conseguir una lenta y local absorción del preparado. El ángulo de inserción de la aguja debe ser de 15%. La inyección debe ser muy lenta y debe aparecer una pápula que desaparecerá en 10-30 minutos. Agujas y jeringas Para cada vía de administración parenteral se vienen utilizando unas longitudes y calibres estandarizados de forma rutinaria (Tabla II). Para asegurar que la aguja alcance al músculo y que la vacuna no se dispersará en el tejido celular subcutáneo, la decisión sobre el tamaño de la aguja y la zona de inyección deberá tomarse individualmente, según la edad de la persona, el volumen de material a administrar y el tamaño del músculo (11). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 66-74 CAPITULO 22 03/05/10 13:48 Página 71 Medicina Preventiva Tabla II. Vías y agujas a utilizar Vía Longitud Calibre Bisel Color del cono Intradérmica 9’5-16 mm 25-26 G (0,5 mm) Corto Naranja Subcutánea 16-22 mm 24-27 G (0,6 mm) Medio Naranja Intramuscular 25 -75 mm 19-23 G (0,8 mm) Medio Verde / azul Intravenosa 25- 75 mm 16-21 G (0,9 mm) Largo Amarillo Aguja de carga 40 -75 mm 14-16 G (1 mm) Medio Rosa Se ha demostrado que existe una amplia variación en el espesor del panículo adiposo situado por encima del músculo deltoides y que las mujeres tienen significativamente más tejido subcutáneo que los varones. Estudios de ultrasonidos del brazo indican que el rango de distancia de la piel al músculo varía entre 4-18 mm en varones, entre 5-21 mm en mujeres de índice de masa corporal (IMC) normal y entre 18-34 mm en mujeres obesas. Una aguja estándar de 16 mm no hubiese alcanzado una penetración muscular suficiente (5 mm) en el 17% de los varones y en casi el 50% de las mujeres, en la población estudiada. En los varones de 59-118 Kg y en las mujeres de 60-90 Kg puede ser más seguro utilizar una aguja de 25 mm. Una mujer de 90 Kg necesitaría una aguja de 38 mm (11, 14). Cuando se requiera la administración intramuscular de una vacuna para asegurar una inmunogenicidad óptima y reducir al mínimo las reacciones locales, debería disponerse de una selección de agujas no fijas para permitir a los profesionales sanitarios seleccionar una aguja de longitud y calibre apropiados a cada paciente (11). ELIMINACIÓN DE RESIDUOS La eliminación de residuos constituye una de los puntos importantes de la gestión del riesgo biológico en los centros sanitarios. En el caso que nos ocupa, la administración de vacunas, hay que mencionar que según la Ley 10/1998 de Residuos (15), se entiende por residuo cualquier sustancia u objeto perteneciente a alguna de las categorías que figuran en el anexo de la Ley, del cual su poseedor se desprenda o del que tenga la intención u obligación de desprenderse, y como residuos peligrosos aquellos que figuren en la lista de residuos peligrosos, aprobada por el Real Decreto 952/1997, así como los recipientes y envases que los hayan contenido. Los productos farmacéuticos, medicamentos y productos veterinarios figuran incluidos en la Tabla nº 3 del mencionado R.D. 952/1997, como residuos tóxicos y peligrosos (16). Las vacunas vivas atenuadas son clasificadas dentro del Grupo III, residuos sanitarios específicos, y por sus características y grado de contaminación biológica requieren un tratamiento específico y diferenciado de los residuos municipales, tanto dentro como fuera del centro sanitario. Dentro de este apartado hay que tener en cuenta que se incluyen los viales con restos de vacuna y las vacunas que se deben desechar sin haber sido utilizadas. Los materiales de un solo uso manchados con restos tendrán otro tratamiento diferenciado. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 El resto de vacunas, calificadas por la Ley del Medicamento como productos biológicos, están sujetas al régimen de especialidades farmacéuticas y como medicamentos, recibirán el tratamiento diferenciado como Grupo IV, establecido como específico no incluido en el Grupo III. Nunca deberán ser desechadas como residuo asimilable a urbano, sino que deberán seguir el proceso de gestión de residuos establecido en cada Comunidad Autónoma. Estos materiales (Grupo III) se recogen en bolsa de polietileno color identificativo rojo que cumpla la norma UNE 53-147-85, con galga mínima de 400, tipo 1 y 2 y/o en contenedores con cuerpo y tapa, construidos con materiales que garanticen su total eliminación, rígidos e impermeables, resistentes a agentes químicos y a materiales perforantes y que dispongan de un cierre hermético provisional que garantice estanqueidad hasta su llenado y de un cierre hermético definitivo, con una indicación con símbolo internacional de “Biocontaminante” sobre fondo amarillo (Norma DIN-V-30-739) (17). PREVENCIÓN DE EVENTOS Y REACCIONES ADVERSAS Un evento adverso consiste en un efecto no deseable causado por una vacuna, no relacionado con la producción de inmunidad, que aparece después de su administración y produce morbilidad e incluso la muerte (18). También se define como cualquier incidente clínico asociado temporalmente con una vacunación. La relación temporal entre la vacunación y el evento adverso no implica necesariamente una relación causal (5). El evento adverso inesperado es el que no se menciona en la ficha técnica del producto. Los eventos adversos pueden ser locales y sistémicos y deberse a múltiples causas: • Inducidos por la vacuna; asociado a las características de la vacuna y a la repuesta inmunológica del individuo • Potenciados por la vacuna; precipitado por la vacuna pero que podía haber ocurrido sin ella • Relacionados con la administración de la vacuna; por errores en la gestión o administración vacunal • Coincidente; ocurre posteriormente sin evidencias causales • Por causas desconocidas Si el proceso de gestión vacunal es el correcto, el riesgo teórico de que se produzca un evento adverso es prácticamente nulo (19). Los eventos adversos locales son los más frecuentes y menos severos. Los eventos sistémicos son variados e incluyen fiebre, dolor muscular o articular, cefaleas, anorexia, convulsiones u otros síntomas relacionados con el SNC. 71 66-74 CAPITULO 22 11/05/10 17:20 Página 72 Medicina Preventiva Los eventos alérgicos son infrecuentes y el más temido es la anafilaxia. Se presentan en menos de un caso cada medio millón de dosis. Su presentación puede reducirse y minimizarse con una anamnesis correcta en busca de antecedentes alérgicos a algún componente de la vacuna o a dosis previas. Es muy importante que los eventos adversos se detecten con precocidad y se notifiquen. El Programa Oficial de Fármacovigilancia (SEFV), tiene como objetivo recoger, evaluar y registrar las sospechas de reacciones adversas a medicamentos notificadas por el profesional sanitario y trata de identificar de forma precoz posibles riesgos asociados con el uso de medicamentos. El Sistema Español de Farmacovigilancia se basa en la implantación de la notificación voluntaria o espontánea de reacciones adversas (RA) mediante la Tarjeta Amarilla. Debe ser cumplimentada por el profesional sanitario que sospecha una RA (18). La persona que ha recibido una vacuna debe permanecer en observación durante 30 minutos para detectar “in situ” estos eventos adversos y, en caso de gravedad, poder actuar inmediatamente. Es muy importante esta observación, pues las reacciones alérgicas, especialmente la anafilaxia, son las que se presentan más precozmente, y el tratamiento tardío o inadecuado puede finalizar con el fallecimiento de la persona afectada. Todos los puntos de vacunación deberán disponer del material adecuado para el tratamiento de una reacción anafiláctica y el personal sanitario debe estar adiestrado en la actuación y tratamiento de esta reacción. Anafilaxia Podemos encontrar varias instauraciones: • Formas sistémicas leves: prurito, sensación de calor, hormigueo, congestión y picor nasal, estornudos, lagrimeo y plenitud orofaríngea • Formas moderadas: relacionadas con edema de vías respiratorias superiores y broncoespasmo, apareciendo dificultad respiratoria • Formas sistémicas graves: edema laríngeo grave, broncoespasmo intenso, arritmias y colapso vascular, hipotensión, etc. Se debe establecer el diagnóstico diferencial con la reacción vasovagal / lipotimia, en la que suele producirse bradicardia e hipotensión transitoria. La crisis de broncoespasmo / asma puede confundir las manifestaciones anafilácticas. El material necesario mínimo del que se debe disponer son: fonendoscopio, esfigmomanómetro, jeringas y agujas, plano duro para reanimación cardiopulmonar (RCP), adrenalina acuosa 1/1.000, bicarbonato sódico IM y atropina. Es recomendable disponer también de: equipo de oxigenoterapia, cánula de Guedel, resucitador, aspirador de secreciones, material de intubación, equipos de infusión, antihistamínicos y corticoesteroides. Actuación ante una reacción anafiláctica: • Colocar al paciente en posición de Trendelemburg. • Mantener libres las vías respiratorias (aplicar oxígeno si se dispone). • Administrar vía IM o SC adrenalina 1/1.000 (0’01 cc./Kg. sin superar 0’3 cc. en niños y 0’5 cc. en adultos) en la zona contralateral donde se aplicó la vacuna. Repetir cada 5-10 minutos si es necesario. 72 • Administrar antihistamínicos IM (clorfeniramina 10-20 mg). • En reacciones graves o recurrentes o en pacientes con asma, administrar hidrocortisona 100-500 mg IM o intravenosa IV lento. • En caso de shock o hipotensión, administrar líquidos IV. • Puede ser útil la aplicación de un torniquete proximal para limitar la absorción del antígeno, liberándolo 1 minuto cada 3-5 para no comprometer la circulación arterial. • En caso de parada cardiorrespiratoria, realizar RCP. PREVENCIÓN DEL RIESGO BIOLÓGICO Otro de los aspectos fundamentales en la buena praxis profesional y en la atención de calidad a los usuarios de sistemas sanitarios es la prevención de la infección nosocomial. Podemos encontrar dos partes diferenciadas: a) posibilidad de que nuestra actuación sea un foco de infección de la persona que atendemos, y b) la posibilidad de resultar infectados a partir de la fuentepaciente. Respecto a la primera, ya hemos mencionado en el apartado de la asepsia de la piel de todas aquellas medidas imprescindibles para prevenir esta posibilidad. En la segunda, nos debemos referir a los datos que aporta el Estudio y Seguimiento del Riesgo Biológico en el Personal Sanitario – Proyecto EPINETAC 1996-2002, de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (20). Las infecciones de transmisión sérica son el riesgo laboral más importante y peligroso para los trabajadores de la salud. Son las inoculaciones accidentales las que generan mayor angustia y percepción de riesgo en el colectivo. El principal riesgo asociado a este tipo de accidentes es la probabilidad de transmisión sérica de tres microorganismos: virus de Hepatitis B (VHB), virus de la Hepatitis C (VHC) y virus de la Inmunodeficiencia Humana (VIH). El colectivo profesional con mayor tasa de Exposiciones Ocupacionales Accidentales (EOA) percutáneas ha sido el de enfermería (7’41 exposiciones por 100 matronas + 7’1 exposiciones por 100 enfermeras). El personal de enfermería declara el 46’3% de las exposiciones. Los pinchazos son el tipo de exposición percutánea más frecuente (86’1%). La mayoría de las exposiciones se localizan en las manos (93’55%). Las agujas huecas son el material más frecuentemente implicado (68’7%). Las agujas de jeringas desechables representan el 37’4% de los objetos causantes de inoculación. Más del 62% de las exposiciones se producen tras la utilización de las agujas, por un desechado inmediato inadecuado. Así, estas exposiciones serían fácilmente prevenibles. Por otro lado, en el 33’1% de las exposiciones, el trabajador sanitario no utilizaba guantes. La actuación post-exposición dista de ser la correcta, pues en tan sólo el 41’4% de los casos se actuó correctamente (lavado, sangrado, antisepsia). El 2’3% no realizó ninguna acción. Además, siguen sin declararse un gran número de exposiciones, tanto de bajo como de alto riesgo, lo que nos viene a señalar que la percepción del riesgo por parte de los profesionales sanitarios dista de ser la adecuada. Así pues, se debe continuar incidiendo en los aspectos fundamentales: • Utilización de precauciones de barrera (lavado de manos, guantes, etc..) Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 66-74 CAPITULO 22 11/05/10 17:21 Página 73 Medicina • Correcto desechado de materiales punzo-cortantes • En caso de exposición, correcta actuación según protocolos • Sensibilización y mejora de la notificación de exposiciones Los punzantes se introducirán sin ninguna manipulación y se prestará especial atención a no volver a encapuchar las agujas, e introducirlas cuidadosamente en recipientes de un solo uso especiales y cuya tapa esté dotada de un mecanismo adecuado de desactivación de los dispositivos dotados con elementos cortantes o punzantes insertados en forma de lanza o roscada (17). Cada vez más está extendiéndose la política del desechado completo del conjunto jeringa-aguja, pues el profesional tiende a separar la aguja de la jeringa con la mano para su segregación. De esta manera se evitaría este riesgo. Los contenedores de material punzo-cortante deben situarse siempre en un lugar de fácil acceso inmediato, para facilitar al profesional su desechado automático. Los contenedores deben llenarse hasta 2/3 de su capacidad y nunca se deben efectuar maniobras para aumentar su capacidad. Hoy se dispone de contenedores de pequeño tamaño, adecuados para poderse trasladar fácilmente hasta el lugar donde se efectúe la inyección (domicilios, habitaciones, etc.). Hay que recordar la sentencia del Tribunal Superior de Justicia de Madrid, de 25 de mayo de 1995, que condena al INSALUD a indemnizar a una trabajadora (enfermera) por el contagio del VIH como consecuencia de una EOA y en la que la trabajadora no disponía de un contenedor en la habitación de una paciente (21). Otra cuestión a tratar es la responsabilidad del empresario como consecuencia de los accidentes biológicos que sufran los trabajadores (22). La Ley establece una serie de obligaciones de tipo organizativo y material, encaminadas a garantizar el derecho de los trabajadores a la protección de su salud e integridad. En su artículo 17, punto 2, la Ley insta al empresario a proporcionar a los trabajadores equipos de protección individual adecuados para el desempeño de sus funciones y velar para el uso efectivo de los mismos cuando, por la naturaleza de los trabajos realizados, sean necesarios. También en el artículo 29, punto 2, insta a los trabajadores a utilizar correctamente los medios y equipos de protección facilitados por el empresario, de acuerdo con las instrucciones recibidas de éste. Resumiendo estos apartados, podemos fijar que el empresario debe poner a disposición de los trabajadores los medios, formarlos en su utilización y el trabajador utilizarlos de forma correcta. La tecnología sanitaria ha avanzado en los últimos años hasta el punto de disponer en el mercado en la actualidad de materiales con dispositivos de seguridad biológica que minimizan de forma efectiva el riesgo de exposición. Así, se dispone de agujas con protección definitiva activable tras su uso y de jeringas con aguja retraíble de forma automática tras su uso. ALGUNOS ASPECTOS FORMATIVOS, LEGALES Y ÉTICOS RELACIONADOS CON LAS VACUNACIONES La formación y actualización de conocimientos de todos los profesionales sanitarios implicados en el proceso vacunal es básica y primordial para la consecución de los objetivos planteados. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva Los profesionales de enfermería son el grupo más numeroso y que mayor tiempo pasa con el paciente/cliente. Los pediatras y las enfermeras son los profesionales que más información transmiten a sus clientes, por lo que su formación en vacunología debe ser la más adecuada y actualizada. Además, esta formación y tiempo empleado en la atención de los clientes, redundará en una mayor calidad en la atención y en un descenso significativo de los problemas relacionados con errores sanitarios y seguridad del paciente. Needleman y colaboradores de la Harvard University han publicado en N Engl J Med (2002) un artículo sobre la calidad del cuidado en 799 hospitales de 11 Estados. Los autores analizaron más de cinco millones de pacientes procedentes de medicina interna y más de un millón de cirugía en relación con indicadores de calidad asistencial (infecciones nosocomiales, prolongación de la estancia hospitalaria, complicaciones, sangrados, paro cardiaco, trombosis venosas...) (23). El artículo concluye que el mejor cuidado hospitalario y por lo tanto el menor grado de error estaba asociado a mayor formación por parte del personal de Enfermería y al mayor número de horas de dedicación de la enfermera en el cuidado del paciente. Es necesario adoptar medidas y buscar soluciones por parte de la administración sanitaria para que la información actualizada y basada en la evidencia científica llegue de forma directa a los profesionales. Las burocracias administrativas juegan en contra de esta actualización en conocimientos. Son varias las experiencias que últimamente contribuyen a refrendar esta afirmación. El caso de las niñas afectadas en la Comunidad Valenciana por convulsiones tras la administración de la segunda dosis de vacuna frente a papilomavirus, y que tantos artículos y comentarios suscitó en los medios de comunicación, no fue debidamente explicado (por falta de agilidad y comunicación directa) por las autoridades sanitarias a sus profesionales, contribuyendo a que la información que demandaban los padres de las niñas ya vacunadas y las que estaban pendientes de vacunar a los sanitarios de confianza (su pediatra y su enfermera de pediatría), no fuera ágil y, en muchas ocasiones, distorsionada. El segundo caso en el que nos podemos fijar es en la vacunación frente a la gripe pandémica, que comenzó el día 16 de noviembre en toda España. Diferentes encuestas realizadas entre sus colegiados por parte del Consejo General de Enfermería de España (www.enfermundi.com) y por el Consejo de Enfermería de la Comunidad Valenciana (CECOVA, www.portalcecova.es), muestran que en el primer caso, y a dos días del comienzo de la vacunación, tan sólo un 10% de los enfermeros que han participado en la encuesta muestran su interés en ser inmunizados. En el segundo, es un 17%, tras varias actividades formativas e informativas desarrolladas desde este Consejo Autonómico de Enfermería (presenciales y a través de la web). Tras la campaña de vacunación se podrán valorar los resultados, pero la expectativa no resulta alentadora. ¿A qué es debido esto? Además de ser un colectivo poco proclive a la vacunación propia (sí que se vacuna a los hijos sin ningún tipo de restricción), la información circulante a través de medios de comunicación y modernas redes sociales (Internet), han tenido más influencia que las oficiales y científicas. Sería muy interesante poder estudiar esta situación de cara al futuro, pues estamos ante una demostración de que, o bien los sanitarios no 73 66-74 CAPITULO 22 03/05/10 13:48 Página 74 Medicina Preventiva han recibido la información científica directa desde sus administraciones sanitarias y sociedades científicas, o bien no han creído en ella. Por otro lado, el código deontológico (24) de la enfermería española es claro en el aspecto de la formación de sus colegiados: • Será responsabilidad de la enfermera/o actualizar constantemente sus conocimientos personales, con el fin de evitar actuaciones que puedan ocasionar la pérdida de salud o de vida de las personas que atiende. • La enfermera/o será consciente de la necesidad de una permanente puesta al día mediante la educación continuada y el desarrollo del conjunto de conocimientos sobre los cuales se basa su ejercicio profesional. • La enfermera/o deberá valorar sus propias necesidades de aprendizaje, buscando los recursos apropiados y siendo capaz de autodirigir su propia formación. • La enfermera/o asume la responsabilidad de todas las decisiones que a nivel individual debe tomar en el ejercicio de su profesión. • La enfermera/o debe ejercer su profesión con responsabilidad y eficacia. • La enfermera/o no solamente estará preparada para practicar, sino que deberá poseer los conocimientos y habilidades científicas que la lex artis exige en cada momento a la enfermera competente. La lex artis es el conjunto de reglas y criterios que deben regir la actividad de un buen profesional, en nuestro caso, de un buen enfermero. ¿Dónde se encuentran esas reglas? • Normas jurídicas • Normas recogidas en textos de carácter no normativo (protocolos, códigos deontológicos…) • Normas no escritas. El estado actual de los conocimientos Así pues, se debe exigir esa puesta al día de conocimientos, y no necesariamente por parte del empleador, sino por iniciativa de cada profesional. La Ley de Ordenación de las Profesiones Sanitarias indica claramente: los profesionales sanitarios tienen el deber de prestar una asistencia sanitaria técnica y profesional adecuada a las necesidades de salud de las personas que atienden, de acuerdo con el estado de desarrollo de los conocimientos científicos de cada momento y con los niveles de calidad y seguridad que se establecen en esta Ley y el resto de normas legales y deontológicas aplicables (25). BIBLIOGRAFÍA 1. Burguete Ramón D. Aproximación a la gestión clínica. La variabilidad de la práctica enfermera. Reunión Valenciana de Enfermería en Terapia Intravenosa. Libro de Ponencias (pendiente de publicación). Valencia 2004. 2. Navarro Valdivielso L. Contribución de la Enfermera en el proceso de la inmunización. Actualización en vacunas. III Jornada en La Safor. Gandia. Valencia. 2004. 3. Álvarez Pasquín MJ, Gómez Marco JJ. Estrategias de Vacunación en Atención Primaria. En: De Juanes Pardo JR, editor. Vacunaciones en el adulto. Guía y Recomendaciones. Segunda Edición. ASFORISP. Madrid. 2003; p. 296. 4. Bernal González PJ, Navarro Alonso JA. Registros Vacunales. En: De Arístegui Fernández J, editor. Vacunaciones en el niño: de la teoría a la práctica. Ciclo Editorial: Barcelona, 2004; p. 165-80. 74 5. Picazo de la Garza JJ. Guía Práctica de Vacunaciones para Enfermería. Centro de Estudios Ciencias de la Salud. Madrid. 2003; 125:130-85-112113. 6. Guía de Vacunaciones para Inmigrantes. Generalitat Valenciana. Consellería de Sanitat. 2003. 77:79-94. 7. Rodríguez-Torres A, Castrodeza J, Ortiz de Lejarazu R. Vacuna Antigripal. En: Salleras Sanmartí, LL. Vacunaciones Preventivas. Principios e indicaciones. 2ª edición. MASSON. Barcelona. 2003; p. 352 8. Farjas Abadía P, et al. Manual de Vacunaciones del Adulto. Esteve. A Coruña. 2003; p. 21-5 9. Arévalo JM, Arribas JL, Hernández MJ, Lizán M, Herruzo R. Grupo de Trabajo sobre desinfectantes y antisépticos. Sociedad Española de Medicina Preventiva, Salud Pública e Higiene.http://www.sempsph.com/sempsph/index.php?option=com_content&view=article&id=65:guia-de-utilizacion-de-antisepticos2001&catid=23:desinfeccion-e-higiene&Itemid=29 10. Botella Dorta C. Administración parenteral de medicamentos: conceptos generales. http://www.fisterra.com/material/tecnicas/parenteral/conceptos.asp 11. Zuckerman JN. Importancia de la inyección de vacunas en el músculo. Diferentes pacientes necesitan distintos tamaños de agujas. BMJ 2000;321:1237-8. 12. Cockshott WP, Thompson GT, Howlett LJ, Seeley ET. Intramuscular or intralipomatous injections? N Engl J Med 1982;307:356-8. 13. Arrazola Martínez MP, De Juanes Pardo JR. Recomendaciones Generales para la Administración de vacunas en el adulto. En: De Juanes Pardo JR, editor. Vacunaciones en el adulto. Guía y Recomendaciones. Segunda Edición. ASFORISP. Madrid. 2003; p.90-3. 14. Poland GA, Borrud A, Jacobson R, McDermott K, Wollan P, Brakke D, Charboneau JW. Determinación del panículo adiposo deltoideo. Implicaciones para la selección de la longitud de la aguja en la inmunización de los adultos. JAMA 1997;277:1709-11. 15. Ley 10/1998, de Residuos (BOE nº 96 de 22 de abril de 1998). 16. Real Decreto 952/1997, de 20 de junio, por el que se modifica el reglamento para la ejecución de la ley 20/1986, de 14 de mayo, Básica de Residuos Tóxicos y Peligrosos, aprobado mediante real decreto 833/1988, de 20 de julio. 17. Arístegui Fernández J. Manual de Vacunas en Pediatría. Comité Asesor de Vacunas. Asociación Española de Pediatría. Madrid. Edición 2001; p. 579-86 18. Hernández-Sampelayo Matos T, Corretger Rauet JM, Calbo Torrecilla F. Farmacovigilancia. Teratogénesis y seguridad de las vacunas. En: De Arístegui Fernández J, editor. Vacunaciones en el niño: de la teoría a la práctica. Ciclo Editorial. Bilbao. 2004; p. 144:7 19. De Juanes Pardo JR, Domínguez Rojas V. Efectos adversos de las vacunas. Farmacovigilancia. En: De Juanes Pardo JR, editor. Vacunaciones en el adulto. Guía y Recomendaciones. Segunda Edición. ASFORISP. Madrid, 2003; p.107-13. 20. Arribas Llorente JL, Campins Martí M, Hernández Navarrete MJ, editores. Estudio y Seguimiento del Riesgo Biológico en el Personal Sanitario. Proyecto EPINETAC 1996-2002. Grupo de Trabajo Epinetac. SEMPSPH. Madrid 2005. 21. Gallego Riestra S. Accidentes Biológicos y Responsabilidades Legales. En: Aranaz Andrés JM, Vitaller Burillo J. De las Complicaciones y Efectos Adversos a la Gestión de los Riesgos de la Asistencia Sanitaria. Generalitat Valenciana. Consellería de Sanidad. EVES 2004;217:218 22. Ley 31/1995, de 8 de noviembre, de Prevención de Riesgos Laborales. http://www.boe.es/aeboe/consultas/bases_datos/doc.php?coleccion=iberlex&id=1995/24292 23. Needleman J, Buerhaus P. Nurse staffing and patient safety. Current knowledge and implications for action. Int. Journal for Quality in Health Care 2003;15:275-7. 24. Código deontológico de la Enfermería Española. http://www.ecs.enfermundi.com/fileadmin/Documentos_de_la_profesion/CODIGO_DEONTOLOGICO.pdf 25. LEY 44/2003, de 21 de noviembre, de Ordenación de las Profesiones Sanitarias. http://www.boe.es/aeboe/consultas/bases_datos/doc.php?coleccion=iberlex&id=2003/21340 Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 03/05/10 13:58 Página 76 Medicina Preventiva Capítulo 23 CALENDARIO DE VACUNACIONES SISTEMÁTICAS DEL ADOLESCENTE Y ADULTO RECOMENDADO POR LA SOCIEDAD ESPAÑOLA DE MEDICINA PREVENTIVA, SALUD PÚBLICA E HIGIENE (actualización del año 2009) Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene1 L. Salleras (Coordinador), M. Campins, J. Castrodeza, A. Domínguez, V. Domínguez, J. Fernández-Crehuet, S. Fernández, J. R. de Juanes, V. Pastor, MC. Saenz 1 INTRODUCCIÓN En la reunión constitutiva del Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene, celebrada en Madrid el 23 de septiembre de 2004 se acordó elaborar un calendario de vacunaciones para el adolescente y adulto en el que se incluirían las vacunaciones que son de aplicación sistemática a este grupo de población, salvo en los casos de contraindicación individual. Sería el equivalente del calendario de vacunaciones infantiles en la edad adulta. También se acordó que el calendario sería actualizado períodicamente en función de los avances científicos que se fueran produciendo. El primer calendario se elaboró el año 2005 y fue aprobado en el Congreso de la Sociedad que tuvo lugar en Córdoba dicho año (1). El año 2007 se actualizó la recomendación de vacunación frente a la tos ferina con la vacuna Tdpa (2, 3). En el presente documento se expone la puesta al día del año 2009, en la que se incluye por primera vez la vacuna frente al papilomavirus humano en el calendario vacunal (Tabla I). CRITERIOS SEGUIDOS PARA LA ACTUALIZACIÓN DEL CALENDARIO DE VACUNACIONES SISTEMÁTICAS DE LA POBLACIÓN ADULTA Una vez registrada una vacuna para uso general en la población, la decisión de su inclusión o no en el calendario de vacunaciones sistemáticas de un país o región se basa, por lo general, en los siguientes criterios (4-6): a) carga de la enfermedad (morbilidad, mortalidad, letalidad, incapacidad) en el país o región, b) seguridad de la vacuna, c) eficacia protectora de la vacuna (valor protector en condiciones ideales de aplicación), medida mediante ensayos clínicos controlados, d) efectividad de la vacunación (valor protector en condiciones 76 rutinarias de aplicación en la población), medida mediante estudios epidemiológicos observacionales, e) eficiencia de la vacunación (coste-efectividad y coste-beneficio de la aplicación masiva de la vacuna) en la población del país en cuestión, y f) potencial teórico de eliminación-erradicación de la infección por la vacunación. Los criterios b (seguridad de la vacuna), c (eficacia protectora de la vacuna) y f (potencial teórico de eliminación de la infección por la vacunación) son universales, no variando de una población a otra (6). Los demás criterios, en cambio, son específicos de cada población y explican el por qué los calendarios de vacunaciones sistemáticas no pueden ser universales, sino que deben adaptarse a la situación y necesidades específicas de cada país o región (6). Estos criterios establecidos inicialmente para las vacunas a incluir en los calendarios de vacunaciones de la población infantil son perfectamente aplicables para las vacunas a introducir en los calendarios de vacunaciones de la población adolescente y adulta. La única excepción sería el criterio f (potencial teórico de eliminación-erradicación de la infección por la vacunación), que es aplicable básicamente a las vacunas a incluir en los calendarios de vacunaciones infantiles. Estos criterios fueron los seguidos por el Comité de expertos en vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene en la elección de las vacunas a incluir en el calendario de vacunaciones sistemáticas recomendado para los adultos españoles el año 2005 (1). También lo han sido para la elaboración de la puesta al día del calendario el año 2009. En relación con el primer punto, “carga de la enfermedad”, se han analizado los datos disponibles en nuestro país sobre morbilidad, mortalidad, letalidad y discapacidad de las diferentes enfermedades inmunopreve- Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 11/05/10 17:23 Página 77 Medicina Preventiva Tabla I. Calendario de vacunaciones sistemáticas del adulto recomendado por la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. España 2009 Grupo de edad Vacuna Tétanos Difteria Tos ferina 13-14 años 15-49 años 50-64 años ≥65 años DTpa (1 sola dosis) Td (1 dosis cada 10 años) Td (1 dosis cada 10 años) Td (1 dosis cada 10 años) Sustituir la primera dosis de vacuna Td a administrar por la vacuna dTpa Gripe VAI (1 dosis anual)* Antihepatitis B 3 dosis (0, 1-2, 4-6 meses)# Antihepatitis A 2 dosis (0, 6-12 meses)# Varicela 2 dosis (0, 1-2 meses) (No vacunados y con historia de varicela negativa) 2 dosis (0, 1-2 meses) (seronegativos) Neumocócica polisacárida 23-valente Papilomavirus humano Sarampión*** Rubéola Parotiditis VAI (1 dosis anual) (1 sola dosis)** 3 dosis (solo mujeres) 3 dosis (15-25 años) (solo mujeres) 1 ó 2 dosis 1 ó 2 dosis * Incorporar progresivamente la vacuna antigripal inactivada al grupo de de edad de 50 a 64 años, comenzado por el de 60-64 años. ** Revacunar con una sola dosis a los que hayan recibido la primera dosis antes de los 65 años (intervalo mínimo de 5 años). *** Adolescentes y adultos nacidos después de 1966 sin antecedentes fiables de vacunación o de padecimiento de la enfermedad. El año de corte puede variar en alguna Comunidad Autónoma en función de la política de vacunación seguida. # Considerar sólo en adolescentes no vacunados en la infancia. nibles que afectan a la población adolescente y adulta española. Para algunas enfermedades (gripe (7, 8), enfermedad neumocócica (9), hepatitis B (10), hepatitis A (11) y cáncer de cuello de útero (12), los datos disponibles muestran una importante carga de la enfermedad en la actualidad en España, que es susceptible de reducción mediante la vacunación sistemática. Para otras (difteria y polio, por ejemplo), la carga de la enfermedad es prácticamente inexistente en la actualidad al haberse conseguido su eliminación como consecuencia de la vacunación masiva de la población infantil (13). Sin embargo, hasta que no se consiga la erradicación a nivel mundial, las enfermedades que han sido eliminadas o que están prácticamente eliminadas en una comunidad pueden reintroducirse a partir de casos importados. Esto es lo que ha ocurrido con el sarampión y la rubéola, enfermedades de las que se han presentado importantes brotes en los últimos años en diversas comunidades autónomas (14-19). La inclusión de las vacunas frente a estas enfermedades en el calendario de vacunaciones del adulto forma parte de las estrategias para Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 mantener la eliminación de la enfermedad. Por último, para algunas (tétanos, tos ferina, parotiditis), si bien se ha conseguido una importantísima reducción de su incidencia en los últimos años, todavía persiste una importante morbilidad en los lactantes, adolescentes y adultos jóvenes (tos ferina) y ancianos (tétanos) (13). En este caso, las vacunas se han incluido para intentar reducir al máximo la morbilidad residual (13). En cuanto al valor protector de la vacuna, las decisiones se han tomado en base a los resultados de los ensayos clínicos controlados llevados a cabo para evaluar su eficacia protectora (20). Sólo cuando no han existido, como es el caso de las vacunas comercializadas hace ya muchos años (difteria, tétanos) se han valorado los resultados de los estudios observacionales que han evaluado la efectividad de la vacunación en condiciones rutinarias de aplicación a la población o los de los estudios descriptivos que han evaluado el impacto de los programas vacunales en la población (20). En una vacuna, la neumocócica 23-valente, la decisión se ha tomado en base a los resultados de los estudios observa- 77 76-86 CAPITULO 23 03/05/10 13:58 Página 78 Medicina Preventiva cionales de evaluación de la efectividad, al considerar que, por problemas metodológicos, los ensayos clínicos controlados no han aportado conclusiones válidas sobre su valor protector (21). VACUNAS INCLUIDAS EN EL CALENDARIO DE VACUNACIONES PARA ADOLESCENTES Y ADULTOS Vacunación frente al tétanos, difteria y tos ferina En este apartado, se ha ratificado la recomendación de la incorporación en el calendario de vacunaciones de la vacuna de la tos ferina acelular a los 13-14 años de edad, recomendándose la utilización de la vacuna triple bacteriana (difteria, tétanos, tos ferina acelular o dTpa) en sustitución de la vacuna Td utilizada anteriormente en este grupo de edad (1). Esta recomendación se justifica por la necesidad de proteger a los adolescentes y adultos jóvenes frente a la tos ferina, de incidencia creciente en este colectivo en nuestro país. Además, con ello se pretende, también, prevenir que los adultos jóvenes en contacto con niños, principalmente los padres, contraigan la enfermedad y se constituyan en fuente de infección para sus hijos (22-24). Por otro lado, se ha recomendado la sustitución en los adultos menores de 65 años de la primera dosis booster decenal de Td por la vacuna dTpa. En el caso de la tos ferina esta recomendación se justifica en la duración de la inmunidad vacunal frente a esta enfermedad, que es de solo 5-7 años. De ahí la necesidad de la vacunación con dTpa en la dosis de recuerdo a los 14-16 años, o en la edad adulta joven, ya que muchos casos de tos ferina del lactante tienen su origen en casos de tos ferina de sus progenitores, que muchas veces ignoran que padecen esta enfermedad (2, 3). En el caso de adultos no vacunados previamente, ya que la vacuna dTpa no está autorizada para primovacunación, sólo para dosis de recuerdo, el esquema vacunal que se recomienda es la sustitución de una de las 3 dosis (0, 1, 6-12 meses) por la vacuna dTpa. En relación con la vacuna antitetánica, algunos autores han recomendado aumentar los intervalos entre las dosis booster en los adultos, con el argumento de que ocurren muy pocos casos entre las personas que han recibido una inmunización primaria durante la edad infantil con un mínimo de tres dosis y hasta un total de 5 dosis, y que en estos casos, las muertes son excepcionales (25-27). También aducen que con ello se evitarían las situaciones de hiperinmunización, consecuencia de la medicación defensiva practicada en los servicios de urgencias traumatológicas de los hospitales y que, a su vez, comportan una mayor reactogenicidad de las succesivas dosis administradas (26). Estos argumentos fueron defendidos por Gardner (25) en Estados Unidos hace unos años, pero no han encontrado respuesta en los CDC, que siguen recomendando la revacunación decenal (28-30). Lo justifican en que se han publicado casos graves de tétanos en personas que han recibido las tres dosis de la inmunización primaria (31-38), y en que las encuestas seroepidemiológicas han demostrado que a pesar de que desde hace 40 años se recomienda la revacunación decenal con vacuna Td, el 20% de la población de 40 a 49 años está desprotegida frente al tétanos y que en las personas de 70 años el porcentaje de desprotegidos llega al 70% (39). Se da la paradoja, además, de que la mayoría de casos de tétanos se dan en la población de edad avanzada (31). 78 En España, esta polémica ha ocurrido como consecuencia del desabastecimiento de la vacuna Td ocurrido en los últimos años. De hecho, un reciente documento del Ministerio de Sanidad recomienda claramente la reducción del número de dosis booster en la edad adulta (40). El Comité ha analizado a fondo estos puntos y ha recomendado mantener la vacunación decenal durante toda la vida adulta con la vacuna Td. Se recomienda que la primera de las dosis a aplicar, con excepción del grupo de edad de ≥65 años, se sustituya por dTpa. El principal argumento es que en España todavía una importante proporción de la población adulta y anciana está desprotegida frente al tétanos. Las encuestas seroepidemiológicas han mostrado que la población infantil y adolescente está bien protegida. En cambio, en la población adulta la situación es claramente mejorable (41-43). Por ejemplo, en Cataluña el 37% de los varones de más de 55 años y el 55% de las mujeres de la misma edad carecen de anticuerpos protectores (43). Además, si bien la incidencia de la enfermedad ha disminuido de forma importante en los últimos años (se ha pasado de unos 90 casos a principios de los 80 del pasado siglo a menos de 20 en la actualidad y las muertes se han reducido de unas 70 a menos de 5 al año), todavía queda una morbilidad y mortalidad residual que se concentra sobre todo en las personas mayores (44). El Comité considera fundamental que los adultos que no hayan recibido una pauta completa de inmunización primaria, la reciban en el primer contacto que tengan con el sistema sanitario y, de forma preferente, en la atención primaria. Hay que tener presente que los nacidos antes de 1964 es improbable que la hayan recibido. En relación con este punto, el Comité hace especial énfasis en la recomendación de utilizar pautas diferentes según la edad en que se aplica la vacuna por primera vez a las personas adultas con antecedente de vacunación desconocido. En los adultos de menos de 45 años, nacidos después de la puesta en marcha en España de los programas de vacunaciones sistemáticas de la población infantil, se considera que una sola dosis es suficiente (45, 46). En las personas de más de 45 años se considera que se debe aplicar una pauta vacunal completa (3 dosis a los 0, 1, 6-12 meses) para que queden correctamente inmunizados (45, 46). En ambos colectivos se seguirá con 1 dosis cada diez años durante toda la vida adulta con la vacuna dTpa, con excepción del grupo de edad de ≥65 años que deberá recibir la vacuna Td (45, 46). Una última consideración que justifica el establecimiento de la revacunación decenal de los adultos con la vacuna Td en España, es que la inmunidad frente al bacilo diftérico disminuye más rápidamente que la antitetánica en ausencia de revacunación (47, 48). La mejor prueba de ello es que en los países, como Estados Unidos, donde desde hace más de 40 años se revacuna con la vacuna Td, la prevalencia de anticuerpos antidiftéricos es mucho más baja que la de antitetánicos en un mismo grupo de edad (47, 48). Muchos expertos opinan que la elevada incidencia de casos de difteria ocurridos en la población adulta rusa en la epidemia de los años 90, fue debida en gran parte a la caída de la inmunidad por ausencia de revacunaciones periódicas en la edad adulta (49, 50). La mayoría de la población adulta había recibido la inmunización primaria durante la edad infantil y aunque los anticuerpos habían desaparecido la administración de una sóla dosis booster devolvió la inmunidad antidiftérica a Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 03/05/10 13:58 Página 79 Medicina niveles protectores. De hecho, la administración de una sola dosis booster a todos los grupos de edad condujo al control rápido de la epidemia (49, 50). La experiencia adquirida con esta epidemia sugiere la necesidad de la administración de dosis booster decenales durante toda la vida adulta para mantener la inmunidad y evitar la introducción y difusión de bacilos diftéricos toxigénicos en la población. Los CDC recomiendan encarecidamente esta estrategia (30). En España, la difteria ha sido eliminada desde hace más de 30 años. Pero los bajos niveles de protección inmunitaria mostrados por las encuestas seroepidemiológicas hacen recomendable la estrategia de las revacunaciones decenales con Td (51). Vacunación antigripal En este capítulo, el Comité se ratifica en las recomendaciones efectuadas el año 2005. La principal novedad en este apartado en el calendario del año 2005 fue la recomendación de la vacunación sistemática anual del grupo de edad de 50 a 64 años (1). Esta recomendación se justifica por la elevada prevalencia de personas con condiciones médicas en las que está indicada la vacunación en este grupo de edad en nuestro país (alrededor del 40%) (52-54). Dado que las coberturas vacunales son más elevadas cuando la indicación de la vacunación antigripal se establece en función de la edad que cuando se hace en función de la pertenencia a grupos de riesgo, esta estrategia pretende aumentar indirectamente la cobertura vacunal en la población en riesgo de este grupo de edad (52-55). No hay que olvidar, además, que a partir de los 50 años se incrementan ya de forma importante las hospitalizaciones y muertes por complicaciones de la gripe (56,57). También se han tenido presentes los resultados de varios estudios experimentales y observacionales que han demostrado que la vacunación de las personas de 50 a 64 años de edad proporciona importantes beneficios de salud y económicos, tanto al individuo como a la sociedad (58-61). Un último argumento a favor de la decisión está en la línea del utilizado en Ontario para establecer la vacunación antigripal de toda la población, infantil y adulta (62, 63): cuanto mayor sea la proporción de la población vacunada anualmente en los periodos interpandémicos, más fácil será lograr coberturas elevadas en caso de la eclosión de una pandemia (62). Por último, el Comité considera que en los grupos de población en riesgo en los que la inmunogenicidad de las vacunas inactivadas clásicas no es óptima, las vacunas de inmunogenicidad incrementada recientemente comercializadas en nuestro país (vacuna adyuvada con MF59 para las personas de ≥65 años (64), y las vacunas virosomales para todos los grupos de edad (65) constituyen una alternativa para lograr mejores niveles de protección en estos colectivos. Lo mismo cabe decir de las vacunas administradas por vía intradérmica de próxima comercialización. Vacuna frente a la hepatitis B En este apartado no se produce ninguna novedad en relación con el calendario aprobado el año 2005. Se recomienda continuar con la vacunación sistemática frente a la hepatitis B de los preadolescentes de 12 años en las escuelas, en tanto no alcancen los 12 años de edad los niños de la primera cohorte vacunada durante el primer año de vida, lo cual variará en las diferentes comunidades autónomas (1). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva En su momento, la recomendación se justificó por la importante carga de la enfermedad en la población adolescente y adulta (tasas de incidencia de entre 20 y 30 por 100.000 habitantes y tasas de prevalencia de portadores crónicos de HBsAg del 1% en España en la época prevacunal) (66, 67), por los elevados niveles de eficacia protectora de la vacuna (68-71) y por el gran impacto ocasionado por los programas masivos de vacunación antihepatitis B en los países en los que se han implantado (72-74). En la mayoría de las Comunidades Autónomas, la vacunación se aplicó en las escuelas en forma de programa de salud pública, ya que éste es el único ámbito en el que se pueden lograr elevadas coberturas vacunales en los preadolescentes (75). Se recomienda aplicar 3 dosis de vacuna a los 0-1 y 6 meses. Se aconseja administrar las dos primeras dosis durante el primer trimestre del curso escolar y la tercera durante el tercer trimestre. El impacto de los programas de vacunaciones ha sido muy importante y en la actualidad las tasas de incidencia en nuestro país son relativamente bajas (75). No se recomienda la aplicación de dosis booster durante la vida adulta, ya que la memoria inmunológica es muy potente y protege frente a la exposición al virus, incluso si los anticuerpos han desaparecido (76). Vacuna antihepatitis A En este punto, el Comité se ha ratificado en la recomendación efectuada el año 2005 de incorporar la vacunación frente la hepatitis A en el calendario de vacunaciones sistemáticas (1). La carga de la enfermedad, el previsible desplazamiento de la afección en el futuro hacia la edad adulta cuando la mayoría de las infecciones son clínicamente aparentes y cursan con mayor gravedad, y los óptimos niveles de protección conferidos por las actuales vacunas inactivadas, justifican ampliamente esta recomendación. Como en la hepatitis B, la vacunación de los grupos de riesgo de la población adulta (cuidadoras de guarderías, viajeros internacionales, varones que practican el sexo con personas de su mismo género, etc.) sólo permitiría prevenir un pequeño porcentaje de la carga de esta enfermedad en nuestro país (67). Sólo la vacunación universal de la población infantil y, en especial, de los preadolescentes, puede conducir al control efectivo de esta enfermedad (77). Aunque continúa siendo importante (tasas de 2,27 por 100.000 habitantes el año 2007), en los últimos años se ha producido un cierto descenso en la morbilidad declarada por hepatitis A en España, probablemente como consecuencia de la importante mejora experimentada por la situación higiénica sanitaria del país (11). Paralelamente, las encuestas seroepidemiológicas han puesto de manifiesto un incremento continuado en la proporción de adolescentes y adultos jóvenes susceptibles a la enfermedad (78-80). En estas edades, a diferencia de la edad infantil en la que la mayoría de las infecciones son asintomáticas, la mayoría de infecciones suelen ser clínicamente aparentes. Aunque los casos suelen evolucionar favorablemente, la enfermedad puede recidivar (8-10% de los casos), evolucionar de forma fulminante e incluso ocasionar la muerte (letalidad del 0,3% en el grupo de 15 a 39 años y del 2,1% en el de 40 o más años), produciendo una importante carga de ingresos hospitalarios (81, 82). 79 76-86 CAPITULO 23 03/05/10 13:58 Página 80 Medicina Preventiva Por otro lado, los ensayos clínicos controlados efectuados han demostrado elevados niveles de eficacia protectora de la vacuna, cercanos al 100% (83, 84). Los estudios observacionales han dado resultados semejantes de la vacunación (85). Por último, en aquellas áreas geográficas en las que se ha incorporado la vacuna al calendario vacunal, el impacto ha sido muy grande, produciéndose un importante descenso en la incidencia de la enfermedad en las cohortes vacunadas y un descenso menor en los no vacunados, debido, probablemente, a la inmunidad de grupo proporcionada por la vacunación (86). Rodríguez et al (87) han comparado recientemente la evolución de la incidencia de la hepatitis A en las comunidades autónomas de España que han incorporado la vacuna al calendario vacunal (Cataluña, Ceuta y Melilla) con la observada en las demás comunidades autónomas. El resultado es claramente favorable a las primeras y confirma los resultados publicados anteriormente sobre la efectividad e impacto de la vacunación en Cataluña (85, 88). Los resultados obtenidos en España son similares a los observados en los países que han introducido la vacuna frente a la hepatitis A en el calendario de vacunaciones sistemáticas (86): Estados Unidos (al comienzo sólo en los estados con incidencia superior a la media y después en todos los estados) (89-95), Israel (96, 97), Australia (North Queensland) (98) e Italia (Puglia) (99). Estos resultados señalan la necesidad de considerar la introducción de la vacunación universal de la población infantil frente a la hepatitis A en nuestro país (100-101). La estrategia más eficiente sería la vacunación combinada A+B de los preadolescentes en las escuelas (102). Sin embargo, la elevada incidencia de brotes en guarderías y escuelas ocurridos en diferentes regiones de España en los últimos años y la prevista interrupción de la vacunación antihepatitis B en los adolescentes cuando las cohortes vacunadas en el primer año de la vida alcancen los 12 años de edad, hace aconsejable considerar la vacunación en el segundo año de la vida con la vacuna antihepatitis A simple, aunque el coste de la intervención sea más elevado (85, 88, 101). En Israel, la vacunación masiva de los preescolares ha terminado con los brotes que habitualmente se producían en las escuelas de este país (103). No se recomienda la revacunación. Se considera que la memoria inmunológica generada por la vacunación protege a los expuestos al virus, aunque los anticuerpos hayan desaparecido (104). Vacuna de la varicela En este apartado, el Comité se ratifica en sus recomendaciones del año 2005. En España, por el momento no se ha introducido la vacunación universal frente a la varicela en el calendario de vacunaciones sistemáticas de la población infantil, por lo que el virus de la varicela-zóster circula intensamente entre los niños, con el consiguiente riesgo para los adolescentes y adultos susceptibles en los que las complicaciones son más frecuentes, incluidas las mujeres embarazadas seronegativas (105-107). Todo ello hace especialmente necesaria la puesta en marcha de programas de vacunación de los preadolescentes de 10 o más años y de los adultos que no hayan padecido la enfermedad con anterioridad. Tanto uno como otro colectivo deben recibir dos dosis de vacuna para maximizar la protección frente a la enfermedad (106, 107). 80 Se recomienda llevar a cabo la vacunación de los adolescentes en las escuelas y la de los adultos en los centros de atención primaria y en su lugar de trabajo con el fin de conseguir coberturas vacunales elevadas. Como norma general no se recomienda el cribado serológico previo, sólo el interrogatorio sobre el padecimiento previo de la enfermedad. En todo caso, se puede considerar el estudio de anticuerpos en los adultos que en el interrogatorio manifiesten no haber padecido la enfermedad, ya que muchos de ellos ya habrán sufrido la infección. La excepción son las mujeres en edad fértil no embarazadas, las cuales deben ser sometidas a cribado serológico y, en su caso, a la vacunación en los centros de planificación familiar y visitas periódicas al ginecólogo. Se recomienda de forma especial la vacunación de los adultos con mayor riesgo de contraer la enfermedad por estar en contacto frecuente con niños: personal sanitario; contactos familiares susceptibles de pacientes inmunodeprimidos; personas que viven o trabajan en ámbitos donde existe gran facilidad de transmisión del VVZ (por ejemplo, guarderías, escuelas); adultos jóvenes de poblaciones cerradas o semicerradas (estudiantes, reclutas); mujeres no embarazadas en edad de procrear; inmigrantes procedentes de países tropicales, etc (106-108). Estas recomendaciones se justifican por el mayor riesgo de complicaciones de la enfermedad en la población adolescente y adulta (106, 107). Las encuestas seroepidemiológicas han puesto de manifiesto un vacío de inmunidad de alrededor del 5% en el grupo de edad de 15 a 34 años, que desaparece a partir de los 35 años, lo que es indicativo de que un pequeño, aunque significativo porcentaje de casos de la enfermedad, ocurre en la edad adulta, periodo en el que son más frecuentes las complicaciones (109, 110). De hecho, una varicela padecida en la edad adulta es 25 veces más probable que presente un curso grave que una varicela padecida en la edad infantil (111). En España, cada año se producen unas 1.500 hospitalizaciones por varicela, de las cuales el 41% corresponden a adolescentes y adultos, dando lugar a 6.350 estancias hospitalarias, de las cuales 3.333 son de adolescentes y adultos (112, 113). El coste anual de estas hospitalizaciones ha sido estimado por Gil et al en 1,2 millones de euros, de los cuales 500.000 corresponderían a las personas de ≥10 años (112, 113). Por último, los ensayos clínicos controlados efectuados en niños han demostrado una eficacia protectora del 88 al 100% para las formas graves durante el primer año después de la vacunación (114, 115). La efectividad protectora ha oscilado entre el 83 y el 85% en la prevención de todas las formas de la enfermedad y entre el 97 y el 100% en la prevención de las formas moderadas o graves (116-123). Vacuna neumocócica polisacárida 23-valente Se recomienda la vacunación sistemática de las personas de 65 o más años, cualquiera que sea su estado de salud, con una dosis de vacuna neumocócica 23-valente (1). Esta recomendación se justifica por la elevada carga de la enfermedad (la incidencia global estimada de enfermedad neumocócica en España es de 250 a 550 por 100.000 habitantes y la incidencia de las formas invasoras, de 50 por 100.000) (124) y porque se considera probado el valor protector de la vacuna frente a las formas invasoras en base a estudios observacionales (efectividad protectora del 60 al 80%) (21, 125). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 03/05/10 13:58 Página 81 Medicina Aunque existen todavía bastantes dudas sobre el valor protector de esta vacuna frente a la neumonía neumocócica no invasora (21), la efectividad frente a las formas invasoras se considera probada, por lo que la vacunación se justifica sobradamente sólo con este efecto protector. Si, además, se acaba probando un efecto protector frente a las neumonías, el impacto potencial de la vacunación se incrementará de forma importante y la eficiencia de los programas de vacunaciones mejorarán en la misma medida. Un reciente estudio de casos y controles efectuado en tres comunidades autónomas de España ha encontrado una efectividad protectora del 25% de esta vacuna frente a las neumonías por todas las causas (126). No se recomienda la revacunación, con excepción de los adultos que alcancen los 65 años de edad y hubieran sido vacunados antes, como consecuencia de condiciones médicas de riesgo127-129. En este caso, la revacunación se efectuará pasados 5 años de la primera dosis (127-129). Vacuna del sarampión, rubéola y parotiditis Tanto para el sarampión como para la rubéola, la carga de la enfermedad es muy pequeña en la actualidad en España (130, 131), y aunque se había conseguido prácticamente su eliminación, en los últimos años se han producido brotes que han afectado a la población autóctona. El año 2007 se declararon 241 casos de sarampión, 60 de rubéola, la mayor parte de los cuales ocurrieron en inmigrantes o eran casos importados, y 10.343 casos de parotiditis. Estos datos de carga de la enfermedad se corresponden con las prevalencias de anticuerpos específicos frente a estas enfermedades en la población adulta española (1996), muy elevada para el sarampión (98% para ambos sexos) y la rubéola (98% en la población femenina en edad fértil) y algo más baja para la parotiditis (90% de los 20 a 24 años, 93% de los 25 a 29 años y 94% de los 30 a 39 años para ambos sexos) (132). Después de analizar estos datos, el Comité ha recomendado la vacunación frente al sarampión con 2 dosis de vacuna triple vírica separadas con un intervalo mínimo de 28 días, de los adolescentes o adultos nacidos después de 1966 y que no acrediten estar inmunizados (carnet vacunal o estudio de anticuerpos). El año de corte puede variar en función de la política de vacunación seguida por la comunidad autónoma. Esta recomendación es aplicable especialmente en situación de brote o de exposición a la infección, en los trabajadores sanitarios y en los viajeros internacionales (1). El Comité recomendó especialmente la vacunación con vacuna triple vírica de las mujeres en edad fértil que tengan intención de quedar embarazadas y no acrediten estar inmunizadas (carnet vacunal o estudio de anticuerpos) (1). Se administraran 2 dosis separadas por 28 días de intervalo. Las mujeres en edad fértil vacunadas deben evitar el embarazo durante el mes siguiente a la recepción de la segunda dosis. Las mujeres embarazadas seronegativas deben ser vacunadas en el posparto inmediato. El personal sanitario del sexo femenino y los viajeros internacionales susceptibles deben, también, ser vacunados con la misma pauta. En caso de brote o de exposición a la infección se vacunará a los expuestos que no acrediten estar inmunizados, con excepción de las mujeres embarazadas. Por último, el Comité recomendó la vacunación de los adultos que no acrediten estar inmunizados frente a la parotiditis (carnet vacunal o estudio de anticuerpos) con 2 dosis de vacuna separadas por un intervalo mínimo de 28 días (1). Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva Vacunas frente al papilomavirus humano (VPH) Se han identificado más de 150 tipos virales del virus del papiloma humano (VPH) (133), los cuales, según su tropismo, se han clasificado como cutaneotrópicos o mucosotrópicos (134, 135). Los VPH mucosales afectan sobre todo a la región genital y se transmiten por vía sexual (136, 137). De hecho, la infección por el VPH es la más frecuente de las enfermedades de transmisión sexual en los países desarrollados (136, 137). Los VPH mucosales anogenitales se adquieren rápidamente después del inicio de las relaciones sexuales (136, 137). Se estima que entre el 50 y el 75% de las mujeres de los países occidentales desarrollados se infectan por uno o más VPH durante su vida sexual activa (138, 139). Los VPH mucosales pueden ser de bajo o alto bajo riesgo oncogénico. Los VPH de bajo riesgo, como los VPH 6 y 11, son responsables de la mayor parte de las verrugas anogenitales, de algunas lesiones cervicales precancerosas de bajo grado (CIN 1) y de la papilomatosis respiratoria recurrente de los lactantes (137, 140-142). Los VPH de alto riesgo oncogénico”, como los tipos 16 y 18, son responsables del 70% de las lesiones precancerosas de alto grado (CIN 2 y CIN 3) del cuello de cérvix, las cuales pueden progresar y evolucionar a carcinoma in situ y carcinoma invasor. (137, 140-142). La mayor parte de las infecciones por VPH oncogénicos son inaparentes y se eliminan espontáneamente en uno o dos años (136, 137). Pero un pequeño porcentaje cursan en forma de infección persistente y con el tiempo pueden ocasionar lesiones precancerosas del cuello de cérvix de diferentes grados (140, 142). De todas formas, una elevada proporción de estas lesiones, sobre todo las de bajo grado revierten espontáneamente y no evolucionan a carcinoma in situ o a cáncer de cérvix invasivo (137). Aunque los primeros estudios epidemiológicos sobre VPH en España indicaban una relativa baja prevalencia de detección de ADN del VPH (1,3% a 5,5 % en mujeres de 1574 años) (134), análisis preliminares del estudio CLEOPATRE utilizando la técnica de captura de híbridos (HC2, Qiagen) estiman una prevalencia del VPH estandarizada por edad del 14% en mujeres de 18-65 años y del 29% en mujeres de 18-25 años. Además, se estima que cada año ocurren en España unos 2.100 casos de cáncer de cuello de útero, con una mortalidad anual de 740 muertes. Se estima que unas 9.000 mujeres se diagnostican cada año de lesiones precancerosas de alto grado (CIN 2 y CIN 3), las cuales comportan un elevado coste para el sistema sanitario y son fuente de angustia para las mujeres afectadas (134). La extrapolación a nuestro país de los datos disponibles en los países del norte de Europa, permite estimar que una de cada 8 mujeres sufrirá al menos un episodio de verrugas genitales antes de alcanzar los 50 años de edad (143). Muy recientemente se han comercializado dos vacunas frente al virus del papiloma humano en nuestro país: una vacuna tetravalente (GardasilTM) del laboratorio Sanofi Pasteur MSD y otra bivalente (CervarixTM) del laboratorio GlaxoSmithKline. Ambas son vacunas profilácticas a base de partículas “virus like” (VLP) formadas a partir de las proteínas L1 autoensambladas. Estas vacunas se diferencian en el número de tipos virales contenidos en la vacuna (6, 11, 16 y 18 en la tetravalente y 16 y 18 en la bivalente), y en el adyuvante utilizado (hidrofosfato sulfato de aluminio en la tetravalente y 81 76-86 CAPITULO 23 03/05/10 13:58 Página 82 Medicina Preventiva ASO4 en la bivalente) (134, 144). También se diferencian en el sistema de producción de las VLP, expresadas en levaduras en la vacuna tetravalente y en un baculovirus en la bivalente. Ambas vacunas se administran en 3 dosis (0-2-6 meses GardasilTM y 0-1-6 meses CervarixTM) (134, 144). Las vacunas VPH profilácticas han demostrado ser muy seguras y poco reactógenas en los ensayos clínicos controlados realizados para evaluar seguridad, inmunogenicidad y eficacia clínica (145-150). En la vigilancia poscomercialización se ha confirmado la buena tolerancia de estas vacunas. Los efectos adversos más importantes han sido las reacciones anafilácticas que en general no han revestido gravedad y han sido muy infrecuentes (alrededor de un caso por cada millón de dosis administradas en Estados Unidos) (151-152). En Australia, estas reacciones parecen haber sido más frecuentes (2,6 por cada 100.000 dosis administradas), sin que la causa haya sido aclarada hasta el momento (153, 154). Las reacciones adversas notificadas en el mes de febrero de 2009 en dos mujeres preadolescentes vacunadas en Valencia y otra en Baleares con la vacuna tetravalente que debutaron con convulsiones que requirieron ingreso hospitalario durante semanas, no fueron finalmente asociadas a la vacuna. Después de una exhaustiva evaluación de los tres casos por parte de un comité de expertos creado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) en colaboración con la Agencia Europea de Medicamentos y la red de agencias de estados miembros de la UE, concluyó que la ausencia de una base biológica que explicara la posible asociación entre los trastornos paroxísticos presentados y las vacunas hacía muy improbable que dichos cuadros pudiesen considerarse como reacciones adversas a las mismas, afirmando que la relación beneficio-riesgo de las vacunas frente al VPH se mantenía como favorable. La opinión más aceptada actualmente es que el patrón convulsivo observado en las tres preadolescentes, el cual no se acompañó de alteraciones en el electroencefalograma ni de otros hallazgos sugestivos de alteración orgánica, correspondía probablemente a un cuadro psicógeno compatible con un síndrome de conversión neurótica (155). Las vacunas VPH son altamente inmunógenas y se acompañan de títulos de anticuerpos neutralizantes frente a los genotipos incluidos en la vacuna que son hasta 100 veces superiores a los que siguen a la infección natural (156, 157). Las tasas de seroconversión en las niñas adolescentes y en las mujeres jóvenes son similares, pero las concentraciones geométricas medias de anticuerpos son sensiblemente más elevados en las niñas que en las mujeres jóvenes, lo que demuestra la buena respuesta inmunitaria frente a esta vacuna en la adolescencia (158). Ambas vacunas generan, además, buenos niveles de memoria inmunológica, lo que hace prever que la protección inmunitaria conferida será de por vida (159, 160). Los ensayos clínicos aleatorizados de fase III efectuados en mujeres de 15 a 26 años han demostrado en ambas vacunas una eficacia protectora cercana al 100% en la prevención de la infección persistente y de las lesiones precancerosas cervicales (CIN 2/3) de diferentes grados, producidas por los tipos virales incluidos en la vacuna (145157, 159-165). La vacuna tetravalente ha mostrado también una eficacia protectora del 100% frente a verrugas genitales, así como una elevada protección frente a lesiones VIN2/3 y 82 VAIN2/3 producidas por los tipos 16 y 18 incluidos en la vacuna (148, 149). La duración de la protección clínica en ambas vacunas se estima en al menos 5 años (corresponde a la duración de los ensayos en 2007) (166, 167). La existencia de memoria inmunológica hace prever que la protección será de por vida (159, 160). Ambas vacunas han demostrado un cierto grado de protección cruzada frente a la infección persistente (≥6 meses) y lesiones precancerosas asociadas a algunos tipos virales oncogénicos no incluidos en la vacuna (156, 168-172). Los estudios de evaluación económica, efectuados en Estados Unidos, de la estrategia de vacunación sistemática de las niñas adolescentes de 12 a 14 años acompañada de cribado versus cribado solo (la estrategia actual), han demostrado que la vacunación no ahorra dinero, pero que las razones costeefectividad son aceptables (coste por año de vida ganado, de 17.802 a 45.000 dólares y coste por año de vida ganado ajustado por calidad, de 15.000 a 24.000 dólares, en ambos casos desde la perspectiva de la sociedad) (173-176). En el estudio efectuado en España desde la perspectiva del proveedor, el coste por año de vida ganado ha sido de 8.657 euros y el coste por año de vida de calidad ganado, de 6.493 euros (177). En conclusión, se puede afirmar que las vacunas VPH reúnen las condiciones necesarias para ser incluidas en el calendario de vacunaciones sistemáticas en nuestro país: 1) la carga de la enfermedad es importante, 2) las vacunas son seguras, inmunógenas y generan buenos niveles de memoria inmunológica, lo que hace prever una duración larga de la protección, probablemente de por vida, 3) ambas vacunas han demostrado ser eficaces en la prevención de la infección persistente y de las lesiones precancerosas por los tipos virales incluidos en la vacuna, 4) aunque los tipos virales 16 y 18 sólo son responsables del 70% de las lesiones precancerosas en España, la inmunidad cruzada con otros tipos virales oncogénicos no incluidos en la vacuna hace prever que la efectividad de la vacunación será superior al 70%, y 5) la estrategia de vacunación sistemática de las niñas en la adolescencia complementada con el cribado periódico, comparada con la estrategia actual, es decir, sólo cribado periódico, no ahorra dinero ni al proveedor ni a la sociedad, pero las razones coste-efectividad son muy razonables, similares a las de otras vacunas incluidas en los calendarios de vacunaciones sistemáticas de nuestro país. En la vacuna tetravalente, la carga de enfermedad evitada se incrementa al prevenir el 100% de las verrugas genitales producidas por los genotipos 6 y 11. De momento, ambas vacunas sólo están registradas para su aplicación en las personas del sexo femenino de 9 a 26 años (Gardasil TM) y de 10 a 25 años (Cervarix TM). Los datos preliminares de los ensayos clínicos en varones indican que GardasilTM puede ser también eficaz en la prevención de infección persistente, verrugas genitales y otras lesiones anogenitales asociadas al VPH en hombres, pero los datos finales no están aún publicados. Lo ideal es administrar la vacuna a las niñas de 12-14 años, antes del inicio de la vida sexual activa. Para que las coberturas vacunales sean elevadas, es recomendable administrar la vacuna en las escuelas en forma de programa de salud pública. Se recomienda también la vacunación de las mujeres de 16 a 25 años o más con carácter individual en las consultas de ginecología, planificación familiar y medicina de familia. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 03/05/10 13:58 Página 83 Medicina Aunque algunas de ellas ya habrán sido infectadas por alguno de los tipos virales incluidos en la vacuna, raramente lo habrán sido por todos. Estas mujeres, además, quedarán también protegidas de futuras infecciones por tipos vacunales, por lo que pueden también beneficiarse de los efectos protectores de la vacuna. BIBLIOGRAFÍA 1. Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. L. Salleras (Coordinador), JM. Bayas, F. Calbo, M. Campins, J. Castrodeza, A. Cerrillo, M. Conde, A. Domínguez, V. Domínguez, JA. Forcada, A. Gil, JR. de Juanes, MC Saenz. Calendario de vacunaciones sistemáticas del adulto y recomendaciones de vacunación para los adultos que presentan determinadas condiciones médicas, exposiciones o conductas de riesgo. Vacunas 2006;7 (supl. 1):1-173. 2. Comité de Vacunas de la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene. L. Salleras (Coordinador), JM. Bayas, F. Calbo, M. Campins, J. Castrodeza, A. Cerrillo, M. Conde, A. Domínguez, V. Domínguez, JA. Forcada, A. Gil, JR. de Juanes, MC Saenz. Puesta al día: “Vacunación antitosferina de los adolescentes y adultos”. Vacunas. 2007;8:38-47. 3. Salleras L. Vacunación frente a la tos ferina en el adolescente y adulto: una estrategia marcada por la epidemiología. Vacunas 2007;8:1-2. 4. Pickering LK, Orenstein WA. Development of pediatric vaccine recommendations and policies. Semin Pediatr Infect Dis 2002;13:148-54. 5. Rabinovich NR, Orenstein WA. Vaccines. Overview. Epidemiol Rev 1999;21:1-6. 6. Salleras L. El futuro del calendario vacunal. Vacunas 2003;4 (supl. 1):42-53. 7. Rodríguez Torres A, Castrodeza J, Ortiz de Lejarazu R. Vacuna antigripal. En: Salleras Sanmartí L, ed. Vacunaciones preventivas. 2ª edición. Barcelona: Masson 2003; p. 321-62. 8. De Juanes JR. Influenza: key issues and immunisation. Chemist 2002;2:4-16. 9. Domínguez A, Salleras L, Cardeñosa N, Ciruela P, Carmona G, Martinez A et al. The epidemiology of invasive Streptococcus pneumoniae disease in Catalonia (Spain). A hospital-based study. Vaccine 2002;3250:1-6. 10. Bruguera M, Sánchez Tapias JM. Epidemiología de la hepatitis B en España. Med Clin (Barc) 1990;95:470-5. 11. Bruguera M, Forns X. Epidemiología actual de las hepatitis virales: ¿quién las padece y quien puede protegerse? Enferm Infec Microbiol Clin 2004;22:443-7. 12. Castellsagué X, Bosch FX. Vacunas frente al virus del papiloma humano. Enferm Infecc Microbiol Clin 2007;25(supl. 5):65-77. 13. Salleras L, Taberner JL, Batalla J, Urbiztondo L, Rodríguez G, Plans P et al. Enfermedades prevenibles mediante vacunaciones sistemáticas. Evaluación de los objetivos del Plan de Salud para el año 2000. Med Clin (Barc) 2003;121 (supl. 1):74-8. 14. Domínguez A, Torner N, Barrabeig I, Rovira A, Rius C, Caylà J et al. Large measles outbreak in a community with high vaccination coverage. Clin Infect Dis 2008;47:1143-9. 15. Perucha M, Ramalle-Gómara E, Lezaun ME, Blanco A, Quiñones C, Blasco M et al. Measles outbreak in children under 15 months of age in La Rioja, Spain 2005-2006. Euro Sureill 2006;11:202. 16. Carnicer-Pont D, Peña-Rey I, de Aragón VM, de Ory F, Dominguez A, Torner N et al. Eliminating congenital rubella syndrome in Spain: does massive immigration have any influence? Eur J Public Health. 2008;18:688-90. 17. García L. Outbreak of rubella in the Madrid region, Spain, 2005. Euro Surveill 2005;10:E050707.2. 18. García L. Measles outbreak in the region of Madrid, Spain, 2006. Euro Surveill 2006;11:E060330.3. 19. Martínez-Torres AO, Mosquera MM, Sanz JC, Ramos B, Echevarría JE. Phylogenetic analysis of rubella virus strains from an outbreak in Madrid, Spain, from 2004 to 2005. J Clin Microbiol 2009;47:158-63. 20. Salleras L, Domínguez A. Evaluación de la eficacia de las vacunas y de la efectividad de los programas de vacunaciones. En: Salleras L, editor. Vacunaciones preventivas. 2ª ed. Barcelona: Masson, 2003; p. 781-800. 21. Fedson DS, Liss C. Precise answers to the wrong question: prospective clinical trials and the meta-analysis of pneumococcal vaccine in elderly and high risk adults. Vaccine 2004;22:927-46. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 22. Campins M, Moraga FA. Vacuna antipertussis. En: Salleras L, editor. Vacunaciones preventivas. 2ª edición. Barcelona: Masson 2003; p. 139-62. 23. De Juanes JR, Gil A, González A, Arrazola MP, Sanmartín M, Esteban J. Seroprevalence of pertussis antibody among health care personnel in Spain. Eur J Epidemiol 2004;19:69-72. 24. Forsyth KD, Campins-Marti M, Caro J, Cherry JD, Greenberg D, Guiso N et al. New pertussis vaccination strategies beyond infancy: Recommendations by the Global Pertussis Initiative. Clin Infect Dis 2004;39:1802-9. 25. Gardner P. Issues related to the decennial tetanus-diphteria toxoid booster recommendations in adults. Infect Dis Clin North Am 2001;15:143-53. 26. Mathias RG, Schechter MT. Booster inmunization for diphtheria and tetanus no evidence for need in adults. Lancet 1985;1:1089-91. 27. Simonsen O, Kjelgelsen K, Heron I. Inmunity against tetanus and effect of revaccination 25-30 years after primary vaccination. Lancet 1984;2:1240-2. 28. CDC. Recommended adult immunization schedule – United States, 2009. MMWR 2009;57:Q1-Q4. 29. CDC. Recommended immunization schedule for persons aged 0 through 18 years – United States, 2009. MMWR 2009;57;Q1-Q4. 30. CDC. Preventing tetanus, diphteria and pertussis among adults: use of tetanus toxoid, reduced diphtheria toxoid and acellular pertussis vaccines recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55 (RR17):1-37. 31. Wassilak SGF, Roper MH, Kretsinger K, Orenstein WA. Tetanus toxoid. In: Plotkin SA, Orenstein WA, Offit PA, eds. Vaccines fifth edition. Philadelphia: Saunders; 2008:805–39. 32. Gidengil CA, Sandora TJ, Lee GM. Tetanus-diphtheria-acellular pertussis vaccination of adults in the USA. Expert Rev Vaccines 2008;7:621-38. 33. LaForce FM, Young LS, Bennett JV. Tetanus in the United States (1965-1966). N Engl J Med 1969:280:569-74. 34. Pascual FB, McGinley E, Zanardi LR, Cortese MM, Murphy TV. Tetanus surveillance – United States, 1998-2000. MMWR 2003; (SS-3):1-8. 35. Pryor T, Onarecker C, Coniglione T. Elevated antitoxin titers in a man with generalized tetanus. J Fam Pract 1997;44:299-303. 36. Abrahamian FM, Pollack CV Jr, LoVecchio F, Nanda R and Carlson RW. Fatal tetanus in a drug abuser with “protective” antitetanus antibodies. J Emerg Med 2000;18:189-93. 37. Long AP, Sartwell PE. Tetanus in the US Army in the World War II. Bull US Army Med Dept 1947;7:371-85. 38. Murphy KJ. Fatal tetanus with brain-stem involvement and myocarditis in an exserviceman. Med J Aust 1970;57:542-4. 39. McQuillan GM, Kruszon-Moran D, Deforest A, Chu Sy, Wharton M. Serologic immunity to diphtheria and tetanus in the United States. Ann Intern Med 2002;136:660-6. 40. Vacunación en adultos. Recomendaciones. Vacuna de difteria y tétanos. Actualización 2009. Ministerio de Sanidad Política Social http://www.msc.es/ciudadanos/proteccionSalud/vacunaciones/docs/TetanosDifteria 2009.pdf 41. Estudio seroepidemiológico. Situación de las enfermedades vacunables en España. Ministerio de Sanidad y Consume. ISC III. Centro Nacional de Epidemiología. España 2000. 42. Vidal J, Salleras L. Vacuna antitetánica. En: Vacunaciones preventivas. Principios y aplicaciones, 2ª ed. Masson, Barcelona 2003. 43. Domínguez A, Plans P, Costa J, Espuñes J, Cardeñosa N, Salleras L et al. The seroepidemiology of tetanus in Catalonia, Spain. Med Microbiol Immunol 2007;196:115-9. 44. Salleras L, Domínguez A. Políticas vacunales oficiales en España. En: Plotkin SA, Orenstein WA, Picazo JJ, Offit PA, editores. Vacunas. 1.ª ed. española. Acindes, Madrid 2007. 45. Bayas JM, Vilella A, Bertran MJ, Vidal J, Batalla J, Asenjo MA, Salleras Ll. Immunogenicity and reactogenicity of the adult tetanus-diphtheria vaccine. How many doses are necessary?. Epidemiol Infect 2001;127:451-60. 46. Bayas JM, Vilella A. Vacunaciones del adulto. En: Salleras L, editor. Vacunaciones preventivas. 2ª ed. Barcelona: Masson 2003; p. 849-65. 47. Vitek CR, Wharton M. Diphtheria Toxoid. In: Plotkin SA, Orenstein WA, Offit PA, eds. Vaccines. 5th ed. Saunders; 2008: p. 139-156. 48. WHO. Diphtheria vaccine. WHO position paper. Wkly Epidemiol Rec 2006;81:24-32. 49. Galazka AM, Robertson SE. Diphtheria: changing patterns in the developing world and the industrialized world. Eur J Epidemiol 1995;11:107-17. 50. Galazka AM, Robertson SE, Oblapenko GP. Resurgence of diphtheria. Eur J Epidemiol 1995;11:95-105. 83 76-86 CAPITULO 23 03/05/10 13:58 Página 84 Medicina Preventiva 51. Salleras L, Vidal J, Plans P, Campins M, Domínguez A, Bayas JM. Bajos niveles de protección inmunitaria frente a la difteria en la población adulta de Cataluña (España). Med Clin (Barc) 1998;111:692-5. 52. Jiménez R, Larrauri A, Carrasco P, Esteban J, Gómez-López LL, Gil A. Influenza coverages in Spain and vaccination-related factors in the subgroup aged 50-64 years. Vaccine 2003;21:3550-5. 53. Salleras L. Las personas del grupo de edad de 50 a 64 años: nueva indicación de la vacuna antigripal. Vacunas 2006;7:1-3. 54. Domínguez A, Juncá S, Tresserres R, Batalla J, Salleras L. Influenza vaccination: the prevalence of risk factors in persons aged 50 years and more in Catalonia. Vacunas 2003;4:114-8. 55. CDC. Prevention and Control of Influenza: Recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2005;54 (RR-8):1-40. 56. Thompson WW, Shay DK, Weintraub E, Brammer L, Bridges CB, Cox NJ et al. Influenza-associated hospitalizations in the United States. JAMA. 2004;292:1333-40. 57. Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ et al. Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA 2003;289:179-86. 58. Wilde JA, McMillam JA, Serwint J, Butta J, O’Riordan MA, Steinhoff MC. Effectiveness of influenza vaccine in health care professionals: a randomized trial. JAMA 1999;282:908-13. 59. Nichol KL, Lind A, Margolis KL, Murdoch M, McFadden R, Hauge M et al. The effectiveness of vaccination against influenza in healthy, working adults. N Engl J Med 1995;33:889-93. 60. Campbell DS, Rumley MH. Cost-effectiveness of the influenza vaccine in a healthy, working-age population. I Occup Environ Med 1997;39:408-14. 61. Bridges CB, Thompson WW, Meltzer MI, Reeve GR, Talamonti WJ, Cox NJ et al. Effectiveness and cost-benefit of influenza vaccination of healthy working adults: A randomized controlled trial. JAMA 2000;284:1655-63. 62. Shabas R. Mass influenza vaccination in Ontario: a sensible more. Can Med Assoc J 2001;164:36-7. 63. Demicheli V. Mass influenza vaccination in Ontario: is it worthvwhile? Can Med Assoc J 2001;164:36-7. 64. Banzhoff A, Nacci P, Podda A. A new MF59-adjuvanted influenza vaccine enhances the immune response in the elderly with chronic diseases: Results from an immunogenicity metaanalysis. Gerontology 2003;49:177-84. 65. De Bruijn IA, Nauta J, Cramer WC, Gerez L, Palache AM. Clinical experience with inactivated, virosomal influenza vaccine. Vaccine 2005;23 (Suppl. 1):S39-S49. 66. Bruguera M. Sánchez Tapias JM. Epidemiología de la hepatitis B en España. Med Clin (Barc) 1990;95:470-5. 67. Domínguez A, Vidal J, Bruguera M, Salleras L. Epidemiología de las hepatitis virales. Enf Infecc Microbiol Clin 1995;13:50-61. 68. Szmuness W, Stevens CE, Harley EJ, Zang EA, Oleszko WR, William DC et al. Hepatitis B vaccine: demonstration of efficacy in a controlled clinical trial in a high-risk population in the United States. N Engl J Med 1980;303:833-41. 69. Francis DP, Hadler SC, Thompson SE, Maynard JE, Ostrow DG, Altman N et al. Prevention of hepatitis B with vaccine: report from the Center for Disease Control multi-center efficacy trial among homosexual men. Ann Intern Med 1982;97:362-6. 70. Crosnier J, Jungers P, Couroucé A-M, et al. Randomised placebocontrolled trial of hepatitis B surface antigen vaccine in French haemodialysis units: I. Medical staff. Lancet 1981;1:455-9. 71. Hadler SC, Francis DP, Maynard JE, Thompson SE, Judson FN, Echenberg DF et al. Long-term immunogenicity and efficacy of hepatitis B vaccine in homosexual men. N Engl J Med 1986;315:209-14. 72. Chan CY, Lee SD, Lo KJ. Legend of hepatitis B vaccination: the Taiwan experience. Gastroenterol Hepatol 2004;19:121-6. 73. Harpaz R, McMahon BJ, Margolis HS, Shapiro CN, Havron D, Carpenter G et al. Elimination of new chronic hepatitis B virus infections: results of the Alaska immunization program. J Infect Dis 2000;181:413-8. 74. CDC Incidence of acute hepatitis B. United States 1990-2002. MMWR 2004;52:1252-4. 75. Salleras L, Domínguez A, Bruguera M, Cardeñosa N, Batalla J, Carmona G et al. Dramatic decline in acute hepatitis B infection and disease incidence rates among adolescents and young people after twelve years of a mass hepatitis B vaccination programme of preadolescents in the schools of Catalonia. Vaccine 2005;23:2181-4. 84 76. European Consensus Groups on Hepatitis B Immunity. Are booster immunisations needed for lifelong hepatitis B immunity? Lancet 2000;355:561-5. 77. Lopalco PL, Salleras L, Barbuti S, Germinario C, Bruguera M, Buti M et al. Hepatitis A and B in children and adolescents--what can we learn from Puglia (Italy) and Catalonia (Spain)? Vaccine 2000;19:470-4. 78. Salleras L, Bruguera M, Vidal J, Taberner JL, Plans P, Jiménez de Anta MT et al. Cambio en el patrón epidemiológico de la hepatitis A en Cataluña (España). Med Clin (Barc) 1992;99:87-9. 79. Amela C, Pachon L, Bueno R, Domínguez C, Martínez Navarro F. Trends in hepatitis A virus infecions in reference to the process of urbanization in the greater Madrid area (Spain). Eur J Epidemiol 1995;11:569-73. 80. Domínguez A, Bruguera M, Plans P, Costa J, Salleras L. Prevalence of hepatitis A antibodies in schoolchildren in Catalonia (Spain) after the introduction of virosomal hepatitis A immunization. J Med Virol 2004;73:172-6. 81. Salleras L, Bruguera M, Buti M, Domínguez A, Vidal J, Navas E et al. Hepatitis A vaccination policy in Catalonia (Spain). Vacunas 2000;1:30-5. 82. Gil A, González A, San-Martín M, Carrasco P. Hospitalizaciones por hepatitis A en España 1995-1998. Vacunas 2004;5:31-4. 83. Innis BL, Snitbhan R, Kunasol P, Laorakpongse T, Poopatanakool W, Kozik CA et al. Protection against hepatitis A by an inactivated vaccine. JAMA 1994;271:1328-34. 84. Pérez OM, Herzog C, Zellmeyer M, Loaisiga A, Frosner G, Egger M. Efficacy of virosome hepatitis A vaccine in young children in Nicaragua: randomized placebo controled trial. J Infect Dis 2003;188:671-7. 85. Domínguez A, Oviedo M, Carmona G, Batalla J, Bruguera M, Salleras L et al. Impact and effectiveness of a mass vaccination programme of preadolescents seven years after introduction. JAMA 2001;286:2968-73. 86. Van Damme P, Van Merck KV. Effect of hepatitis A vaccination programs. JAMA 2005;294:246-8. 87. Rodríguez C, Basile L, Urbiztondo L, Borrás E, Batalla J. Vacunación antihepatitis A ¿Selectiva o universal? Vacunas 2009;10:4-8. 88. Domínguez A, Salleras L, Carmona G, Batalla J. Effectiveness of a mass hepatitis A vaccination program in preadolescents. Vaccine 2003;21:698-701. 89. Samandari T, Bell BP, Armstrong GL. Quantifying the impact of hepatitis A immunization in the United States, 1995-2001. Vaccine 2004;22:4342-50. 90. Wasley A, Samandari T, Bell BP. Incidence of hepatitis A in the United States in the era of vaccination. JAMA 2005;294:194-201. 91. Vogt TM, Wise ME, Bell BP, Finelli L. Declining hepatitis A mortality in the United States during the era of hepatitis A vaccination. J Infect Dis 2008;197:1282-8. 92. Dienstag JL. Hepatitis A: the vaccine dividend. J Infect Dis 2008;197:1220-2. 93. Averhoff F, Shapiro CN, Bell BP, Hyams I, Burd L, Deladisma A et al. Control of hepatitis A through routine vaccination of children. JAMA 2001; 286:2968-73. 94. CDC. Prevention of hepatitis A through active or passive immunization: recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR 2006;55(No. RR-7):1-23. 95. Lieberman JM, Word BM, Jacobs RJ, Dagan R, Marchant CD. Universal hepatitis A vaccination in the United States: a call for action. Ped Infect Dis J 2008;27:287-91. 96. Dagan R, Leventhal A, Anis E, Slater P, Ashur Y, Shouval D. Incidence of hepatitis A in Israel following universal immunization of toddlers. JAMA 2005;294:202-10. 97. Chodick G, Heymann AD, Ashkenazi S, Kokia E, Shalev V. Longterm trends in hepatitis A incidence following the inclusion of Hepatitis A vaccine in the routine nationwide immunization program. J Viral Hepat 2008;15(supl. 2):62-5. 98. MacIntyre CR, Burgess MA, Hull B, McIntyre PB. Hepatitis A vaccination options for Australia. J Paediatr Child Health 2003;39:83-7. 99. Lopalco PL, Prato R, Chironna M, Germinario C, Quarto M. Control of hepatitis a by universal vaccination of adolescents, puglia, Italy. Emerg Infect Dis 2008;14:526-8. 100. Salleras L, Domínguez A. Vacuna frente a la hepatitis A en la adolescencia y la edad adulta joven. Vacunas 2006;7(supl.1):37-43. 101. Salleras L. Vacunación universal frente a la hepatitis A. Vacunas 2009;10:1-3. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 76-86 CAPITULO 23 03/05/10 13:58 Página 85 Medicina 102. Navas E, Salleras L, Gisbert R, Domínguez A, Bruguera M, Rodríguez G et al. Efficiency of the incorporation of the hepatitis A vaccine as a combined A+B vaccine to the hepatitis B vaccination programme of preadolescents in schools. Vaccine 2005;23:2185-9. 103. Belmaker I, Dukhan L, Yosef Y, Leventhal A, Dagan R. Elimination of hepatitis a infection outbreaks in day care and school settings in southern Israel after introduction of the national universal toddler hepatitis a immunization program. Pediatr Infect Dis J 2007;26:36-40. 104. Van Damme P, Banatvala J, Fay O, Iwarson S, McMahon B, Van Herck T et al. International Consensus Group of Hepatitis A Virus Immunity. Hepatitis A booster vaccination: is there a need? Lancet 2003;362:1065-71. 105. Moraga F, Campins M. Vacuna de la varicela. Una inmunización del niño y del adutlo. Enfer Infec Microbiol Clin 2000;18:516-8. 106. Salleras L, Salleras M, Domínguez A, Prat A, Navas E. Varicela en el adolescente y adulto: carga de la enfermedad y estrategias de prevención mediante la vacunación. Vacunas 2005;3:92-100. 107. Salleras L, Salleras M, Prat A, Garrido P, Domínguez A. Vacuna frente al virus de la varicela zoster. Enferm Infecc Microbiol Clin 2007;25 (supl. 1):29-47. 108. Guide for Adult Immunization. Third edition. Philadelphia: American College of Physicians,1994. 109. De Juanes JR, Gil A, Sanmartín M, González A, Esteban J, García de Cades A. Seroprevalence of varicella antibodies in healthcare workers and health sciences students. Reliability of self-reported history of varicella. Vaccine 2005;23:1434-6. 110. Salleras L, Dominguez A, Vidal J, Plans P, Salleras M, Taberner JL. Seroepidemiology of Varicella-zoster virus infection in Catalonia (Spain). Rationale for universal vaccination programmes. Vaccine 2001;19:183-8. 111. Seward J, Galil K, Wharton M. Epidemiology of varicella. In: Arvin AM, Gershon AA editors. Varicella-zoster virus. Cambridge University Press 2000; p. 206-19. 112. Gil A, Gonzalez A, Oyaguez I, San-Martín M, Carrasco P. The burden of severe varicella in Spain, 1995-2000 period. Eur J Epidemiol 2004;19:699-702. 113. Gil A, San-Martin M, Carrasco P, Gonzalez A. Epidemiology of severe varicella-zoster virus infection in Spain. Vaccine 2004;22:3947-51. 114. Varis T, Vesikari T. Efficacy of High-Titer Attenuated Varicella Vaccine in Healthy Young Children. J Infect Dis 1996;174 (Supl. 3):330-4. 115. Weibel RE, Neff BJ, Kuter BJ, Guess HA, Rothenberger CA, Fitsgerald AJ et al. Live attenuated varicella vaccine: efficacy trial in healthy children. N Engl J Med 1984;310:1409-15. 116. Galil K, Fair E, Mountcastle N, Britz P, Seward J. Yonger age at vaccination may increase risk of varicella vaccine failure. J Infect Dis 2002;186:102-5. 117. TugweLL BD, Lee LE, Lorber K, Gillette H, Lorber EM, Hedberg K et al. Chickenpox outbreak in a highly vaccinated school population. Pediatrics 2004;113:455-9. 118. Izurieta HS, Strebel PM, Blake PA. Postlicensure effectiveness of varicella vaccine during an outbreak in a child care center. JAMA 1997;278:1495-9. 119. Clements DA, Moreira SP, Coplan PM, Bland CL, Walter EB. Postlicensure study of varicella vaccine effectiveness in a day care setting. Pediatric Infect Dis J 1999;18:1047-50. 120. Watson B, Seward J, Yang A, Witte P, Lutz J, Chan C et al. Postexposure effectiveness of varicella vaccine. Pediatrics 2000;105:84-8. 121. Vazquez M, La Russa PS, Gershon AA, Steinberg SP, Freudingman K, Shapiro ED. The effectiveness of the varicella vaccine in clinical practice. N Egl J Med 2001;344:955-60. 122. Passwell JH, Hemo B, Levi Y, Ramon R, Friedman N, LernerGeva L. Use of a computerized database to study the effectiveness of an attenuated varicella vaccine. Pediatr Infect Dis J 2004;23:221-6. 123. Sheffer R, Segal D, Rahamani S, Dalal I, Linhart Y, Stein M et al. Effectiveness of the Oka/GSK attenuated varicella vaccine for the prevention of chickenpox in clinical practice in Israel. Pediatr Infect Dis J 2005;24:434-7. 124. Salleras L, Sanchez F, Prats G, Garau X. Vacuna antineumocócica 23-valente. En: Salleras L, editor. Vacunaciones preventivas. 2ª ed. Masson, Barcelona 2003; p. 363-98. 125. Domínguez A, Salleras L, Fedson D, Izquierdo C, Ruiz L, Ciruela P et al. Effectiveness of pneumococcal vaccination for elderly people in Catalonia. A case control study. Clin Infect Dis 2005;40:1250-7. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010 Preventiva 126. Domínguez A et al. Effectiveness of 23-valent pneumococcal vaccine in the prevention of all-causes pneumonia. A case control study. JAMA 2009 (en prensa). 127. Centers for Disease Control and Prevention. Prevention of pneumococcal disease: Recommendations of the Advisory Committee on Immunizations Practices (ACIP). MMWR 1997;46 (RR-8):1-24. 128. The US Preventive Task Force. Guide to clinical preventive services. Second edition. Baltimore, Williams and Wilkins, 1996. 129. Canadian Task Force on the Periodic health Examination. The Canadian guide to clinical preventive health care. Otawa, Canada, Communication Group Publishing, 1994; 386-95. 130. Salleras L, Domínguez A. Vacuna antisarampión. En: Salleras L, editor. Vacunaciones Preventivas. Principios y Aplicaciones. 2ª ed. Barcelona: Masson, 2003; p. 217-43. 131. Salleras L, Vidal J, Asensi F, Gentile A. Vacuna antirrubeola. En: Salleras L, editor. Vacunaciones Preventivas. Principios y aplicaciones. 2ª ed. Barcelona: Masson, 2003; p. 245-63. 132. Amela C, Pachón I. Estudio seroepidemiológico y situación de las enfermedades vacunables en España. Madrid: Ministerio de Sanidad y Consumo, 2000. 133. Lowy DR, Howley PH. Papillomaviruses. In: Knipe DM, Howley PH, editors. Fields Virology. Philadelphia: Lippincott, William & Wilkins, 2001; p. 2231- 64. 134. Castellsagué X, Bosch FX. Vacunas frente al virus del papiloma humano. Enferm Infecc Microbiol Clin 2007;25(supl. 5):65-77. 135. Dunne EF, Markowitz LE. Genital human pa pillomavirus infection. Clin Infect Dis 2006;43:624-9. 136. Lowy DR, Schiller JT. Prophylactic human papillomavirus vaccines. J Clin Invest 2006;116:1167-73. 137. Schiffman M, Castle PE, Jeronimo J, Rodriguez AC, Wacholder S. Human papillomavirus and cervical cancer. Lancet 2007;370:890-907. 138. Cates W Jr. Estimates of the incidence and prevalence of sexually transmitted diseases in the United States. American Social Health Association Panel. Sex Transm Dis 1999;26(supl. 4):2-7. 139. Baseman JG, Koutsky LA. The epidemiology of human papillomavirus infections. J Clin Virol 2005;32(supl. 1):16-24. 140. Muñoz N, Bosch FX, de Sanjosé S, Herrero R, Castellsagué X, Shah KV et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518-27. 141. Shew ML, Fortenberry JD. HPV infection in adolescents: natural history, complications, and indicators for viral typing. Semin Pediatr Infect Dis 2005;16:168-74. 142. Ault KA. Epidemiology and Natural History of Human Papillomavirus Infections in the Female Genital Tract. Infect Dis Obstet Gynecol 2006;2006:40470. 143. Kjaer SK, Tran TN, Sparen P, Tryggvadottir L, Munk C, Dasbach E et al. The burden of genital warts: A study of nearly 70,000 women from the general female population in the 4 nordic countries. J Infect Dis 2007:196:1447-54. 144. Daward M, Deeks S, Dobson S. Human papillomavirus vaccines launch a new era in cervical cancer prevention. CMAJ 2007;177:456-61. 145. Harper DM, Franco EL, Wheeler CM, Ferris DG, Jenkins D, Schuind A et al. Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with human papillomavirus types 16 and 18 in young women: a randomized controlled trial. Lancet 2004;364:1757-65. 146. Villa LL, Costa RL, Petta CA, Andrade RP, Ault KA, Giuliano AR et al. Prophylactic quadrivalent human papillomavirus (types 6, 11, 16, and 18) L1 virus-like particle vaccine in young women: a randomised double-blind placebo-controlled multicentre phase II efficacy trial. Lancet Oncol 2005;6:271-8. 147. Paavonen J, Jenkins D, Bosch FX, Naud P, Salmeron J, Wheeler CM et al. Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human papillomavirus types 16 and 18 in young women: an interim analysis of a phase III double-blind, randomised controlled trial. Lancet 2007;369:2161-70. 148. Garland SM, Hernandez-Avila M, Wheeler CM, Perez G, Harper DM, Leodolter S et al. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases. N Engl J Med 2007;356:1928-43. 149. Joura EA, Leodolter S, Hernandez-Avila M, Wheeler CM, Perez G, Koutsky LA et al. Efficacy of a quadrivalent prophylactic human papillomavirus (types 6, 11, 16, and 18) L1 virus-like-particle vaccine against highgrade vulval and vaginal lesions: a combined analysis of three randomised clinical trials. Lancet 2007;369:1693-702. 85 76-86 CAPITULO 23 03/05/10 13:58 Página 86 Medicina Preventiva 150. CDC. Quadrivalent human papillomarivus vaccine. Recommendations of the Advisory Committee on Immunization Practices. MMWR 2007;56 (RR02);1-24. 151. Halsey NA. The human papillomavirus vaccine and risk of anaphylaxis. CMAJ 2008;179:509-10. 152. MacDonald N, Stanbrook MB, Hebert PC. Human papillomavirus vaccine risk and reality. CMAJ 2008;179:503. 153. Kang LW, Crawford N, Tang ML, Buttery J, Royle J, Gold M et al. Hypersensitivity reactions to human papillomavirus vaccine in Australian schoolgirls: retrospective cohort study. BMJ 2008;337:a2642. doi: 10.1136/bmj.a2642. 154. Brotherton JM, Gold MS, Kemp AS, McIntyre PB, Burgess MA, Campbell-Lloyd S. New South Wales Health HPV Adverse Events Panel. Anaphylaxis following quadrivalent human papillomavirus vaccination. CMAJ 2008;179:525-33. 155. Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Nota informativa 23 de abril de 2009 sobre los episodios de Valencia y Baleares ocurridos tras la administración de la vacuna frente al papilomavirus humano. http://www.msc.es/gabinetePrensa/notaPrensa/desarrolloNotaPrensa.jsp?id=1466 156. Harper DM, Franco EL, Wheeler CM, Moscicki AB, Romanowski B, Roteli-Martins CM et al. Sustained efficacy up to 4.5 years of a bivalent L1 virus-like particle vaccine against human papillomavirus types 16 and 18: follow-up from a randomised control trial. Lancet 2006;367:1247-55. 157. Villa LL, Ault KA, Giuliano AR, Costa RL, Petta CA, Andrade RP et al. Immunologic responses following administration of a vaccine targeting human papillomavirus Types 6, 11, 16, and 18. Vaccine 2006;24:5571-83. 158. Block SL, Nolan T, Sattler C, Barr E, Giacoletti KE, Marchant CD et al. Comparisson of the inmunogenicity and reactogenicity of a prophylactic quadrvalent human papillomavirus ( types 6,11,16, and 18) L1 virus -likeparticles vaccine in male and female adolescents and young adult women. Pediatrics 2008;118:2135-45. 159. Olsson SE, Villa LL, Costa RL, Petta CA, Andrade RP, Malm C et al. Induction of immune memory following administration of a prophylactic quadrivalent human papillomavirus (HPV) types 6/11/16/18 L1 virus-like particle (VLP) vaccine. Vaccine 2007;25:4931-9. 160. Giannini S L, Hanon E, Moris P, Van Mechelen M, Morel S, Dessy F et al. Enhanced humoral and memory B cellular immunity using VPH 16/18 L1 VLP vaccine formulated with the MPL/aluminium salt combination (AS04) compared with aluminium salt only. Vaccine 2006;24:5937-49. 161. The future II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med 2007;356:1915-27. 162. Ault KA. Effect of prophylactic human papillomavirus L1 virus-likeparticle vaccine on risk of cervical intraepithetial neoplasia grade 2, grade 3, and adenocarcinoma in situ: a combined analysis of four randomised clinical trials. Lancet 2007;369:1861-8. 86 163. Rambout L, Hopkins L, Hutton B, Fergusson D. Prophylactic vaccination against human papillomavirus infection and disease in women: a systematic review of randomized controlled trials. CMAJ 2007;177:469-79. 164. La Torre G, de Waure C, Chiaradia G, Mannocci A, Ricciardi W. HPV vaccine efficacy in preventing persistent cervical HPV infection: A systematic review and meta-analysis. Vaccine 2007;25:8352-8. 165. Bosch FX, Castellsague X, de Sanjose S. HPV and cervical cancer: Screening or vaccination? Br J Cancer 2008;98:15-21. 166. Gall SA ,Teixeria J, Wheeler CM et al. Substancial impact on precancerous lesions and HPV infections throug 5.5 years in women vaccinated with the HPV-16-18 L1 ASO4 candidate vaccine. American Assotiation for Cancer Research Annual Meeting, Los Angeles Ca 2007, (Abstract 4900). 167. Villa LL, Costa RL, Petta CA, Andrade RA, Paavonen J, Iversen O-E et al. High sustained efficacy of a proplylactic quadrivalent human papillomavirus types 6/ 11/ 16/18 L1 virus like particule vaccine throug five years of follow-up. Br J Cancer 2006;951459-66. 168. Herrero R. Human papillomavirus (HPV) vaccines: limited crossprotection against additional HPV types. J Infect Dis 2009;199:919-22. 169. Brown DR, Kjaer SK, Sigurdsson K, Iversen OE, HernandezAvila M, Wheeler CM et al. The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in generally HPV-naive women aged 16-26 years. J Infect Dis 2009;199:926-35. 170. Wheeler CM, Kjaer SK, Sigurdsson K, Iversen OE, HernandezAvila M, Perez G et al. The impact of quadrivalent human papillomavirus (HPV; types 6, 11, 16, and 18) L1 virus-like particle vaccine on infection and disease due to oncogenic nonvaccine HPV types in sexually active women aged 16-26 years. J Infect Dis 2009;199:936-44. 171. Schwarz TF. AS04-adjuvanted human papillomavirus-16/18 vaccination: recent advances in cervical cancer prevention. Expert Rev Vaccines 2008;7:1465-73. 172. Jenkins D. A review of cross-protection against oncogenic HPV by an HPV-16/18 AS04-adjuvanted cervical cancer vaccine: importance of virological and clinical endpoints and implications for mass vaccination in cervical cancer prevention. Gynecol Oncol 2008;110(3 Suppl 1):S18-25. 173. Kulasingam SL, Myers ER. Potential health and economic impact of adding a human papillomavirus vaccine to screening programs. JAMA 2003;290:781-9. 174. Taira AV, Neukermans CP, Sanders GD. Evaluating human papillomavirus vaccination programs. Emerg Infect Dis 2004;10:1915-23. 175. Sanders GD, Taira AV. Cost-effectiveness of a potential vaccine for human papillomavirus. Emerg Infect Dis 2003;9:37-48. 176. Goldie SJ, Kohli M, Grima D, Weinstein MC, Wright TC, Bosch FX et al. Projected clinical benefits and cost-effectiveness of a human papi llomavirus 16/18 vaccine. J Natl Cancer Inst 2004;96:604-15. 177. Langeron N, Remy V, Oyee J, San-Martín M, Cortés J, Olmos L. Análisis de coste-efectividad de la vacunación frente al virus del papiloma humano tipos 6, 11, 16 y 18 en España. Vacunas 2008;9:3-11. Medicina Preventiva Vol. XVI, N.º 1, 1er Trimestre, 2010