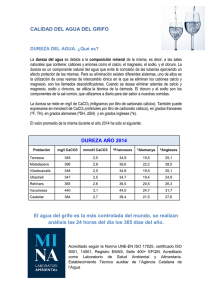
UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL Química del agua: parámetros Químicos Charris Pabon Leider, Crespo Pablo, Gutiérrez Andrés, Torres Abraham Laboratorio de química ambiental, Grupo AD, Programa de Ingeniería Ambiental, Universidad de la costa CUC agutierr18@cuc.edu.coatorres41@cuc,edu.co,Lcharris13@cuc.edu.co, pcrespo3@cuc.edo.co, Nombre del docente: Erika Blanco Donado 28/03/2019 RESUMEN En este informe se presentan los resultados de la práctica de parámetros químicos del agua, la cual se analizaron la acidez, la alcalinidad, la dureza total, cálcica y magnésica, usando para ellos diversos reactivos, para esta práctica se toman los datos de cada parámetro y así poder determinar si existen posibles alteraciones o efectos de procesos industriales o en las fuentes de captación. La alcalinidad tiene un valor de 300mg/l CaCO3,la cual para aguas potables tiene un rango alto, lo que supera el rango >200; la acidez obtuvo 136 mg/l CaCO3, valor muy alto para aguas naturales, la dureza total obtenida en la práctica fue de 740 mg/l CaCO3; la dureza cálcica obtiene el 220 mg/l CaCO3 y la dureza magnésica el 520 mg/l CaCO3 ; la dureza obtenida se considera alta daba basado en la resolución 2115 con el valor máximo permitible de 300 mg/l CaCO3; con los resultados obtenidos se puede dice que el agua no es de consumo ya que su PH es un poco mayor que el básico, la alcalinidad , la dureza y la acidez se consideran altos. Palabras claves: acidez, alcalinidad, dureza total, reactivos ABSTRACT In this report the results of the practice of chemical parameters of water are presented, which analyzed the acidity, alkalinity, total hardness, calcium and magnesium, using various reagents for them, for this practice the data of each parameter is taken and thus be able to determine if there are possible alterations or effects of industrial processes or sources of catchment. The alkalinity has a value of 300mg / l CaCO3, which for drinking water has a high range, which exceeds the range> 200; the acidity obtained 136 mg / l CaCO3, very high value for natural waters, the total hardness obtained in practice was 740 mg / l CaCO3; the calcium hardness obtains the 220 mg / l CaCO3 and the magnesium hardness the 520 mg / l CaCO3; the hardness obtained is considered high given based on resolution 2115 with the maximum allowable value of 300 mg / l CaCO3; with the obtained results it can be said that the water is not of consumption since its PH is a little bigger than the basic, the alkalinity, the hardness and the acidity are considered high. Keywords: acidity, alkalinity, total hardness, reactive 1 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL I. INTRODUCCIÓN Lo parámetros químicos del agua experimentados en magnésica, que es aquella que requiere mucho jabón el laboratorio conciernen al pH, acidez, alcalinidad, para dureza total y dureza cálcica, su aplicación la incrustaciones cuando se eleva la temperatura de una asociamos a nuestra carrera como futuros ingenieros muestra de agua, identificando la validez de los datos. ejercer su acción limpiadora, formando ambientales permitiendo valorar de forma rápida el II. comportamiento de las unidades de tratamiento junto con los parámetros físicos, pero también permite METODOLOGIA MATERIALES E INSUMOS Ácido clorhídrico Fenolftaleína verde de bromocresol Hidróxido de sodio al 0,02N EDTA 0,01 M Murexida Negro de eriocromo T Filtro Bureta 50ml o 25ml Gotero Espátula Erlenmeyer Muestra de agua determinar posibles alteraciones en otros procesos industriales, así como la incidencia que ejercen sobre las líneas de distribución y las unidades de tratamiento.[1] El agua es un recurso natural escaso, indispensable para la vida humana y el sostenimiento del medio ambiente, que, como consecuencia del rápido desarrollo humano y económico y del uso inadecuado que se ha hecho de ella como medio de eliminación, Procedimiento de Acidez Se midió 25ml de la muestra y se pasó a un Erlenmeyer, se agregó 3 gotas de Fenolftaleína, se agregó en una bureta el titulante y se empezó a titular hasta visualizar el cambio de color. Ph final=7,35 Titulante gastado=3,4ml ha sufrido un alarmante deterioro.1 Durante décadas, toneladas de sustancias biológicamente activas, sintetizadas para su uso en la agricultura, la industria, la medicina, etc., han sido vertidas al medio ambiente sin reparar en las posibles consecuencias.[2] En la práctica se pretende determinar los procesos de Procedimiento de Alcalinidad los parámetros químicos del agua, aplicando cada uno Se midió 25ml de la muestra y se pasó a un Erlenmeyer, se agregó 3 gotas de verde bromocresol, se agregó en una bureta el titulante y se empezó a titular hasta visualizar el cambio de color verdeamarillo. Ph final=3.06 Titulante gastado=7,5ml de los métodos de análisis, donde la acidez, para ver cuál es la capacidad de donar protones de una muestra de agua; la alcalinidad, que sirve para neutralizar los iones de H+; Y dureza total, dureza cálcica y dureza 2 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL ACIDEZ La acidez de un agua es su capacidad cuantitativa para reaccionar con una base fuerte hasta un pH designado. Por tanto, su valor puede variar significativamente con el pH final utilizado en la valoración. Se puede deber a la presencia entre otros, de dióxido de carbono no combinado, de ácidos minerales o de sales de ácidos fuertes y bases débiles. En muchas aguas naturales, que se usan para propósitos potables, existe un equilibrio entre carbonato, bicarbonato y dióxido de carbono. Los contaminantes ácidos que entran a los abastecimientos de aguas en cantidad suficiente, pueden alterar el equilibrio carbonato - bicarbonato dióxido de carbono y se pueden estimar por titulación con un álcali valorado a los virajes de pH de 3.7 y 8.3.[3] Procedimiento de dureza total Se midió 25ml de la muestra y se pasó a un Erlenmeyer, se agregó 1ml del buffer más una pizca de negro de eriocromo T, en una bureta se agregó se el titulante (EDTA)y se empezó a titular hasta visualizar el cambio de color. Morado-azul. Ph final=3.06 Titulante gastado=37ml Procedimiento dureza cálcica Se midió 25ml de la muestra y se pasó a un Erlenmeyer, se agregó 1ml de NaoH mas una pizca de murexida, en una bureta se agregó se el titulante y se empezó a titular hasta visualizar el cambio de color. Morado-rosado Ph final=10,62 Titulante gastado=11ml ALCALINIDAD La alcalinidad de un agua es su capacidad para MARCO TEORICO Y ESTADO DEL ARTE De acuerdo al documento “Manual de métodos analíticos para la determinación de parámetros fisicoquímicos básicos en aguas- Carlos Severiche, Marlon Castillo, Rosa acevedo”, los parámetros que se llevan a cabo para la mejora de la calidad de las aguas son muchos y diferentes, pero en este documento se habla de aquellos parámetros químicos que hacen parte de este proceso. neutralizar ácidos y es la suma de todas las bases pH el hidróxido y la mitad del carbonato, mientras que el III. titulables. Por lo general se debe fundamentalmente a su contenido de carbonatos, bicarbonatos e hidróxidos, aunque otras sales o bases también contribuyen a la alcalinidad. Con el indicador de fenolftaleína, el pH 8.3 está próximo al punto de equivalencia para las concentraciones de carbonato y dióxido de carbono y representa la valoración de todo pH inferior (4-5) está próximo al punto de El pH es una medida de la concentración de iones hidrógeno, y se define como 𝑝𝐻 = −log[𝐻 + ]. equivalencia para el ión hidrógeno y el bicarbonato y permite determinar la alcalinidad total. [3] Es una medida de la naturaleza ácida o alcalina de la solución acuosa que puede afectar a los usos específicos del agua. La mayoría de aguas naturales tienen un pH entre 6 y 8. Su medición se realiza fácilmente con un pHmeter bien calibrado, aunque también se puede disponer de papeles especiales que, por coloración, indican el pH. En función del pH se pueden discriminar las especies: 4.5 < pH < 8.3 bicarbonatos 8.3 < pH < 11.0 bicarbonatos y carbonatos pH > 8.5 carbonatos pH > 10.0 hidróxidos y carbonatos. 3 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL DUREZA En la práctica se define la dureza total del agua como IV. la suma de las concentraciones de iones calcio y Cálculos de acidez 𝑚𝑔 𝐴𝑥𝑁𝑥50000 𝐴𝑐𝑖𝑑𝑒𝑧 ( 𝐶𝑎𝐶𝑂3 ) = 𝐿 𝑉 magnesio expresado como carbonato de calcio en mg/L. El método título métrico se basa en la capacidad que tiene la sal sódica del ácido etilendiaminotetraacético (EDTA) para formar ANÁLISIS, CALCULO Y CUESTIONARIO 𝐴 = 𝑉𝑜𝑙. 𝑑𝑒𝑡𝑖𝑡𝑢𝑙𝑎𝑛𝑡𝑒 𝑁 = 𝑁𝑜𝑟𝑚𝑎𝑙𝑖𝑑𝑎𝑑𝑑𝑒𝑙𝑎𝑠𝑙𝑛(0,02𝑁) 𝑉 = 𝑉𝑜𝑙. 𝑑𝑒𝑚𝑢𝑒𝑠𝑡𝑟𝑎(25𝑚𝑙) complejos de quelato solubles al añadirse a soluciones de algunos cationes metálicos. Al determinar la Dureza Total, el pH de la solución debe estar 𝐴𝑐𝑖𝑑𝑒𝑧 = 𝐴𝑥𝑁𝑥50000 𝑉 𝐴𝑐𝑖𝑑𝑒𝑧 = 3.4𝑚𝑙𝑥0.02𝑁𝑥50000 25𝑚𝑙 alrededor de 10, para lo cual se adiciona la solución tampón de dureza y como indicador el Negro de Eriocromo T, que causa una coloración rojo vino. La 𝐴𝑐𝑖𝑑𝑒𝑧 =136mg/l CaCO3 adición de EDTA como titulante acompleja los iones cálculos de alcalinidad calcio y magnesio y en el punto final de la titulación, la solución vira a color azul. [3] 𝑚𝑔 𝐴𝑥𝑁𝑥50000 𝐴𝑙𝑐𝑎𝑙𝑖𝑛𝑖𝑑𝑎𝑑 ( 𝐶𝑎𝐶𝑂3 ) = 𝐿 𝑉 Para la Dureza de Calcio se utiliza como alcalinizante 𝐴 = 𝑉𝑜𝑙. 𝑑𝑒𝑡𝑖𝑡𝑢𝑙𝑎𝑛𝑡𝑒 el hidróxido de sodio para llevar el pH a un alto nivel 𝑁 = 𝑁𝑜𝑟𝑚𝑎𝑙𝑖𝑑𝑎𝑑𝑑𝑒𝑙𝑎𝑠𝑙𝑛(0,02𝑁) con el fin de precipitar el magnesio y poder determinar 𝑉 = 𝑉𝑜𝑙. 𝑑𝑒𝑚𝑢𝑒𝑠𝑡𝑟𝑎(25𝑚𝑙) el calcio, utilizando Murexida como indicador, que forma con el EDTA un punto final de color violeta definido. 𝐴𝑥𝑁𝑥50000 𝑉 7.5𝑚𝑙𝑥0.02𝑁𝑥50000 𝐴𝑙𝑐𝑎𝑙𝑖𝑛𝑖𝑑𝑎𝑑 = 25𝑚𝑙 𝐴𝑙𝑐𝑎𝑙𝑖𝑛𝑖𝑑𝑎𝑑 = La Dureza de Magnesio se determina por diferencia entre la Dureza Total y la de Calcio. El Calcio y el Magnesio se determinan por cálculos provenientes de 𝐴𝑙𝑐𝑎𝑙𝑖𝑛𝑖𝑑𝑎𝑑 = 300 mg/l CaCO3 las Durezas de Calcio y Magnesio, respectivamente. [3] cálculos de dureza total 𝑚𝑔 𝐴𝑥𝑁𝑥50000 𝐷𝑢𝑟𝑒𝑧𝑎𝑡𝑜𝑡𝑎𝑙 ( 𝐶𝑎𝐶𝑂3 ) = 𝐿 𝑉 4 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL ¿Por qué es importante medir pH, alcalinidad, dureza y acidez en un cuerpo de agua? 𝐴 = 𝑉𝑜𝑙. 𝑑𝑒𝑡𝑖𝑡𝑢𝑙𝑎𝑛𝑡𝑒 𝑁 = 𝑁𝑜𝑟𝑚𝑎𝑙𝑖𝑑𝑎𝑑𝑑𝑒𝑙𝑎𝑠𝑙𝑛(0,02𝑁) La alcalinidad hace referencia a la capacidad de esta para neutralizar ácidos o su capacidad para reaccionar con iones de hidrogeno; por otra parte, la acidez del agua, hace referencia a su capacidad para neutralizar bases o reaccionar con iones hidroxilo. El pH es el coeficiente indicador del grado de acidez o basicidad de una solución acuosa a partir de la concentración de los iones de hidrógeno, el cual es medido mediante electrometría de electrodo selectivo (pH metro). El pH influye en algunos fenómenos que ocurren en el agua, como la corrosión. El grado de disociación de ácidos y bases es afectado por cambios de pH, debido a que la toxicidad de algunos compuestos varía con respecto a este. La alcalinidad es un parámetro que posee relación con el pH, ya que proporciona la acción buffer o amortiguadora de cambios de pH al agua y mide la capacidad de esta para neutralizar ácidos. La alcalinidad es importante determinarla para procesos de ablandamiento, coagulación y control de la corrosión; además es trascendental para cuerpos de agua dado que determina la capacidad para mantener procesos biológicos y productividad sostenida. La dureza es un parámetro químico usado en aguas naturales y potables para determinar la capacidad de precipitar jabones; este parámetro se encuentra relacionado con la alcalinidad y el pH. La dureza de aguas naturales es producida por sales de calcio y magnesio. Y es uno de los parámetros químicos más importantes a la hora de medir la calidad del agua. 𝑉 = 𝑉𝑜𝑙. 𝑑𝑒𝑚𝑢𝑒𝑠𝑡𝑟𝑎(25𝑚𝑙) 𝐴𝑥𝑁𝑥50000 𝑉 37𝑚𝑙𝑥0.01𝑥50000 𝐷𝑢𝑟𝑒𝑧𝑎𝑇𝑜𝑡𝑎𝑙 = 25𝑚𝑙 𝑑𝑢𝑟𝑒𝑧𝑎𝑡𝑜𝑡𝑎𝑙 = 𝐷𝑢𝑟𝑒𝑧𝑎𝑇𝑜𝑡𝑎𝑙 = 740 mg/l CaCO3 Cálculos de cálcica 𝑚𝑔 𝐴𝑥𝑁𝑥50000 𝐷𝑢𝑟𝑒𝑧𝑎𝑐𝑎𝑙𝑐𝑖𝑐𝑎 ( 𝐶𝑎𝐶𝑂3 ) = 𝐿 𝑉 𝐴 = 𝑉𝑜𝑙. 𝑑𝑒𝑡𝑖𝑡𝑢𝑙𝑎𝑛𝑡𝑒 𝑁 = 𝑁𝑜𝑟𝑚𝑎𝑙𝑖𝑑𝑎𝑑𝑑𝑒𝑙𝑎𝑠𝑙𝑛(0,02𝑁) 𝑉 = 𝑉𝑜𝑙. 𝑑𝑒𝑚𝑢𝑒𝑠𝑡𝑟𝑎(25𝑚𝑙) 𝐷𝑢𝑟𝑒𝑧𝑎𝐶𝑎𝑙𝑐𝑖𝑐𝑎 = 11𝑚𝑙𝑥0.01𝑀𝑥500000 25𝑚𝑙 𝐷𝑢𝑟𝑒𝑧𝑎𝐶𝑎𝑙𝑐𝑖𝑐𝑎 =220 mg/l CaCO3 cálculos de dureza magnésica 𝐷. 𝑚𝑎𝑔𝑛𝑒𝑠𝑖𝑐𝑎 = 𝑑𝑢𝑟𝑒𝑧𝑎𝑡𝑜𝑡𝑎𝑙 − 𝑑𝑢𝑟𝑒𝑧𝑎𝑐𝑎𝑙𝑐𝑖𝑐𝑎 𝐷. 𝑚𝑎𝑔𝑛𝑒𝑠𝑖𝑐𝑎 = 740 − 220 = 520 ¿Qué indica la dureza en un cuerpo de agua natural? La dureza es un parámetro químico usado en aguas naturales y potables para determinar la capacidad de precipitar jabones; este parámetro se encuentra relacionado con la alcalinidad y el pH. La dureza de aguas naturales es producida por sales de calcio y magnesio. La dureza del agua es uno de los parámetros químicos más importantes a la hora de calificar la calidad de un agua. Investigar cuales son las consecuencias en seres vivos, por elevados valores de cada parámetro. En las plantas un pH elevado puede causar clorosis, en los humanos causa enfermedades como vómitos, diarrea y en animales principalmente en los peces comienzan a mostrar lesiones en la piel y dificultades respiratorias 5 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL capaces de eliminar más de cinco miligramos por litro (5 mg/l) de hierro disuelto. Los ablandadores pueden operar de forma automática, semiautomática, o manual. Cada tipo tiene una ratio de actuación. Un ablandador de agua colecta los minerales que causan la dureza y los contiene en un tanque colector y este es de vez en cuando limpiado de su contenido. Intercambiadores iónicos son a menudo usados para ablandar el agua. Cuando un intercambiador iónico es aplicado para ablandar el agua, este reemplazará los iones de calcio y magnesio por otros iones, por ejemplo, sodio y potasio. Los intercambiadores iónicos son añadidos desde un tanque de intercambiadores de iones que contiene sales de sodio y potasio. (NaCl y KCl) Investigar la importancia del pH sobre cuerpos de agua y la influencia que tiene en otros parámetros. La calidad del agua y el pH son a menudo mencionados en la misma frase. El pH es un factor muy importante, porque determinados procesos químicos solamente pueden tener lugar a un determinado pH. Por ejemplo, las reacciones del cloro solo tienen lugar cuando el pH tiene un valor de entre 6,5 y 8. El pH influye en algunos fenómenos que ocurren en el agua, como la corrosión. El grado de disociación de ácidos y bases es afectado por cambios de pH, debido a que la toxicidad de algunos compuestos varía con respecto a este. ¿Qué es el ablandamiento del agua y como funciona un ablandador en el agua? ¿Qué es un agua incrustante y un agua corrosiva? Agua incrustante: agua que tiene en disolución un exceso de carbonato de cal por el ácido carbónico libre que también esta disuelto en ella; al desprenderse el gas del aire libre, el carbonato de cal se deposita en los objetos sumergidos en el agua. Agua con tendencia a formar incrustaciones calcáreas. Cuando el agua contiene una cantidad significante de calcio y magnesio, es llamada agua dura. El agua dura es conocida por taponar las tuberías y complicar la disolución de detergentes en agua. El ablandamiento del agua es una técnica que sirve para eliminar los iones que hacen a un agua ser dura, en la mayoría de los casos iones de calcio y magnesio. En algunos casos iones de hierro también causan dureza del agua. Iones de hierro pueden también ser eliminados durante el proceso de ablandamiento. El mejor camino para ablandar un agua es usar una unidad de ablandamiento de aguas y conectarla directamente con el suministro de agua. Los ablandadores de agua son específicos intercambiadores de iones que son diseñados para eliminar iones, los cuales están cargados positivamente. Los ablandadores mayormente eliminan los iones de calcio (Ca2+) y magnesio (Mg2). Calcio y magnesio son a menudo referidos como “minerales duros”. El agua depositará sobre las paredes de las tuberías o de los aparatos de producción de agua caliente sanitaria sedimentos duros y adherentes (calcita, aragonito y con mucha menor frecuencia vaterita). Agua incrustante: a partir de +0,5 a +1,5 Medida correctora: reducir pH o Alcalinidad Agua corrosiva: es "agresiva" por su naturaleza, y como se ha explicado, tiende a disolver el cemento y los metales con cierta rapidez, ocasionando problemas múltiples como roturas en intercambiadores de calor, agujeros en filtros de acero, disolución de las juntas del gresite, etc. V. CONCLUSIONES En conclusión, se puede decir que estos métodos son utilizados para determinar ciertas características que presenta el agua en condiciones no muy buenas; con Los ablandadores son algunas veces incluso aplicados para eliminar hierro, cuando el hierro causa la dureza del agua. Los mecanismos de ablandamiento son 6 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL 5. Pozo OJ, Guerrero C, Sancho JV, Ibáñez M, estos se puede atribuir el origen del agua; debido a información suministrada en el laboratorio de química ambiental, la muestra de agua la cual posee una alta carga inorgánica y orgánica, junto con la variación en la acidez, alcalinidad, dureza total, dureza cálcica, y dureza magnésica, lo que quiere decir que la calidad del agua no es la mejor y por lo cual no es apta para el consumo humano sin antes pasar por unos procesos de tratamientos de agua. Pitarch E, Hogendoorn E, Hernández F (2006) J. Chromatogr. A 1103, 83 6. Pozo OJ, Guerrero C, Sancho JV, Ibáñez M, Pitarch E, Hogendoorn E, Hernández F (2006) J. Chromatogr. A 1103, 83. 7. [4]Alonso MC, Pocurull E, Marcé RM, Borrull F, Barceló D (2002) Environ. Toxicol. Chem. 21, 2059. BIBLIOGRAFÍA 8. [5]Huerta-Fontela M, Galceran MT, Ventura F (2007) Anal. Chem. 79, 3821 1. Daughton CG (2001) J. Am. Soc. Mass Spectrom. 12, 1067. 2. Castells P, Santos FJ, Galceran MT (2004b) J. Chromatogr. A 1025, 157. 3. Carlos Severiche Sierra, Marlon castillo Bertel, Rosa Acevedo barrios, Manual de métodos analíticos para la determinación de parámetros fisicoquímicos básicos en aguas – Fundación Universitaria Andaluza Inca Garcilaso. Disponible en línea: http://www.eumed.net/librosgratis/2013a/13 26/1326.pdf 4. Samboni Ruiz, <revisión de parámetros fisicoquímicos como indicadores de calidad y contaminación del agua>, ingeniera e investigación; vol.27, núm. 3 (2007), 2010. Sacado de la pág.: http://www.bdigital.unal.edu.co/18917/#stha sh.nG46ZRnj.dpuf 7 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL ANEXOS fotografía 1 : resultado de la titulación, dureza total Fuente 1 : Autor fotografía 2: muestra sin titular dureza total Fuente 2 : Autor 8 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL fotografía 3: resultado de la titulación alcalinidad Fuente 3 : Autor Fotografía 4: Resultados de la titulación de dureza cálcica Fuente 4 : Autor 9 UNIVERSIDAD DE LA COSTA, CUC DEPARTAMENTO DE CIVIL Y AMBIENTAL PROGRAMA DE INGENIERÍA AMBIENTAL Fotografía 5: Libro consultado Fuente 5 : Autor 10