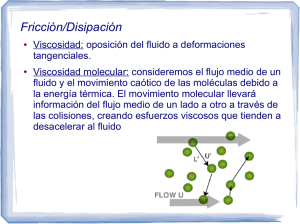
“Año del Bicentenario del Perú: 200 años de Independencia” Universidad Nacional del Callao Escuela Profesional de Ingeniería Química ESTIMACIÓN DEL DIAMETRO MOLECULAR Integrantes: Chapilliquen Rangel Yaritza Patricia Coral Mendoza Camilo Andre Docente: Mg. Albertina Diaz Gutierrez Miércoles, 22 de setiembre del 2021 ÍNDICE INTRODUCCIÓN 3 OBJETIVOS 3 FUNDAMENTO TEORICO 4 PROCEDIMIENTO EXPERIMENTAL 6 CALCULOS Y RESULTADOS 12 CONCLUSIONES 12 RECOMENDACIONES 12 BIBLIOGRAFÍA 12 2 INTRODUCCIÓN La teoría cinética puede considerarse como una rama de la termodinámica estadística ya que deduce propiedades macroscópicas de la materia a partir de propiedades moleculares. Los principios en los que se fundamenta son los siguientes: Un gas está formado por un gran número de partículas esféricas cuyo tamaño es despreciable comparado con la distancia entre las partículas. Las moléculas se mueven en línea recta a gran velocidad y sólo interaccionan cuando colisionan. Los choques entre partículas y con las paredes del recipiente se consideran perfectamente elásticos, conservándose la energía cinética traslacional. La teoría cinética supone que las partículas obedecen las leyes de Newton. Esta suposición es incorrecta (las moléculas cumplen las leyes de la mecánica cuántica) y conduce a resultados incorrectos en la predicción de las capacidades caloríficas del gas, aunque da resultados aceptables en propiedades como presión o difusión. 3 OBJETIVOS Ser capaz de estimar el diámetro molecular del gas empleado. Determinar de forma experimental la viscosidad del gas empleado (O2). Interpretar las teorías de los gases(cinética, viscosidad), propiedades de transporte, ecuación de POISEUILLE. FUNDAMENTO TEORICO VISCOSIDAD: Definida como la resistencia que una parte del fluido(liquido o gas) ofrece al desplazamiento de la otra. Puede pensarse que está causada por la fricción interna de las moléculas (Samuel H. Maron, 2001, p.66). Propiedad de un fluido que tiende a oponerse a su flujo cuando se le aplica una fuerza. Los fluidos de alta viscosidad presentan una cierta resistencia a fluir; los fluidos de baja viscosidad fluyen con facilidad. La fuerza con la que una capa de fluido en movimiento arrastra consigo a las capas adyacentes de fluido determina su viscosidad, que se mide con un recipiente (viscosímetro) que tiene un orificio de tamaño conocido en el fondo. La velocidad con la que el fluido sale por el orificio es una medida de su viscosidad. TEMPERATURA Y VISCOSIDAD: Los efectos de la temperatura en la viscosidad de los fluidos en un gas: si la temperatura aumenta, el intercambio molecular aumentará(porque las moléculas se mueven mas rápido en temperaturas mas altas). Por lo tanto la viscosidad de un gas aumentara con la temperatura. De acuerdo con la teoría quinética 4 de los gases, la viscosidad debe ser proporcional a la raíz cuadrada de la temperatura total. En un liquido: habrá intercambio molecular similar a esos desarrollados en un gas, pero hay un atractivo sustancial adicional, las fuerzas cohesivas entre las moléculas de un liquido (las cuales están mucho mas juntas que en un gas). Tanto, intercambio molecular y cohesión, contribuyen a la viscosidad de los líquidos, el efecto formador tiende a causar una disminución en el esfuerzo cortante, mientras que el ultimo causa que él aumente. El resultado principal es que los líquidos muestran una reducción en la viscosidad mientras se incrementa la temperatura. TIPOS DE MOVIMIENTO DE UN FLUIDO: Los líquidos y los gases tienen la capacidad de fluir debido a la movilidad de las partículas que los constituyen, por esta razón se llaman fluidos. Se llama flujo laminar al tipo de movimiento de un fluido cuando éste es perfectamente ordenado, estratificado, suave, de manera que el fluido se mueve en láminas paralelas sin entremezclarse. Las capas adyacentes del fluido se deslizan suavemente entre sí. El mecanismo de transporte es exclusivamente molecular. Se dice que este flujo es aerodinámico. Ocurre a velocidades relativamente bajas o viscosidades altas como veremos. Se llama flujo turbulento cuando se hace más irregular, caótico e impredecible, las partículas se mueven desordenadamente y las trayectorias de las partículas se encuentran formando pequeños remolinos aperiódicos. Aparece a velocidades altas o cuando aparecen obstáculos abruptos en el movimiento del fluido. ESTIMACIÓN DEL DIAMETRO MOLECULAR El diámetro molecular se estima también mediante un procedimiento comparativo. Para ello se considera la relación entre los tiempos necesarios para que un volumen dado de dos gases escape a través de un tubo capilar. Esta relación se obtiene a partir 5 de la fórmula de Poiseuille, que proporciona el volumen de un fluido que pasa a través de un tubo capilar, de radio R y longitud L, durante un tiempo t, bajo la acción de una diferencia de presión. Para calcular el diámetro molecular de un gas, se utilizará tres ecuaciones de la teoría cinética molecular: Ec. Viscosidad de gases sometidos a un flujo laminar: 1 𝜂 = 𝑚𝜆𝑁𝑣̅ 3 Ec. Camino libre medio de un conjunto de moléculas que tienen una distribución de maxwell de velocidades moleculares: 𝜆= 1 √2𝜋𝑑 2 𝑁 Ec. De la velocidad media de moléculas que tienen una distribución de maxwell de velocidades moleculares. 𝑣̅ = √ 8𝐾𝑇 𝜋𝑚 Agrupando las tres ecuaciones mencionadas y reemplazando convenientemente, obtenemos el diámetro molecular: 𝑑2 = 2 𝐾𝑇𝑚 √ 3𝜂 𝜋 3 η: constante de proporcionalidad, es la viscosidad correspondiente del flfluido K: Constante de Boltzmann 1.381 x 10-23 JK-1 T: la temperatura en que se encuentra el gas m: masa de una molécula gaseos 6 PROCEDIMIENTO EXPERIMENTAL 7 CALCULOS Y RESULTADOS Datos del Gas Oxígeno: Viscosidad teórica del oxígeno: 𝟐. 𝟎𝟐𝟕𝟕 × 𝟏𝟎−𝟓 𝑷𝒂. 𝒔 Longitud del capilar: 𝟓𝟎 𝒄𝒎 Radio del capilar: 𝟎. 𝟓 𝒎𝒎 = 𝟎. 𝟎𝟓 𝒄𝒎 Diámetro molecular teórico del Oxígeno: 𝟑. 𝟒𝟔𝟕 × 𝟏𝟎−𝟏𝟎 𝒎 Datos tomados del experimento: 𝑃1 = 758 𝑚𝑚𝐻𝑔 = 101058.1 𝑃𝑎 𝑃2 = 725 𝑚𝑚𝐻𝑔 = 96658.7 𝑃𝑎 𝑉 = 90 𝑚𝑙 = 90 𝑐𝑚3 𝑡 = 13.86 𝑠 𝜋. 𝑟 4 . (𝑃1 2 − 𝑃2 2 ). 𝑡 𝜂= 16. 𝑙. 𝑉. 𝑃1 𝜋 × (0.05𝑐𝑚)4 × ((101058.1𝑃𝑎)2 − (96658.7𝑃𝑎)2 ) × 13.86𝑠 𝜂= 16 × 50𝑐𝑚 × 90𝑐𝑚3 × 101058.1𝑃𝑎 𝜼 = 3.25 × 10−5 𝑃𝑎. 𝑠 8 Hallamos la mása de 1 mol de oxígeno: 𝑚= 𝑚= 𝑃𝑀 𝑁𝑎 32 𝑔 × 1𝑚𝑜𝑙é𝑐𝑢𝑙𝑎 𝑂2 6.023 × 1023 𝑚𝑜𝑙é𝑐𝑢𝑙𝑎𝑠 𝑚 = 5.313 × 10 −23 10−3 𝐾𝑔 𝑔× = 5.313 × 10−26 𝐾𝑔 1𝑔 Hallando el diámetro molecular: 𝑑2 = 𝑑2 = 𝑑2 = 2 𝐾𝑇𝑚 √ 3𝜂 𝜋 3 2 1.381 × 10−23 𝐽. 𝐾 −1 × 298𝐾 × 5.313 × 10−26 𝐾𝑔 √ 3 × 3.25 × 10−5 𝑃𝑎. 𝑠 𝜋3 2. 𝑚. 𝑠 1.381 × 10−23 𝑘𝑔. 𝑚². 𝐾 −1 × 298𝐾 × 5.313 × 10−26 𝐾𝑔 √ 3 × 3.25 × 10−5 𝑘𝑔 𝜋 3 . 𝑠² 𝑑 = 2.334 × 10−10 𝑚 Ahora que determinamos el diámetro molecular del Oxígeno, podemos hallar la discrepancia porcentual con respecto al valor teórico, para saber que tan precisas fueron las medidas tomadas en el experimento: 3.467 × 10−10 𝑚 − 2.334 × 10−10 𝑚 𝑒% = = 32.7% 3.467 × 10−10 𝑚 Podemos inferir que al tener una discrepancia muy grande, nuestros resultados no fueron los más óptimos, debido a que las mediciones no fueron precisas. 9 CONCLUSIONES Los gases presentan un moviemiento molecular desordenado, donde algunas moléculas que se mueven más rápido chocan con las moléculas que se mueven más despacio y les comunican un momento lineal extra, de esta forma aumenta la velocidad de la capa más lenta y visceversa. La velocidad del flujo v es cero en las paredes (la condición de no deslizamiento) y aumenta hacia el centro del capilar. La grandiente de presión es negativa (la presión P1 en el extremo izquierdo es mayor que la presión P2 en el extremo derecho; la presión desciende continuamente a lo largo del tubo). Para el flujo de un gas a presiones muy bajas, el recorrido medio es largo. La viscosidad de un gas aumenta al aumentar la termperatura y es independiente de la presión. RECOMENDACIONES BIBLIOGRAFÍA https://www.ugr.es/~jtorres/t7.pdf 10