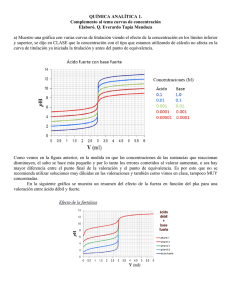
Universidad del Valle de México Coyoacán Selección y valoración del punto final. La naturaleza de las sustancias es uno de los temas más estudiados por la química, ya que de acuerdo a ésta, los tipos de reacciones se determinan de acuerdo a la forma en que se presentan los reactivos en un proceso. La titulación es un método para determinar la cantidad de una sustancia presente en solución. Una solución de concentración conocida, llamada solución valorada, se agrega con una bureta a la solución que se analiza. En el caso ideal, la adición se detiene cuando se agrega la cantidad de reactivo determinada y especificada por la siguiente ecuación. NA VA = NB VB En términos generales la reacción entre cantidades equivalentes de ácidos y bases se llama neutralización o reacción de neutralización, la característica de una reacción de neutralización es siempre la combinación de hidrogeniones que proceden del ácido, con hidroxiliones procedentes de la base para dar moléculas de agua sin disociar, con liberación de energía calorífica como calor de neutralización y formación de una sal, generalmente de acuerdo a la expresión general siguiente: Ácido + Base →Sal + Agua Un caso particular de reacción ácido - base, es la siguiente. HNO3(ac)+ NaOH(ac)→ NaNO3(ac)+ H2O(l) Así pues, la titulación es un proceso en el cual la solución estándar (del patrón primario) se combina con una solución de concentración desconocida para determinar dicha concentración, la curva de titulación es la gráfica que indica cómo el pH de la solución cambia durante el transcurso de la misma . Para realizar un esbozo de las principales técnicas electroanalíticas, es preciso tener en cuenta las propiedades que se están midiendo. Por ello, los métodos básicos que deben listarse son: las técnicas voltamétricas, la conductrimetría, la electrogravimetría y la culombimetría. Estas dos últimas opciones, además, son conocidas como técnicas crono, justamente porque tienen la capacidad de medir la magnitud electroquímica en función directa con el tiempo. En general, es importante destacar que todas estas técnicas tienen en común su gran selectividad, así como también una adecuada sensibilidad. Como si todo esto fuera poco, el costo a la hora de ser aplicadas es infinitamente inferior al de otros métodos disponibles. La potenciometría es una de las tantas técnicas abarcadas por la electroanalítica para la determinación de la cantidad de esa sustancia presente en una solución. Antes de referirnos a ella en detalle, es importante conocer en qué consiste efectivamente un método electroanalítico, que por otra parte, no presenta características unívocas sino que pueden subdividirse en diferentes sistemas o procedimientos. Los métodos de rasgos electroanalíticos son procesos instrumentales empleados para distintos análisis. Asimismo, utilizan todas las propiedades electroquímicas con las que cuenta una determinada solución para precisar debidamente la concertación que ésta posee de un analito. Por otra parte, las técnicas que se emplean son vastas y comprenden las siguientes: electrogravimetría, polarografía, conductimetría, amperometría, voltametría, cronoamperometría, culombimetría, cronoculombimetría y la potenciometría. Además de esto, toda la amplia gama de magnitudes electroquímicas que pueden ser empleadas o que pueden relacionarse con los métodos electroanalíticos también son muchas, de los cuales podemos destacar el grado de intensidad de la corriente eléctrica, el potencial de electricidad con el que se cuenta, la carga eléctrica, la resistencia eléctrica, la masa que se puede acumular en un determinado electrodo y, asimismo, el tiempo, que es un factor que hay que tener siempre en cuenta. Función primordial de la potenciometría Esta técnica es utilizada para determinar la concentración de una especie electroactiva o de una disolución, empleando dos elementos fundamentales. Por un lado, utiliza un electrodo de referencia. Con este nombre se indica al electrodo que posee de manera inherente un potencial constante y conocido en relación con el tiempo. Así mismo se requiere de la presencia de un electrodo de trabajo. Este tipo de electrodo se caracteriza por contar con una gran sensibilidad en relación con la especie electroactiva. Estos electrodos de trabajo presentan una amplia gama de variedades, los podemos encontrar con distintos modelos y clases. En esta técnica también entra en juego otro factor indispensable. Se trata de los electrodos selectivos. Los mismos, como su nombre lo adelanta, se encargan de la selección de los iones ( por eso se los conoce con la sigla ESI ) y también son denominados como electrodos de membrana. Además de esta opción hay otra más que se emplea en la potenciometría: los electrodos de pH, que son elaborados a través de un material de fibra de vidrio. Cabe mencionarse que éstos comenzaron a ser empleados a comienzos del siglo XX y evolucionaron tanto que actualmente se constituyen en el modelo más requerido a la hora de emplear la técnica electroanalítica. Otros electrodos que son considerados como apropiados para aplicar la potenciometría son, por mencionar algunos ejemplos, los electrodos de membrana de cristal, los electrodos confeccionados en vidrio, los que cuentan con una membrana en estado líquido, los que tienen una membrana polimérica y aquellos que son metálicos. Existen dos métodos principalmente para realizar mediciones potenciométricas. El primero es hacer una sola medición de potencial de la celda, se llama potenciometría directa y se utiliza principalmente para calcular el pH de solución acuosa. En el segundo, el ión se puede titular y el potencial se mide en función del volumen del titulante y se le llama titulación potenciométrica la cual utiliza la medición de un potencial para detectar el punto de equivalencia de una titulación. El único requisito es que la reacción incluya un aumento o disminución de un ión sensible el electrodo. En una titulación potenciométrica directa el punto final de la reacción se detecta determinando el volumen en el cual ocurre un cambio de potencial relativamente grande cuando se adiciona el titulante. Para determinar el punto de equivalencia, podemos utilizar el potenciómetro, el cual nos permite generar la curva de titulaciónpotenciométrica de la reacción cuya gráfica resulta de la medición del pH del sistema contra el volumen de ácido o de base agregados en la titulación. Entonces podría entenderse como final de la titulación al momento en que el pH llegase a 7, sin embargo esto NO siempre es ciento, estomás bien, está en función de la “fuerza” del ácido o la base que se está titulando. Así cuando la neutralización se produce entre un ácido fuerte y una base fuerte. El pH en el punto de equivalencia es 7 ya que todos los iones han sido neutralizados. Por otra parte, cuando la reacción ocurre entre una base fuerte y un ácido débil, el anión del ácido sufre una hidrólisis, por lo que el pHal que ocurre la neutralización es mayor que 7. Y en la situación contraria, entre ácido fuerte y una base débil, el catión de la base sufre una hidrólisis produciéndose iones hidrónio, por lo que el pH es menor que 7. Éste último caso es el estudiado experimentalmente con el HCl y Na2CO3, y presentará una posible curva de titulación con una gráfica como la siguiente: Como se observa, la concentración de los iones hidrónio, antes de agregar el ácido y comenzar la titulación corresponde a la concentración de iones hidrónio de la solución de la base débil. A medida que se agrega el ácido, la base débil se transforma en su sal, la solución contiene la base débil y la sal del ácido fuerte, y por consiguiente está amortiguada. El primer punto de equivalencia corresponde a un volumen agregado de ácido, el cual ha neutralizado únicamente una parte de todo el carbonato, y es hasta el segundo punto, donde el carbonato de sodio pierde sus propiedades. ¡Está totalmente! neutralizado. Aquí existe una vertical que contiene el punto de equivalencia, correspondiente alequilibrio. determinación que se realiza mediante la utilización de la primera derivada. La valoración del carbonato sódico no puede realizarse con la exactitud que exige una normalización; por ello se valora siempre el segundo equivalente de hidrógeno. Para llevar a cabo ésta reacción, es indispensable comprender que las normalidades de los reactivos y el volumen de éstos son proporcionales entre un ácido y una base. Háblese así de la fórmula: NAVA = NB VB Y si en éste proyecto experimental, se utilizara una base 0.1N, en un volumen de 50 mL, y ésta fuese neutralizada con 25 mL de ácido. Por lo tanto, a manera de hipótesis, se establece que la normalidad del ácido es 0.2 N al reaccionar en éste sistema. Titulación por medio de indicadores visuales Clasificación de los indicadores. Indicadores químicos o visuales. En el caso de los indicadores químicos la propiedad que normalmente experimenta un cambio es la coloración, detectándose el punto final por el cambio de color de la disolución que se produce cuando varía el pH, potencial,... se subdividen en: Auto-indicadores Cuando el propio valorante o el analito actúan de indicador. El ejemplo más típico es el del permanganato. Indicadores coloreados Son los más utilizados; suelen incorporarse al sistema a valorar, introduciéndolos directamente en la disolución del analito, pero otras veces actúan externamente desde fuera de la disolución, extrayéndose entonces pequeñas fracciones de esta y ensayando frente al sistema indicador. Sus coloraciones deben ser intensas para percibir claramente el cambio aún cuando se añadan en muy pequeña proporción con objeto de que se consuman cantidades insignificantes de disolución valorada. Algunas veces una misma sustancia puede actuar de indicador en diversos tipos de reacciones. Indicadores fluorescentes Su funcionamiento es parecido al de los indicadores coloreados, aunque son menos numerosos. El final de la valoración se pone de manifiesto por la aparición, desaparición o cambio de la fluorescencia de la disolución problema sometido a la luz ultravioleta. Indicadores de adsorción Son sustancias que cambian de color al ser adsorbidas o desorbidas por los sistemas coloidales que se forman en el seno de la disolución problema como resultado de la reacción entre el analito y el valorante. Indicadores fisicoquímicos. Con frecuencia se utilizan diversos instrumentos para seguir la variación de la propiedad física a lo largo de la valoración. El método de valoración suele recibir el nombre del sistema instrumental utilizado para detectar el punto final; valoraciones potenciométricas, conductimetrías, amperometrías, espectrofotométricas, termométricas, siendo los métodos electroquímicos los más utilizados. Sin embargo los métodos físico-químicos de indicación de punto final retardan la volumetría al requerir el trazado de las curvas de valoración, con lo que suele disminuir la frecuencia de los análisis. Frente a los indicadores químicos, los métodos instrumentales alcanzan una mayor sensibilidad, precisión, resolución y no interferencia de partículas en suspensión o de especies coloreadas. Además, se prestan a una automatización más sencilla ya que den directamente una señal fácil de manipular electrónicamente y capaz de ser digitalizada para analizarla con un ordenador. El método de detección utilizado para cada caso particular depende de la reacción que tenga lugar y de la posible presencia de interferencias. Así para la valoración de un ácido fuerte con una base fuerte basta la fenolftaleína, pero si la disolución es coloreada puede ser preferible recurrir a la conductimetría. Error de valoración. La diferencia existente ente la concentración real del analito en la disolución y la hallada experimentalmente constituye el error de valoración. Este error se puede descomponer en: Error químico: debido a la diferencia entre el punto final y de equivalencia. Error visual: debido a la limitada capacidad ocular para comparar colores. Error de indicador: debido al consuma de solución valorante por el propio indicador para que se transforme y de lugar al cambio observable. Mientras que el error químico podrá ser por defecto o por exceso según que el indicador vire antes o después del punto de equivalencia, el error de indicador será siempre por exceso en las volumetrías directas y por defecto en las de retroceso. Usualmente los dos últimos errores son pequeños comparados con el primero que es el que realmente prevalece. El error químico nace de la diferencia existente entre el punto de equivalencia y el punto final, divergencia que dependerá del sistema indicador utilizado y es inherente al método. El error de valoración se puede calcular teóricamente y siempre es posible determinarlo experimentalmente. Generalmente es aditivo, es decir se suma al volumen teórico de disolución consumido en la valoración, independiente de que la cantidad de sustancia a valorar sea grande o pequeña. Por ello la mejor forma de evaluarlo es titular dos o más disoluciones de concentraciones conocidas y muy diferentes entre sí. Con frecuencia se suele compensar el error de valoración realizando una determinación en blanco, es decir con todos los componentes menos el analito y restar el volumen consumido al obtenido en la determinación volumétrica del analito. Para los indicadores físico-químicos no tienen sentido los errores anteriores por lo que son más exactos, pero están también sujetos a la posible respuesta defectuosa del instrumento de medida y un trazado gráfico incorrecto al detectar el punto final de la curva de valoración registrada. Criterio de selección: El pH requerido para la conversión de color aproximada exige una proporción: 1/10 entre las concentraciones de las formas conjugadas del indicador en equilibrio. Partiendo de la forma ácida del indicador, Partiendo de la forma básica del indicador. Propiedades ideales: Posee carácter (ácido/base) mas débil que el analito Presente en concentraciones muy bajas que no interfieren con la curva de valoración Produce cambios perceptibles y nítidos de color en el P.E. Variables que influyen en el comportamiento El intervalo de pH en el que el indicador exhibe un cambio de color depende de la temperatura, de la fuerza iónica del medio y de la presencia de disolventes orgánicos, y de partículas coloidales. Algunos de estos efectos, en particular los dos últimos, pueden ocasionar que el intervalo de viraje se desplace una o dos unidades de pH. Características de un indicador: Titulación Ácido-base Complejométrica Precipitación Oxidación – reducción Característica del indicador Es un ácido o base débil que presenta diferente color en la forma protonada y disociada Se acompleja con el ión que se está analizando y presenta un color característico diferente a cuando el complejo se disocia Forma precipitados coloreados con el primer exceso de titulante. Ante el primer exceso de titulante se oxida, o reduce según el caso, y presenta distinta coloración en ambos