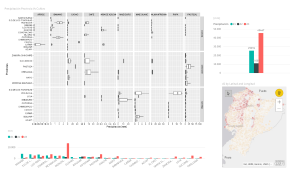
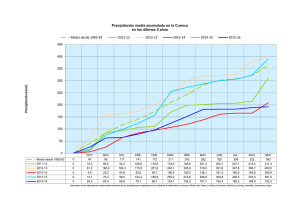
UNIVERSIDAD POLITECNICA ESTATAL DEL CARCHI CARRERA DE ALIMENTOS QUÍMICA GENERAL Práctica Nº 6 Docente: Ing. Carlos Rivas, MSc. Semestre: 1ro A (Alimentos) Guía Modificada del Prof: Ing. Carlos Rivas, MSc. Fecha: Tema: Preparación de soluciones 1. OBJETIVO Esta práctica tiene como objetivo que los estudiantes aprendan a calcular y preparar soluciones y diluciones de diferentes concentraciones. 2. INTRODUCCIÓN Se presentará el concepto de solución en la práctica, esto con el fin de que el estudiante logre un aprendizaje acerca de las generalidades de la solución y de sus componentes. La práctica incluirá la preparación de soluciones de diferente concentración utilizando unidades de concentración físicas y químicas. 3. MATERIALES Y REACTIVOS Materiales y equipos: Vasos de precipitación de 250 ml Matraz o balón aforado de 250 ml Varillas de agitación Pipetas de 10 ml Peras de succión Probetas 100 ml Peras de succión Reactivos: NaCl (sal de mesa). Traer cada grupo HCl Agua destilada. NOTA: Cada grupo deberá traer frascos oscuros de aproximadamente 500 mL 4. CONDICIONES DE SEGURIDAD Tener un manejo adecuado de reactivos. Lea detenidamente las hojas de seguridad. Manipule con especial cuidado el mechero sujételo muy bien para evitar accidentes de quemaduras serios. 5. EQUIPO DE PROTECCIÓN REQUERIDO Mandil, calzado cerrado, guantes, malla para el cabello, gafas de seguridad, mascarilla 6. PROCEDIMIENTO A. Preparar una solución de NaCl 250 ml a una concentración 2 M. 1. Realizar los cálculos pertinentes para determinar la masa de soluto necesario para preparar la solución deseada. 2. Pese en un vaso de precipitación la masa de NaCl necesaria para la preparación de los 250 mL de solución 2M. 3. Agregar agua de tal forma que se disuelva preliminarmente la sal. 4. Traslade el contenido del vaso de precipitación a un balón aforado de 250 ml y complete el volumen con agua destilada, agite y tape el balón y guarde la solución. B. Preparación de 250 mL de una solución de HCl 0,1 N. 1. Realizar los cálculos pertinentes (volumen necesario) para preparar la solución deseada. 2. En un vaso de precipitación coloque agua destilada necesaria para la dilución con el ácido. 3. Agregue cuidadosamente el HCl calculado en el vaso de precipitación con agua y agitar. 4. Colocar la dilución en un balón aforado de 250 ml y afore con agua hasta completar la solución 250 ml. 5. Tapar la solución y anotar sus características. Terminada la práctica, lave, seque y entregue los materiales y reactivos. Lávese correctamente las manos antes de abandonar el laboratorio. 7. RESULTADOS Generar los debidos cálculos para preparar las soluciones en estudio 8. CUESTIONARIO ¿Qué es una solución acuosa? ¿Qué diferencias existen entre soluciones saturadas y diluidas?