VALORACIÓN ÁCIDO-BASE: “DETERMINACIÓN DEL CONTENIDO
Anuncio
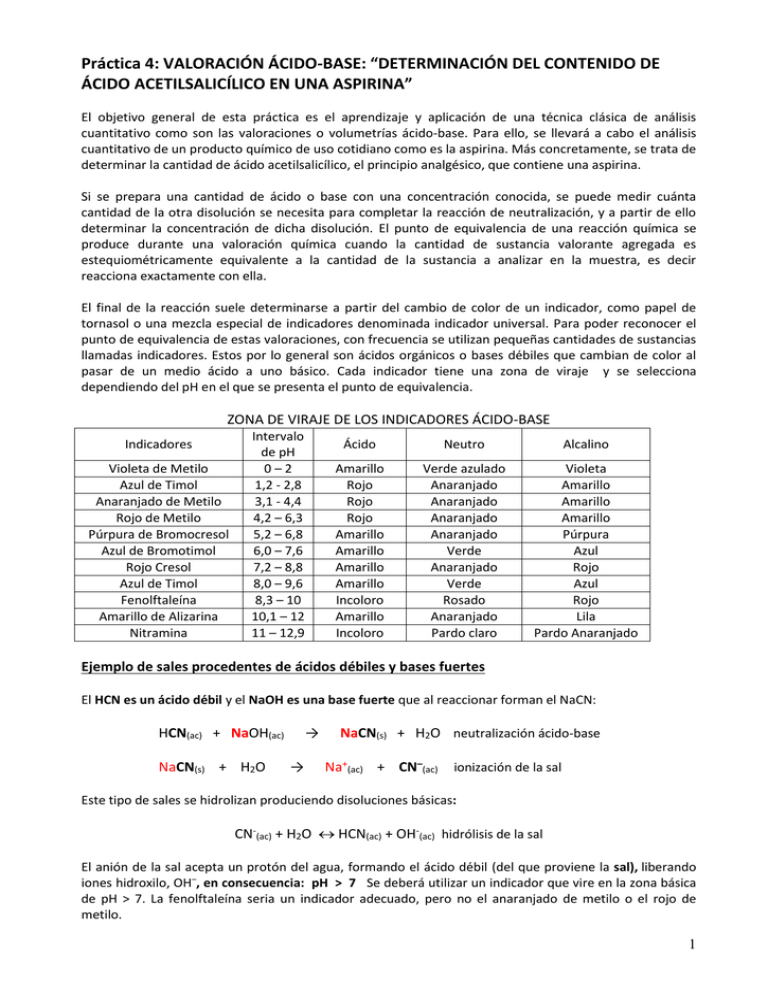
Práctica 4: VALORACIÓN ÁCIDO-BASE: “DETERMINACIÓN DEL CONTENIDO DE ÁCIDO ACETILSALICÍLICO EN UNA ASPIRINA” El objetivo general de esta práctica es el aprendizaje y aplicación de una técnica clásica de análisis cuantitativo como son las valoraciones o volumetrías ácido-base. Para ello, se llevará a cabo el análisis cuantitativo de un producto químico de uso cotidiano como es la aspirina. Más concretamente, se trata de determinar la cantidad de ácido acetilsalicílico, el principio analgésico, que contiene una aspirina. Si se prepara una cantidad de ácido o base con una concentración conocida, se puede medir cuánta cantidad de la otra disolución se necesita para completar la reacción de neutralización, y a partir de ello determinar la concentración de dicha disolución. El punto de equivalencia de una reacción química se produce durante una valoración química cuando la cantidad de sustancia valorante agregada es estequiométricamente equivalente a la cantidad de la sustancia a analizar en la muestra, es decir reacciona exactamente con ella. El final de la reacción suele determinarse a partir del cambio de color de un indicador, como papel de tornasol o una mezcla especial de indicadores denominada indicador universal. Para poder reconocer el punto de equivalencia de estas valoraciones, con frecuencia se utilizan pequeñas cantidades de sustancias llamadas indicadores. Estos por lo general son ácidos orgánicos o bases débiles que cambian de color al pasar de un medio ácido a uno básico. Cada indicador tiene una zona de viraje y se selecciona dependiendo del pH en el que se presenta el punto de equivalencia. ZONA DE VIRAJE DE LOS INDICADORES ÁCIDO-BASE Indicadores Violeta de Metilo Azul de Timol Anaranjado de Metilo Rojo de Metilo Púrpura de Bromocresol Azul de Bromotimol Rojo Cresol Azul de Timol Fenolftaleína Amarillo de Alizarina Nitramina Intervalo de pH 0–2 1,2 - 2,8 3,1 - 4,4 4,2 – 6,3 5,2 – 6,8 6,0 – 7,6 7,2 – 8,8 8,0 – 9,6 8,3 – 10 10,1 – 12 11 – 12,9 Ácido Neutro Alcalino Amarillo Rojo Rojo Rojo Amarillo Amarillo Amarillo Amarillo Incoloro Amarillo Incoloro Verde azulado Anaranjado Anaranjado Anaranjado Anaranjado Verde Anaranjado Verde Rosado Anaranjado Pardo claro Violeta Amarillo Amarillo Amarillo Púrpura Azul Rojo Azul Rojo Lila Pardo Anaranjado Ejemplo de sales procedentes de ácidos débiles y bases fuertes El HCN es un ácido débil y el NaOH es una base fuerte que al reaccionar forman el NaCN: HCN(ac) + NaOH(ac) NaCN(s) + H2O → → NaCN(s) + H2O neutralización ácido-base Na+(ac) + CN–(ac) ionización de la sal Este tipo de sales se hidrolizan produciendo disoluciones básicas: CN-(ac) + H2O HCN(ac) + OH-(ac) hidrólisis de la sal El anión de la sal acepta un protón del agua, formando el ácido débil (del que proviene la sal), liberando iones hidroxilo, OH–, en consecuencia: pH > 7 Se deberá utilizar un indicador que vire en la zona básica de pH > 7. La fenolftaleína seria un indicador adecuado, pero no el anaranjado de metilo o el rojo de metilo. 1 VALORACIÓN ÁCIDO-BASE: “DETERMINACIÓN DEL CONTENIDO DE ÁCIDO ACETILSALICÍLICO EN UNA ASPIRINA” Para realizar este análisis se utilizará la técnica volumétrica. El ácido acetilsalicílico es un ácido y, por tanto, en disolución acuosa, liberará protones, que pueden neutralizarse mediante una base como es el hidróxido sódico. C8 H7 O2-COOH + NaOH + NaOH + H2O C8 H7 O2-COONa + H2O El ácido acetilsalicílico (M = 180.16) es un ácido débil, por tanto, su punto de equivalencia estará ligeramente desviado hacia la zona de pH básico. En el punto de equivalencia, que determinaremos mediante un indicador, se tendrá que cumplir que: nº moles ácido acetilsalicílico = nº moles NaOH ya que la reacción es mol a mol. Podemos, por tanto, a partir de la cantidad de disolución de base gastada en la neutralización, determinar la cantidad (masa) de ácido acetilsalicílico presente en la aspirina y por tanto su riqueza en la aspirina. Material y reactivos - Agitador de vidrio - Soporte, nuez - Bureta - Mortero, espátula, vidrio de reloj - Vaso de precipitados 250 ml - Matraz erlenmeyer 250 ml - Matraz aforado 100 ml - Embudo cónico - Cuentagotas - Aspirina - Hidróxido sódico - Fenolftaleína Procedimiento - Preparar 100 ml de NaOH 0,3 M. - Colocar la bureta en su soporte tal como se indica en la figura. Antes, lavar bien la bureta, primero con agua, y finalmente con la disolución patrón de NaOH (enjuagando la bureta con esta disolución al menos una vez). - Llenar la bureta con la disolución de hidróxido de sodio y enrasar a cero. - Pesar una tableta de aspirina en una balanza - Pulverizar la aspirina en el mortero y echarla en un vaso de precipitados. - Añadir 100 ml de agua destilada y agitar hasta que se disperse bien la aspirina. Trasvasarla a un matraz erlenmeyer. - Añadir 2 ó 3 gotas de disolución alcohólica de fenolftaleína en el erlenmeyer . - Abrir la llave de la bureta, dejando que la disolución de NaOH caiga sobre la disolución de aspirina contenida en el erlenmeyer. Los primeros ml se pueden añadir más o menos rápidamente, pero después conviene dejar que el NaOH vaya cayendo lentamente gota a gota, agitando suavemente el erlenmeyer mediante movimientos circulares de la mano, para que se mezclen bien las dos disoluciones, hasta que aparezca un cambio permanente de coloración del indicador. Esto indicará el final de la valoración. - Medir al menos el pH de la disolución ácida antes de añadir el NaOH, en el momento de la neutralización y después. (Si se va a hacer la curva de valoración, hay que tomar más medidas y anotar en cada caso, el volumen de NaOH gastado). - Anotar el nuevo nivel de la disolución en la bureta y anotar el número de ml de disolución de NaOH gastados. - Finalmente, recoger los datos obtenidos por otros grupos de la masa media que contiene cada aspirina y su masa total y represéntalos en columnas agrupadas. 2 Cuestiones 1.- ¿Podrían emplearse otros indicadores distintos de la fenolftaleína? ¿Cuáles? ¿Qué colores tomarán antes y después de la valoración? 2.- ¿Por qué es necesario enjuagar la bureta antes de la valoración? 3.- ¿Cuál es el punto de equivalencia? 4.- Calcula la masa de ácido acetilsalicílico que contiene la aspirina. 5.- Determina la riqueza, en tanto por ciento en masa, del ácido presente en la aspirina. 6.- Haz un diagrama de columnas agrupadas con las distintas masas obtenidas de ácido contenido en cada aspirina y la masa restante del comprimido. Haz un diagrama con el % en masa del ácido. 7.- Representa el pH frente al volumen de NaOH agregado (curva de valoración) 0.8 90% 0.7 80% 0.6 70% 60% 0.5 otros 0.4 masa ácido 0.3 % ácido masa comprimido (g) Ejemplos 50% 40% 30% 0.2 20% 0.1 10% 0 0% 1 2 3 muestras 4 1 2 3 4 muestras 3



