Lab-quim-2A-2B-CN - Polimodal de Ciencias Naturales
Anuncio

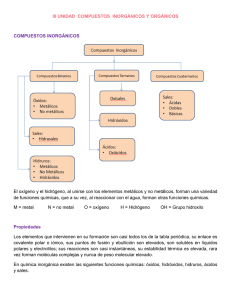
Polimodal C. Naturales 2A y 2B LABORATORIO DE QUÍMICA: NOMENCLATURA La siguiente actividad es propuesta para repasar los temas de nomenclatura y formuleo ya que son necesarios para comprender y poder resolver los ejercicios de la Unidad 3 de Ecuaciones Redox, ya que el primer paso en una ecuación redox es calcular el número de oxidación de los átomos de los elementos presentes. El éxito en la resolución de una ecuación redox está justamente en los primeros pasos a realizar y ellos son calcular los números de oxidación y escribirlas las ecuaciones de disociación o ionización según corresponda. Impriman estas hojas y resuelvan los ejercicios, estos son para entregar. Mucha suerte en esta ejercitación!!!! Saludos a todos. CRISTINA COMPUESTOS QUÍMICOS FÓRMULAS Y NOMENCLATURA DE COMPUESTOS QUÍMICOS El lenguaje de la Química es una forma de expresión especial en la cual se siguen ciertas reglas para nombrar a los compuestos y escribir las fórmulas. Es necesario definir número de oxidación Número de oxidación: El número de oxidación es un número positivo o negativo, que se asigna a cada uno de los átomos de los elementos que forman un compuesto. Si tiende a ceder o cede electrones el número de oxidación es positivo, si tiende a ganar o gana electrones su número de oxidación será negativo Reglas de los números de oxidación: 1) El número de oxidación de un elemento en una sustancia simple es cero. Ejemplo: Fe, Zn; O2, O3 2) En los compuestos la suma algebraica de los números de oxidación de los elementos presentes multiplicadas por las respectivas atomicidades, es igual a cero 3) Para los iones, la suma algebraica de los números de oxidación de los elementos presentes multiplicados por las respectivas atomicidades es igual a la carga del ion 4) El hidrógeno combinado presente número de oxidación +1 en la mayoría de los compuestos, excepto en los hidruros que es -1. Ejemplo con +1: HCl, HNO3, H2O 5) El oxígeno combinado presente generalmente número de oxidación -2 en la mayoría de los compuestos, excepto en los peróxidos que es -1 y combinado con flúor que +2. Ejemplo con -2: HClO, HNO3, H2O, BaO, CO2 6) Todos los elementos del grupo IA tienen número de oxidación +1 7) Todos los elementos del grupo IIA tienen número de oxidación +2 8) El flúor siempre tiene número de oxidación -1 COMPUESTOS BINARIOS A) Sales no oxigenadas Completar la siguiente tabla de compuestos binarios llamados sales: Sales no oxigenadas (catión + anión no metálico) FORMULA KCl Na2S NOMENCLATURA TRADCIONAL NOMENCLATURA MODERNA Cloruro de calcio Bromuro de magnesio FeCl2 FeCl3 Sulfuro niqueloso Fluoruro de niquel (III) Cloruro de plomo (IV) B1) Compuestos con oxígeno: Óxidos Los siguientes compuestos son óxidos de metales y están formados por: un metal + oxígeno. Completar la siguiente tabla FORMULA K 2O Al2O3 MgO PbO PbO2 NOMENCLATURA TRADICIONAL NOMENCLATURA MODERNA óxido ferroso óxido férrico óxido de niquel (II) óxido de cobre (I) B2) Óxidos de no metales Los siguientes compuestos son óxidos de no metales, formados por: no metal + oxígeno. Completar la siguiente tabla. FORMULA NOMENCLATURA NOMENCLATURA TRADICIONAL MODERNA SO3 SO2 Cl2O Cl2O3 óxido clórico óxido perclórico óxido de nitrógeno (III) óxido de nitrógeno (V) C) Compuestos con hidrógeno: C1) Hidruros Los Hidruros son compuestos formados por: con metal + hidrógeno en donde el hidrógeno tiene número de oxidación –1. FORMULA NOMBRE TRADICIONAL NOMBRE MODERNO NaH FeH2 Hidruro niqueloso Hidruro de aluminio Hidruro de cobalto (III) C2) Hidrógeno unido a halógenos y azufre, el hidrógeno tiene número de oxidación +1. En estos compuestos el no metal puede ser del grupo VIA (todos menos el oxígeno) y del grupo VIIA. Completar la siguiente tabla. FORMULA Nomenclatura Tradicional Nomenclatura moderna HCl H2S Seleniuro de hidrógeno ácido bromhídrico ácido fluorhídrico ALGUNOS COMPUESTOS FORMADOS POR HIDROGENO Y UN NO METAL CONSERAVAN EL NOMBRE COMUN FORMULA H2O NH3 PH3 AsH3 SiH4 NOMBRE Agua Amoníaco Fosfina Arsina Silano COMPUESTOS TERNARIOS A) HIDROXIDOS (metal, oxígeno e hidrógeno. Completar la siguiente tabla Fórmula NaOH Al(OH)3 Fe(OH)2 Fe(OH)3 Nomenclatura Tradicional Nomenclatura Moderna Hidróxido niquélico Hidróxido de cobre(I) B) OXOACIDOS ( hidrógeno, no metal y oxígeno. Completar la siguiente tabla: Fórmula H2CO3 HNO2 HNO3 Nomenclatura Tradicional Nomenclatura Moderna ácido sulfúrico ácido sulfuroso HClO HClO2 HClO3 HClO4 seleniato (VI) de hidrógeno iodato (III) de hidrógeno C) SALES DE OXOACIDOS ( OXOSALES) (Metal, No metal, y Oxígeno. Completar la siguiente tabla. Fórmula Nombre tradicional Nombre Moderno K2CO3 CaSO3 CaSO4 Fe(NO2) 2 CuNO2 Mg(NO3)2 Ni(NO3)3 Perclorato ferroso Hipoclorito de bario Sulfato (IV) de cobre (I) Carbonato de aluminio Completar el siguiente cuadro, escribiendo la fórmula del compuesto que se forman al unir el catión con el anión. Iones Mg2+ Cu+ Cu2+ Ba2+ Fe3+ 2CO3 S2NO3SO42ClO3Escribir las ecuaciones de disociación o de ionización según corresponda de los hidróxidos, oxoácidos y oxosales que figuran en las tablas correspondientes. REPASAR ESTE TEMA DE LOS APUNTES QUE YA TIENEN