EJERCICIOS PRIMERA UNIDAD - OB Ciencias Experimentales
Anuncio
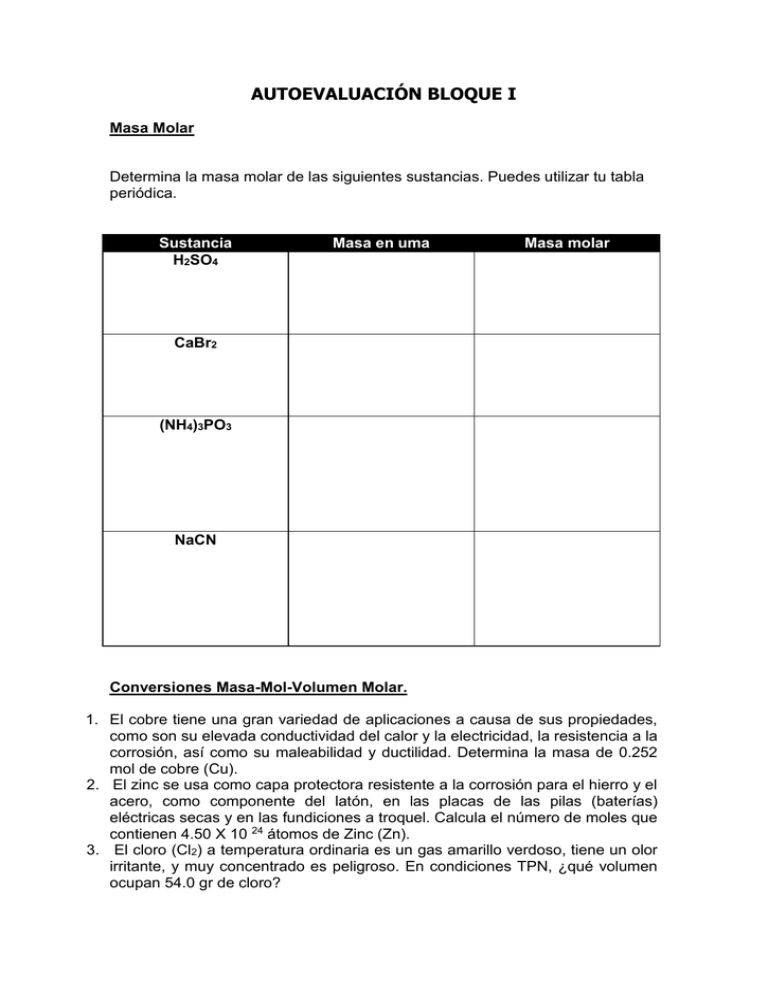
AUTOEVALUACIÓN BLOQUE I Masa Molar Determina la masa molar de las siguientes sustancias. Puedes utilizar tu tabla periódica. Sustancia H2SO4 Masa en uma Masa molar CaBr2 (NH4)3PO3 NaCN Conversiones Masa-Mol-Volumen Molar. 1. El cobre tiene una gran variedad de aplicaciones a causa de sus propiedades, como son su elevada conductividad del calor y la electricidad, la resistencia a la corrosión, así como su maleabilidad y ductilidad. Determina la masa de 0.252 mol de cobre (Cu). 2. El zinc se usa como capa protectora resistente a la corrosión para el hierro y el acero, como componente del latón, en las placas de las pilas (baterías) eléctricas secas y en las fundiciones a troquel. Calcula el número de moles que contienen 4.50 X 10 24 átomos de Zinc (Zn). 3. El cloro (Cl2) a temperatura ordinaria es un gas amarillo verdoso, tiene un olor irritante, y muy concentrado es peligroso. En condiciones TPN, ¿qué volumen ocupan 54.0 gr de cloro? Composición porcentual Determina la composición porcentual de los siguientes compuestos: a. b. c. d. e. f. g. h. NaNO3 AlO4 FeO H2CO3 BaTe CdF2 KCl H2S 1. El cloruro de aluminio se forma al hacer reaccionar 13.43 gr de aluminio con 53.18 g de cloro. ¿Cuál es la composición porcentual del compuesto? 2. Al analizar una muestra de cloruro de etileno se vio que contenía 6 gr de carbono, 1 gr de hidrógeno y 17.75 gr de cloro. Calcula la composición porcentual del cloruro de etileno. 3. Calcula la composición porcentual de un óxido con una masa de 14.2 gr que se formó al hacer reaccionar con oxígeno una muestra de 6.20 gr de fósforo. Fórmula empírica (mínima) El nylon es un material que por su resistencia y elasticidad es utilizado para elaborar fibras textiles; experimentalmente se encontró que este compuesto contiene 63.68% de carbono, 12.38% de nitrógeno, 9.8% de hidrógeno y 14.14% de oxígeno. Calcula la fórmula mínima de este compuesto. Fórmula molecular (verdadera) 1. La serotonina es un compuesto que conduce los impulsos nerviosos en el cerebro. Está constituida por 68.2% de carbono, 6.86% de hidrógeno y 9.08% de oxígeno ¿Cuál es su fórmula verdadera si tiene una masa molar de 176 g/mol? Reacciones Químicas y Estequiometría El acetileno arde al aire con una llama caliente y brillante. Se utilizaba como fuente de iluminación, pero hoy en día se emplea principalmente en la soldadura. En condiciones TPN, calcula para la siguiente reacción: C2H2 (g) + O2(g) a) b) c) d) CO2(g) + H2O(l) La masa del acetileno que producen 100 lts de dióxido de carbono. El volumen de agua producido por 18 moles de oxígeno. La masa de dióxido de carbono que se produce con 46 gr de oxígeno. Los moles de acetileno que reaccionan con 28 gr de oxígeno. Reactivo Limitante Se deja una muestra de 16.5 gr de óxido de cromo (III) reaccione con 8.20 gr de aluminio. Calcula: a) El número de gramos de cromo que se pueden producir. b) El número de moles de reactivo en exceso que quedan al término de la reacción. c) El porcentaje de rendimiento si se obtienen experimentalmente 10.9 gr de cromo. Cr2O3 + Al(s) Cr(s) + Al2O3 Relación entre la contaminación y la estequiometría. 1. El hidrógeno, que en griego significa “creador de agua”, es un elemento gaseoso y, como la mayoría de los elementos gaseosos, es diatómico (H2). Se encuentra ampliamente distribuido en nuestro planeta. Investiga porqué el hidrógeno sólo se encuentra en pequeñas cantidades en la atmósfera y por qué en el espacio interestelar abunda en el Sol y en otras estrellas. 2. Aplica los cálculos estequiométricos en la contaminación del aire y resuelve el siguiente problema: El dióxido de azufre es un peligroso contaminante atmosférico y los medios químicos son los más eficientes para eliminarlo. Por ejemplo, podemos quemar piedra caliza (carbonato de calcio), CaCO3(s) CaO(s) + CO2(g) Y emplear el óxido de calcio (cal viva) producido para que reaccione con el dióxido de azufre y formar sulfito de calcio. CaO(s) + SO2(g) CaSO3(s) Imagina que se quema gas natural en una instalación petrolera, a razón de 100 kg/h, y que contiene 10% en peso de H2S. a) ¿Qué masa de SO2 se produce por hora? b) Cuántas toneladas diarias de piedra caliza se requieren para eliminar el SO2 formado? 2H2S(g) + 3O2(g) 2SO2(g) + 2H2O2(l) 3. En la actualidad existen muchos grupos defensores del medio ambiente y la población empieza a tener conciencia de que algo grave ocurre y que es necesario tomar medidas al respecto. ¿Qué acciones propones para prevenir la contaminación urbana del agua, que es uno de los principales problemas ambientales? 4. Aplica los cálculos estequiométricos en la contaminación del agua y resuelve el siguiente problema: En el tratamiento primario de aguas residuales el hidróxido de aluminio (Al(OH)3) se utiliza para separar coloides y bacterias por floculación. Si se ponen a reaccionar 10.7 toneladas de Ca(OH)2 y 16.4 toneladas de Al2(SO4)3, determina, a) El reactivo que limita la producción de hidróxido de aluminio (Al(OH)3) b) La cantidad de Al (OH)3 que se producirá. La ecuación es la siguiente: Ca(OH)2 + Al2(SO4)3 Al(OH)3 + CaSO4





