Isomería alquenos
Anuncio
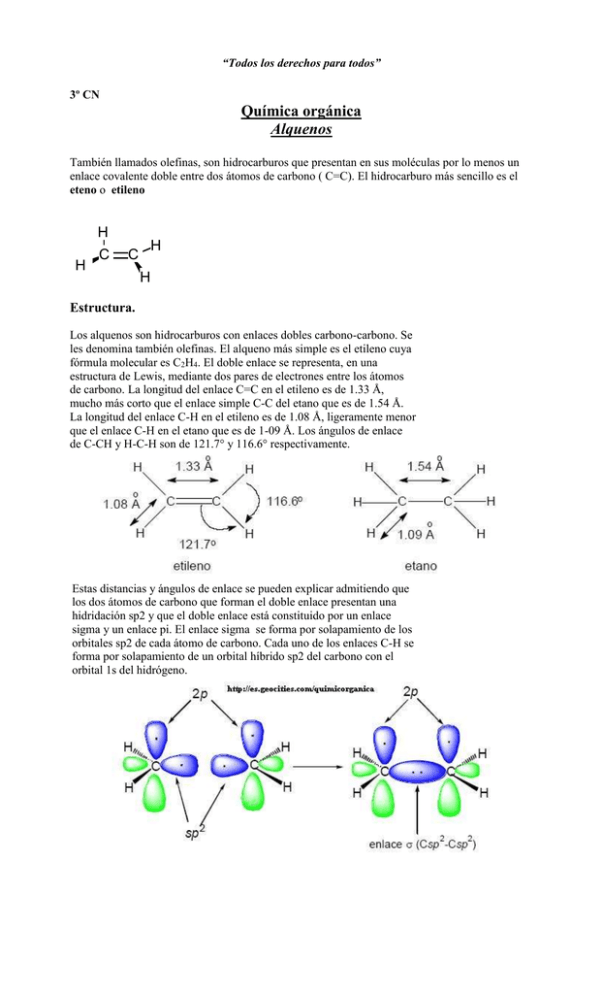
“Todos los derechos para todos” 3º CN Química orgánica Alquenos También llamados olefinas, son hidrocarburos que presentan en sus moléculas por lo menos un enlace covalente doble entre dos átomos de carbono ( C=C). El hidrocarburo más sencillo es el eteno o etileno H H C C H H Estructura. Los alquenos son hidrocarburos con enlaces dobles carbono-carbono. Se les denomina también olefinas. El alqueno más simple es el etileno cuya fórmula molecular es C2H4. El doble enlace se representa, en una estructura de Lewis, mediante dos pares de electrones entre los átomos de carbono. La longitud del enlace C=C en el etileno es de 1.33 Å, mucho más corto que el enlace simple C-C del etano que es de 1.54 Å. La longitud del enlace C-H en el etileno es de 1.08 Å, ligeramente menor que el enlace C-H en el etano que es de 1-09 Å. Los ángulos de enlace de C-CH y H-C-H son de 121.7° y 116.6° respectivamente. Estas distancias y ángulos de enlace se pueden explicar admitiendo que los dos átomos de carbono que forman el doble enlace presentan una hidridación sp2 y que el doble enlace está constituido por un enlace sigma y un enlace pi. El enlace sigma se forma por solapamiento de los orbitales sp2 de cada átomo de carbono. Cada uno de los enlaces C-H se forma por solapamiento de un orbital híbrido sp2 del carbono con el orbital 1s del hidrógeno. En la región de enlace carbono-carbono deben entrar dos electrones más. Cada átomo de carbono contiene todavía un orbital 2p no hibridizado. por superposición lateral de los orbitales 2p puros se forma el orbital molecular pi El solapamiento de los orbitales p es menos eficaz que el solapamiento frontal por el que se forman los orbitales sigma. Por consiguiente un enlace pi es más débil que un enlace sigma. Los alquenos responden a la fórmula general: CnH2n Nomenclatura de los alquenos. Para nombrar sistemáticamente a los alquenos hay que seguir una serie de reglas que se indican a continuación. 1º. Seleccionar la cadena principal de carbono más larga que contenga el doble enlace (o el mayor número de dobles enlaces). El nombre fundamental del alqueno se generará cambiando la terminación –ano, correspondiente al alcano con el mismo número de carbonos, por la terminación –eno (propeno, buteno, octeno, etc). 2º. Numerar la cadena principal empezando por el extremo más próximo al doble enlace, e indicar la posición del doble enlace por el número que corresponda al primer carbono del mismo (1-penteno, 2-penteno, etc). 3º. Indicar el número de grupos alquilo y su posición de unión a la cadena principal. Isomería de alquenos Dos compuestos son isómeros cuando presentan la misma fórmula molecular pero difieren en sus propiedades físicas y/o químicas En el caso de los alquenos podemos observar los siguientes tipos de isomería: a) isómeros de cadena (ver unidad 6 correspondiente a alcanos) donde los átomos de carbono se disponen formando distintas cadenas. 1-hepteno 3,4-di meti l -1-penteno b) isómeros de posición : la cadena carbonada tiene la misma longitud pero difieren en la ubicación del doble enlace o de algún otro grupo funcional. 2-penteno 1-penteno c) isómeros geométricos: A diferencia de lo que ocurre en los enlaces simples, en los enlaces dobles C=C no hay libre rotación. Este es el origen de la isomería cis-trans. Por lo tanto estos isómeros se diferencian en la distribución espacial de los átomos, con respecto al doble enlace. trans-2-buteno cis-2-buteno ¿ Cuáles son los isómeros geométricos del 3-metil-2-penteno? d) isómeros de función: de los cicloalcanos CH2=CH-CH3 C3H6 Ciclopropano C3H6 propeno Propiedades Físicas Son poco solubles en agua, (aunque son considerablemente más solubles que los alcanos, debido a que la mayor concentración de electrones en la doble ligadura produce una mayor atracción del extremo positivo del dipolo de la molécula de agua), tienen bajos puntos de fusión y ebullición. En condiciones ambientales el eteno, el propeno y el buteno son gases, los siguientes hasta 18 átomos de carbono son líquidos y los términos superiores son sólidos. Propiedades químicas: A diferencia de los alcanos son muy reactivos. La unión es más débil que la mayoría de los enlaces entre átomos de carbono y átomos de otros elementos. La labilidad de los electrones del enlace pi permite la adición de dos átomos o radicales monovalentes , transformándose la doble ligadura en una unión simple. De allí que los alquenos se caracterizan por dar reacciones de adición. Una reacción de adición generalizada puede representarse así: C=C + AB C C A B I) Adición de grupos idénticos o simétricos: 1- Hidrogenación : El hidrógeno puede ser adicionado a los alquenos en presencia de catalizadores (Ni ; Pt y/o Pd), para llevar adelante la misma se inyecta hidrógeno a una leve presión en un recinto que contiene el alqueno con el catalizador finamente dividido . CH2 CH CH3 Pt + H2 CH3 CH2 CH3 El catalizador reduce la energía de activación, de modo que pueda proceder rápidamente a temperatura ambiente. No modifica el cambio neto de energía del proceso total, sólo rebaja el máximo energético entre reaccionantes y los productos. Los reactivos se adsorben en la superficie del metal dividido finamente. Se cree que la superficie del metal rompe el enlace (pi) del alqueno antes que éste se combine con el hidrógeno. La hidrogenación de compuestos no saturados es de gran valor industrial ya permite transformar los aceites vegetales en grasas sólidas, las cuales constituyen la manteca artificial conocida comúnmente como margarinas. 2-Halogenación: El cloro y el bromo se adicionan muy bien a los alquenos a temperatura ambiente , con desprendimiento de calor: C=C + Br2 C C Br Br Si se hace burbujear eteno en agua de bromo, de color rojizo, ésta se decolora rápidamente por la formación del 1,2-dibromoetano , compuesto incoloro. La presencia de un doble enlace en la molécula se reconoce por esta reacción( característica de los alquenos). El yodo reacciona con dificultad, produciendo una reacción reversible. El flúor reacciona en forma violenta y el cloro reaccionan con mayor rapidez que el bromo. Por lo tanto la reactividad con los halógenos será: I2 < Br2 < Cl2 < F2 Mecanismo de la halogenación: La adición de halógenos en los alquenos no se produce en una sola etapa, sino en diferentes momentos: Al estar próximos los electrones a un extremo de la molécula de halógeno se polariza el enlace, los electrones de la molécula de bromo se desplazan hacia el otro extremo. Se origina una zona con baja densidad electrónica sobre uno de los átomos de bromo. Br Br Br R CH CH R Br- + C C Se forma un compuesto intermedio, donde el bromo se encuentra unido a los dos átomos de carbono del doble enlace conocido como ion bromonio cíclico . La molécula de bromo sufre una ruptura heterolítica formando un ion bromuro ( Br-) con 8electrones, y un ion bromonio ( Br+) con 6 electrones. Este catión bromonio, reactivo electrofílico ( captador de electrones) se une al centro de alta densidad electrónica de la molécula de eteno formando el compuesto intermedio. El ion bromuro, reactivo nucleofílico, se unirá entonces al carbono deficiente en electrones formando el producto final. Br Br C C C + Br- C Br II) ) Adición de compuestos asimétricos: 1-Adición de hidrácidos: Los hidrácidos dan reacciones de adición con los alquenos , formando derivados monohalogenados de los alcanos. Los hidrácidos son ácidos fuertes, y por lo tanto se disocian totalmente. Los iones hidrógeno (especies deficientes de electrones y por ello agentes electrofílicos) se orientan hacia el doble enlace. De este ataque resulta una carga positiva : un ion carbonio, que luego se estabiliza al unirse con un anión (cloruro o bromuro). La facilidad en la adición depende de la fuerza del ácido por lo que para soluciones concentradas : HI > HBr > HCl > HF Para esta reacción podríamos sugerir las siguientes etapas El ácido se encuentra disociado según : HCl ------ H+ + ClExperimentalmente se demuestra que en presencia de un alqueno asimétrico se obtiene en mayor proporción el isómero monohalogenado, donde el halógeno está unido al carbono menos hidrogenado, en el caso aquí planteado se forma 2-cloropropano. Podemos plantear la siguiente interpretación: La naturaleza inductiva del grupo metilo, produce un desplazamiento de los electrones de la unión covalente desde el carbono 3 hacia el carbono 2 ( efecto inductivo). De esta forma el carbono 2 aumenta su densidad electrónica y de esta forma desplaza los electrones del enlace hacia el carbono 1. Este efecto se llama mesomérico. Como resultado de esto el carbono 2 adquiere una carga parcial positiva, y el carbono1 una carga parcial negativa. Esto explica que el ion hidrógeno lo haga al carbono 1 donde hay mayor densidad electrónica, y el ion cloruro se adicione preferentemente al carbono 2 que tiene deficiencia de electrones 1º) H + C H CH3 2º) H H C H C H H H C C H CH3 H H H C CH3 H+ H C + Cl - CH3 C Cl H H La explicación a este comportamiento observado experimentalmente fue enunciada en 1870 por Marcownicoff dando lugar ala regla que hoy lleva su nombre: Regla de Marcownicoff Cuando una molécula polar se adiciona a una doble ligadura carbono - carbono, la parte positiva de dicha molécula polar se adiciona al carbono más hidrogenado. El extremo más positivo se une al carbono más hidrogenado 2-Adición de ácido sulfúrico : Al mezclar un alqueno con ácido sulfúrico a temperatura ambiente se produce la adición con formación de los sulfatos ácidos de alquilo isómeros, cumpliéndose en el caso de los alquenos asimétricos la regla de Marcownicof CH3- HC=CH2 + H2SO4 O-SO3H CH3 -C –CH3 H Sulfato ácido de isopropilo Estos sulfatos ácidos sufren hidrólisis dando los alcoholes correspondientes O-SO3H CH3 -C –CH3 + H2O CH3-CHOH-CH3 + H2SO4 H A medida que aumenta el número de átomos de carbono y las ramificaciones la adición se produce más fácilmente. 3-Reacciones de oxidación: a- Reacción de Baeyer Los alquenos reaccionan con soluciones diluidas de permanganato de potasio (KMnO4), en medio neutro o básico, formando alcoholes dihidroxilados o glicoles 3CH2=CH2 + 2 KMnO4 + 4 H2O 3CH2-CH2 + 2 MnO2 + 2 KOH OH OH Etanodiol ( etilenglicol) Esta reacción permite diferenciar los hidrocarburos no saturados de los saturados, ya que estos últimos no decoloran las soluciones diluidas de permanganato de potasio. b- Adición de ozono: Los alquenos reaccionan con el ozono para formar un compuesto cíclico denominado ozónido primario o molozónido. El molozónido tiene dos enlaces peróxido y es bastante inestable y se transpone inmediatamente, aun a muy bajas temperaturas, para generar un compuesto denominado ozónido, como se pone de manifiesto en el siguiente esquema: Los ozónidos son inestables y explosivos , por lo general no se los aísla. La ozonización permite reconocer la ubicación del doble enlace. En efecto el ozónido tiende a hidrolizarse, rompiéndose la molécula entre los dos carbonos del enlace primitivo del alqueno y formándose dos aldehídos o cetonas ( además agua oxigenada). CH3-CH2-CH =CH2 H CH3 –CH2 – C—O---CH2 ozónido del 1-buteno O O + O3 H CH3 –CH2 – C—O---CH2 O--O + H2O CH3-CH2-C=O + O=C + H2O2 H H Propanal metanal Identificando los compuestos formados, se determina la estructura del alqueno y la posición del doble enlace. Los ozónidos no son estables y generalmente se reducen inmediatamente con un agente reductor como zinc o sulfuro de dimetilo (SMe2). Los productos de esta reacción son aldehídos y cetonas 4._Polimerización El polímero es un compuesto de elevado peso molecular, cuya estructura puede considerarse -en una primera aproximación - constituido por muchas partes idénticas más pequeñas llamadas monómeros. Los alquenos se polimerizan por adición en presencia de catalizadores. Por ejemplo, al calentar etileno por encima de los 100 ºC y a presión de 100 atm. en presencia de pequeñas cantidades de oxigeno es convertido en polietileno. 100 ºC, 100 ATM n CH2=CH2 (-CH2-CH2-)n Siendo n 600 a 1000 unidades. El polietileno es duro, flexible aislante eléctrico y presenta gran resistencia a los agentes químicos . Es termoplástico, es decir que cuando es calentado se ablanda y fluye porque las moléculas se pueden deslizar unas sobre otras. En este estado pueden moldearse o transformarse en hojas o láminas delgadas que , al enfriarse, se solidifican. Los principales usos del polietileno son la fabricación de hojas y bolsas para envases, aislamiento de cables, juguetes , tuberías, artículos para el hogar, etc. El propeno o propileno es el monómero del polipropileno nCH2=CH-CH3 (-CH2-CH2-CH2-)n El polipropileno es un material termoplástico resistente, rígido, liviano, de buena resistencia al impacto , al calor y a los agentes químicos. Con excelentes propiedades dieléctricas. Se lo usa para equipamiento hospitalario y de laboratorio, piezas para plantas químicas y artículos domésticos. En forma de láminas se lo utiliza para embalajes y envases.. Se lo puede transformar en filamentos, con los que se realizan telas para filtros, cuerdas y redes para pesca. 5-Combustión: Los alqueno son combustibles y en estado gaseoso arden al aire, con llama luminosa y forman dióxido de carbono y agua. 2 CH2= CH2-CH3 +9 O2 6CO2 + 6 H2O Preparación de alqueno Industrialmente se los obtiene por descomposición térmica o cracking de alcanos, por ser éstos materia prima de bajo costo. En los laboratorios se los obtiene por distintos métodos , siendo todos ellos reacciones de eliminación. Las mismas consisten en separar dos átomos o grupos atómicos de carbonos contiguos. Los métodos más usuales son: a- Deshidratación de alcoholes: Por este método se puede obtener eteno, calentando a 180ºC una mezcla de un volumen de alcohol etílico y dos volúmenes de ácido sulfúrico concentrado, que actúa como deshidratante. La eliminación de una molécula de agua conduce a la formación de eteno: HO H H2SO4 H2C - CH2 H2C=CH2 En la deshidrogenación como en la deshidratación, si la eliminación puede dar por resultado la formación de más de un alqueno , se forma de manera predominante el alqueno más estable, que es el más sustituido con grupos alquilo. Esto se conoce como Regla de Saytzeff CH2CH2CHCH3 OH CH3CH=CHCH3 + CH3CH2CH=CH2 en mayor proporción b-Deshalogenación de dihalogenuros vecinales: Los dihalogenuros vecinales son los que poseen los dos átomos de halógeno sobre átomos de carbono vecinales. Los átomos de halógeno se eliminan calentando con polvo de zinc en solución alcohólica. La reacción resulta útil para purificar alquenos de una mezcla con alcanos que tengan puntos de ebullición muy próximos. La olefina se transforma en el dihalogenuro con bromo en oscuridad, el dibromuro se separa por destilación. El alqueno se regenera luego con zinc y alcohol. R R C Cl R´ R R´ C Cl + Zn C R R´ C R´ + ZnCl2