UNIVERSIDAD NACIONAL EXPERIMENTAL POLITÉCNICA DE LA FUERZA ARMADA SEMESTRE ASIGNATURA
Anuncio

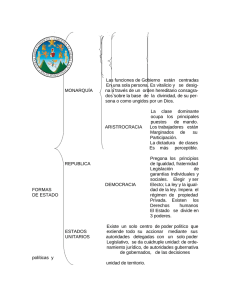
UNIVERSIDAD NACIONAL EXPERIMENTAL POLITÉCNICA DE LA FUERZA ARMADA CICLO BÁSICO DE INGENIERÍA ASIGNATURA QUÍMICA GENERAL HORAS PRÁCTICA LABORATORIO UNIDADES DE CRÉDITO 2 2 3 TEORÍA 2 1. OBJETIVO GENERAL Aplicar los conceptos fundamentales de la Química General en la resolución de problemas físicos químicos. SEMESTRE 4to. CÓDIGO QUF-22014 PRELACIÓN - 2. SINOPSIS DE CONTENIDO La asignatura Química General en el Ciclo Básico de Ingeniería, tiene como propósito proveer al futuro ingeniero de los conocimientos básicos y suficientes en lo que respecta a la composición, clasificación, propiedades y transformaciones de la materia y la aplicación, y proyección de estos en los procesos de su saber particular. UNIDAD 1. La estructura atómica. UNIDAD 2. Propiedades periódicas. UNIDAD 3. Enlace Químico. UNIDAD 4. Estequiometría. UNIDAD 5. Gases. UNIDAD 6. Líquidos. UNIDAD 7. Sólidos. UNIDAD 8. Soluciones. 3. ESTRATEGIAS METODOLÓGICAS GENERALES Diálogo Didáctico Real: que lo comprenden las actividades presenciales (comunidades de aprendizaje), tutorías y actividades electrónicas. Diálogo Didáctico Simulado: que son las actividades de autogestión académica y estudio independiente, así como los servicios de apoyo al estudiante. OBJETIVOS DE APRENDIZAJE CONTENIDO ESTRATEGIAS DE BIBLIOGRAFIA EVALUACIÓN Utilizar los números cuánticos en la UNIDAD 1. ESTRUCTURA Realización de Pruebas Cortas. Brown T., Lemay Jr., (1998). “Química la Realización de Pruebas Parciales. ciencia central”. Séptima edición. representación geométrica de los ATÓMICA. Realización de Talleres. Prentice Hall Hispanoamericana SA. orbitales atómicos. 1.1. El átomo como unidad fundamental Realización de Exposiciones de la materia. Diversas teorías Realización de Trabajo Escrito Chang R. (2007). “Química”. Novena atómicas: modelo de Thomson, edición. México. Mc Graw Hill. modelo atómico de Rutherford. El núcleo y los electrones periféricos. Espectro electromagnético. Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo 1.2. Teoría cuántica de radiación. Efecto Interamericano. fotoeléctrico. Modelo atómico de Bohr para el átomo de hidrógeno. Postulados, radio de las órbitas estacionarias, energía de los estados estacionarios, cambios de energía producidos en los saltos electrónicos. Aplicación del modelo a especies isoelectrónicas de hidrógeno. 1.3. Teoría atómica moderna: relación de Broglie. Principio de incertidumbre de Heisemberg. Ecuación de Schrodinger. Concepto moderno del átomo. Números cuánticos: Su relación con los niveles y subniveles electrónicos. Representación geométrica de los orbitales atómicos S.P.D.F. Caracterizar los elementos de acuerdo a: Radio atómico, potencial de ionización, electronegatividad y afinidad electrónica. UNIDAD 2. PERIÓDICAS. PROPIEDADES 2.1. Periodicidad química. Periodicidad química de las propiedades atómicas. Periodicidad en la variación del carácter ácido – base de compuestos de hidrógeno y de oxígeno. Carácter redox de los compuestos hidrogenados. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito Explicar la formación de los diferentes tipos de enlaces químicos. 3.1. Enlace Químico.Definición. Enlace Covalente (representación simbólica). Regla del octeto. 3.2. Enlace coordinado. Enlace iónico. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. 2.2. Energía relativa de los niveles y subniveles electrónicos. Regla de Hund. Principio de exclusión de Pauli. 2.3. Tabla Periódica.Configuración electrónica y tabla periódica (grupos y períodos). 2.4. Variaciones periódicas de los potenciales de ionización. Radio atómico y afinidad electrónica de los elementos. UNIDAD 3. ENLACE QUÍMICO. Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Umland y Bellama. (2000). “Química General”. Tomson International. Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito . Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. Energía de enlace. 3.3. Polaridad y electronegatividad. Cálculo del porcentaje del carácter iónico de un enlace. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. Umland y Bellama. (2000). “Química General”. Tomson International. Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano. Utilizar los principios estequiométricos en las reacciones químicas. UNIDAD 4. ESTEQUIOMETRÍA. 4.1. Principios de la estequiometría. Número de avogadro. Concepto de Mol. El atomógramo y la molécula gramo. Masa Atómica. Masa Molecular. Masa Formular. Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. gases. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. 4.3. Reacción y ecuación química. Fórmulas químicas, empíricas y moleculares. Reacción química. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. 4.4. Estequiometría de reacciones en solución acuosa. Cálculos ponderables y volumétricos usando las unidades de concentración: Molar, molal, normal, fracción molar de una reacción. 4.5. Reacciones de óxido-reducción. Número de oxidación. Método de ajustes de las reacciones redox. Umland y Bellama. (2000). “Química General”. Tomson International. 4.2. Volumen molar de Equivalente gramo. Expresar cuantitativamente y cualitativamente la desviación en el Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito UNIDAD 5. GASES los Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. comportamiento de un gas real y un gas ideal. 5.1. Propiedades generales. Presión, volumen y temperatura de los gases en condiciones normales y en otras condiciones. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. 5.2. Teoría cinética del gas ideal. Postulados de la teoría cinética. 5.3. Ley de Boyle. Velocidad molecular. Variación de la energía cinética con la temperatura. La constante de Boltzman. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. 5.4. Difusión Gaseosa. Ley de Graham de la difusión gaseosa. Determinar con precisión las propiedades generales de los líquidos: presión de vapor, evaporación, ebullición y destilación y emplearlas en el diagrama de fases de una sustancia. 5.5. Gases reales. Desviación del comportamiento ideal. Ecuación de Van der Waals. Covolumen. UNIDAD 6. LÍQUIDOS. 6.1. Propiedades generales: presión de vapor, evaporación, ebullición, destilación. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito . 6.2. Equilibrio líquido-vapor. Diagrama de fases. Punto triple. Caracterizar los sólidos de acuerdo a su sistema cristalino. UNIDAD 7. SÓLIDOS. 7.1. Propiedades cristalinas. Sistemas cristalinos simples. Parámetros. Celda. Unidad. 7.2. Tipos de empaquetamiento. Fracción de espacio libre en algunos tipos de empaquetamiento. Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. 7.3. Defectos reticulares. Clasificación. Defectos Intrínsecos. Equlibrios de defectos Schottky y Frenkel. Defectos extrínsecos. Efecto del dopado sobre el equilibrio químico. Conductividad Iónica. Defectos lineales: Dislocaciones. Defectos planares. Superficies e Interfases. Sólidos nanoestructurados y amorfos. Determinar con precisión las características de soluciones ideales binarias con componentes volátiles y soluciones binarias con soluto no volátil. UNIDAD 8. SOLUCIONES. 8.1. Soluciones ideales. Soluciones binarias con componentes volátiles. 8.2. Presión de las soluciones. Raoult. Realización de Pruebas Cortas. Realización de Pruebas Parciales. Realización de Talleres. Realización de Exposiciones Realización de Trabajo Escrito Ley de 8.3. Soluciones binarias con soluto no volátil. Soluciones con más de un componente volátil. Ley de Raoult. El potencial químico en soluciones ideales. Soluciones binarias y regla de la palanca. Cambios de estado por reducción isotérmica de la presión. Diagramas temperatura-composición. Cambios de estado con aumento de la temperatura. Destilación fraccionada. Solución ideal diluida. Ley de Henry. 8.4. Propiedades coligativas: presión de vapor, ascenso del punto de ebullición, descenso del punto de congelación y presión osmótica. 1.- Adquirir destreza en el empleo del mechero Bunsen y la balanza analítica. LABORATORIO Prueba corta (Quiz). Informe de laboratorio. Empleo del mechero Bunsen. La pesada PRACTICA No. 1 Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. Umland y Bellama. (2000). “Química General”. Tomson International. Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano. Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. 2.Iniciar y capacitar en el adiestramiento de un conjunto de operaciones y técnicas sencillas que se emplean en el laboratorio. 3.- Determinar la reactividad relativa de un grupo de metales, así como algunas características y propiedades. 4.- Sintetizar ioduro de zinc a partir de zinc metálico y cristales de yodo. 5.- Evaluar la constante “R” de los gases. en la balanza analítica. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. PRACTICA No. 2 Operaciones fundamentales. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. PRACTICA No. 3 Estudio cualitativo de la reactividad de un grupo de metales. PRACTICA No. 4 Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. Umland y Bellama. (2000). “Química General”. Tomson International. Síntesis de yoduro de zinc. PRACTICA No. 5 6.- Determinar la densidad de muestras problemas por métodos volumétricos gravimétricos. 7.- Determinar el peso molecular de un componente desconocido mediante el descenso del punto de congelación en una solución Benzoica. 8.Analizar algunas reacciones químicas y observar los cambios que ocurren en ella. Evaluación de la constante de la Ley de los gases. PRACTICA No. 6 Determinar de la densidad de muestras problemas. PRACTICA No. 7. Determinación del peso molecular por descenso del punto de congelación PRACTICA No. 8 Reacciones químicas. 9.- Realizar un análisis volumétrico por el método de neutralización. PRACTICA No. 9 10.Análisis volumétrico de una valoración de oxido-reducción. Preparación de soluciones. volumétrico. PRACTICA No. 10 Valoración oxido-reducción. Análisis Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano. BIBLIOGRAFÍA Brown T., Lemay Jr., (1998). “Química la ciencia central”. Séptima edición. Prentice Hall Hispanoamericana SA. Chang R. (2007). “Química”. Novena edición. México. Mc Graw Hill. Whitten, Gailey y Davis. (1992). “Química General”. Segunda edición. México. Mc Graw Hill. Atkins y Jones. (1998). “Química. Moléculas. Materia. Cambio”. Tercera edición. Omega S.A. Umland y Bellama. (2000). “Química General”. Tomson International. Maham, B. (1986) "Química. Curso Universitario". Fondo Educativo Interamericano.