El ENLACE QUÍMICO. (Tipos, características generales y ejemplos) Tipo de Características generales
Anuncio
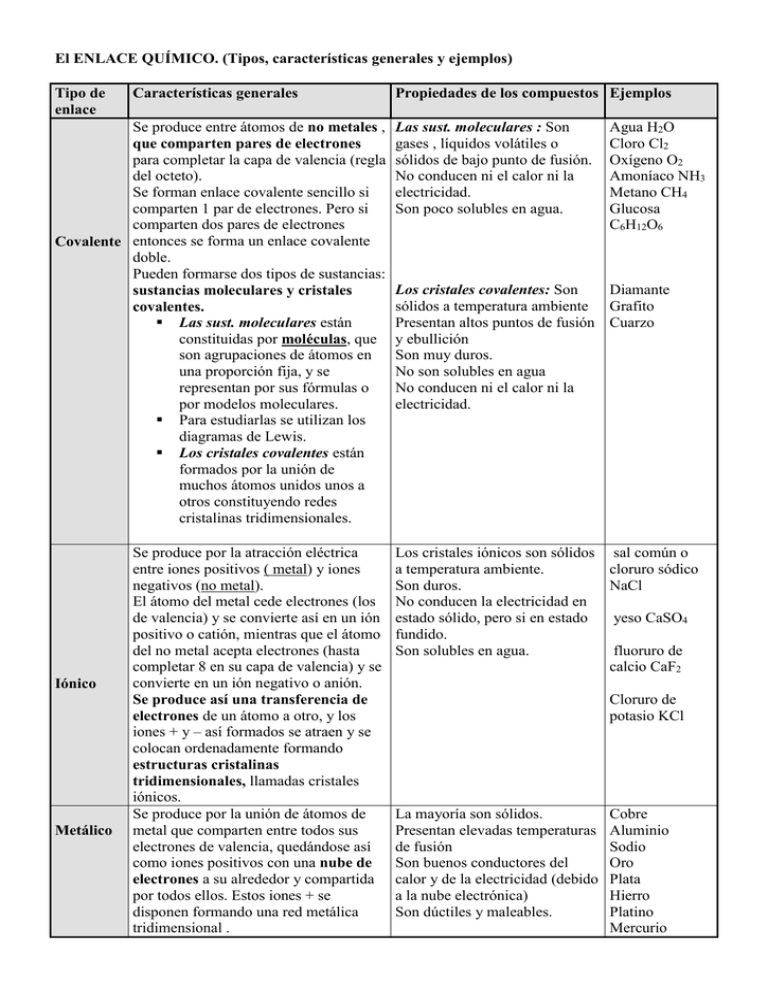
El ENLACE QUÍMICO. (Tipos, características generales y ejemplos) Tipo de enlace Características generales Se produce entre átomos de no metales , que comparten pares de electrones para completar la capa de valencia (regla del octeto). Se forman enlace covalente sencillo si comparten 1 par de electrones. Pero si comparten dos pares de electrones Covalente entonces se forma un enlace covalente doble. Pueden formarse dos tipos de sustancias: sustancias moleculares y cristales covalentes. Las sust. moleculares están constituidas por moléculas, que son agrupaciones de átomos en una proporción fija, y se representan por sus fórmulas o por modelos moleculares. Para estudiarlas se utilizan los diagramas de Lewis. Los cristales covalentes están formados por la unión de muchos átomos unidos unos a otros constituyendo redes cristalinas tridimensionales. Iónico Metálico Se produce por la atracción eléctrica entre iones positivos ( metal) y iones negativos (no metal). El átomo del metal cede electrones (los de valencia) y se convierte así en un ión positivo o catión, mientras que el átomo del no metal acepta electrones (hasta completar 8 en su capa de valencia) y se convierte en un ión negativo o anión. Se produce así una transferencia de electrones de un átomo a otro, y los iones + y – así formados se atraen y se colocan ordenadamente formando estructuras cristalinas tridimensionales, llamadas cristales iónicos. Se produce por la unión de átomos de metal que comparten entre todos sus electrones de valencia, quedándose así como iones positivos con una nube de electrones a su alrededor y compartida por todos ellos. Estos iones + se disponen formando una red metálica tridimensional . Propiedades de los compuestos Ejemplos Las sust. moleculares : Son gases , líquidos volátiles o sólidos de bajo punto de fusión. No conducen ni el calor ni la electricidad. Son poco solubles en agua. Agua H2O Cloro Cl2 Oxígeno O2 Amoníaco NH3 Metano CH4 Glucosa C6H12O6 Los cristales covalentes: Son Diamante sólidos a temperatura ambiente Grafito Presentan altos puntos de fusión Cuarzo y ebullición Son muy duros. No son solubles en agua No conducen ni el calor ni la electricidad. Los cristales iónicos son sólidos sal común o a temperatura ambiente. cloruro sódico Son duros. NaCl No conducen la electricidad en estado sólido, pero si en estado yeso CaSO4 fundido. Son solubles en agua. fluoruro de calcio CaF2 Cloruro de potasio KCl La mayoría son sólidos. Presentan elevadas temperaturas de fusión Son buenos conductores del calor y de la electricidad (debido a la nube electrónica) Son dúctiles y maleables. Cobre Aluminio Sodio Oro Plata Hierro Platino Mercurio











