Concentracion - Instituto Montini
Anuncio
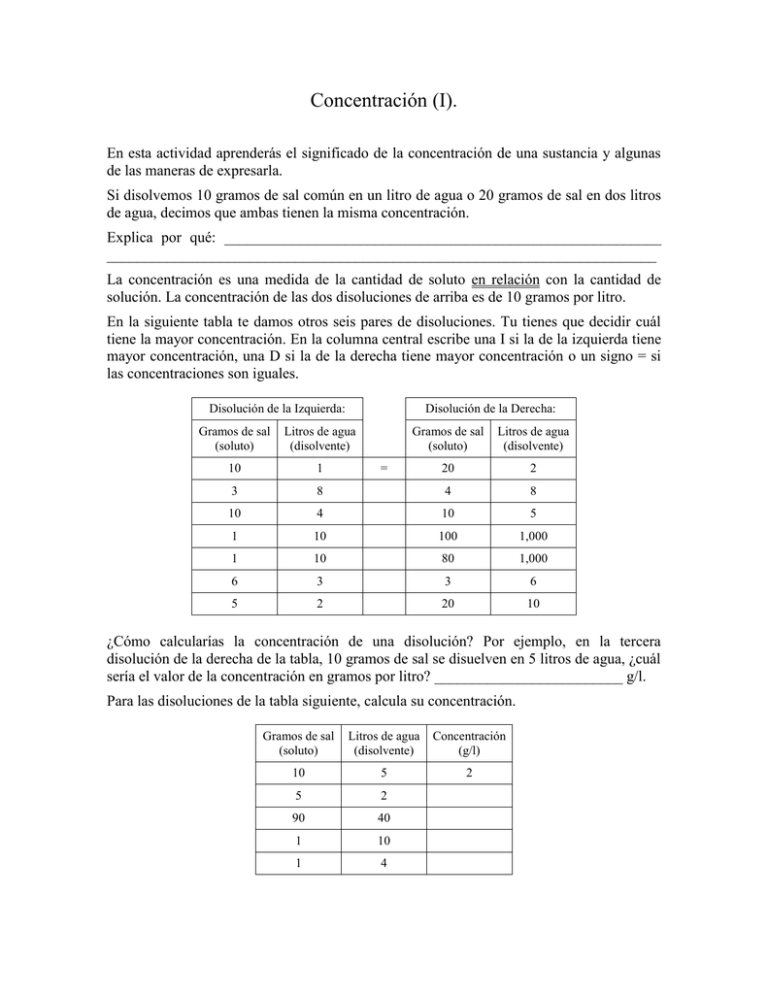
Concentración (I). En esta actividad aprenderás el significado de la concentración de una sustancia y algunas de las maneras de expresarla. Si disolvemos 10 gramos de sal común en un litro de agua o 20 gramos de sal en dos litros de agua, decimos que ambas tienen la misma concentración. Explica por qué: __________________________________________________________ _________________________________________________________________________ La concentración es una medida de la cantidad de soluto en relación con la cantidad de solución. La concentración de las dos disoluciones de arriba es de 10 gramos por litro. En la siguiente tabla te damos otros seis pares de disoluciones. Tu tienes que decidir cuál tiene la mayor concentración. En la columna central escribe una I si la de la izquierda tiene mayor concentración, una D si la de la derecha tiene mayor concentración o un signo = si las concentraciones son iguales. Disolución de la Izquierda: Disolución de la Derecha: Gramos de sal (soluto) Litros de agua (disolvente) Gramos de sal (soluto) Litros de agua (disolvente) 10 1 20 2 3 8 4 8 10 4 10 5 1 10 100 1,000 1 10 80 1,000 6 3 3 6 5 2 20 10 = ¿Cómo calcularías la concentración de una disolución? Por ejemplo, en la tercera disolución de la derecha de la tabla, 10 gramos de sal se disuelven en 5 litros de agua, ¿cuál sería el valor de la concentración en gramos por litro? _________________________ g/l. Para las disoluciones de la tabla siguiente, calcula su concentración. Gramos de sal (soluto) Litros de agua (disolvente) Concentración (g/l) 10 5 2 5 2 90 40 1 10 1 4 ¿Cuál de las disoluciones de la tabla anterior tendrá un “sabor más salado”? ________________________________________________________________________ En la tabla siguiente completa las cantidades de tres disoluciones posibles que tengan una concentración de 30 g/l (las primeras dos dan ya un dato; en la tercera tienes más libertad): Disoluciones con una concentración de 30 g/l Disolución #1 Gramos de sal: Disolución #2 Disolución #3 90 Litros de agua: 0.5 ¿Cuál de las tres tendría un “sabor más salado”? ________________________________ Discute con tus compañeros la pregunta siguiente: si tienes dos disoluciones de sal en agua, con concentraciones de 30 g/l y 50 g/l, ¿cuál de ellas tendrá más agua? (la respuesta es que no se puede saber, pero ¿por qué?). Existe una concentración muy especial de sal en agua, la cuál tiene un valor de 58.5 g/l. ¿Qué tiene ésta de especial? Primero recordemos cuál es la masa molecular del cloruro de sodio (NaCl): Masa atómica del Na + masa atómica del Cl = 23 + 35.5 = _______________ Como recordarás, esto quiere decir que un mol de NaCl tiene una masa de 58.5 gramos. Así, para el cloruro de sodio, una concentración de: 58.5 g/l equivale a 1 mol por litro De acuerdo a lo anterior, en la tabla siguiente realiza las conversiones que se te piden: Para la sal común: Concentración Concentración en g/l en mol/l 58.5 1 2 0.2 234 360 A la concentración, medida en moles por litro (mol/l), se le conoce como concentración molar o molaridad. El símbolo para representar la concentración molar es “M”. Así, por ejemplo, de la tabla anterior podemos ver que una disolución con una concentración de 2 M (2 mol/l) de NaCl, tendrá 117 gramos de esta sal por litro. Una disolución 4 M de NaCl, tendrá _______________________ moles de esta sal por litro y _____________________________ gramos de esta sal por litro. ¿Qué concentración molar se obtiene al disolver 2 moles de NaCl en medio litro de agua? _________________________________________________________________________ Supongamos ahora que agregamos 5 gramos de azúcar de mesa a un cuarto de litro. ¿Cuál será la concentración de esta disolución en gramos por litro? ________________________ Para convertir este valor a moles de azúcar por litro, tenemos que conocer su masa molecular. El azúcar de mesa (la sacarosa) tiene como fórmula química a C12H22O11. Así, su masa molecular puede calcularse como: 12 masa atómica del C + 22 masa atómica del H + 11 masa atómica del O = 12 12 + 22 1 + 11 16 = _________________ Es decir, un mol de C12H22O11 tiene una masa de 342 gramos. De acuerdo con esto, en la tabla siguiente realiza las conversiones que se te piden: Para el azúcar de mesa: Concentración Concentración en g/l en mol/l 342 1 2 0.2 171 2,052 Una disolución 4 M de sacarosa, tendrá _______________________ moles de este azúcar por litro y _________________________ gramos de este azúcar por litro. ---------------------------La glucosa es el azúcar simple más común en el organismo humano, cuya fórmula química es C6H12O6. Calcula a continuación su masa molecular: ________________________ = ___________________________ Es decir, un mol de C6H12O6 tiene una masa de _______________________________ g. En la tabla siguiente realiza las conversiones que se te piden: Para la glucosa: Concentración Concentración en g/l en mol/l 180 1 2 0.2 90 900 Una disolución 4 M de glucosa, tendrá _________________________ moles de este azúcar por litro y _______________________ gramos de este azúcar por litro. Tarea Una cucharadita de azúcar contiene más o menos 5 gramos. Una taza para café, tiene una capacidad aproximada de 250 ml (un cuarto de litro). Usa estos datos para responder las siguientes preguntas. Una persona prepara su café con 3 cucharaditas de azúcar en una taza. ¿Qué concentración de azúcar en gramos por litro tendrá este café? __________________________________ Un químico prepara su café con una concentración molar de 0.1 M de sacarosa. ¿Qué concentración de azúcar en gramos por litro tendrá este café? _____________ ¿Cuántos gramos de azúcar le pone a una taza de un cuarto de litro? ____________ Aproximadamente, ¿cuántas cucharaditas le pone? ________________________________ Averigua en tu casa cuánta azúcar le ponen a una limonada (tienes también que saber la cantidad de agua usada). Con esta información, calcula la concentración molar de azúcar de una limonada. Compara tu valor con el de tus compañeros para saber dónde hacen la limonada más dulce. (por si lo necesitas, una cuchara de azúcar contiene más o menos 15 gramos). Concentración (II). En esta actividad haremos más diluida y más concentrada una solución, y observaremos el efecto de este procedimiento sobre el valor de su concentración. También hablaremos de “solubilidad”. Tomemos una disolución de 100 gramos de sal en un litro de agua (concentración: 100 g/l) y agregémosle más agua. ¿Qué puede pasarle al valor de la concentración: aumentará o disminuirá? _________________________ Por ejemplo, si agregamos un litro más de agua a la solución anterior, ¿cuál será su concentración resultante? _______________________ Continúa tu razonamiento anterior para completar la tabla siguiente: Disoluciones con Litros de agua 100 gramos de sal agregada Litros de agua en total Concentración (g/l) - 1 100 1 2 50 3 10 999 ¿Cómo varía la concentración con la cantidad total de litros de agua? __________________ Verifica que, en cada caso, al multiplicar los litros totales de agua por la concentración, siempre se obtiene el valor de 100, que corresponde a la cantidad de gramos de sal. Si deseáramos una concentración de 4 g/l, ¿cuántos litros de agua habría que agregar a la disolución inicial? (Para resolver esto, auxíliate con la siguiente continuación de la tabla): 4 ¿Se puede llegar a una concentración de 0.001 g/l? _____________________________ ¿Se puede llegar a una concentración de 0.000001 g/l? __________________________ Discútelo con tus compañeros. Hagamos ahora el proceso inverso. Extraigamos agua pura de una disolución. ¿Qué puede pasarle al valor de su concentración al hacer esto: aumentará o disminuirá? _______________________________________________________________________ Extraer agua de una solución no es cosa de magia. Un método común para separar una disolución de un sólido en un líquido (como la sal en el agua de mar) es la destilación. Se calienta el agua para que se vaya evaporando o se hierve el agua, dejando así que la sal se quede a una mayor concentración. Supón que tenemos una disolución de 100 g de sal en 10 l de agua (concentración: 10 g/l) y extraemos 5 litros de agua pura, ¿cuál será su concentración resultante una vez que se agite bien? ____________________________________________________________________ El ejemplo anterior está sintetizado en la segunda fila de números de la tabla siguiente (la primera fila da los valores iniciales). Obsérvalos y continúa llenándola de acuerdo con ellos. Disoluciones con Litros de agua 100 gramos de sal extraída Litros de agua que quedan Concentración (g/l) - 10 10 5 5 20 9 0.5 9.9 ¿Crees que podamos llegar a concentraciones más y más grandes extrayendo agua? _________________________________________________________________________ Explica: __________________________________________________________________ Discute las siguientes ideas con tus compañeros. Imagina que tienes un litro de agua y le agregas un poco de sal. Esta se disolverá, ¿no es así? __________________________ Supón ahora que sigues agregando más y más sal, mezclándola con el agua. ¿Crees que llegará el momento en que el agua ya no pueda disolver toda la sal? _________________ ¿Crees que se pueden disolver 10 kilos de sal en un litro de agua? ___________________ -------------------------------------- En realidad, el agua tiene una capacidad máxima (solubilidad) para disolver la sal y otras sustancias. Por ejemplo, en un litro de agua se pueden disolver como máximo 360 gramos de sal. Si se le agrega más sal, el agua no podrá disolverla. Cuando se llega a esta concentración (360 g/l) se dice que se tiene una disolución saturada. ¿Cuántos gramos de sal se necesitan para saturar 5 litros de agua? ___________________ ¿Cuántos gramos de sal se necesitan para saturar 100 ml de agua? ___________________ ¿A cuánto equivale la concentración de saturación del cloruro de sodio en moles por litro? _________________________________________________________________________ La solubilidad de la sacarosa es aproximadamente de 6 mol/l (muy parecida a la de la sal común que obtuviste en el párrafo anterior). Es decir, se pueden disolver como máximo 6 moles de este azúcar en un litro de agua. ¿Cuántos gramos de este azúcar saturan un litro de agua? ______ ¿Cuántos gramos como máximo, del azúcar de mesa, se pueden disolverse en 100 ml de agua? ____________________________________________________________________ Concentración (III). En esta actividad continuaremos con la investigación de la segunda parte de este tema, en la que diluimos o hicimos más concentrada una disolución. Pensemos en la siguiente situación general. Tenemos una disolución inicial de un soluto y agua a la cual se le agrega o se le extrae cierta cantidad del soluto o de agua, obteniendo así una disolución final. Usando el ejemplo específico de la segunda parte, supongamos que tenemos una disolución de 100 g de sal en 10 l de agua y que extraemos de ella, 5 litros de agua pura. Construye una hoja de cálculo como la indicada a continuación para que represente este tipo de situaciones. Las celdas que necesitan fórmulas serían C11 y D11 para calcular las cantidades totales de soluto y agua en la disolución final (C11=C3+C7). También requieren de fórmulas las celdas E3, F3, E11 y F11 para calcular las concentraciones de la disolución inicial y final (nota que para la concentración molar necesitas la masa molecular del soluto dada en la celda A7). A 1 2 3 4 5 6 7 8 9 10 11 Nombre del soluto sal Masa molecular 58.5 B C D Datos disolución inicial: Cantidad Cantidad soluto (g) agua (l) 100 10 E F Concentración Concentración (g/l) molar (mol/l) 10 0.17094 Cantidades agregadas (+) o extraídas (-) Cantidad Cantidad soluto (g) agua (l) 0 -5 Datos disolución final: Cantidad Cantidad soluto (g) agua (l) 100 5 Concentración Concentración (g/l) molar (mol/l) 20 0.34188 Con tu hoja de cálculo, resuelve los siguientes problemas: A una disolución de 100 g de sal y 10 l de agua, se le extrae 9.5 l de agua. Por el mismo proceso de extracción de agua, se pierden también 15 g de sal. ¿Cuál es la concentración final de la disolución? ______________________________________ g/l _________________________________________________________________ mol/l. Comprueba que la concentración aumentó 17 veces. A una disolución de 100 gramos de sal y 10 litros de agua, se le agrega sal hasta que se satura a una concentración de 360 g/L. ¿Cuántos kilos de sal se tuvieron que agregar? ________ ¿Cuál fue la concentración molar final? ____________ En un frasco se tiene una disolución que contiene 20 ml (0.02 l) de agua a una concentración de 0.5 g/l. Encuentra la cantidad de sal que contiene (varía esta cantidad en tu hoja hasta que obtengas la concentración correcta) ________________________ ¿Qué cantidad de agua se le debe agregar a la disolución anterior para obtener una concentración molar de 0.01 g/l? ___________________________________________ A 2 l de agua se le agregan 100 g de azúcar de mesa (peso molecular: 342). ¿Cuál es la concentración molar de esta disolución? _____________________________________ ¿Qué cantidad de azúcar hay que agregar a la disolución anterior para que tenga una concentración molar de 1 mol/l? ____________________________________________ Se tiene un disolución de 2 l de agua con 100 g de azúcar. Encuentra cuatro manera de agregar agua y azúcar para que la concentración aumente a 200 g/l: Gramos de azúcar agregados: Litros de agua agregados: 1 manera: 2 manera: 3 manera: 4 manera: ¿Cuánta agua hay que dejar evaporar de la disolución original para llegar a una concentración de 200 g/l? ________________________________________________