NOMENCLATURA EN QUIMICA INORGANICA
Anuncio

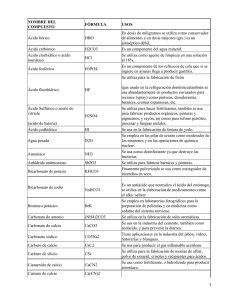
1 NOMENCLATURA EN QUIMICA INORGANICA La nomenclatura química es un sistema de símbolos y nombres, tanto para los elementos químicos como para los compuestos que resultan de las combinaciones químicas. El lenguaje de la química es universal, de tal manera que para el químico, el nombre de una sustancia no sólo se identifica sino que revela la fórmula y composición. La Unión Internacional de Química Pura y Aplicada (IUPAC) se reúne periódicamente con el fin de fijar las normas que se deben seguir para unificar el lenguaje y las técnicas de publicación. 1. Compuestos binarios. Son aquellos compuestos que están formados por dos elementos. En este grupo se distinguen los óxidos, hidruros, hidrácidos, sales binarias y peróxidos. a. Oxidos. Son compuestos binarios formados por un elemento y oxígeno. Los óxidos se dividen en dos grupos, de acuerdo con el carácter del elemento. Si es metálico, el óxido es básico o simplemente óxido. Cuando el elemento es no metálico el compuesto resultante es un óxido ácido o anhidrido. Se nombran: óxido de elemento (estado de oxidación) Cuando el elemento posee más de un estado de oxidación se puede usar la terminación oso para el menor y la terminación ico para el mayor. Oxido ferroso Oxido de fierro (II) Oxido férrico Oxido de fierro (III) Las fórmulas se escriben anotando primero el símbolo del elemento seguido por el oxígeno, su fórmula general es ExOy. 2 Eleme Estado nto Oxidación Fórmula Nombre K +1 K20 Oxido de potasio Na +1 Na2O Oxido de Sodio Cu +1 Cu2O Oxido de Cobre (I) Cu +2 CuO Oxido de cobre (II) Cl +1 Cl2O Oxido de Cloro (I) Cl +7 Cl2O7 Oxido de Cloro (VII) N +5 N2O5 Oxido de Nitrógeno (V) Cu2O óxido cuproso, óxido de cobre (I) CuO óxido cúprico, óxido de cobre (II). Si el elemento forma óxidos con cuatro estados de oxidación, el de menor estado de oxidación se nombra con el prefijo hipo y el sufijo oso, el con segundo estado de oxidación con el sufijo oso, el siguiente con sufijo ico y el con el mayor EO con el prefijo per y el sufijo ico. Ejemplos: Cl2O oso Cl2O3 Cl2O5 Cl2O7 Oxido hipocloroso Oxido cloroso ico Oxido clórico Oxido perclórico 3 b. Hidruros. Son compuestos binarios formados por un metal "M" y el hidrógeno. Se anota primero el metal y después el hidrógeno. Su fórmula general es MHx, donde x = EO. Se nombran: hidruro de metal Ejemplos: NaH Hidruro de sodio CaH2 Hidruro de calcio AlH3 Hidruro de aluminio c. Hidrácidos. Resultan de la unión de un no metal del grupo VI-A y VII-A con hidrógeno. El no metal utiliza siempre el EO menor. Su fórmula general es, respectivamente, HX o H2X. Se nombran: ácido elemento hídrico Ejemplos: HF Acido fluorhídrico HI ............................... HCl Acido clorhídrico H2Se ............................... HBr Acido bromhídrico H2Te .............................. H2Se H2S d. Sales binarias. Son compuestos binarios formados por un metal del grupo I o IIbA y un no metal del gupo VI o VIIA. Se anota el metal seguido del no metal (MXn). Se nombran: no metal uro de metal Ejemplos: 4 NaCl Cloruro de sodio K2S Sulfuro de potasio BiI3 Yoduro de bismuto (III) CuBr2 Bromuro de cobre (II), bromuro cúprico. 2. Compuestos ternarios. Están formados por tres elementos, entre ellos el oxígeno. a. Hidróxidos. También se denominan bases o álcalis. Son compuestos que resultan al reaccionar un óxido metálico con agua y están formados por un metal y uno o más grupos OH, dependiendo del estado de oxidación del metal. Su fórmula general es M(OH)n. Se nombran: hidróxido de elemento (EO). Ejemplos: NaOH Hidróxido de sodio Ba(OH)2 Hidróxido de bario Fe(OH)2 Hidróxido de fierro (II), hidróxido ferroso Fe(OH)3 Hidróxido de fierro (III), hidróxido férrico Ca(OH)2 Ni(OH)3 Pt(OH)4 Co(OH)2 Mg(OH)2 Hidróxido de escandio Hidróxido de cadmio Pb(OH)4 5 b. Acidos ternarios u oxiácidos. Están formados por hidrógeno, no metal y oxígeno. Se obtienen al reaccionar un óxido ácido con agua, su fórmula general es HnXOm. N2O3 + H20 H2N2O4 = HNO2 Oxido nitroso Acido nitroso CO2 + H20 H2CO3 Oxido carbónico Acido carbónico Si el no metal tiene varios EO existen varios ácidos, uno para cada EO. En ese caso, para nombrar el ácido se usan los sufijos oso, ico y los prefijos hipo y per, según proceda. Cuando el no metal tiene sólo un EO se usa la terminación ico. Los ácidos se nombran: ácido no metal oso ico En algunos casos (P, As, Sb, B), el óxido puede reaccionar con 1, 2 ó 3 moléculas de agua, obteniéndose en cada caso ácidos diferentes. Se nombran anteponiendo los prefijos: meta (1 H2O), piro (2 H2O) y orto (3 H2O). P2O3 + H2O H2P2O4 ===> HPO2 P2O3 + 2H2O H4P2O5 ===> H4P2O5 Ac. pirofosforoso P2O3 + 3H2O H6P2O6 ===> H3PO3 P2O5 + H2O P2O5 + 2H2O P2O5 + 3H2O B2O3+ H2O Ac. metafosforoso Ac. ortofosforoso 6 c. Sales ternarias. Resultan al reaccionar un ácido con un hidróxido. Se reemplaza el o los hidrógenos del ácido por el metal del hidróxido y se desprende agua. Las sales toman el nombre del ácido del cual derivan, cambiando la terminación oso por ito e ico por ato. Se llama anión al grupo atómico que resulta al eliminar parcial o totalmente los hidrógenos del ácido. Ejemplos de aniones: Fórmula ácido Nombre ácido Fórmula anión Nombre anión H4P2O5 Ác. pirofosforoso P2O54- Pirofosfito H2CO3 Ác. carbónico CO3= Carbonato H2CO3 Ác. carbónico HCO3- Bicarbonato Se nombran las sales: anión de metal (EO). Ejemplos: HNO2 + NaOH Ácido nitroso H3PO4 hidróxido de sodio + Fe(OH)3 NaNO2 + Nitrito de sodio Fe PO4 + Ácido ortofosfórico hidróxido de fierro Ortofosfato férrico HClO4 Mg(HClO4)2 + Mg(OH)2 H2O + 3 H2O 2 H2O Ácido perclórico hidróxido de magnesio Perclorato de magnesio 3 H2SO4 Al2(SO4)3 Ácido sulfúrico + 2 Al(OH)3 hidróxido de aluminio + Sulfato de aluminio 6 H2O 7 GUIA EJERCICIOS NOMENCLATURA 1. Escriba el símbolo y la(s) valencia(s) principal(es) de los siguientes elementos: a. Plomo b. Estaño c. Mercurio d. Cobre e. Cinc f. Neón g. Cesio h. Talio i. Manganeso j. Magnesio k. Azufre l. Antimonio 3. Escriba la fórmula y el nombre de los óxidos de los elementos de la pregunta anterior. 4. Escriba la fórmula y el nombre de los hidróxidos y ácidos de los elementos de la pregunta 1. 5. Escriba la fórmula de los siguientes compuestos: a. Oxido de cobre (II) b. Oxido perclórico c. Acido selenhídrico d. Borato de sodio e. Hidróxido de calcio f. Sulfuro férrico g. Oxido de manganeso (VII) h. Arseniato de potasio i. Sulfito de sodio j. Sulfato de aluminio k. Fluoruro de bario l. Acido cloroso m. Hipoclorito de sodio n. Carbonato de calcio o. Nitrato de sodio p. Nitrito de magnesio q. Metafosfito de potasio r. Acido selenhídrico s. Hidruro de litio t. Peróxido de potasio u. Oxido de plata (I) v. Ortofosfato diácido de sodio 8 TABLA PERIODICA