/20
Anuncio

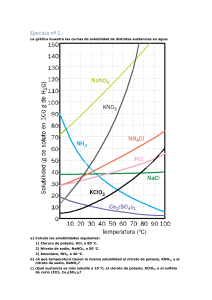
Examen Diversidad de la Materia Nombre y Apellidos: 3º ESO /20 1. Clasifica las siguientes mezclas en homogéneas y heterogéneas (1 punto) y explica DETALLADAMENTE cómo separarías sus componentes a. arena y agua (1 punto) Se trata de una mezcla heterogénea, y el método de separación que emplearía es la filtración. Usaría un papel de filtro colocado en un embudo, sobre el cual vertería la mezcla, que recogería en un vaso de precipitados. La arena quedaría en el papel de filtro, y el agua en el vaso, ya que la arena es insoluble en el agua. b. aceite y agua (1 punto) Se trata de una mezcla heterogénea, y el método de separación que usaría es la decantación. Vertería la mezcla en un embudo de decantación, con lo que el agua, más densa que el aceite, quedaría en la parte inferior y el aceite en la superior. Abriría la llave y recogería el agua en un vaso de precipitados, quedando el aceite en el embudo. c. alcohol y agua (1 punto) Se trata de una mezcla homogénea o disolución, y el método a usar es la destilación simple. Vertería la mezcla en un matraz con un tapón en el que debe ir un termómetro para controlar la temperatura. El matraz, que se calentaría hasta alcanzar una temperatura superior a la de ebullición del alcohol e inferior a la del agua, estaría conectado a un serpentín que recogería el alcohol vaporizado y lo enfriaría. Este método se basa en las diferentes temperaturas de ebullición del agua y el alcohol. d. agua con sal y azúcar disueltos en ella (2 puntos) Se trata de una mezcla homogénea o disolución. Primero evaporaría el agua, recogiendo la mezcla de azúcar y sal. Luego la vertería en alcohol, en el que se disolvería el azúcar, pero no la sal, que es insoluble en alcohol. Filtraría esta nueva mezcla, con lo que obtendría la sal. Luego evaporaría el alcohol, con lo que separaría el azúcar. 2. Medimos la masa en gramos de oxígeno y de dióxido de carbono que se disuelven en 1 litro de agua a diferentes temperaturas. En esta experiencia, la presión se mantiene constante (1 atm) Solubilidad (g/l de agua) O2 CO2 0ºC 0,07 3,3 20ºC 0,04 1,7 fisicayquimica.com 40ºC 0,03 1,0 60ºC 0,02 0,6 a. ¿Cómo varía la solubilidad del oxígeno y del dióxido de carbono en el agua al aumentar la temperatura? (1 punto) Disminuye al aumentar la temperatura. b. ¿Puedes explicar por qué el tapón de una botella de cava sale con más fuerza cuando la botella está a temperatura ambiente que cuando está recién sacada de un frigorífico? (1 punto) Porque el CO2 es menos soluble a temperatura ambiente, con lo cual se acumula en la botella y hace saltar el tapón con más fuerza que cuando la botella es sacada del frigorífico, pues estando fría tiene más CO2 disuelto en el cava. c. Ciertas especies acuáticas acostumbradas a aguas frías pueden morir al ser trasladadas a aguas más cálidas. ¿Por qué? (1 punto) Por la menor concentración de oxígeno y CO2 en las aguas cálidas. 3. ¿Qué volumen de alcohol contiene una botella de licor de 750 ml en cuya etiqueta se puede leer 40º? (40º = 40% v/v) (1 punto) Sabiendo que la densidad del alcohol es 0,8 g/ml, calcula cuántos gramos de alcohol contiene la botella (1 punto) 40º indica que el 40% del volumen del licor es alcohol puro, por lo que procederemos a calcular el 40% de 750 ml. 750 ml 40% 750 40 750 ml 40 300 ml de alcohol 100 100 Como la densidad nos indica la relación entre la masa y el volumen, conociendo la densidad y el volumen podemos calcular la masa. m g m V 0,8 300 ml = 240 g de alcohol V ml 4. Preparamos una disolución que contiene 10 g de nitrato de potasio y 15 g de cloruro de potasio en 475 g de agua. a. ¿Cómo clasificarías esta disolución según el número de componentes? (1 punto) Ternaria. b. ¿Cuál es el disolvente? ¿Y el soluto? (1 punto) El disolvente es el agua, y los solutos son el nitrato de potasio y el cloruro de potasio. c. Calcula el tanto por ciento en masa, % m/m, de cada soluto. (1 punto) Lo primero es calcular la masa total de la disolución, mdisolución = (10 + 15 + 475) g = 500 g Ahora basta con usar la definición del porcentaje en masa, % (m / m) masa de soluto 100 masa de la disolución Para el caso del nitrato de potasio, % (m / m) masade nitrato de potasio 10 g 100 100 2% de nitrato de potasio masade la disolución 500 g Para el caso del cloruro de potasio, fisicayquimica.com % (m / m) masade cloruro de potasio 15 g 100 100 3% de cloruro de potasio masade la disolución 500 g 5. A la vista de la curva de solubilidad de la página siguiente: a. ¿Cuál es la más soluble a 20ºC? ¿y la menos? (1 punto) La más soluble es el clorato de sodio, y la menos el sulfato de potasio. b. ¿A qué temperatura coinciden la solubilidad del sulfato de cobre y el cloruro de sodio? (1 punto) 156º c. ¿Cuál es la solubilidad del sulfato de cobre a 80ºC? (1 punto) 162 g d. ¿A qué temperatura tiene el clorato de sodio una solubilidad de 90 g? (1 punto) 111º e. ¿Qué masa de cristales de sulfato de potasio se formará si una disolución saturada en 100 g de agua se enfría de 80º a 20º? (1 punto) 20 g – 10 g = 10 g f. ¿Qué masa de cristales de nitrato de potasio se formará si una disolución saturada en 300 g de agua se enfría de 50º a 10º? (1 punto) Como la gráfica nos da datos de solubilidad por cada 100 g de agua, habrá que multiplicar por 3 para tener datos relativos a 300 g de agua, 3 × (80 – 20) g = 3 × 60 g = 1180 g fisicayquimica.com