Contenidos 2 Bac
Anuncio
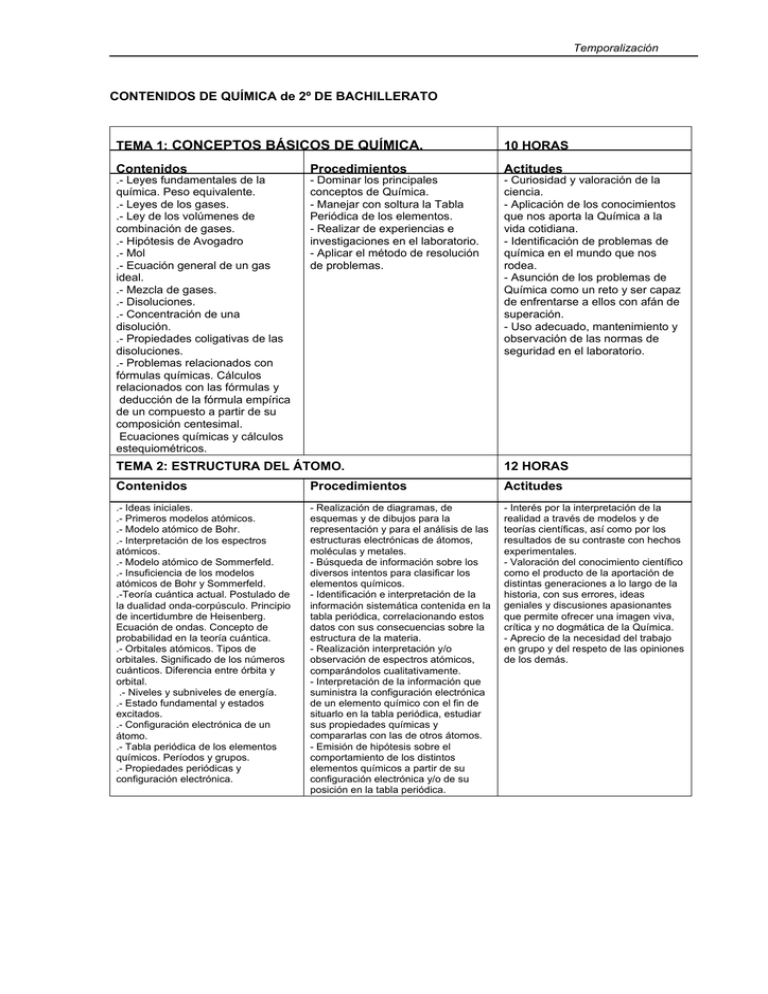
Temporalización CONTENIDOS DE QUÍMICA de 2º DE BACHILLERATO TEMA 1: CONCEPTOS BÁSICOS DE QUÍMICA. 10 HORAS Contenidos Procedimientos Actitudes .- Leyes fundamentales de la química. Peso equivalente. .- Leyes de los gases. .- Ley de los volúmenes de combinación de gases. .- Hipótesis de Avogadro .- Mol .- Ecuación general de un gas ideal. .- Mezcla de gases. .- Disoluciones. .- Concentración de una disolución. .- Propiedades coligativas de las disoluciones. .- Problemas relacionados con fórmulas químicas. Cálculos relacionados con las fórmulas y deducción de la fórmula empírica de un compuesto a partir de su composición centesimal. Ecuaciones químicas y cálculos estequiométricos. - Dominar los principales conceptos de Química. - Manejar con soltura la Tabla Periódica de los elementos. - Realizar de experiencias e investigaciones en el laboratorio. - Aplicar el método de resolución de problemas. - Curiosidad y valoración de la ciencia. - Aplicación de los conocimientos que nos aporta la Química a la vida cotidiana. - Identificación de problemas de química en el mundo que nos rodea. - Asunción de los problemas de Química como un reto y ser capaz de enfrentarse a ellos con afán de superación. - Uso adecuado, mantenimiento y observación de las normas de seguridad en el laboratorio. TEMA 2: ESTRUCTURA DEL ÁTOMO. 12 HORAS Contenidos Procedimientos Actitudes .- Ideas iniciales. .- Primeros modelos atómicos. .- Modelo atómico de Bohr. .- Interpretación de los espectros atómicos. .- Modelo atómico de Sommerfeld. .- Insuficiencia de los modelos atómicos de Bohr y Sommerfeld. .-Teoría cuántica actual. Postulado de la dualidad onda-corpúsculo. Principio de incertidumbre de Heisenberg. Ecuación de ondas. Concepto de probabilidad en la teoría cuántica. .- Orbitales atómicos. Tipos de orbitales. Significado de los números cuánticos. Diferencia entre órbita y orbital. .- Niveles y subniveles de energía. .- Estado fundamental y estados excitados. .- Configuración electrónica de un átomo. .- Tabla periódica de los elementos químicos. Períodos y grupos. .- Propiedades periódicas y configuración electrónica. - Realización de diagramas, de esquemas y de dibujos para la representación y para el análisis de las estructuras electrónicas de átomos, moléculas y metales. - Búsqueda de información sobre los diversos intentos para clasificar los elementos químicos. - Identificación e interpretación de la información sistemática contenida en la tabla periódica, correlacionando estos datos con sus consecuencias sobre la estructura de la materia. - Realización interpretación y/o observación de espectros atómicos, comparándolos cualitativamente. - Interpretación de la información que suministra la configuración electrónica de un elemento químico con el fin de situarlo en la tabla periódica, estudiar sus propiedades químicas y compararlas con las de otros átomos. - Emisión de hipótesis sobre el comportamiento de los distintos elementos químicos a partir de su configuración electrónica y/o de su posición en la tabla periódica. - Interés por la interpretación de la realidad a través de modelos y de teorías científicas, así como por los resultados de su contraste con hechos experimentales. - Valoración del conocimiento científico como el producto de la aportación de distintas generaciones a lo largo de la historia, con sus errores, ideas geniales y discusiones apasionantes que permite ofrecer una imagen viva, crítica y no dogmática de la Química. - Aprecio de la necesidad del trabajo en grupo y del respeto de las opiniones de los demás. Temporalización TEMA 3: EL ENLACE QUÍMICO. 16 HORAS Contenidos Procedimientos Actitudes .- El enlace químico. .- Enlace iónico. Geometría de los compuestos iónicos. Número de coordinación. Energía reticular de un sólido iónico. .- Enlace covalente mediante la teoría de Lewis. Limitaciones de la teoría de Lewis del enlace covalente. .- Teoría moderna del enlace covalente.. Método del enlace de valencia (EV). .- Geometría de las moléculas covalentes. .- Hibridación. .- Carácter iónico del enlace covalente.. Distinción entre polaridad de enlace y de una molécula. .- Resonancia. .- Fuerzas intermoleculares. .- Enlace metálico. Modelo de la nube de electrones. Modelo de bandas. .- Propiedades de los compuestos según su tipo de enlace. .- Propiedades de los sólidos metálicos - Estudio del enlace en función de la tendencia a ganar o perder electrones por parte de los átomos. - Utilización de las propiedades periódicas de los elementos químicos y del balance energético mediante el ciclo de Born-Haber en la formación de enlaces iónicos. - Utilización del modelo de solapamiento de orbitales para la descripción de la formación de enlaces covalentes a partir de la compartición de electrones. - Interpretación de la geometría de las moléculas sencillas por medio del modelo de repulsión de pares de electrones, tomando como base las estructuras de Lewis. - Utilización del modelo de enlace metálico para justificar algunas de las propiedades de los metales. - Comparación de las características de los distintos tipos de enlace y establecimiento de criterios para su distinción. - Predicción de fórmulas de compuestos sencillo, a partir de los átomos que intervienen en la molécula y de sus posiciones en la tabla periódica - Formulación y nombramiento de compuestos inorgánicos según las reglas de la IUPAC - Interés por la observación de fenómenos naturales, su interpretación a través de modelos y la confrontación experimental de éstos. - Valoración de la necesidad de un lenguaje común y de notaciones claras y sencillas que ayuden a comprender un fenómeno o propiedad y a entendernos con los demás. - Apreciar y valorar la necesidad de las normas de seguridad en toda actividad así, como la necesidad de conocerlas y respetarlas. Temporalización TEMA 4: TERMODINÁMICA 8 HORAS Contenidos Procedimientos Actitudes .- Definiciones y magnitudes. .- Calor y trabajo. .- Energía interna. Primer principio de la termodinámica. Transformaciones termodinámicas. .- Entalpía. Entalpía normal. Entalpía normal de reacción. .- Ley de Hess. .- Entalpía de enlace. .- Segundo principio de la termodinámica. Desorden. Entropía. .- Entropía e irreversibilidad. .- Energía libre de Gibbs. Discusión de la espontaneidad de una reacción química. - Formulación de ecuaciones termodinámicas sencillas realizando el cálculo de entalpías de formación y reacción y, mediante la formulación de rutas alternativas en varios pasos, confirmación de la ley de Hess. - Realización de diagramas en los que se ponga de manifiesto los enlaces que se rompen y que se forman en el curso de una reacción química. - Resolución de problemas y ejercicios en los que se relacionen la estequiometría de una reacción y la energía intercambiada en el proceso. - Análisis y estudio de los factores que afectan a la espontaneidad de una reacción química. - Elaboración de criterios que determinen la espontaneidad de una reacción química. - Interés por la observación y la interpretación de los flujos de energía en los fenómenos del entorno, y por su confrontación con los modelos experimentales. - Respeto por las normas de utilización de combustibles comburentes y de máquinas, tanto en el laboratorio como en el uso cotidiano. - Valoración de las aplicaciones tecnológicas de la Termodinámica en la mejora de las condiciones de vida y como respuesta a los requerimientos de la Sociedad actual. - Toma de conciencia y compromiso en el empleo idóneo de las combustiones y en la adopción de medidas que minimicen las alteraciones ambientales y/o las incidencias en la salud. TEMA 5: CINÉTICA QUÍMICA 8 HORAS Contenidos Procedimientos Actitudes .- Cinética Química. .- Velocidad de reacción. Medida de la velocidad de reacción. .- Teorías de las reacciones químicas .- Estudio de los factores de los que depende la velocidad de reacción. Influencia del estado físico de las sustancias reaccionantes. .- Catalizadores. . -Orden de una reacción. .- Mecanismo de reacción. - Diseño y realización de reacciones químicas a diferentes velocidades, mediante la modificación de sus condiciones (variables de estado, concentraciones y catalizadores). - Elaboración de informes sobre la evolución experimental de una reacción química y, tomando datos de la propiedad de seguimiento frente al tiempo a de concentración/tiempo, realización de la estimación gráfica y/o analítica de su velocidad. - Realización de cálculos, gráficos y analíticos, estimando la propagación de errores y la significatividad de los resultados. - Valoración de las teorías cinetoquímicas como búsqueda interpretativa de la realidad y para proponer soluciones o respuestas tecnológicas a las demandas de la humanidad. - Interés por la realización correcta de cálculos, analíticos o gráficos, en la confección de informes, respetando las normas de utilización de datos y de errores en los operacionales y valorando la importancia de la pulcritud en todas las fases de realización. Temporalización TEMA 6: EQUILIBRIO QUÍMICO 8 HORAS Contenidos Procedimientos Actitudes .- Reacciones reversibles e irreversibles. .- Cinética química y equilibrio. Ley de Acción de Masas. .- Cociente de reacción. Constante de equilibrio . Formas de expresar la constante de equilibrio: Kp y Kc. Relacción entre ambas. .- Grado de disociación. .- Factores que modifican al equilibrio químico: principio de Le Châtelier. .- Termodinámica y equilibrio. Variación de la constante de equilibrio con la temperatura. .- Equilibrio heterogéneo. Producto de solubilidad. Reacciones de precipitación. - Aplicación de la ley de Acción de Masas a estados de equilibrio químico. - Aplicación de las leyes de la estequiometría al estudio de la evolución de un equilibrio y al cálculo de la constante. - Utilización de las relaciones entre las distintas constantes de equilibrio. - Formulación de hipótesis sobre la evolución de algún equilibrio químico al modificar los factores que lo condicionan, contrastando las predicciones documentalmente y/o experimentalmente. - Búsqueda de información sobre procesos industriales que implique situaciones de equilibrio. - Valoración del efecto que tiene sobre el medio ambiente la alteración de los equilibrios que se dan en la naturaleza. - Valoración de la importancia que tienen los sistemas en equilibrio en el estudio y resolución de los problemas industriales, medioambientales y de la vida cotidiana. TEMA 7: EQUILIBRIO ÁCIDO-BASE. 12 HORAS Contenidos Procedimientos Actitudes .- Concepto de ácido-base según las teorías de Arrhenius, BrönstedLowry y de Lewis. . El equilibrio de autoprotólisis del agua. Concepto de pH. . Fuerza de los ácidos y de las bases. Constantes de disociación y grado de ionización. .- Reacciones de neutralización. Punto de equivalencia. - Volumetrías de neutralización ácido base. Indicadores. Valoración de un ácido fuerte con una base fuerte. Valoración de ácido débil con base fuerte. .- Disolución de sales en agua: reacción de hidrólisis. - Elaboración de tablas clasificadoras y comparativas de sustancias como ácidas o básicas, según sus diferencias experimentales de reactividad, y comparación de estos comportamientos con los que ocurren en el entorno. - Determinación de la concentración de disoluciones de ácidos y de bases a partir de valores del pH. - Cálculo de concentraciones y de volúmenes requeridos para una neutralización y realización experimental de la volumetría, con indicación colorimétrica del punto final. - Predicción de los valores de pH de disoluciones de sales que implique una hidrólisis y contraste cualitativo de los cálculos con medidas experimentales. - Búsqueda de información y elaboración de informes sobre métodos de obtención, usos y aplicaciones de algunos ácidos y bases como por ejemplo: ácido nítrico, ácido acético, amoníaco - Interés por la realización correcta de cálculos, analíticos o gráficos, en la confección de informes, respetando las normas de utilización de datos y de errores en los operacionales y valorando la importancia de la pulcritud en todas las fases de realización. - Actitud reflexiva y crítica sobre la utilización rigurosa de términos químicos, tanto en los medios de comunicación y en la publicidad como en las conversaciones o debates. - Valoración de la importancia de las teorías ácido base en la construcción del conocimiento químico de las sustancias Temporalización TEMA 8: REACCIONES REDOX 12 HORAS Contenidos Procedimientos Actitudes .- Oxidación y reducción. Oxidantes y reductores. Número de oxidación. .- Ajuste de las reacciones redox: método del ión-electrón. .- Estequiometría de las reacciones redox. .- Pilas galvánicas. Representación simbólica de las pilas. .- Potencial normal de electrodo. Escala normal de potenciales. .- Espontaneidad de los procesos redox. .- Electrólisis. Leyes de Faraday. Analogías y diferencias entre una pila galvánica y una cuba electrolítica. .- Aplicaciones de los procesos electrolíticos. - Utilización del método del ion electrón como sistema de ajuste de las reacciones químicas en las que hay transferencia de electrones. - Aplicación de las leyes de la estequiometría a los procesos redox, incluido el cálculo del número de electrones. - Utilización de la escala de potenciales normales de reducción para predecir la espontaneidad de un proceso redox. - Búsqueda de información y elaboración de informes sobre la obtención de algún metal, la corrosión, formas de protegerlo, en procesos industriales, como por ejemplo en la fabricación de automóviles y su importancia en la tecnología y la sociedad. - Valoración de la trascendencia de las aplicaciones tecnológicas de la Electroquímica en la mejora de las condiciones de vida en la sociedad actual. - Sensibilización y compromiso ante el proceso de recogida selectiva de pilas y de acumuladores de desecho, evaluando la capacidad que tienen para producir alteraciones en el medio ambiente. - Interés por la realización correcta de cálculos, analíticos o gráficos, en la confección de informes, respetando las normas de utilización de datos y de errores en los operacionales y valorando la importancia de la pulcritud en todas las fases de realización. TEMA 9: QUÍMICA DESCRIPTIVA 6 HORAS Contenidos Procedimientos Actitudes .-Estudio de los grupos principales: alcalinos, alcalinotérreos, térreos, carbonoideos, nitrogenoideos, anfígenos, halógenos. .- Estudio de los principales compuestos de hidrógeno, oxígeno, nitrógeno y azufre: Hidruros Óxidos Ácidos - Recogida de información, contraste y elaboración de informes relacionados con problemas relacionados con la Química y relevantes para la sociedad actual. - Búsqueda de información y elaboración de informes sobre métodos de obtención, usos y aplicaciones de algunos ácidos y bases como por ejemplo: ácido nítrico, ácido sulfúrico, amoníaco. - Análisis de algún proceso industrial importante para el desarrollo y economía de nuestro país. - Valorar las respuestas que da la Química a las necesidades de la Humanidad mediante la producción de materiales y el incremento en la producción de alimentos y medicinas que redundan en la calidad de vida. - Valorar críticamente el efecto de los productos químicos presentes en el entorno: sobre la salud, el patrimonio artístico y el futuro de nuestro planeta, analizando las medidas internacionales que se establecen a este respecto. Temporalización TEMA 10: QUÍMICA DEL CARBONO 16 HORAS Contenidos Procedimientos Actitudes .- Las reacciones en Química Orgánica. .- Tipos de ruptura de los enlaces covalentes. .- Iones orgánicos y radicales en las reacciones de Química Orgánica. .- Reactivos nucleófilos y electrófilos. .- Efecto inductivo. .- Resonancia y efecto mesómero. -. Mecanismo de reacción. .- Reacciones de sustitución. .- Reacciones de adición. .- Reacciones de eliminación. .- Reacciones de transposición. .-Reacciones a través de radicales libres. .- Reacciones de oxidación y reducción en Química Orgánica. .- Reacciones de polimerización. Polimerización de adición y por condensación. .- Polímeros naturales. Caucho. Proteínas. Polímeros de la glucosa. - Observación de la evolución gradual de alguna propiedad en una serie homóloga y con el cambio de grupo funcional. - Diseño y realización experimental de alguna ruta de síntesis sencilla de un compuesto orgánico elemental. - Observación experimental de alguna transformación biológica, espontánea y/o inducida, en algún compuesto orgánico. - Representación gráfica en fórmula estructural de compuestos de carbono y su nomenclatura según las reglas de la IUPAC. - Valorar el interés económico e industrial que tienen los polímeros artificiales y naturales, justificando según su estructura algunos rasgos que les dan este interés. - Valoración de la trascendencia del conocimiento de las transformaciones de los compuestos de carbono en los seres vivos, juzgando objetivamente la intervención en ellas. - Valoración de la trascendencia del conocimiento generado por la Química Orgánica en la sociedad actual e interés por la búsqueda de objetividad ante informaciones procedentes de diversas fuentes. - Valoración de las aplicaciones de los compuestos orgánicos a la mejora de las condiciones de vida de las personas y de sus influencias en la sociedad actual. - Reflexión crítica sobre la mejora de la calidad de vida que supone la sustitución de los materiales tradicionales (metales, madera, lana, cuero, lino, algodón, etc.) por estos nuevos materiales (los polímeros) y su coste social (crisis del acero) y medioambiental (residuos, contaminación). TEMPORALIZACIÓN A modo de aproximación, y considerando que puede variar con las características específicas del grupo, la distribución temporal programada para el próximo curso se describe en el siguiente cuadro. El tema 7probablemente se impartirá entre el segundo y tercer trimestre. TEMA 1: CONCEPTOS BÁSICOS DE QUÍMICA. 12 HORAS TEMA 2: ESTRUCTURA DEL ÁTOMO. 12 HORAS TEMA 3: EL ENLACE QUÍMICO. 16 HORAS TEMA 4: TERMODINÁMICA 8 HORAS TEMA 5: CINÉTICA QUÍMICA 8 HORAS TEMA 6: EQUILIBRIO QUÍMICO 8 HORAS TEMA 7: EQUILIBRIO ÁCIDO-BASE. 12 HORAS TEMA 8: REACCIONES REDOX 12 HORAS TEMA 9: QUÍMICA DESCRIPTIVA 6 HORAS TEMA 10: QUÍMICA DEL CARBONO 16 HORAS 1er Trimestre 2º Trimestre 3er Trimestre Temporalización






