ciencias 6º: cambios de estado
Anuncio

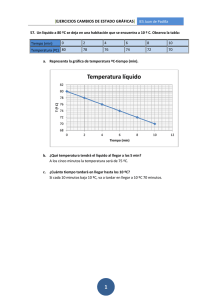
FÍSICA Estudia los procesos físicos, es decir, aquellos en que no cambia la naturaleza de las sustancias. Por ejemplo : los cambios de estado, el movimiento, la acción de las fuerzas, la presión… CAMBIOS DE ESTADO La sustancia adquiere otro estado físico, pero sin cambiar su naturaleza. Los SÓLIDOS tienen sus partículas muy juntas y casi inmóviles ; si se separan y se mueven más, pasan a LÍQUIDO y si lo hacen aún más , pasan a GAS; pero las partículas son las mismas. Progresivos : absorben calor -------------------------------------------------------------------------------------------------- SUBLIMACIÓN EBULLICIÓN FUSIÓN VAPORIZACIÓN EVAPORACIÓN SÓLIDO LÍQUIDO SOLIDIFICACIÓN GAS LICUACIÓN O CONDENSACIÓN SUBLIMACIÓN REGRESIVA Regresivos : desprenden calor ---------------------------------------------------------------------------------------------------- SÓLIDO LÍQUIDO LEYES DE LA FUSIÓN Cada sustancia pura funde a una temperatura determinada, llamada Temperatura de fusión. Esta temperatura es igual que la del paso contrario : Temperatura de solidificación. Mientras dura la fusión de una sustancia pura, la temperatura permanece constante. Las sustancias disueltas en un líquido hacen bajar la temperatura de solidificación. LÍQUIDO GAS Existen 2 modos de VAPORIZACIÓN : a) EBULLICIÓN (Hervir) Se realiza en cualquier parte de la masa líquida. Es un proceso rápido Leyes : 1ª ) Cada sustancia pura hierve a una temperatura determinada, que es mayor cuanto mayor sea la presión que soporta. Esta temperatura de ebullición es igual que la del paso contrario (Temperatura de licuación) 2ª) Mientras dura la ebullición de una sustancia pura, la temperatura permanece constante. 3ª) Las sustancias disueltas en un líquido hacen subir su temperatura de Ebullición. b) EVAPORACIÓN Sólo ocurre en las partículas de la superficie Es un proceso lento Puede ocurrir a cualquier temperatura, pero cuánto mayor sea ésta, más rápido será. La temperatura puede variar mientras dura la evaporación. LÍQUIDO GAS Existen también 2 modos de conseguir la CONDENSACIÓN Por enfriamiento (bajando la temperatura) Por compresión (aumentando la presión) Por ambos procedimientos se consigue que las partículas se acerquen hasta convertirse en líquido. Ejercicio 1) Representar esta tabla de valores ( en papel cuadriculado) e interpretarla: Tiempo (min) 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Temperat.(ºC) 15 20 25 25 25 25 30 35 40 45 45 45 45 50 55 60 65 Ejercicio 2) Hacer una representación aproximada del calentamiento del agua desde -10ºC hasta 110ºC (Papel cuadriculado) Ejercicio 3 ) Algunos ejemplos de interés entre los cambios de estado : explicación y consecuencias (Reflexión personal, comentario y apuntes en clase) : Sudor.- botijo.- regar calles.- frigoríficos.- olla exprés.-petróleo.- aguardiente.naftalina.- ambientadores sólidos.- echar sal cuando nieva.- echar sal para cocer un huevo.