material n° 2 agua y sales minerales
Anuncio

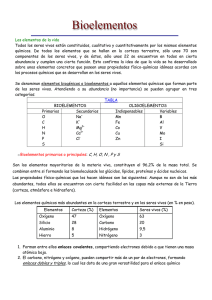
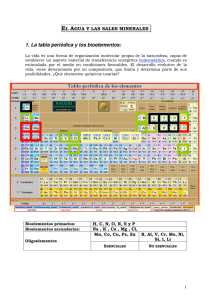
Curso: Biología Mención Material N° 2 Prof. Katherine Galleguillos Adaros Preuniversitario Tongoy Agua y Sales Minerales El agua, el líquido más común de la superficie terrestre, el componente principal en peso de todos los seres vivos, mas abundantes de los seres vivos, tiene un número de propiedades destacables. Estas propiedades son consecuencia de su estructura molecular y son responsables de la “aptitud” del agua para desempeñar su papel en los sistemas vivos. El agua está constituida por dos átomos de hidrógeno y un átomo de oxígeno que se mantienen unidos por enlaces covalentes polar. Presenta una estructura angular con polos positivos en los hidrógenos y un pole negativo en el oxigeno (Figura 1) por ello la molécula de agua tiene características de dipolo. Cada molécula de agua puede formar puentes de hidrógeno con otras cuatro moléculas de agua. Aunque los enlaces individuales son débiles y se rompen continuamente, la fuerza total de los enlaces que mantienen a las moléculas juntas es muy grande. Propiedades del agua Fuerza de cohesión: A raíz de la existencia de los puentes de hidrógeno que mantienen unidas a las moléculas de agua (cohesión), estas característica hace que el agua sea incomprensible, actúa como lubricante o almohadón para proteger frente a golpes o lesiones el agua tiene una alta tensión superficial Elevado calor específico: (la cantidad de calor que una cantidad dada de sustancia requiere para un aumento dado de temperatura). El agua puede absorber una gran cantidad de calor mientras que su temperatura solo asciende ligeramente, convirtiéndola en un buen aislante térmico que mantiene la temperatura interna de los seres vivos a pesar de las variaciones externas, la temperatura corporal permanece relativamente constante. Alto calor de vaporización: La vaporización, o evaporación como se la llama más comúnmente, es el cambio de líquido a gas. El agua tiene un alto calor de vaporización. En su punto de ebullición (100°C a una presión de una atmósfera), se necesitan 540 calorías para convertir un gramo de agua líquida en vapor, Para que una molécula de agua se separe de las moléculas vecinas, o sea, para que se evapore, deben romperse los puentes de hidrógeno. Esto requiere energía térmica. En consecuencia, cuando el agua se evapora, ya sea de la superficie de la piel o de una hoja, las moléculas que escapan llevan consigo una gran cantidad de calor. Así, la evaporación tiene un efecto refrigerante. Estados del Agua: Inmediatamente antes de congelarse, el agua se expande es decir aumenta su volumen y disminuye su densidad, de esta forma el hielo tiene una densidad menor y un volumen mayor que el agua líquida y, como resultado, el hielo –sólido– flota en el agua líquida. Las capas de hielo en lagos y mares se mantienen en la superficie, lo cual aisla al medio acuatico de las bajas temperaturas permitiendo el desarrollo de una diversidad de seres vivos. El agua como solvente: las moléculas polares de agua atraen iones y otros compuestos polares, haciendo que se disocien. Las moléculas que se disuelven fácilmente en agua se conocen como hidrofílicas. Gracias a esta propiedad pueden disolverse en las células muchos tipos de moléculas permitiendo gran variedad de reacciones químicas y el transporte de numerosas sustancias. LAS SALES MINERALES Las sales minerales son biomoléculas inorgánicas que aparecen en forma precipitada, disuelta en forma de iones o asociada a otras moléculas los seres vivos de Precipitadas Las sales se forman por unión de un ácido con una base, liberando agua. En forma precipitada forman estructuras duras, que proporcionan estructura o protección al ser que las posee. Ejemplos son las conchas, los caparazones o los esqueletos Disueltas Las sales disueltas en agua manifiestan cargas positivas o negativas. Los cationes más abundantes en la composición de los seres vivos son Na+, K+, Ca2+, Mg2+... Los aniones más representativos en la composición de los seres vivos son Cl-, PO43-, CO32-... Las sales disueltas en agua pueden realizar funciones tales como: Mantener el grado de grado de salinidad. Amortiguar cambios de pH, mediante el efecto tampón. Controlar la contracción muscular Producir gradientes electroquímicos Estabilizar dispersiones coloidales. Asociadas a otras moléculas Los iones pueden asociarse a moléculas, permitiendo realizar funciones que, por sí solos no podrían, y que tampoco realizaría la molécula a la que se asocia, si no tuviera el ión. La hemoglobina es capaz de transportar oxígeno por la sangre porque está unida a un ión Fe++. Los citocromos actúan como transportadores de electrones porque poseen un ión Fe+++. La clorofila captura energía luminosa en el proceso de fotosíntesis por contener un ión Mg++ en su estructura. Algunos minerales esenciales en la nutrición humanan Yodo Constituyente de hormonas tiroideas (tiroxina) sal de mesa, mariscos. ACTIVIDADES 1. ¿Por qué una botella de vidrio llena de agua se revienta si la congelamos? ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 2. ¿En qué nos beneficia sudar en un día de sol? ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 3. Cuando la temperatura ambiental indica 15°C ¿por qué la temperatura corporal permanece constante? ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 4. ¿Cuál es el catión más abundante en el liquido extracelular (LEC) y cual lo es en el liquido intracelular (LIC)? ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ 5. Cuáles son los beneficios de la sal yodada ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________