EJERCICIOS DE repaso 4º eso2011-12
Anuncio
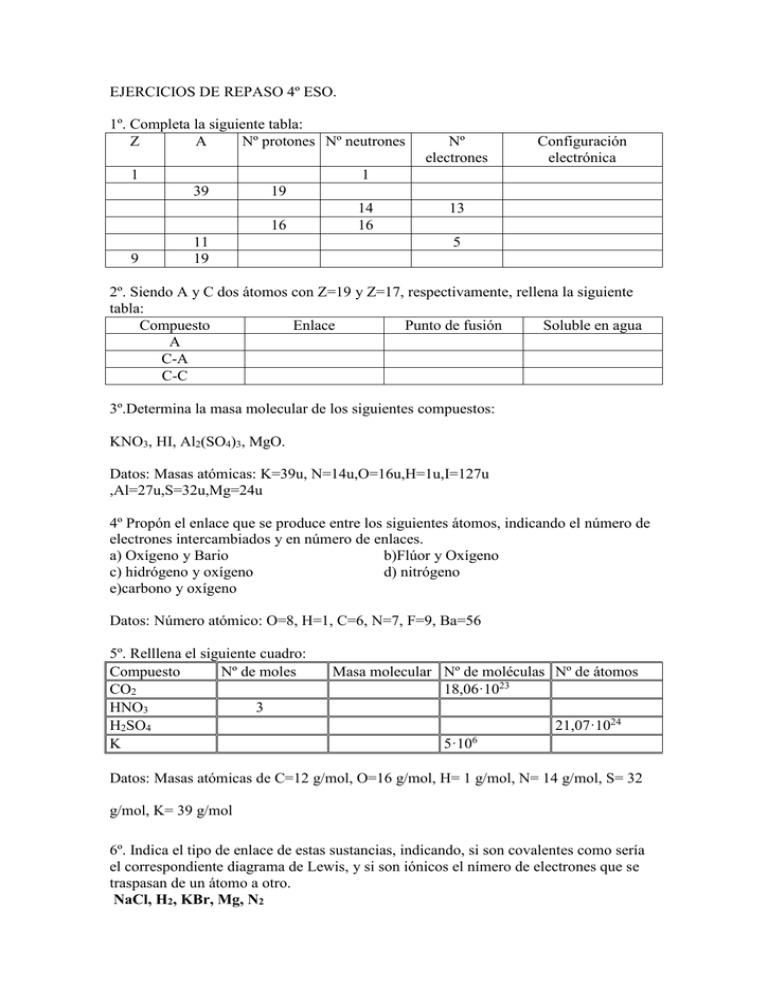
EJERCICIOS DE REPASO 4º ESO. 1º. Completa la siguiente tabla: Z A Nº protones Nº neutrones 1 Configuración electrónica 1 39 19 16 9 Nº electrones 11 19 14 16 13 5 2º. Siendo A y C dos átomos con Z=19 y Z=17, respectivamente, rellena la siguiente tabla: Compuesto Enlace Punto de fusión Soluble en agua A C-A C-C 3º.Determina la masa molecular de los siguientes compuestos: KNO3, HI, Al2(SO4)3, MgO. Datos: Masas atómicas: K=39u, N=14u,O=16u,H=1u,I=127u ,Al=27u,S=32u,Mg=24u 4º Propón el enlace que se produce entre los siguientes átomos, indicando el número de electrones intercambiados y en número de enlaces. a) Oxígeno y Bario b)Flúor y Oxígeno c) hidrógeno y oxígeno d) nitrógeno e)carbono y oxígeno Datos: Número atómico: O=8, H=1, C=6, N=7, F=9, Ba=56 5º. Relllena el siguiente cuadro: Compuesto Nº de moles CO2 HNO3 3 H2SO4 K Masa molecular Nº de moléculas Nº de átomos 18,06·1023 21,07·1024 5·106 Datos: Masas atómicas de C=12 g/mol, O=16 g/mol, H= 1 g/mol, N= 14 g/mol, S= 32 g/mol, K= 39 g/mol 6º. Indica el tipo de enlace de estas sustancias, indicando, si son covalentes como sería el correspondiente diagrama de Lewis, y si son iónicos el nímero de electrones que se traspasan de un átomo a otro. NaCl, H2, KBr, Mg, N2 7º. Calcular: a) cuántos átomos de fósforo hay en 0’25 moles de óxido de fósforo (V) b) la masa en gramos de 2·1024 átomos de Zn ( masa atómica del Zn = 65’37 g/mol). SOLUCIÓN: a) 3’01·1023 átomos de P; b) 217’2 g de Zn. 8º. En 0’6 moles de clorobenceno ( C6H5Cl) a) cuántos moles de átomos de C hay b) Cuantas moléculas c) Cuantos átomos de H. SOLUCIÓN: a) 3’6 moles de átomos de C; b) 3’6·1023 moléculas; c) 1’8·1024 átomos de H. 9º Una disolución de HCl concentrado de densidad 1’19 g/cm3 contiene 37 % de HCl. Calcular: a) su fracción molar b) su molaridad c) El volumen que tendría que coger de esta disolución para obtener 1 litro de otra más diluida de concentración 2 M, tras disolverla en agua. 10º.Introducimos O2 en un pistón a 0 ºC de Temperatura, e inicialmente ocupa un volumen de 1 litro, ejerciendo una presión de 2 atmósferas sobre las paredes del pistón. Si comprimimos el gas hasta un volumen de 0.5 l a la misma temperatura, Hallar : a) La presión del gas. b) La masa del gas encerrado. Datos : R. 0’082 atm·l/(K·mol) 11º.-Una cierta cantidad de gas, que ocupa un volumen de 1 litro a la temperatura de 100 ºC y 2 atmósferas de presión, se calienta hasta 150 ºC, manteniendo constante la presión. ¿Qué volumen ocupará en estas últimas condiciones ?. 12º. Tenemos un gas encerrado en un recipiente de 6 litros de volumen a una presión de 2 atmósferas y una temperatura de 100 ºC. Calcular la presión que tendría la misma cantidad de gas encerrada en un volumen de 3 litros y a una temperatura de 200 ºC. 13º. Los elementos A, B y C están situados en el tercer período de la tabla periódica, y tienen, respectivamente, 2, 4 y 7 electrones de valencia. a) Indica la configuración electrónica de cada uno de ellos, y justifica a qué grupo pertenecen. b) Justifica qué compuesto será posible esperar que formen los elementos A y C, y qué tipo de enlace presentaría. c) Haz lo mismo que en el apartado b) para los elementos B y C. 14º. Escriba la combinación o combinaciones de números cuánticos correspondientes a : a) un electrón 5p, b) un electrón 3d, c) un electrón 1s, d) un electrón 4f. 15º. Los elementos A, B, C, y D tienen los siguientes números atómicos: 11, 15, 16 y 25. Responda razonadamente a las siguientes cuestiones: a) Indique el ión más estable que puede formar cada uno de los elementos anteriores. b) Escriba la estequiometría que presentarán los compuestos más estables que formen A con C, B con D y B con C. c) 16º. Ordenar razonadamente, de mayor a menor número de átomos, las cantidades siguientes: a) 10 g de cloruro de plata. b) 3·1020 moléculas de dióxido de azufre c) 4 moles de monóxido de carbono d) 20 l de oxígeno en condiciones normales. Datos: Masas atómicas: Cl = 35,5; Ag = 108 17º.¿ Cuál es la molaridad de una disolución de ácido sulfúrico del 26 % de riqueza y de densidad 1,19 g/ml?. 18º. Se mezclan 100 ml de HCl 0,2 M, 400 ml de HCl 0,1 M y 250 ml de agua destilada. Calcule la molaridad de la disolución resultante ( suponer que los volúmenes son aditivos)











