Apendices IR 3
Anuncio

Experiment Twenty-five
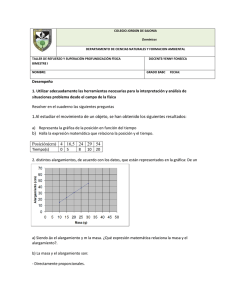
300
C=O?
(s, 1820-1630
No
I
cm ")
Yes
I
I
D-H?
(b, 3200-2500 cm "]
D-HandC-D?
(s, 3650-3100 cm -1 and
s, 1300-1000 cm-1)
No
I
N-H?
(m, 3600-3200
N~
I
I
I
Yes
1
1 ° or 2° Amine
.:.:N<~a_1 Yes
N-H?
(m, 3500-3200
1
Alcohol
or
Phenol
cm -1)
C-D?
(s, 1300-1000)
No
r-r-r- __
Yes
1
Carboxylic acid
cm -1)
I
Yes
No
C-D?
(s, 1300-1000
No
Yes
1
Amide
cm ")
two C=O bond s?
(~1815 and ~1750 cm 11)
Y~
1
o
Ether
C=N?
(m, 2260-2220
cm -1)
1
cm"! and s, 1380-1300
Yes
1
Acid
anhydride
1
No
cm ")
I
Carboxylate
ester
\ Yes
1
Nitrile
N02?
(s, 1570-1500
No
11
C-H?
(m, ~2720 em ")
Aldehyde
C=O
1820-1770
cm-1?
1
No
Nitro
compound
Acid
chloride
C=O
1775-1700
3° Amine or
Hydrocarbon or
Halohydrocarbon
No
I
cm "?
Yes
1
Ketone
C=O
1710-1630
C=c?
C=C?
ArH?
(w, 2260-2100
(w, 1680-1620
cm ")
cm "]
(2 to 4 bands, m, ~1600,
~1580, ~1500, and ~1450 cm -1)
Figure 25.1
weak, b
=
cm-1?
1
Amide
Scheme far the analysis of an infrared spectrum.
(s = strong, m
= medium,
W =
broad).
Micht{e~.f~ ~Oj\e
,E~eYl'W\eY\.~L
¡'S-tr1 ~4Sntsfq~O
Oí:jCiV1iGC/ll~M
t
TABLA PARA INTERPRETACIÓN ESPECTRAL*
R–1 La identificación de las bandas de absorción características, causadas por
grupos funcionales diferentes, es la base para la interpretación de espectros
infrarrojos. Es útil hacer una división de la porción media del infrarrojo en dieciocho
regiones y agrupar los diferentes grupos funcionales contenidos en las moléculas
orgánicas:
−
λ(µm)
ν cm −1
Enlace y tipo de vibración
2,5-3,13
4 000–3 200
O–H, N–H, (alargamiento).
3,0-3,3
3 300–3 000
-C≡C–H, >C=CH-, Ar–H, (C-H de alargamiento).
3,3-3,7
3 000–2 700
-CH 3 , -CH 2 -, -C–H, -COH, (C-H de alargamiento).
4,2-4,7
2 400–2 100
C≡C, C≡N, X≡Y, X=Y=Z, (alargamiento); X, Y y Z pueden representar, C,N,O,y S.
Alquinos, Alenos, Cianatos, Isocianatos, Nitrilo, Isocianidas, Acidas, Sales de
diazonio, Cetenos, Tiocianatos, Isotiocianatos.
5,2-6,0
1 900–1 650
>C=O, (alargamiento en ácidos carboxílicos, aldehído, cetona, amida, éster, etc.).
6,2-6,6
1 690–1 620
>C=C< alifáticos y aromáticos, >C=N–, (alargamiento).
5,92-6,21
1680-1610
-N=O, (alargamiento), compuestos nitrito orgánicos.
6,04-6,21
1655-1610
-O-NO 2 , (alargamiento asimétrico) compuestos nitrato orgánicos, el alargamiento
simétrico del -O-NO 2 ocurre en 1300 cm
6,25-6,62
1600-1510
−1
- 1225
cm −1 .
-NO 2 , (alargamiento asimétrico), compuestos nitro orgánicos, el alargamiento
−1
−1
simétrico del -NO 2 ocurre 1385 cm -1325 cm .
6,25-6,90
1600-1450
>C=C<, (alargamiento), en sistema de anillos aromáticos.
6,7-7,7
1 475–1 300
C–H, (deformación), Metilo, metileno y metino.
7,04-10,10
1420-990
>S=O, (alargamiento), sulfoxidos, sulfatos, sulfitos, ácidos o ésteres sulfínicos,
sulfonas, ac. sulfónico, sulfonatos, sulfonamidas, halogenuro de-sulfonilo.
8,3-10,0
1 300–1 000
C–N-, C–O-, (alargamiento)
8,16-9,67
1225-1045
>C=S, (alargamiento), tioésteres, tioureas, tiamidas, pirotionas.
10,0-12,82
1 000–780
>C=CH-, ( C-H, deformación fuera del plano), instauración alifática
11,11-14,93
900-670
Ar–H, (C-H, deformación fuera del plano), sustitución aromática
11,7-20,0
850-500
C-X, (alargamiento), organohalogenados. X puede ser Cl, Br, o I.
13,7-13,9
730-720
(CH 2 ) n>3 , cuatro o más grupos metilénicos consecutivos
S
O
pirotiona
Fuente: Sócrates G., Infrared Characteristic Group Frecuencies, Second edition, John Wiley & Sons, Great
Britain, 1994.