Documento 271633
Anuncio

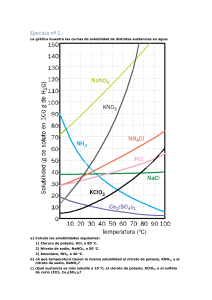
Nombre: ..................................................................................................................... ........... Calificación: Curso: 3º ESO Prueba Extraordinaria de Recuperación Fecha: ........................ 1) La altura de una torre, desde su base hasta la parte más elevada, es de 115 m. Expresa esta altura en mm, cm, dm y km. 2) La masa de varios volúmenes del mismo material se mide y se registra en la siguiente tabla: M (kg) 0,25 V (cm3) 500 0,50 1000 0,75 1500 1,00 2000 1,25 2500 1,50 3000 a) ¿Qué instrumentos se han utilizado para realizar esta experiencia? b) ¿Cómo determinarías los volúmenes de este material si se trata de sólidos irregulares? c) Representa gráficamente la masa (ordenadas) frente al volumen (abcisas), usando papel milimetrado. d) ¿Qué relación existe entre ambas magnitudes? ¿Cuál es su valor? e) ¿Cuál será la masa de 250 cm3 de ese material? f) ¿Cuál será el volumen de 0,600 Kg de este material? 3) Explica mediante la teoría cinética de la materia: a) Por qué los gases tienden a ocupar todo el espacio disponible. b) Por qué un gas contenido en un recipiente ejerce presión. c) Por qué una sustancia en estado sólido puede llegar a pasar al estado líquido y de este al gaseoso. d) La relación que existe entre la temperatura de un cuerpo y el movimiento de sus partículas. 4) La gráfica de la figura corresponde a la curva de calentamiento de una sustancia pura: a) ¿Qué cambios de estado tienen lugar? ¿Qué nombre reciben estos cambios de estado? b) ¿Cuál es el punto de ebullición de esta sustancia? c) ¿Por qué se mantiene constante la temperatura durante cada uno de los cambios de estado? d) ¿Es lo mismo ebullición que evaporación? 5) Preparamos una disolución que contiene 10 g de nitrato de potasio y 15 g de cloruro de potasio en 475 g de agua. a) Distingue entre soluto y disolvente en esta disolución. b) Calcula el tanto por ciento en masa de cada soluto en la disolución obtenida. 6) Observa la grafica de curvas de solubilidad adjunta y contesta a las siguientes preguntas: a) ¿La solubilidad de qué sustancia varía más rápidamente con la temperatura? b) ¿Cuál es la solubilidad del nitrato de sodio a 10ºC? ¿Y a 40ºC? c) ¿La solubilidad de qué sustancia varía menos con la temperatura? d) ¿Qué masa de sulfato de potasio se disuelve en 100g de agua a 20ºC? e) ¿Qué masa de nitrato de potasio se formará si una disolución saturada en 100g de agua se enfría desde 50ºC a 20ºC? f) ¿Cómo prepararías una disolución saturada de sulfato de cobre hidratado a 45ºC? ¿Y una disolución sobresaturada a esa misma temperatura? 1 7) Responde si las siguientes afirmaciones son verdaderas o falsas. a) La carga del protón es igual en valor numérico a la carga del neutrón. b) La carga del electrón es igual en valor numérico a la carga del protón. c) La masa de un protón es mayor que la masa de un electrón. d) La masa de un neutrón es similar a la masa de un protón. e) La masa del átomo está prácticamente concentrada en su núcleo. 8) Completa la siguiente tabla: Isótopo Ca Z A Nº de electrones Nº de protones Nº de neutrones Na 9) Los átomos que constituyen los distintos tipos de materia se pueden presentar aislados o unidos formando moléculas y cristales. Indica cuáles de las siguientes sustancias se presentan en la naturaleza, preferentemente como átomos aislados, moléculas o cristales: a) Diamante b) Helio c) Oxígeno d) Cuarzo e) Dióxido de carbono f) Cloruro de sodio g) Neón h) Cobre 10) ¿Qué compuesto tiene mayor porcentaje de oxígeno, el agua, H 2O, o el dióxido de carbono, CO2? (Masas atómicas: H=1; O=16; C=12) 11) ¿Cuáles son los elementos que componen principalmente los seres vivos?¿Cuáles de ellos son metales y cuáles no metales? 2 12) El nitrato de plata, AgNO3, reacciona con el cloruro de sodio, NaCl, ambos en disolución acuosa, para dar un precipitado blanco de cloruro de plata, AgCl, y nitrato de sodio, NaNO 3. a) Escribe y ajusta la reacción química que se produce. b) Calcula la cantidad de cloruro de plata que se obtiene cuando1 mol de nitrato de plata reacciona con una cantidad suficiente de cloruro de sodio. c) Calcula la masa de cloruro de plata que se obtiene cuando 10g de nitrato de plata reaccionan con una masa suficiente de cloruro de sodio. d) ¿Qué cantidad de cloruro de sodio reacciona exactamente con 1 mol de nitrato de plata? 13) Indica cómo afecta a la velocidad de una reacción química los siguientes factores: a) El que los reactivos estén pulverizados. b) Un aumento de la temperatura. c) La presencia de un catalizador. d) El que los reactivos estén concentrados. 14) Indica de qué tipo de es una sustancia disuelta en agua si: a) Su pH es menor de 7 b) Su pH es mayor de 7 c) Su pH es igual a 7. ¿Qué ocurre si la sustancia del apartado a) reacciona con la sustancia del apartado b)? 15) ¿Qué diferencias existen entre un material conductor y uno aislante?¿Cómo puede cargarse un material aislante? 3