Apellido1_Apellido2_Nombre_CTI_B06_T2
Anuncio
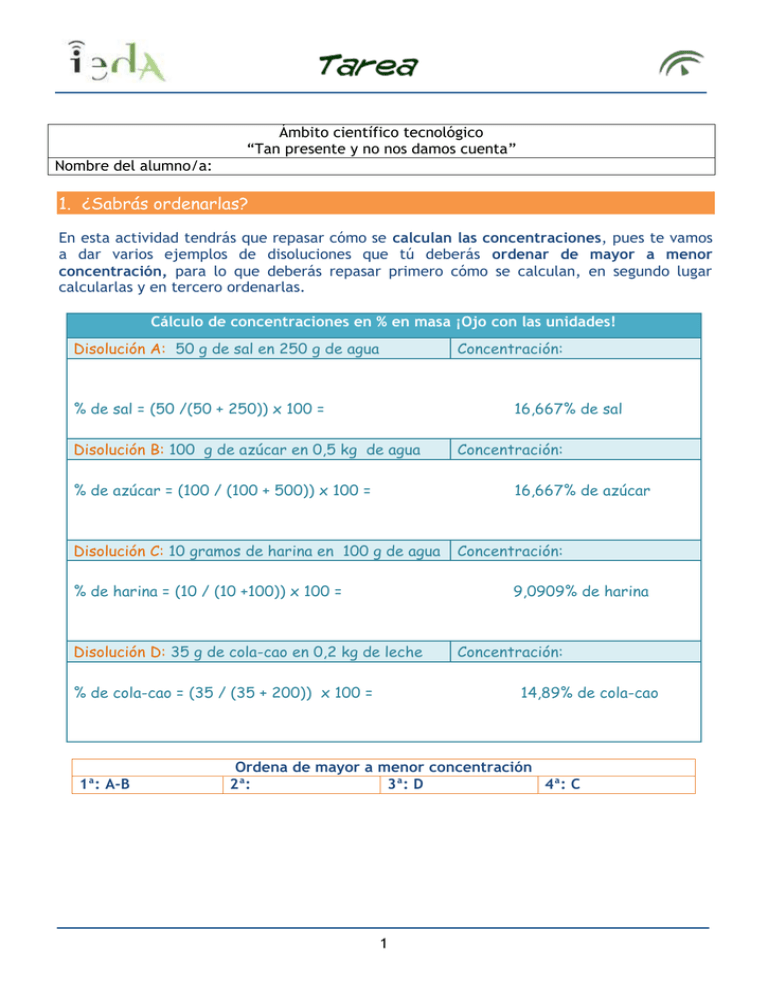
Ámbito científico tecnológico “Tan presente y no nos damos cuenta” Nombre del alumno/a: 1. ¿Sabrás ordenarlas? En esta actividad tendrás que repasar cómo se calculan las concentraciones, pues te vamos a dar varios ejemplos de disoluciones que tú deberás ordenar de mayor a menor concentración, para lo que deberás repasar primero cómo se calculan, en segundo lugar calcularlas y en tercero ordenarlas. Cálculo de concentraciones en % en masa ¡Ojo con las unidades! Disolución A: 50 g de sal en 250 g de agua Concentración: % de sal = (50 /(50 + 250)) x 100 = 16,667% de sal Disolución B: 100 g de azúcar en 0,5 kg de agua % de azúcar = (100 / (100 + 500)) x 100 = 16,667% de azúcar Disolución C: 10 gramos de harina en 100 g de agua % de harina = (10 / (10 +100)) x 100 = Concentración: 9,0909% de harina Disolución D: 35 g de cola-cao en 0,2 kg de leche % de cola-cao = (35 / (35 + 200)) x 100 = 1ª: A-B Concentración: Concentración: 14,89% de cola-cao Ordena de mayor a menor concentración 2ª: 3ª: D 4ª: C 1 2. ¿Qué habrá pasado? Una vez leído el texto, intenta razonar que ha podido ocurrir, teniendo siempre presente la característica de las reacciones químicas “masa de los reactivos es igual a la masa de los productos”. Un químico está realizando un experimento con una pastilla que debe disolverse en agua. Pesa un vaso con agua destilada con una balanza de precisión. Luego pesa la pastilla. Como tiene que ausentarse, le dice a su ayudante que introduzca la pastilla en el agua para que se disuelva. Cuando vuelve, su ayudante no está y se encuentra el vaso con agua, perfectamente transparente. Como no está seguro si era ese vaso, lo pesa, dando como resultado algo menos que la suma del vaso con agua y la pastilla que él tenía originalmente. Debido a la temperatura y humedad del laboratorio, y al poco tiempo transcurrido, no se ha evaporado agua del vaso, sin embargo, el científico, al comprobar la diferencia de peso, dice: ¡Si este es el vaso con la pastilla ! ¿Por qué? Porque se ha producido una reacción química, se han producido sustancias distintas con propiedades distintas a las de las sustancias iniciales. 3. ¿Qué compuestos son? ¡Verás que divertido! Como sabes la masa de los reactivos es igual a la de los productos, por lo que el número de átomos de los reactivos tiene que ser el mismo que el de los productos, por lo tanto deberemos ajustar para que nos salga lo mismo. Hidrógeno Escribe la reacción: H2 Cloro + Cl2 HCl 2 Explica los ajustes que realizas: Partiendo de 2 átomos de hidrógeno ( H) y 2 átomos de cloro (Cl) se han formado 2 moléculas, cada una de ellas formada por un átomo de hidrógeno y un átomo de cloro 2 HCl Ajusta la reacción: H2 + Cl2 2 HCl Hidrógeno Nitrógeno Escribe la reacción: H2 + N2 H3N Explica los ajustes que realizas: Partiendo de 6 átomos de hidrógeno (H) y de 2 átomos de nitrógeno (N) se han producido 2 moléculas, cada una de ellas formada por 3 átomos de hidrógeno y un átomo de nitrógeno 2 H3N Ajusta la reacción: Hidrógeno 3H2 + N2 2 H3N Carbono Oxígeno Escribe la reacción: H8C3 + O2 O2C + H2O Explica los ajustes que realizas: Partiendo de 8 átomos de hidrógeno (H), de 3 átomos de carbono (C) y de 10 átomos de oxígeno (O) se han producido 3 3 moléculas, cada una de ellas formada por 1 átomo de carbono y 2 átomos de oxígeno 3 O2C y 4 moléculas de agua H2O Ajusta la reacción: H8C3 + 5 O2 Hidrógeno 3 O2C + 4 H2O Carbono Oxígeno Escribe la reacción: H4C2 + 3 O2 2 O2C + 2 H2O Explica los ajustes que realizas: Partiendo de 4 átomos de hidrógeno (H), de 2 átomos de carbono (C) y de 6 átomos de oxígeno (O) se han producido 2 moléculas, cada una de ellas formada por 1 átomo de carbono y 2 átomos de oxígeno 2 O2C y 2 moléculas de agua H2O Ajusta la reacción: H4C2 + 3 O2 2 O2C + 2 H2O 4 4. Y ahora... recordemos la solubilidad En primer lugar, te vas a fijar en una tabla dónde están recogidos los datos de como varía la solubilidad del sulfato de cobre con el aumento de temperatura, y contestar a las siguientes preguntas: ¿Qué cantidad de sulfato de cobre se puede disolver en 5 litros de agua a 40 ºC? 290 g/L x 5 L = 1450g ¿A qué temperatura aproximada hay que poner 1 litro de agua para que disuelva 500 g de sulfato de cobre (II)? A 75º C ¿Qué cantidad de sulfato de cobre (II) se disuelve en un litro de agua a 60 ºC? 400g ¿Qué sucede si intentamos disolver 1 kg de sulfato de cobre (II) en 2 litros de agua a 60ºC? Que hay un exceso de sulfato de cobre que no se puede disolver y se precipita en el fondo del recipiente, 200g ¿Qué cantidad de agua a 40 ºC se necesita para disolver 1 kg de sulfato de cobre (II)? 1000 g / 290 g/L = 3,45 L Pero esto no acaba aquí, también deberás extraer la información de esta tabla en la que se indican las distintas solubilidades de varias sustancias, pero en g/100 cm3 ¡Ojo con las unidades! Y deberás averiguar si son diluidas, concentradas o saturadas dependiendo de los valores recogidos en la tabla, y como siempre contestar a una serie de cuestiones para que practiques estos cálculos. Si en un matraz tenemos una disolución de 200 cm3 de agua con 20 g de sal común (NaCl), ¿cómo es? 5 2 x 35,9g = 71,8 g (para la saturación) Si tenemos 20g de sal la solución está diluida Si disponemos de 97,2 g de carbonato de sodio (CO3) Na2 en un litro de agua. ¿Cómo es esa disolución? 10 x 19,4 g = 194 g Si tenemos 97,2g de carbonato de sodio la solución está diluida ¿Qué es más soluble en medio litro de agua el nitrato de sodio (NaNO3) o el clorato de sodio (ClO3Na)? ¿Por qué? El clorato de sodio porque mientras podemos diluir 86g de nitrato de sodio en 100cm3 de agua, de clorato de sodio podemos diluir 97,2g 5. ¿Por qué no podemos vivir sin ella? Porque casi la totalidad de los procesos químicos que ocurren en la naturaleza, tienen lugar entre sustancias disueltas en agua. 6
