Guía para el Control Instrumental Duymovich, C., Acheme, R., Mazziotta, C.
Anuncio

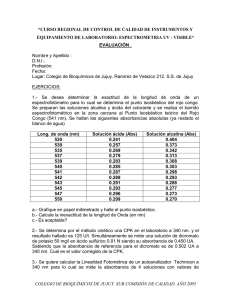
Duymovich, C., Acheme, R., Mazziotta, C. Guía para el Control Instrumental Programa de Evaluación Externa de Calidad (PEEC) Fundación Bioquímica Argentina Actualización 2.001 CONTROL DE CALIDAD EN INSTRUMENTOS Y EQUIPAMIENTO DE LABORATORIOS ESPECTROFOTOMETRIA UV - VISIBLE Duymovich, C., Acheme, R., Mazziotta, D., INTRODUCCION: Dentro de los requerimientos para el buen desempeño de un Laboratorio de Química Clínica, ocupa un lugar preferencial el tipo de instrumento utilizado en la detección y cuantificación de los parámetros que se analizan y el control de su óptimo funcionamiento. El espectrofotómetro UV - Vis. constituye el instrumento más utilizado en el Laboratorio, ya que la mayoría de las determinaciones se llevan a cabo colorimétrica o espectrofotométricamente. Esta guía tiene el objeto de brindar al laboratorista una breve pero eficiente reseña de algunos controles que deben efectuarse periódicamente para evaluar el funcionamiento de su instrumento de lectura. Aunque los aparatos de medición que existen en el mercado son sometidos a controles de calidad por sus fabricantes, el intenso uso y el envejecimiento deterioran su rendimiento, dando lugar a errores analíticos de origen instrumental que, aunque sea parcialmente, se pueden detectar y corregir. En el laboratorio se debe llevar un registro de todo el instrumental, donde deben constar todos los controles que se realizan, los desperfectos que se producen, las reparaciones que se efectúan, los responsables del servicio técnico, etc de manera de constituirse en una documentación válida que respalde el accionar profesional. NOMENCLATURA ESPECTROFOTOMETRICA Rango Espectral: Intervalo de longitudes de onda en el cual el instrumento puede realizar medidas de absorbancia o transmitancia. Abarca habitualmente el UV y el visible. Exactitud de la Longitud de Onda: diferencia entre la longitud de onda que indica el seleccionador y la longitud de onda real. Es el corrimiento de longitud de onda y se mide en nm. Precisión de longitud de onda: Es la capacidad del instrumento de reproducir la longitud de onda elegida. Se mide también en nm. Estabilidad de lectura, deriva y ruido: Es la variación del cero electrónico del instrumento en función del tiempo. La deriva es una inclinación hacia una lectura más alta o más baja durante un período de tiempo y el ruido es la falta de estabilidad. Abs Abs Tiempo Tiempo Bajo ruido y baja deriva Baja deriva y alto ruido Abs Abs Tiempo Tiempo Alta deriva y bajo ruido Alta deriva y alto ruido Exactitud fotométrica: Exactitud de las medidas de absorbancia, es decir, diferencia entre la absorbancia real y la absorbancia medida de una solución. Precisión fotométrica: Repetibilidad de las medidas de absorbancia. Sensibilidad o linealidad fotométrica: es la capacidad de respuesta lineal de un espectrofotómetro a concentraciones crecientes o decrecientes de una sustancia que cumpla la ley de Beer a distintas longitudes de onda. Ancho espectral de rendija (AER): es el intervalo de longitudes de onda que emerge del monocromador cuando seleccionamos un valor de longitud de onda que va a recibir la máxima cantidad de luz. Se expresa en nm. Ancho espectral de banda o ancho de banda (AEB): es el intervalo de longitud de onda que recibe el 50 % del máximo de intensidad de radiación. Generalmente es la mitad del AER y se mide en nm. (Figura 2) Intensidad A B D C E Longitud de onda Figura 2: A: longitud de onda seleccionada DE: ancho de rendija BC: ancho de banda Luz parásita: es toda radiación electromagnética de longitud de onda distinta a la seleccionada por el monocromador que alcanza el detector y por lo tanto queda registrada por el instrumento. PROCEDIMIENTOS PARA EVALUAR EL DESEMPEÑO DEL ESPECTROFOTOMETRO 1.- Control de la exactitud de la longitud de onda. El método más exacto consiste en reemplazar la lámpara del instrumento por una fuente de energía radiante que emita fuertes líneas a determinadas longitudes de onda. Son útiles para este fin: a) Lámpara de vapor de mercurio (313, 365, 405, 436 y 546 nm) y b) Lámpara de hidrógeno y de deuterio(486 y 656 nm.) Un segundo método consiste en la utilización de filtros de tierras raras como el óxido de Holmio ( 361, 418, 453, 536 y 636 nm.) y el Didimio ( 573, 586, 685, 741 y 803 nm.). En caso de no contar con estos filtros o sus soluciones se recomienda usar el método del punto Isosbéstico. Esta es una característica que presentan ciertas sustancias con isómeros estables cuyos espectros en solución equimolecular ácida y alcalina se cortan en una longitud de onda característica. La importancia del método resulta de que el punto isosbéstico es independiente de la concentración absoluta de la sustancia y de la temperatura entre 4 y 45 ºC. La experiencia consiste en determinar los espectros de absorción-emisión de alguna de las sustancias que luego se mencionan, en sus formas ácidas y alcalinas. El punto isosbéstico se define gráficamente tal como muestra la figura 3. FIGURA 3: Espectro del rojo Congo Realizar el espectro de barrido de las soluciones ácidas y alcalinas de las siguientes soluciones: a) Dicromato de Potasio ( 29.5 mg/l) Pto. Isosbéstico: 339, 445 nm. b) Azul de bromotimol ( 25 mg/l) Pto. Isosbéstico: 325 y 498 nm. c) Rojo Congo( 14 mg/l) Pto. Isosbéstico 541 nm. 2.- Control de la exactitud fotométrica. Se pueden utilizar filtros comerciales con absorbancias conocidas y certificadas a longitudes de onda dadas. Por ejemplo los filtro de Didimio u Oxido de Holmio o neutros. En su ausencia se puede recurrir a soluciones con absorbancias conocidas a determinadas longitudes de onda. Estas deben cumplir con la condición de presentar un amplio pico máximo de absorbancia, alto coeficiente de extinción molar, buena solubilidad, ser estables e independencia de la absorbancia con la temperatura. a) Dicromato de Potasio en Ácido Perclórico 0,001 N a 340 nm b) Nitrato de Cobalto en Ácido Sulfúrico 0.37 N a 510 nm c) Cianmetahemoglobina a 540 nm En caso de hallarse errores en la exactitud que superen los límites de aceptabilidad se deben realizar correcciones pues generalmente en esta zona del espectro se llevan a cabo lecturas absolutas para determinación de enzimas por métodos cinéticos. Factor de corrección: F = Abs. referencia Abs. hallada x 100 Este factor se puede utilizar siempre que el error en la medida de absorbancia no supere el 10 % ya que en este caso es imprescindible recurrir al servicio técnico. 3.- Control de la precisión fotométrica: Alicuotar por ejemplo la solución de Dicromato de Potasio empleada en el punto anterior, en 10 porciones y medir los valores de absorbancia de cada una cuidando de colocar la cubeta en la misma orientación. Hallar la media, la desviación estándar y el coeficiente de variación. El valor de CV deberá ser inferior a 1 % para cubetas paralelas y 2 % para tubos de fotocolorimetría. Puede realizarse la misma experiencia con soluciones de Nitrato de Cobalto para la zona de los 510 nm o con soluciones de Sulfato de Cobre a 650 nm. 4.- Control de la linealidad fotométrica. El método más práctico consiste en preparar diluciones de determinadas sustancias y ver la respuesta del instrumento. Se recomienda medir la linealidad a más de una longitud de onda, sobre todo de aquellas sustancia utilizadas en los métodos de detección de Química Clínica. a) Dicromato de Potasio Acido a 340 nm. b) P - Nitrofenol a 405 nm. c) Nitrato de Cobalto a 510 nm. d) Cianmetahemoglobina a 540 nm. Se pueden obtener situaciones como las del gráfico 3. gráfico a gráfico c gráfico b gráfico d a) Recta ideal b) Buena linealidad. Diferencia de exactitud de la absorbancia. c) Linealidad aceptable hasta aproximadamente 1.000 UA; luego disminuye d) Mala linealidad en todo el rango de absorbancia (mala sensibilidad: no registra cambios significativos de absorbancia al cambia la concentración) 5.- Control de la estabilidad de las lecturas. La deriva y el ruido deben comprobarse y registrarse al menos una vez al mes por medio de la medición de las variaciones de ABS cada 30 segundos, durante 15 minutos, tanto para un blanco de agua de 0,000 UA como para una solución de Dicromato de ABS aproximadamente a 0,400 UA a 340 nm. Un instrumento que tenga alto ruido o deriva no debe usarse para ensayos cinéticos y cuando se usa para métodos colorimétricos punto final con Estándares debe tenerse cuidado con el intervalo de tiempo entre la primera y la última lectura de absorbancia. 6.- Control de cubetas. a) En caso de trabajar con más de una cubeta se debe verificar la homogeneidad de las mismas. Por ejemplo, llenadas con Dicromato y llevadas en forma arbitraria a ABS = 0,400 no deben diferir entre si en una cantidad mayor de 0,004 unidades de absorbancia. Realizar la prueba a 340nm. b) Si el instrumento que se usa tiene un portacubetas con más de una posición variando la ubicación de la misma cubeta en el carro, no debe diferir la absorbancia en 0,002 unidades en 0.400 UA. 7.- Control de luz parásita. Se puede medir introduciendo en el aparato una muestra que tenga una transmitancia del 0 %; por lo tanto, cualquier radiación detectada e indicada en el lector corresponderá a luz espuria. Ajustar cuidadosamente el 100 % T con agua destilada a 340 nm. Luego medir la transmitancia aparente de una solución de NO2 Na ( 50g/l). El valor máximo admisible de T es de 1.0 % . CAUSAS DE ERROR Los principales defectos que originan errores son la baja intensidad de emisión de la fuente lumínica, la inestabilidad de emisión de la lámpara debida a la inestabilidad de la corriente de la red, el ennegrecimiento del bulbo de la lámpara debido a su tiempo de uso, el agotamiento de las lámparas, el ancho de banda excesivo, el mal ajuste o centrado del dispositivo portacubetas, las cubetas sucias, rayadas, manchadas o no paralelas, la falta de sensibilidad o agotamiento del fototubo, la luz espuria o el excesivo ruido de fondo, la filtración de luz, etc. CONCLUSIONES El bioquímico deberá controlar la exactitud fotométrica, la precisión, la sensibilidad en forma periódica, a fin de disminuir la posibilidad de errores y , aunque debe evaluarse el desempeño del instrumento de lectura en todas las longitudes de onda en las cuales se realizan prácticas habituales, se deberá hacer hincapié en la zona de 340 nm., donde se realizan lecturas absolutas. También en aquellas técnicas donde se usan factores o curvas sin medir en forma paralela un testigo de concentración conocida. Finalmente, el control de calidad de un espectrofotómetro debe incluir dos aspectos: por una parte, conocer de manera real el instrumento recién adquirido y confrontarlo con las especificaciones que da el fabricante y, por otro lado, chequear periódicamente el aparato para que se encuentre en condiciones óptimas de funcionamiento. Es importante conocer las limitaciones técnicas del espectrofotómetro y recordar que, como todo instrumento de precisión, necesita un mantenimiento periódico para que funcione correctamente. BIBLIOGRAFIA. 1.- Martinek RG, Jacobs L., Hammer F. Spectrophotometric standardization of enzyme assays. Clin Chin Acta 1972; 36 (1) : 75-84. 2.- Fernández Espira C., Candau García R. Control de calidad en espectrofotrometría UV - Vis. An Clin 1979; 4 (16) : 153-9. 3.- Hoster G. Suggested isosbéstic wavelength calibration in clinical analyses. Clin Chem 1979; 25 (1) : 143-6. 4.- Dharan M. Control de calidad en los laboratorios clínicos. Barcelona: Reverté, 1980; Cap. 11. 5.- D’Alessio E., Locasio G. Algunos elementos de control de calidad de instrumentos en el laboratorio de análisis clínucos. 6.- Kolthoff, Sandell, Meehan, Bruckenstein. Análisis químico cuantitativo. 4ed. Editorial Nigal. 7.- Rand R. N. Practical Spectrophotometric standards Clin. Chem. 15,9 (1969) 839-863. 8.- Kaplan-Pesce Química Clínica Ed.Panamericana(1988). 9.- Franzini La Spectrofotometría in Biochimica Clinica. Bioch. Clínica 12/88 420-426 (1988).