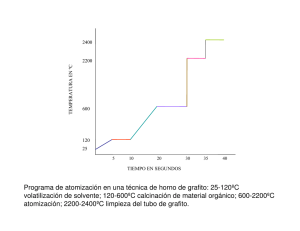
Energía calorífica
Anuncio

Ensayos a la Flama (Pruebas preliminares de identificación) Objetivo: El alumno identificará metales alcalinos, alcalinotérreos y algunos otros como el cobre, el plomo y el arsénico. Breve discusión teórica: Algunos elementos como los metales alcalinos y alcalinotérreos al proporcionarles cierto tipo de energía (en este caso calorífica) una parte de ésta la absorben y la ceden como energía luminosa dando coloraciones diferentes que en el caso del espectro electromagnético comprendido en el rango visible (longitud de onda de 400 − 700 nm) van de violeta a rojo. La temperatura del mechero Bunsen en algunos casos es suficiente para vaporizar algunos elementos. Esto provoca cambios en los niveles energéticos del átomo, la flama excita a los electrones de las capas exteriores del átomo mandándolos a niveles superiores de energía, al regresar a su nivel normal, la energía absorbida se desprende en forma de ondas electromagnéticas de mayor longitud de onda y cuya frecuencia es proporcional a las diferencias de energía entre la constante de Planck, es decir: La longitud de onda se relaciona con la frecuencia de la sig. manera: Donde: E0= contenido de energía del átomo en su estado fundamental. E1= contenido de energía del átomo en su estado excitado h= constante de Planck 6.625x10−27 erg*seg = frecuencia en ciclos/seg c= velocidad de la luz 3x1010 cm/seg = longitud de onda en nanómetros (nm) Si el valor de está dentro del rango del espectro visible se producirá un color en el ensaye a la flama, por esta razón cada elemento al ser excitado produce un espectro único, característico y diferente al de cualquier otro elemento. Su estudio cae dentro del campo de la espectroscopia. Desarrollo experimental: Este ensayo se debe realizar transportando los elementos a la flama con un aplicador inerte, que puede ser un alambre de platino, pero se obtiene el mismo resultado con un aplicador de grafito, preparado t libre de impurezas; para esto se introduce en HCl 1:1 y se calienta en la zona de fusión, repitiendo esta operación hasta que no se observe coloración emanada del grafito. Una vez purificando el aplicador se procede de la siguiente forma: 1 Se introduce el aplicador en el ácido. Se toma un poco de muestra Se lleva a la base de la flama NOTA: Si no se observa color se va subiendo a zonas más calientes hasta que se produzca un color persistente. Material: Reactivo: 1 Vaso de precipitados de 50 ml. HCl 1 Placa colorimétrica ¡ punta de grafito Cuestionario: • Calcule la cantidad de reactivo necesario para preparar la solución 1:1 de HCl. Por 50 ml de HCl se agregan 50 ml de H2O, es decir en proporciones iguales siempre y cuando el HCl sea puro (al 100%). 2. En la siguiente tabla indique la coloración que comunican a la flama los cationes: ELEMENTO K Na Li Ca COLOR DE LA FLAMA BIBLIOGRAFICO VIOLETA AMARILLO ROJO CARMÍN ROJO LADRILLO COLOR OBSERVADO VIOLETA AMARILLO HUEVO AMARILLO ROJIZO AMARILLO ROJIZO 2 Sr Cu CARMESI VERDE AMARILLENTO Pb AZUL PÁLIDO Mg ROJO INTENSO VERDE PALIDO VIOLETA PALIDO EN EL Pb(C2H3)2 AZUL PALIDO EN EL PbSO4 VERDE BRILLANTE 3. ¿Cuál o cuáles fueron las muestras problema? La muestra problema que nos tocó era un sólido blanco en gránulos, al llevarlo a la flama que tomo una coloración rojo carmín, por lo que se concluye que la muestra contenía LITIO. 3