Redox - Mediateca
Anuncio
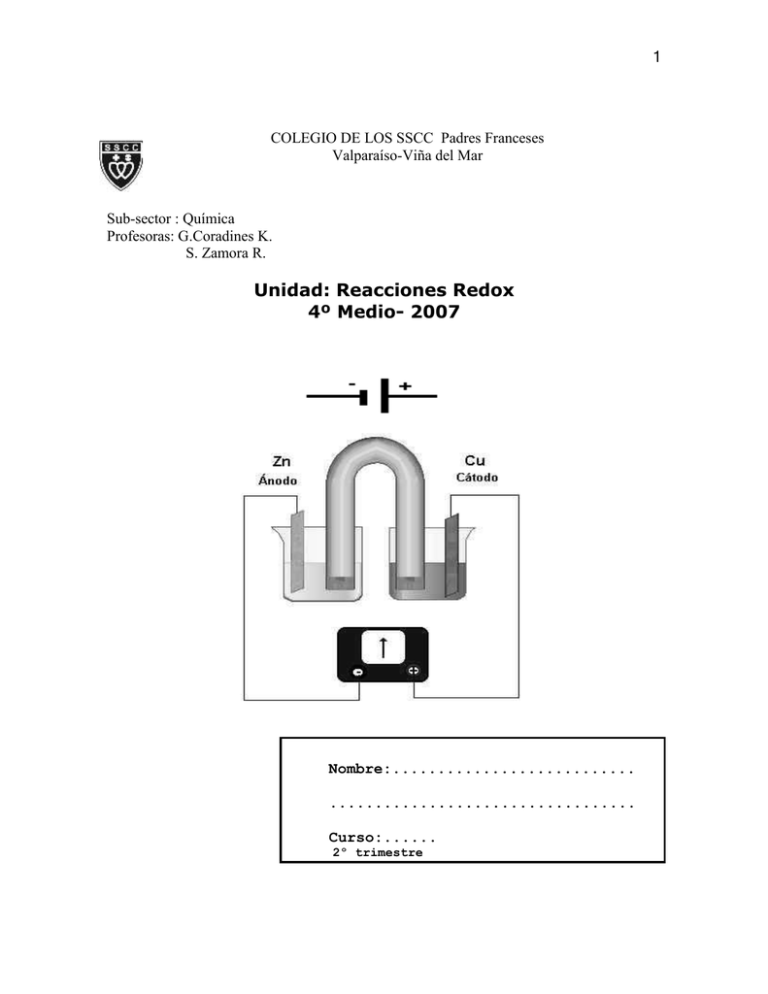
1 COLEGIO DE LOS SSCC Padres Franceses Valparaíso-Viña del Mar Sub-sector : Química Profesoras: G.Coradines K. S. Zamora R. Unidad: Reacciones Redox 4º Medio- 2007 Nombre:........................... .................................. Curso:...... 2º trimestre 2 Nota: Metodología de trabajo la explicación complementaria Apuntes y cuaderno para REACCIONES DE OXIDO-REDUCCION ( REDOX ) Una reacción de oxidación-reducción o abreviadamente una reacción redox, es aquella en la cual ocurre una transferencia de electrones. La sustancia que gana electrones se denomina oxidante y la que los cede reductor. Por lo tanto, el oxidante o agente oxidante se reduce ( le sucede una reducción ) y el reductor o agente reductor se oxida ( le acontece una oxidación ). Se asevera entonces que una reacción redox se conforma de dos semi-reacciones: oxidación y reducción. Ambas se producen simultáneamente. También se da el hecho de que una misma sustancia se reduce y oxida a la vez. Esto se llama dismutación. Antes de comenzar la unidad, vamos a determinar las sub-unidades que vamos a estudiar en forma secuenciada: a.- Concepto de redox b.- Concepto de estado o número de oxidación (profesor pizarra) c.- Reglas para calcular el estado de oxidación d.- Identificar una reacción redox e.- Identificar agentes (oxidante y reductor) f.- Identificar semi-reacciones (oxidación y reducción) g.- Igualación Método Ión - electrón c.-Reglas para asignar el número de oxidación. Para calcular el número de oxidación de los elementos en compuestos inorgánicos, considera las siguientes reglas: Regla N° 1.El número de oxidación de cualquier átomo en estado libre, es decir, no combinado, es cero. 3 Regla N° 2. El número de oxidación del hidrogeno es +1, con algunas excepciones. Regla N° 3. El número de oxidación del oxigeno es –2, con algunas excepciones. Regla N° 4. El número de oxidación de un ion formado solo por un átomo (ion monoatómico) es igual a la carga del ion. Regla N° 5. La suma algebraica de los números de oxidación de todos los átomos en la formula química de un compuesto es cero. Regla N° 6. La suma algebraica de los números de oxidación de todos los átomos en la formula de un ion formado por mas de un átomo (ion poli atómico) es igual a la carga del ion. Problemas resueltos 1. Calcula el número de oxidación del nitrógeno en el ácido nítrico (HNO3). Primero, recordamos el numero de oxidación del hidrogeno y oxigeno. Según las reglas N°2 y N° 3, el H = +1 y el O = -2. Segundo, con la información que nos entrega la formula química, planteamos la ecuación según la regla N°5. +1 x –2 H N O3 (+1)+x+3 x (-2) = 0 Finalmente, despejamos la incógnita y obtenemos el número de oxidación del nitrógeno. X = -3 x (-2) – (+1) X = (+6)-1 X = +5 , N+5 2. Calcula el estado de oxidación del azufre en el ion sulfato (SO42-). Primero, escribimos sobre los símbolos los números de oxidación que conocemos: X –2 S O42Segundo, aplicamos la regla N°6, formulando la siguiente ecuación: X + 4 x (-2) = -2 4 Finalmente, resolvemos la ecuación, según: X = (-2) +8 X = +6, S+6 Observa que el numero de oxidación se escribe sobre el símbolo del elemento, anotando primero el signo (+ ó -) y luego el número; en cambio, la carga del ión se anota como superíndice, anotando primero el número y después el signo. Ejercitación: Calcula el número de oxidación de cada elemento: 1 ) Zn 2 ) Ca 3 ) Fe 4 ) H2 5 ) N2 6 ) O2 7 ) P4 + 8) H – 9) F + 10 ) Na +2 11 ) Cu +3 12 ) Fe –2 13 ) O –2 14 ) S 15 ) HF 16 ) CaF2 17 ) MgCl2 18 ) Na2S 19 ) NH3 20 ) CO2 21 ) CO 22 ) AlCl3 23 ) N2O3 24 ) N2O4 25 ) N2O5 – 26 ) NO3 –2 27 ) SO4 –2 28 ) SO3 – 29 ) ClO3 + 30 ) NH4 – 31 ) MnO4 –2 32 ) CrO4 5 33 ) 34 ) 35 ) 36 ) 37 ) 38 ) 39 ) 40 ) 41 ) –2 Cr2O7 NaOH LiOH Ca(OH)2 HNO3 H2SO4 H3PO4 HCN H4P2O7 RESPUESTAS 1 ) al 7 ) número de oxidación 8 ) al 14 ) número de oxidación 15 ) número de oxidación del H = número de oxidación del F = 16 ) número de oxidación del Ca número de oxidación del F = 17 ) número de oxidación del Mg número de oxidación del Cl 18 ) número de oxidación del Na número de oxidación del S = 19 ) número de oxidación del N = número de oxidación del H = 20 ) número de oxidación del C = número de oxidación del O = 21 ) número de oxidación del C = número de oxidación del O = 22 ) número de oxidación del Al número de oxidación del Cl 23 ) número de oxidación del N = número de oxidación del O = 24 ) número de oxidación del N = número de oxidación del O = 25 ) número de oxidación del N = número de oxidación del O = 26 ) número de oxidación del N = número de oxidación del O = 27 ) número de oxidación del S = número de oxidación del O = 28 ) número de oxidación del S = número de oxidación del O = 29 ) número de oxidación del Cl = número de oxidación del O = 30 ) número de oxidación del N = = 0 = carga del ión +1 –1 = +2 –1 = +2 = –1 = +1 –2 –3 +1 +4 –2 +2 –2 = +3 = –1 +3 –2 +4 –2 +5 –2 +5 –2 +6 –2 +4 –2 +5 –2 –3 6 31 ) 32 ) 33 ) 34 ) 35 ) 36 ) 37 ) 38 ) 39 ) 40 ) 41 ) número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del número de oxidación del H = Mn= O = Cr = O = Cr = O = Na = O = H = Li = O = H = Ca = O = H = H = N = O = H = S = O = H = P = O = H = C = N = H = P = O = +1 +7 –2 +6 –2 +6 –2 +1 –2 +1 +1 –2 +1 +2 –2 +1 +1 +5 –2 +1 +6 –2 +1 +5 –2 +1 +2 –3 +1 +5 –2 Ejercitación: 1. En los siguientes compuestos químicos, calcular el número de oxidación del elemento que esta coloreado: H2SO4, NaOH, MgO, Al2O3, H2CO3 y CuSO4. 2. En los siguientes iones poli atómicos, calcula el número de oxidación del átomo que esta coloreado: PO43-,CO32- y MnO4-. 3.-Completa con los coeficientes la ecuación planteada para la mezcla ideal de bencina y oxigeno. 2 C8H18 + 25 O2 CO2 + H2O a) Calcula los números de oxidación del O, H y C en O2, H2O y CO2. b) Completa una tabla realizada por ti, con el cambio en el número de oxidación que sufre el átomo. 7 4.-Escribe una ecuación química para cada una de las reacciones: a.-ácido :el HCl, y base: el NaOH b.-ácido: HCl y metal, el magnesio (Mg) c.-base :NaOH y metal, el magnesio (Mg) ¿En cuál de ellas no hay cambio en el número de oxidación? ¿En cuál de ellas hay cambio en el número de oxidación? d.-Identificar una reacción de redox (El numero de oxidación como un referente). La oxidación y la reducción se definen en función del cambio del número de oxidación que sufren los átomos al pasar de reactantes a productos. Si en una reacción hay cambio en el número de oxidación, entonces la reacción es de oxido-reducción o reacción redox. Por lo tanto, en el proceso de oxidación un átomo o ion cede uno o más electrones; mientras que en el de reducción, el átomo o ion capta uno o mas electrones. Ambos procesos son complementarios y ocurren simultáneamente. De ahí el nombre de reacciones redox. Cada vez que hay un aumento en el número de oxidación, ocurre una oxidación y cuando hay una disminución en el número de oxidación, se lleva a cabo una reducción Reacciones redox: transferencia de electrones. Cuando un elemento se oxida, pierde uno o varios electrones. Eso implica que otro átomo debe captarlos y, por tanto, ser reducido: La oxidación y la reducción siempre se dan simultáneamente. Un elemento se oxida cuando aumenta su estado de oxidación y se reduce cuando disminuye su número de oxidación. En toda reacción de oxidación-reducción se pueden distinguir dos semirreacciones, una de oxidación y otra de reducción. 8 Por ejemplo, en la reacción: CuSO4 + Zn ZnSO4 + Cu El zinc se oxida, pasando de estado de oxidación 0 a +2 y el cobre se reduce, al pasar su número de oxidación de +2 a 0. INFORMACIÓN QUE SE PUEDE RESCATAR DE ESTA REACCIÓN Zn0 + Cu+2 Zn+2 + Cu0 8ecuación iónica) Cu+2 Zn0 Zn0 Cu0 semirreacción de reducción Zn+2 semirreacción de oxidación Agente reductor: se oxida, libera electrones y permite que otro se reduzca Cu+2 Agente oxidante : se reduce Átomo o ion que se: OXIDA Cede electrones Aumenta su numero de oxidación Es un agente reductor REDUCE Acepta electrones Disminuye su numero de oxidación Es un agente oxidante La tabla resume el significado de los conceptos oxidación y reducción. 9 Experimenta con una reacción redox. - Introduce una lamina de Zinc en una disolución concentrada de sulfato de cobre (II) Deja pasar unos minutos y observa que ocurre. Responde: 1.- Describe detalladamente lo que le ocurrió a la lámina de zinc. 2.- En base a la ecuación química que representa la reacción, completa la tabla. Zn + CuSO4 Cu + ZnSO4 DE: A: CAMBIO EN EL NUMERO SE REDUCE O DE OXIDACIÓN SE OXIDA Zn CuSO4 ZnSO4 Cu De ______ a______ De ______ a______ 3.- El ion sulfato (SO 4 -2) aparece en ambos lados de la ecuación. ¿Sufre cambio en su número de oxidación? 4.- La ecuación que muestra sólo las especies que sufren cambio en su número de oxidación es: +2 0 0 +2 Cu2+ + Zn Cu + Zn2+ -¿Cuántos electrones cede el zinc?................... -¿Cuántos electrones acepta el Cu2+?................... 5.- En base a las ecuaciones que describen la oxidación y la reducción, completa los conceptos. a) escribe la semi-reacción de oxidación: b) escribe la semi-reacción de reducción: 6.- Completa: Oxidación es el proceso en el que el número de oxidación...................... .......................................................................... Reducción es el proceso en el que el número de oxidación....................... .......................................................................... 10 Problemas resueltos. 1. El cobre reacciona con el ácido nítrico, según la ecuación: Cu + HNO3 Cu(NO3)2 + H2O + NO2 ¡Verifica si se trata de una reacción redox.! Primero, establecemos los números de oxidación de los átomos de los reactantes y después, el de los productos. Cu + H N O3 Cu (N O3)2 + H2O + N O2 Segundo, vemos los átomos que cambian su numero de oxidación durante el proceso. El cobre cambia de 0 a +2 (en el Cu(NO3)2), es decir, cede 2 e-. El nitrógeno, en cambio varia de +5 (en el HNO3) a +4 (en el NO2), es decir, acepta 1 e-. ¡La reacción descrita es redox, pues ocurren los procesos de oxidación y de reducción.! 2. Escribe las semi-reacciones de oxidación y de reducción de la reacción anterior. Identifica el oxidante y el reductor. Primero, escribimos la semi-reacción de oxidación, escribiendo la ecuación para la sustancia cuyo numero de oxidación aumenta, es decir, el cambio que sufre el cobre. Cu° Cu+2 + 2 e- Segundo, escribimos la semi-reacción de reducción, escribiendo la ecuación para la sustancia cuyo numero de oxidación disminuye, es decir, el cambio que experimenta el nitrógeno. N+5 + e- N+4 El nitrógeno es el oxidante porque se reduce.gana o acepta electrones Observa que las cargas deben ser iguales a cada lado de la ecuación. Eso lo consigues, agregando los electrones correspondientes. Recuerda que al poner e-, sumas cargas negativas. Ejercicios. 1. En las siguientes semi-reacciones: Mg Mg2+ + 2 e- y Cu2+ + 2 eCu, ¿cuál es la oxidación y la reducción? ¿Cuál es el agente oxidante y reductor en cada caso? 2. El proceso industrial conocido como cementación permite la producción de cobre metálico por la adición de hierro (Fe) a una disolución acuosa de sulfato de cobre, según: Fe + CuSO4 FeSO4 + Cu. 11 a) Escribe las semi-reacciones de oxidación y de reducción b) Identifica cual es el agente oxidante y cual el reductor. Balance de ecuaciones redox por el método ion-electrón. Para balancear las ecuaciones que representan a las reacciones redox, podemos aplicar el método ion-electrón. Para ello debemos considerar todas las especies químicas tal como existen en una disolución, ya sea en forma iónica o molecular, así como el medio (ácido o básico) en que ocurre la reacción. PASOS PARA EQUILIBRAR 1.- En primer lugar se escribe la ecuación iónica, siguiendo la teoría de disociación electrolítica de Arrhenius y sin ajustar 2.- Se determinan los números de oxidación de los átomos y se identifican las especies que se oxidan y reducen 3.- Se escriben las dos semirreacciones iónicas: la de oxidación y la de reducción 4.- Se ajustan las semirreacciones en 2 pasos A) Se ajustan oxígeno, hidrógeno y el elemento añadiendo agua y protones, si el medio es ácido, o agua y oxidrilos si el medio es básico B) Se ajusta la carga de ambas partes de la reacción iónica añadiendo electrones en la parte que sean necesarios 5.- Se igualan los electrones en ambas semirreacciones 6.- Mediante la suma de las semirreacciones con igualdad en los electrones se obtiene la ecuación iónica ajustada 7.- Se cambian los iones por las moléculas correspondientes y se ajusta por tanteo las moléculas restantes, si las hay Apliquemos a un ejemplo 1.- En primer lugar se escribe la ecuación iónica, siguiendo la teoría de disociación electrolítica de Arrhenius y sin ajustar. Si la reacción es: K2Cr2O7 + KI + H2SO4 K2SO4 + Cr2(SO4)3 + I2 La reacción iónica será: K+ + Cr2O72- + I- + H+ + SO42- K+ + SO42- + Cr3+ + I2 12 2.- Se determinan los números de oxidación de los átomos y se identifican las especies que se oxidan y reducen En la reacción iónica: K+ + Cr2O72- + I- + H+ + SO42- K+ + SO42- + Cr3+ + I2 Los estados de oxidación antes de la reacción son Potasio Cromo Oxígeno Iodo Hidrógeno Azufre Oxígeno K+ Cr2O72- Cr2O72- I- H+ SO42- SO42- +1 +6 -2 -1 +1 +6 -2 Tras la reacción, los números de oxidación son: Potasio Cromo Oxígeno Iodo Azufre K+ Cr3+ SO42- I2 SO42- +1 +3 -2 0 +6 3.- Se escriben las dos semirreacciones iónicas: la de oxidación y la de reducción El cromo, cuyo número de oxidación pasa de +6 a +3, se reduce y el iodo, cuyo estado de oxidación pasa de -1 a 0, se oxida. K+ + Cr2O72- + I- + H+ + SO42- K+ + SO42- + Cr3+ + I2 La reacción iónica se divide en dos semirreacciones, una para las moléculas que contienen cromo, que se reduce: Cr2O72- Cr3+ y otra para el iodo, que se oxida: I- I2 4.- Se ajustan las semirreacciones en 2 pasos 4A) Se ajustan oxígeno, hidrógeno y el elemento añadiendo agua y protones, si el medio es ácido, o agua y oxidrilos si el medio es básico Cr2O72- Cr3+ En la parte izquierda hay dos átomos de cromo y siete de oxígeno. Como el medio es ácido, se añade en ese mismo lado catorce protones: Cr2O72- + 14H+ Cr3+ 13 Para ajustar la semirreacción, a la derecha debe haber dos átomos de cromo y siete moléculas de agua: Cr2O72- + 14H+ 2Cr3+ + 7H2O En la semirreacción: I- I2 no faltan ni sobran oxígenos o hidrógenos. Basta duplicar el número de iones yoduro: 2I- I2 4B) Se ajusta la carga de ambas partes de la reacción iónica añadiendo electrones en la parte que sean necesarios En el primer miembro de la ecuación hay doce cargas positivas y en el segundo seis: Cr2O72- + 14H+ 2Cr3+ + 7H2O Para ajustar las cargas se añaden seis electrones a la izquierda: Cr2O72- + 14H+ + 6e- 2Cr3+ + 7H2O En la otra semirreacción hay dos cargas negativas en el lado izquierdo: 2I- I2 Se ajusta añadiendo dos electrones a la derecha: 2I- I2 + 2e- 5.- Se igualan los electrones en ambas semirreacciones Para que el número de electrones sea igual en las dos reacciones, se multiplican las semirreacciones por los factores correspondientes. Cr2O72- + 14H+ + 6e2Cr3+ + 7H2O 2II2 + 2eMultiplicando la segunda reacción por tres, se igualan los electrones: 14 6I- 3I2 + 6e- 6.- Mediante la suma de las semirreacciones con igualdad en los electrones se obtiene la ecuación iónica ajustada Al sumar las semirreaciones iónicas, con igual número de electrones, se obtiene la reacción iónica ajustada: Cr2O72- + 14H+ + 6e+ 6I Cr2O72- + 14H+ + 6I- 2Cr3+ + 7H2O 3I2 + 6e2Cr3+ + 7H2O + 3I2 Los electrones, al estar a derecha e izquierda, se pueden eliminar. 7.- Se cambian los iones por las moléculas correspondientes y se ajusta por tanteo las moléculas restantes, si las hay Recordando las especies moleculares de las que procede cada ion, se sustituye en la ecuación iónica: Cr2O72- + 14H+ + 6IK2Cr2O7 + 7H2SO4 + 6KI 2Cr3+ + 7H2O + 3I2 Cr2(SO4)3 + 7H2O + 3I2 Finalmente, el potasio aparecerá como cuatro moléculas de sulfato de potasio en el segundo miembro de la ecuación: K2Cr2O7 + 7H2SO4 + 6KI Cr2(SO4)3 + 7H2O + 3I2 + 4K2SO4 Aplica tu y luego revisa La reacción entre zinc y el ácido clorhídrico es una reacción redox, Zn + HCl ZnCl2 + H2 porque hay cambio en el número de oxidación de los átomos participantes. 1. Se establece el cambio en los números de oxidación (debes verificar el estado de oxidación de cada especie presente en la reacción). Zn0 + H+1 Cl-1 Zn +2 Cl -12 + H20 2. Se plantean las semi-reacciones. Semi-reacción de oxidación: 15 Zn Zn2+ Semi-reacción de reducción: H+ H2 3. Se verifica si las semi-reacciones están equilibradas y se anteponen los coeficientes correctos. Como la semi-reacción de reducción no esta equilibrada (hay 1 H al lado izquierdo y 2 H al lado derecho de la ecuación), se antepone el coeficiente 2. 2 H+ H2 4. Se escriben los e- correspondientes al cambio del número de oxidación, y se equilibran las cargas. Semi-reacción de oxidación: Zn Zn2+ + 2eSemi-reacción de reducción: 2 H+ + 2 eH2 5. Se suman las semi-reacciones y se anteponen los coeficientes a la ecuación general. Zn Zn2+ + 2 e+ 2H + 2 e H2 Zn + 2H+ Zn2+ + H2 6. Se verifica que la reacción esté equilibrada Zn + 2 HCl ZnCl2 + H2 NOTA: la manera de verificar si el ejercicio de equiibrio estyá correcto es contar y sumar los átomo y las cargas ( si las hubiese) en reactantes y productos Problemas propuestos. 1.- Aplicando el método ion-electrón, equilibra las siguientes ecuaciones redox. a) b) c) Mg + O2 Fe + O2 C(s) + Cl2(g) MgO Fe2O3 CCl4(I) 2.- Identifica los agentes oxidantes y reductores en cada una de las reacciones anteriores. 3.-Importante: Ajuste cada reacción, siguiendo paso a paso las indicaciones dadas anteriormente. Además señale el oxidante y el reductor. Semi-reacciones. Compruebe su resultado con el que esta dado para cada una de ellas. Por ningún motivo memorice las reacciones. 16 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. aKMnO4 + bH2SO4 + cH2 dK2SO4 + eMnSO4 + fH2O aKl + bK2Cr2O7 + cH2SO4 dCr2(SO4)3 + eK2SO4 + fH2O +il2 aMnO4- + bHAsO2 + cH+ + dH2O eMn2+ + fH3AsO4 aHAsO2 – bI2 + cH2O dH3 AsO4 + eI- + fH+ aAsO2- + bOH- + cI2 dAsO34- + eI- + fH+ 22aS2O3 + bI2 cS4O6 + dIaH2S + bI2 cH+ + dI- + eS aAsO2- + bOH- + cI2 dAsO43- + eI- + fH2O aH2SO3 + bI2 + cH2O dH2SO4 + eH+ + fIaSn2+ + bI2 cSn2+ +dI+ aIO3 + bI + cH dI2 + eH2O aBrO3- + bI- + cH+ dI2 + eBr- + fH2O 22aI2 + bS2O3 cS4O6 + dIaBrO3- + bHAsO2 + cH2O dH3AsO4 + eBr+ aBrO3 + bBr + cH dBr2 + eH2O aBr2 + bI cI2 + dBr aMnO4- + bH+ + cCldMn2+ + eCl2 + fH2O aSO2 + bH2SO4 + cNa2Cr2O7 dNa2SO4 + eCr2(SO4)3 + fH2O Respuestas: 1. 2 KMnO4 + 3H2SO4 + H2 K2SO4 + 2 MnSO4 + 8 H2O 2. 6 KI + K2Cr2O7 + 7 H2SO4 Cr2(SO4)3 + 4 K2SO4 + 7 H2O + 3 I2 3. 2 MnO4- + 5 HAsO2 + 6 H+ + H2O 2 Mn2+ + 5 H3AsO4 4. HAsO2- + I2 + 2 H2O H3AsO4 + 2 I- + 2 H+ 5. AsO2 + 4 OH + I2 AsO43- + 2 I- + 2 H2O 226. 2 S2O3 + I2 S4O6 + 2 I7. H2S + I2 2 H+ + 2 I- + S 8. AsO2 + 4 OH + I2 AsO43- + 2 I- + 2 H2O 9. H2SO3 + I2 + H2O H2SO4 + 2 H+ + 2 I2+ 4+ 10. Sn + I2 Sn + 2 I11. IO3- + 5 I- + 6 H+ 3 I2 + 3 H2O 12. BrO3- + 6 I- + 6 H+ 3 I2 + Br- + 3 H2O 13. I2 + 2 S2O32S4O62- + 2I14. BrO3 + 3 HAsO2 + 3 H2O 3 H3 AsO4 + Br15. BrO3- + 5 Br- + 6 H+ 3 Br2 + 3 H2O 16. Br2 + 2 II2 + 2 Br17. 2 MnO4- + 16 H+ + 10 Cl2 Mn2+ + 5 Cl2 + 8 H2O 18. 3 SO2 + H2SO4 + Na2Cr2O7 Na2SO4 + Cr2(SO4)3 + H2O 17 APLICACIONES DE LAS REACCIONES REDOX Cada vez que enciendes una linterna estás usando la corriente eléctrica , producida por una reacción química .Específicamente por una reacción REDOX. Otras aplicaciones de este tipo de reacciones de intercambio de electrones son: - Los procesos respiratorios: (el O se reduce de 0 a -2) - La combustión (también reducción del O2 ambiental) - Obtención de metales a partir de sus minerales: por ejemplo reducción del Cobre desde el mineral ( CuO entre otros) hasta la obtención de Cu0 metálico. - Pilas o celdas galvánicas: reacción redox que genera energía - Electrólisis: reacción no espontánea de separación de compuestos por ejemplo 2H2O 2H2 + O2 (REACCIÓN REDOX) 1.- CELDAS GALVÁNICAS O PILAS Es un dispositivo que permite la obtención de corriente eléctrica a partir de una reacción REDOX que ocurre espontáneamente Dentro de una celda galvánica hay dos electrodos que es donde ocurren las reacciones de oxidación y de reducción . El electrodo donde ocurre la oxidación se llama ánodo , tiene carga negativa ( _ ), de el escapan los electrones El electrodo donde ocurre la reducción se llama cátodo, tiene carga positiva ( + ) hacia el migran los electrones Ánodo oxidación escapan los electrones (-) Cátodo reducción atrae electrones (+) El ánodo es el polo negativo de la celda galvánica, y hacia él se dirigen los aniones, de ahí su nombre. El polo positivo de la celda galvánica es el cátodo. Su nombre procede de que hacia él se dirigen los cationes. Entre el cátodo y el ánodo se produce un diferencia de potencial, y por lo tanto se genera una corriente eléctrica . 18 Las celdas galvánicas se representan empezando por el ánodo y finalizando en el cátodo. Una línea vertical (|) simboliza un cambio de fase y dos líneas verticales (||) un puente salino. Los constituyentes de cada celda se pueden especificar en su forma molecular o sólo escribiendo la forma iónica, pero siempre especificando el estado de agregación. La pila de Daniell ( que está representada en las dos figuras) se indicaría: Zn | ZnSO4(ac) || CuSO4(ac) | Cu Escribiendo las especies iónicas: Zn | Zn2+(ac) || Cu2+(ac) | Cu Se puede escribir únicamente uno de los electrodos. Así el cátodo sería: Cu2+(ac) | Cu y el ánodo: Zn | Zn2+(ac) Esta Celda Galvánica está compuesta de: - Semiceldas: en este caso, vasos precipitados con electrodos y solución salina. Cada celda se compone de 2 semiceldas, en una de ellas se lleva a cabo la oxidación y en la otra la reducción. - Puente salino: consiste en un tubo de vidrio en U que permite el flujo de iones ( en este caso (SO4-2) entre una semicelda y otra con el objetivo de equilibrar la cantidad de iones en ambos lados de la reacción - Alambre conector: por donde circulan los electrones desde una semirreacción (oxidación= cede electrones) a otra ( reducción = capta electrones) - Ampolleta o voltímetro: que verifica el flujo de electrones - electrodos: son las placas metálicas que forman parte de la semicelda. Uno de los electrodos es el lugar donde ocurre la oxidación (ánodo) y el otro electrodo es el lugar donde ocurre la reducción ( cátodo) 19 Una celda galvánica produce una corriente eléctrica continua, entre sus electrodos hay una diferencia de potencial, la fuerza electromotriz de la pila. Puesto que el cátodo es el electrodo positivo y el ánodo el negativo, la diferencia de potencial de la pila sería la diferencia entre el potencial del cátodo y el del ánodo. E = Eox + Ere El potencial eléctrico de un electrodo, sin embargo, no puede determinarse de forma absoluta, así que se calculan haciendo referencia a un electrodo especial: el electrodo de hidrógeno . Potencial de reducción normal de electrodo es la diferencia de potencial, a 25 ºC, entre el electrodo considerado y el electrodo normal de hidrógeno, cuando las especies iónicas están presentes con una concentración de 1 M y las especies gaseosas a una presión de 1 atm. La serie electroquímica es un sistema ordenado de reacciones de reducción en las que el potencial normal de reducción aumenta. Los potenciales de oxidación tendrán signo contrario y con la reacción inversa Reacción de reducción Potencial (V) Li+ + eLi K+ + e K Ba2+ + 2eBa Na+ + eNa Mg2+ + 2eMg Al3+ + 3eAl Zn2+ + 2eZn Cr3+ + 3eCr Fe2+ + 2eFe H3PO4 +2H+ + 2eSn2+ + 2eSn Pb2+ + 2ePb SO42- +4H+ + 2eCu2+ + 2eCu H2SO3 + 4H+ + 2eCu+ + eCu -3.05 -2.92 -2.90 -2.71 -2.34 -1.66 -0.76 -0.74 -0.44 H3PO3 + H2O -0.20 -0.14 -0.13 H2SO3 + H2O 0.17 0.35 S + 2H2O 0.45 0.52 20 1/2I2 + eIFe3+ + eFe2+ Ag+ + eAg HNO3 + 2H+ + 2e1/2Br2 + eBr 1/2Cl2 + eClMnO4- +4H+ + 3e1/2F2 + eF- 0.54 0.77 0.80 HNO2 + H2O 0.93 1.06 1.36 MnO2 + 2H2O 1.67 2.87 Para que la reacción sea espontánea, la fuerza electromotriz de la reacción deberá ser positiva, ya que así disminuirá la energía libre. Con los potenciales de reducción de la serie electroquímica es posible determinar la fuerza electromotriz de la reacción y, por tanto, la espontaneidad de la reacción redox. Ejemplo: 1.-Determina Ag+ + eCl- la fuerza Ag y electromotriz normal (fem) de la reacción entre 1/2Cl2 + e- Y predice en que sentido ocurre la reacción Respuesta: Primero: Se busca el potencial de reducción normal en la tabla Ag+ + e- Ag E= 0.80 V Cl1/2Cl2 + e- E= -1,36 (este valor se debe invertir, ya que la tabla considera sólo reacciones de reducción) Segundo: reemplaza en E= Eox + Ered E = -1,36 + 0,80 = -0,56 Esto significa que la reacción es no espontánea en el sentido que esta descrita. Es espontánea en el sentido inverso 21 2.- Una celda galvánica consta de un electrodo de magnesio en una solución 1 M de Mg(NO3)2 y un electrodo de plata en una disolución 1 M de AgNO3. Calcula la fuerza electromotriz estándar de esta celda electroquímica a 25ºC Mg+2 + 2e Mg0 E= - 2,37 V + Ag0 Ag+1 + 1e E= 0,80 V Si las reacciones se suman tal y como están escritas resultará una reacción no espontánea por lo tanto las semirreacciones se deben invertir para que la pila funcione y la diferencia de potencial realmente genere energía eléctrica Además se debe igualar la cantidad de electrones en ambas semirreacciones(amplificando por 2 la segunda semirreaccion) esto no afecta al potencial E Mg0 Mg+2 + 2e E= + 2,37 V (oxidación) + 2Ag+1 + 2e 2Ag0 E= - 0,80 V (reducción) _____________________________________________________ Mg0 + 2Ag+1 + 2e E= Eox + Ered Mg+2 + 2e + 2Ag0 E= 3,17 E positivo, reacción espontánea MAS EJERCICIOS EN CHANG “QUIMICA GENERAL”(capítulo 19) 2.CELDAS ELECTROLITICAS Cátodo: Na+1 Çanodo: 2 Cl-1 +1e Na0 Cl2 + 2e El proceso de electrolisis es un proceso inverso a las celdas galvánicas. Es un proceso no espontáneo en donde se necesita aporte de energía eléctrica para que la reacción proceda Se utiliza para obtener elementos puros a partir de sales o compuestos oxidados. Ejemplo, electrólisis del agua (para obtener H2y O2, electrólisis del NaCl para obtener Na y Cl2 22 Química en acción. El monóxido de carbono (CO) producido en las combustiones incompletas es un gas altamente nocivo. Al inhalar CO, este ingresa directamente a nuestro cuerpo, transportado por la corriente sanguínea. En la sangre, el CO se combina con la hemoglobina con gran eficiencia, reacciona con ella nada menos que unas 200 veces mas “agresivamente” que el oxigeno. Así, la sangre deja de cumplir su rol de transportar oxigeno hacia las células. Dependiendo de la cantidad de CO en el aire y del tiempo de exposición a este gas, mas y mas hemoglobina se combina con el CO y los síntomas progresan desde simples dolores de cabeza a mareos, náuseas, como y muerte. El límite seguro de CO respirable en 8 horas de exposición, Una vez al año, es de 10 ppm. Concentraciones mayores son permisibles en periodos de exposición más cortos. En un tráfico pesado, los niveles de CO alcanzan frecuentemente los 50 ppm y a veces, a50 ppm. El humo de un cigarrillo contiene entre 200 y 400 ppm de CO. Por lo tanto, fumar mientras se está en un taco es dolor de cabeza seguro. Nota : Puedes buscar más información y/o ejercicios en los textos de Biblioteca y en Internet. Existe mucho material teórico y problemas