C.H.U. JUAN CANALEJO ... A Coruña, MAYO 2005 SERVICIO DE FARMACIA
Anuncio

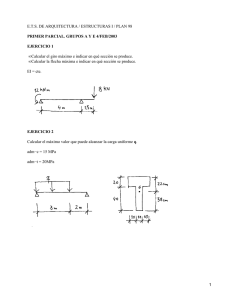
C.H.U. JUAN CANALEJO A Coruña, MAYO 2005 INFORMACIÓN DE MEDICAMENTOS SERVICIO DE FARMACIA ACIDO MICOFENOLICO (micofenolato de sodio) Nombre comercial: MYFORTIC® Presentación: Myfortic® 180 mg 100 comprimidos gastrorresistentes. Myfortic® 360 mg 50 comprimidos gastrorresistentes. Laboratorio: NOVARTIS FARMACÉUTICA Grupo terapéutico: L04 AA06- inmunosupresor selectivo Fecha de comercialización: enero 2004. PVL: Myfortic® 180 mg 100 comp. …. 105,73 € Myfortic® 360 mg 50 comp. …... 105,73 € INTRODUCCIÓN: En la actualidad el tratamiento inmunosupresor disponible en el trasplante renal está basado en: Ciclosporina (Sandimum Neoral®), Tacrolimus (Prograf®), Micofenolato mofetilo (Cellcept®) Sirolimus (Rapamune®) Azatioprina (Imurel®) y corticosteroides. El ácido micofenólico en comprimido gastrorresistente (EC-MPS) es una formulación que libera, directamente, ácido micofenólico a nivel del intestino delgado. El potencial de toxicidad a nivel superior del tracto gastrointestinal parece estar reducido en el EC-MPS, ya que a diferencia del micofenolato mofetil (MMF) que libera MPA en el estómago, el EC-MPS libera MPA en el intestino delgado, como evidencia su mayor Tmax en comparación con MMF (2 horas vs 8 h, respectivamente). 1 ACCIÓN FARMACOLÓGICA: El ácido micofenólico (MPA) es un inhibidor potente, selectivo, no competitivo y reversible de la inosina monofosfato deshidrogenasa, e inhibe, por tanto, la síntesis de novo del nucleótido guanosina, sin incorporación al ADN. Dado que los linfocitos T y B dependen de una manera decisiva para su proliferación de la síntesis de novo de purinas, mientras que otros tipos de células pueden utilizar mecanismos de recuperación de purinas, el MPA tiene unos efectos citostáticos más potentes en los linfocitos que en otras células.2 INDICACIONES Y POSOLOGÍA: El micofenolato de sodio (EC-MPS) está indicado en combinación con ciclosporina y corticoesteroides para la profilaxis del rechazo agudo en pacientes adultos sometidos a un trasplante renal alogénico. La dosis recomendada es de 720 mg administrados dos veces al día (dosis diaria de 1440 mg). Esta dosis de micofenolato de sodio corresponde a 1 g de micofenolato mofetilo administrado dos veces al día (dosis diaria de 2 g). Myfortic® se puede administrar con o sin alimentos pero debe realizarse siempre de la misma manera. Los comprimidos deben tomarse enteros con un vaso de agua y no deben triturarse con el fin de mantener la integridad del recubrimiento entérico. En los pacientes con trasplante renal de novo el tratamiento con Myfortic® debe iniciarse dentro de las 72 horas posteriores al trasplante. Poblaciones especiales: - Niños y adolescentes: No se dispone de datos suficientes que apoyen la eficacia y seguridad de EC-MPS en niños y adolescentes. Se dispone de escasos datos farmacocinéticos sobre los pacientes pediátricos con trasplante renal - Ancianos: La dosis recomendada en pacientes ancianos es de 720 mg dos veces al día. - Insuficiencia renal: No se precisan ajustes de dosis en pacientes que experimenten función retardada del injerto renal en el postoperatorio. Los pacientes con insuficiencia renal grave (tasa de filtración glomerular <25 mlmin-11,73 m-2) deben ser controlados cuidadosamente y la dosis diaria no debe exceder de 1440 mg. Insuficiencia hepática: No se precisan ajustes de dosis en pacientes con trasplante renal afectos de una insuficiencia hepática grave. Tratamiento durante los episodios de rechazo: El rechazo del trasplante renal no induce cambios en la farmacocinética del MPA; no es necesario modificar la posología ni interrumpir su administración. FARMACOCINÉTICA: El micofenolato de sodio (EC-MPS) se absorbe considerablemente tras la administración oral. El MPA, debido al recubrimiento entérico del comprimido, tarda 1,5-2 horas aproximadamente en alcanzar su concentración máxima (Tmax). En los pacientes con trasplante renal estable, que recibieron un tratamiento inmunosupresor basado en ciclosporina, la absorción gastrointestinal del MPA fue del 93% y la biodisponibilidad absoluta del 72 %. La farmacocinética de Myfortic® es proporcional a la dosis y lineal en el intervalo de dosis estudiadas de 180 a 2160 mg. El volumen de distribución del MPA en estado estacionario es de 50 L. Tanto el ácido micofenólico como el glucurónido del ácido micofenólico se unen fuertemente a proteínas, en un porcentaje del 97% y del 82%, respectivamente. La concentración de MPA libre puede aumentar en condiciones clínicas en las que exista una disminución de la unión a proteínas (uremia, deficiencia hepática, hipoalbuminemia, uso concomitante de fármacos de gran unión a proteínas). Ello podría exponer a los pacientes a un mayor riesgo de reacciones adversas relacionadas con el MPA. El MPA se metaboliza principalmente mediante la glucuronil transferasa que lo convierte en el glucurónido fenólico del MPA, glucurónido del ácido micofenólico (MPAG). El MPAG es el principal metabolito del MPA y no manifiesta actividad biológica. Aunque pueden detectarse pequeñas cantidades de MPA (<1,0%) en la orina, la mayor parte del MPA se elimina en la orina en forma de MPAG. El MPAG secretado en la bilis queda a disposición de la flora intestinal para su desconjugación. El MPA resultante de esta desconjugación puede ser reabsorbido. Alrededor de 6-8 horas después de la administración de Myfortic® puede medirse un segundo pico de concentración del MPA, consistente con la reabsorción del MPA desconjugado. La semivida del MPA es de 12 h aproximadamente y el aclaramiento de 8,6 l/h, mientras que la semivida del MPAG es más larga, aproximadamente 16 h y su aclaramiento es de 0,45 L/h. CONTRAINDICACIONES Contraindicado en pacientes con hipersensibilidad al micofenolato de sodio, ácido micofenólico o micofenolato mofetilo o a cualquiera de los excipientes. ADVERTENCIAS Y PRECAUCIONES: Los pacientes que reciben regímenes inmunosupresores presentan un mayor riesgo de desarrollar linfomas y otras neoplasias, especialmente neoplasias de la piel. Para reducir al mínimo el riesgo de cáncer de piel, los pacientes deben limitar la exposición a la luz solar, a los rayos UV y que utilicen un filtro solar adecuado. Se debe instruir a los pacientes que reciban Myfortic® para que comuniquen inmediatamente cualquier signo de infección, hematomas inesperados, hemorragias o cualquier otra manifestación de depresión de la médula ósea. Durante el tratamiento con Myfortic® se debe controlar la posible aparición de neutropenia, que puede estar relacionada con el propio MPA, con los medicamentos concomitantes, con las infecciones víricas o con alguna combinación de estas causas. Se deben realizar recuentos sanguíneos completos semanalmente durante el primer mes, dos veces al mes en el segundo y tercer mes de tratamiento, y posteriormente una vez al mes durante el primer año. En caso de neutropenia podría ser necesario interrumpir o suspender el tratamiento con Myfortic®. Dado que se ha observado una asociación entre los derivados del ácido micofenólico y una elevada incidencia de reacciones adversas del aparato digestivo, incluyendo casos poco frecuentes de ulceración, hemorragia y perforación del tracto gastrointestinal, el MPA se debe administrar con precaución en pacientes con enfermedades activas graves del aparato digestivo. Debido a que no se ha evaluado la administración conjunta de Myfortic y azatioprina, no se recomienda su uso concomitantemente. Micofenolato de sodio y micofenolato mofetilo no deberían intercambiarse o sustituirse indiscriminadamente, dado que sus perfiles farmacocinéticos son diferentes. Myfortic® se ha administrado en combinación con corticoesteroides y ciclosporina. Existe escasa experiencia sobre su uso concomitante con terapias de inducción como globulina anti-linfocitos o basiliximab. No se ha estudiado la eficacia ni la seguridad del uso de Myfortic® con otros inmunosupresores (p. ej: tacrolimus). Myfortic® es un inhibidor de la IMDH (inosina monofosfato deshidrogenasa). Por lo tanto, se debería evitar en pacientes con deficiencias hereditarias raras de la hipoxantina guanina fosforribosil transferasa (HGFRT), como el síndrome de Lesch-Nyhan y de Kelley-Seegmiller. Se debe evitar la administración concomitante de Myfortic® con: -Aciclovir y Ganciclovir: se cabe esperar un aumento de los niveles de glucurónido del ácido micofenólico (MPAG) y de aciclovir/ganciclovir, posiblemente como resultado de una competición por la vía de secreción tubular. Es improbable que los cambios en la farmacocinética del MPAG, tengan un significado clínico en los pacientes con función renal adecuada. En presencia de insuficiencia renal, es posible un aumento aun mayor en las concentraciones plasmáticas de MPAG y aciclovir/ganciclovir. -Colestiramina y fármacos que se unen a los ácidos biliares: ya que interfieren con la circulación enterohepática y puede dar como resultado una exposición sub-terapéutica del MPA sistémico y una eficacia reducida del Myfortic®. -Antiácidos que contengan magnesio y aluminio: Se ha observado un descenso del AUC y Cmax del MPA en aproximadamente un 37% y un 25%, respectivamente. Los antiácidos que contienen magnesio y aluminio se pueden utilizar de forma intermitente para el tratamiento de la dispepsia ocasional. Sin embargo, no se recomienda el uso diario, crónico de estos antiácidos con Myfortic®, debido al potencial para disminuir la exposición del MPA y reducir la eficacia. EFECTOS ADVERSOS Entre los efectos adversos más frecuentes se encuentran: o Infecciones e infestaciones: Infección viral, bacteriana y fúngica. o Trastornos de la sangre y del sistema linfático: leucopenia, trombocitopenia, y anemia. o Trastornos del sistema nervioso: cefalea. o Trastornos respiratorios, torácicos y mediastínicos: tos. o Trastornos gastrointestinales: diarrea, distensión abdominal, dolor abdominal, sensibilidad abdominal al tacto, estreñimiento, dispepsia, flatulencia, gastritis, heces blandas, náuseas, vómitos. o Trastornos generales: pirexia y fatiga. o Trastornos hepatobiliares: Alteración de los parámetros de la función hepática o Trastornos renales y urinarios: Aumento de la creatinina en sangre. Efectos adversos poco frecuentes o raros: infección de la herida, convulsiones, pancreatitis, enfermedad similar a la gripe, edema del limbo inferior, anorexia, hiperlipidemia, alopecia, taquicardia, papiloma de la piel. EFICACIA CLÍNICA Se ha evaluado la eficacia inmunosupresora de EC-MPS en combinación con ciclosporina para microemulsión y corticosteroides en la prevención del rechazo del injerto en ensayos clínicos aleatorizados en adultos receptores de transplante renal, y en la conversión de MMF a EC-MPS en pacientes trasplantados renales. Salvadori et al.3 Estudio multicéntrico, doble ciego, aleatorizado, con grupos paralelos durante 12 meses. El objetivo principal del estudio consistió en demostrar la equivalencia terapéutica de Myfortic® 1,44 g/día y MMF 2g/día. La variable principal de eficacia fue la incidencia de rechazo agudo demostrado mediante biopsia (BPAR), pérdida del injerto, muerte o la pérdida para el periodo de seguimiento en los primeros 6 meses de tratamiento. También se comparó el perfil de seguridad de ambos medicamentos. Se incluyó un total de 423 pacientes (213 asignados a Myfortic® y 210 a MMF) La población del estudio se compuso de pacientes de ambos sexos, edades comprendidas entre 18 y 75 años, que fuesen receptores de un primer trasplante de riñón de donante vivo o cadaver. Los pacientes presentaban triple terapia inmunosupresora en combinación con ciclosporina y esteroides. 6 meses EC-MPS MMF BPAR, pérdida del injerto, muerte o la pérdida para el periodo de seguimiento BPAR, pérdida del injerto o muerte BPAR 25,8% 12 meses EC-MPS MMF 26,2% 26,3% 22,5% 28,1% 24,3% A los 6 meses no hubo diferencias estadísticamente significativas en la variable principal, demostrando equivalencia terapéutica entre ambos medicamentos a estudio. El perfil de efectos adversos e incidencia de efectos gastrointestinales (GI) fue similar en ambos grupos. Una proporción similar de pacientes experimentaron efectos adversos a nivel GI durante los 12 meses del periodo de estudio (EC-MPS 80,8% vs MMF 80%; p=ns), aunque este estudio no fue diseñado para demostrar diferencias entre ambos medicamentos a nivel de efectos adversos gastrointestinales. En los 12 meses de seguimiento, 15% de EC-MPS y 19,5% MMF necesitaron cambios de dosis (discontinuación o reducción de dosis) por problemas GI. El estudio concluye en la equivalencia terapéutica de ambos medicamentos con un perfil de efectos adversos similar. Estudio B302. Budde K et al. 4 Estudio doble ciego, randomizado, multicéntrico, grupos paralelos, durante 1 año en que se evaluaba si pacientes trasplantados renales tratados con MMF podían ser cambiados, sin riesgo, a EC-MPS. 159 pacientes fueron aleatorizados para recibir 720 mg dos veces al día de EC-MPS y 163 pacientes continuaban recibiendo MMF 2g/día. El objetivo principal de seguridad fue evaluar la incidencia y severidad de efectos adversos GI a los 3 meses y neutropenia. 3 meses 6 meses EC-MPS MMF EC-MPS MMF EA GI 26.4% 20.9% 28.9% 27.6% EA GI superior 21.2% 13.5% 15.7% 16.6% EA GI no superior 18.2% 12.9% 20.1% 18.4% EAGI: efectos adversos a nivel gastrointestinal 12 meses EC-MPS MMF 29.6% 24.5% 15.1% 14.1% 18.9% 19.0% A los 3 meses no hubo diferencias estadísticamente significativas en la variable principal, demostrando similar perfil de seguridad de ambos medicamentos. Objetivos secundarios incluían evaluar la incidencia y severidad de efectos adversos GI y neutropenia, incidencia y severidad de infecciones e interrupción por efectos adversos serios. La eficacia fue evaluada como objetivo secundario midiendo la falta de eficacia (variable compuesta de BPAR, pérdida del injerto o muerte a los 6 y 12 meses). Con la excepción de incidencia de infecciones graves (8.8% vs 16.0%; p>0.05), no se encontraron diferencias estadísticamente significativas entre EC-MPS y MMF en los parámetros de seguridad y eficacia evaluados. Abbud-Filho M et al 5 Estudio prospectivo, multicéntrico, abierto sobre una población de América Latina. El objetivo del estudio era determinar la seguridad y tolerabilidad de la conversión de MMF a EC-MPS en pacientes mayores de 6 años, trasplantados renales estables, tratados con MMF. Todos los pacientes recibieron triple terapia: EC-MPS 1440 mg/día (dosis equivalente a MMF 2 g/día), ciclosporina (dosis ajustada mediante la determinación de la concentración plasmática a las 2 horas) y esteroides. Aquellos pacientes que recibían dosis inferiores a 2 g/día de MMF previo a la conversión, fueron incluidos y recibieron dosis de EC-MPS de 1,4 g/día cuando el investigador lo consideraba apropiado. El período de seguimiento del ensayo fue de 3 meses, donde se incluyeron 93 pacientes con una edad media 37,4 12,2 años (62 hombres, 31 mujeres) con una media de tiempo post-trasplante de 2,2 1,8 años y una creatinina basal de 1,3 0,29 mg/dL. Después de la conversión a EC-MPS la incidencia de efectos adversos fue del 40,9%, de los cuales el 19,4% eran gastrointestinales incluyendo un 10,8% de efectos adversos del tracto gastrointestinal superior y un 5,4% diarrea. Se comunicaron efectos adversos hematológicos con una incidencia del 1,1% (un caso de poliglobulia) e infecciones en un 28% de los casos (1 sólo caso de infección por CMV). A ningún paciente se le suspendió el tratamiento por efectos adversos y, sólo 6 pacientes necesitaron una reducción de dosis de EC-MPS. No hubo episodios de rechazo agudo, muerte o pérdida del injerto. En resumen, la conversión de MMF a EC-MPS fue segura en términos de función renal y toxicidad. MyPROMS. Subprotocol DE02: Europe6 Subestudio prospectivo, abierto, multicéntrico para determinar la eficacia y seguridad del cambio de MMF a EC-MPS en pacientes trasplantados renales estables. La inmunosupresión base consistía cn ciclosporina con o sin corticoesteroides. Los datos preliminares a los 3 meses con 57 pacientes son: Incidencia total de EA (efectos adversos) Incidencia EA GI Incidencia de EA relacionados con EC-MPS Neutropenia, Leucopenia, Trombocitopenia Falta de eficacia (BPAR) 61,4% 15,8% 10,5% 0% 1,8% Sólo un paciente (1,8%) presentó efecto adverso gastrointestinal que obligó a reducir la dosis y posteriormente a suspender el medicamento. Los resultados preliminares del subestudio a 3 meses sugieren que la conversión de MMF a EC-MPS es bien tolerada. ÁREA ECONÓMICA: POSOLOGÍA COSTE/DÍA (€) Micofenolato de sodio Myfortic ® 720 mg/ 12 h Micofenolato mofetilo Cellcept® 1000 mg/ 12 h 8,46 8,10 CONSIDERACIONES: EC-MPS es un inhibidor potente, selectivo, no competitivo y reversible de la inosina monofosfato deshidrogenasa, ejerciendo efectos citostáticos más potentes en los linfocitos B y T que en otras células, que utilizan mecanismos de recuperación de purinas. EC-MPS presenta equivalencia terapéutica con micofenolato de mofetilo. El perfil de efectos adversos es similar en ambos fármacos. A pesar de una absorción a nivel del intestino delgado de EC-MPS, no se obtuvieron diferencias estadísticamente significativas en relación a los efectos adversos a nivel superior del tracto gastrointestinal. BIBLIOGRAFÍA 1 Bjarnson I. Enteric coating of mycophenolate sodium: a rational approach to limit topical gastrointestinal lesions and extend the therapeutic index of mycophenolate. Transplantation Proceedings;2001: 3238-3240. 2 Ficha técnica Myfortic®. Laboratorio Novartis farmacéutica. Junio 2004. 3 Salvadori M, Holzer H, de Mattos A, Sollinger H, Arns W, Oppenheimer F, Macca J and may M. Enteric-coated mycophenolate sodium is therapeutically equivalent to mycophenolate mofetil in de novo renal transplant patients. American Journal of Transplantation 2003;4(2): 231-236. 4 Budde K ,Curtis J, Knoll G, Chan L, Neumayer HH, Seifu Y and Hall M. Enteric-coated mycophenolate sodium can be safely administered in maintenance renal transplant patients: results of 1-year study. American Journal Transplantation 2003;4:237-243. 5 Abbud-Filho M, Giron F, Hernandez E, Juarez F, Liendo C, Novoa P, Toledo M; Myproms Latam Study Group. Stable renal transplant recipients can be safely converted from MMF to enteric-coated mycophenolate sodium tablets: Interim results of a multicenter Latin American study. Transplant Proc. 2004 Jul-Aug;36(6):1647-9. 6 Nashan B, Ivens K, Arns W, Abbud Filho M on behalf the myPROMS DEO2 and LA01 study groups. Conversion from mycophenolate mofetil to enteric-coated mycophenolate sodium in maintenance renal transplant patients: preliminary results from the myfortic prospective multicenter study. Transplantation proceedings 2004; 36(suppl2s): 521S-523S.