Clase_equi 4
Anuncio
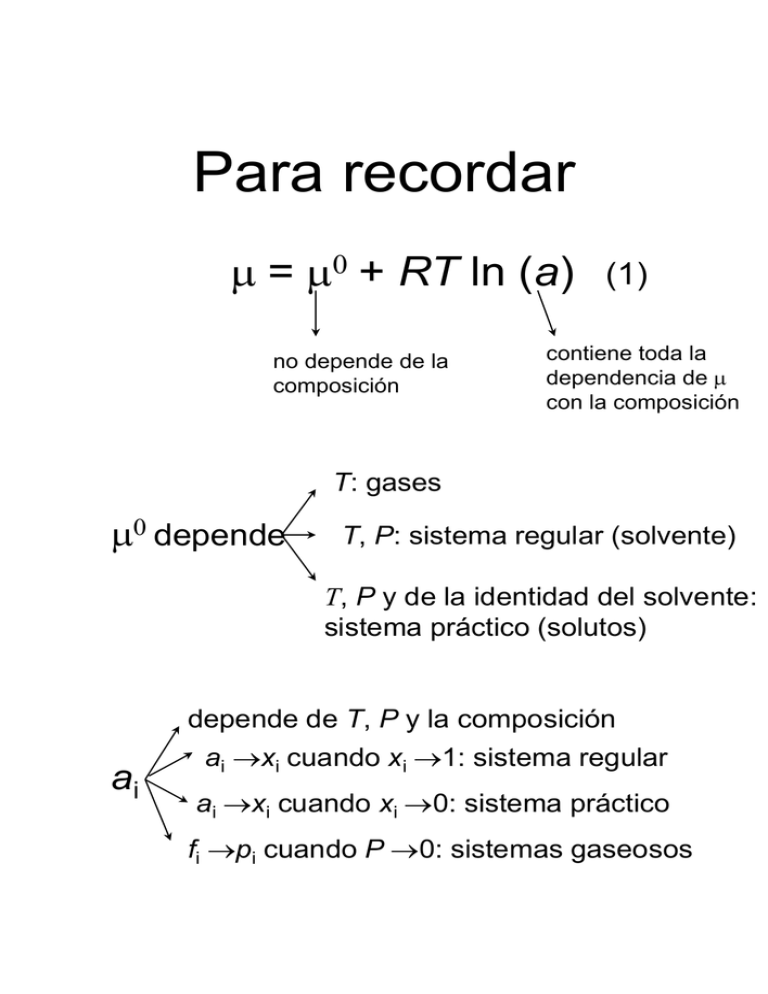
Para recordar m = m0 + RT ln (a) no depende de la composición (1) contiene toda la dependencia de m con la composición T: gases m0 depende T, P: sistema regular (solvente) T, P y de la identidad del solvente: sistema práctico (solutos) ai depende de T, P y la composición ai xi cuando xi 1: sistema regular ai xi cuando xi 0: sistema práctico fi pi cuando P 0: sistemas gaseosos La constante de equilibrio G v m 0 i i en el equilibrio (2) a T y P constante. i DGr vA A vB B DG v m v m r B B A A DG v m RT ln (a )) v m RT ln (a )) r B B B A DG v m v m RT ln (a r B B A vB A B DG DG RT ln(a 0 r r vB B A a ) a ) vA A DG DG RT ln (Q ) 0 r r (3) vA A A En el equilibrio DGr = 0 DG RT ln (Q ) 0 r eq Q e (4) (5) DGr 0 RT DGr 0 RT eq a a vB B vA A e eq función independiente de la composición cociente de funciones de la composición a a vB B vA A K independiente de la composición eq K(T) reacciones fase gaseosa K K(T, P) reacciones en solución ¿Qué pasa si se agregan reactivos o productos a un sistema reactivo en equilibrio químico? Efecto de la temperatura sobre K DG (6) ln(K ) RT 1 DG DG ln(K ) RT T RT T DS DG TDS DG ln(K ) T RT RT RT RT DH ln(K ) (7) RT T 0 0 0 2 P P 0 0 2 0 2 0 2 P 0 2 P ¿Qué pasa si se modifica súbitamente la temperatura de un sistema reactivo en equilibrio químico? K a y Kc a K K a a c K c K K a vB vB B B vA vA A A vB B vA (8) A vB B a vA A c (9) AcH + H2O Ac- + H3O+ K 10 5 DG 0 0 ¿El ácido acético se disocia espontáneamente cuando se disuelve en agua? a a DG DG RT ln a a DG RT ln(K ) 0 H 3O Ac H 2O AcH 0 DG indica el sentido espontáneo de la reacción. DG0 indica la posición de equilibrio del sistema.











