TECNICAS DE CULTIVO DE ESPECIES PLANCTONICAS E INVERTEBRADOS.docx
Anuncio
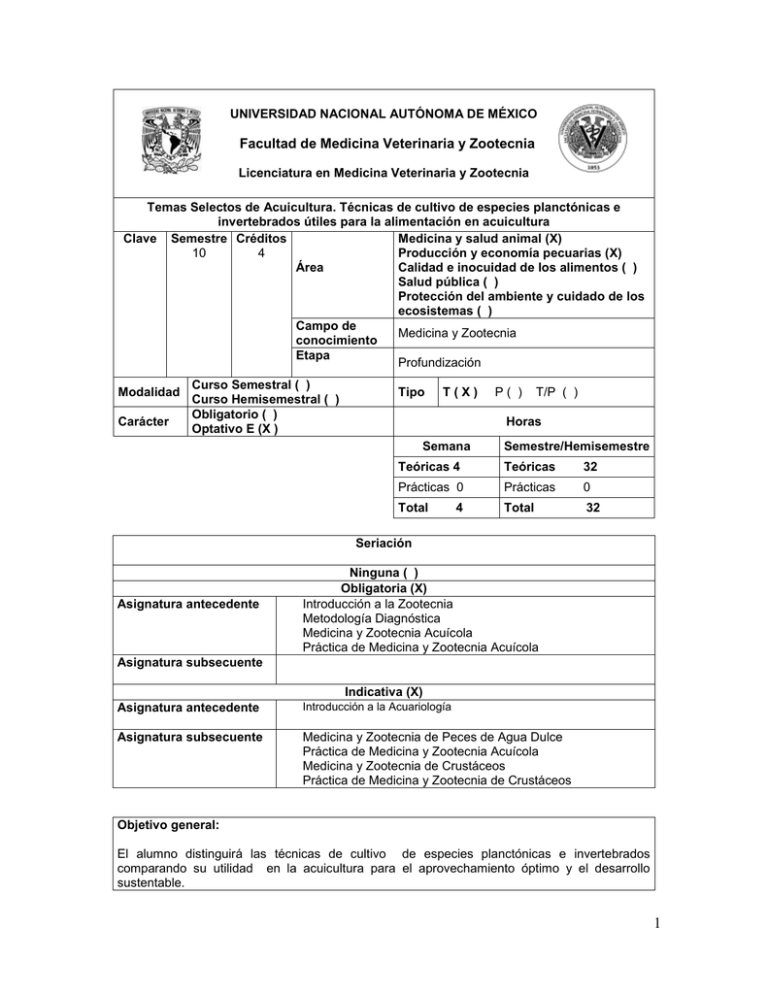
UNIVERSIDAD NACIONAL AUTÓNOMA DE MÉXICO Facultad de Medicina Veterinaria y Zootecnia Licenciatura en Medicina Veterinaria y Zootecnia Temas Selectos de Acuicultura. Técnicas de cultivo de especies planctónicas e invertebrados útiles para la alimentación en acuicultura Clave Semestre Créditos Medicina y salud animal (X) Producción y economía pecuarias (X) 10 4 Área Calidad e inocuidad de los alimentos ( ) Salud pública ( ) Protección del ambiente y cuidado de los ecosistemas ( ) Campo de Medicina y Zootecnia conocimiento Etapa Profundización Modalidad Carácter Curso Semestral ( ) Curso Hemisemestral ( ) Obligatorio ( ) Optativo E (X ) Tipo T(X) P( ) T/P ( ) Horas Semana Semestre/Hemisemestre Teóricas 4 Teóricas 32 Prácticas 0 Prácticas 0 Total Total 32 4 Seriación Asignatura antecedente Ninguna ( ) Obligatoria (X) Introducción a la Zootecnia Metodología Diagnóstica Medicina y Zootecnia Acuícola Práctica de Medicina y Zootecnia Acuícola Asignatura subsecuente Indicativa (X) Asignatura antecedente Introducción a la Acuariología Asignatura subsecuente Medicina y Zootecnia de Peces de Agua Dulce Práctica de Medicina y Zootecnia Acuícola Medicina y Zootecnia de Crustáceos Práctica de Medicina y Zootecnia de Crustáceos Objetivo general: El alumno distinguirá las técnicas de cultivo de especies planctónicas e invertebrados comparando su utilidad en la acuicultura para el aprovechamiento óptimo y el desarrollo sustentable. 1 Objetivos específicos: Unidad 1. Objetivo temático. El alumno reconocerá el cultivo de microalgas de la División Chlorophyta y la División Chyrosophyta, para la alimentación de peces herbívoros a través de las características de cada una de las especies. Unidad 2. Objetivo temático. El alumno reconocerá las generalidades de la especie a través de las diferentes fases de vida para la alimentación de organismos acuáticos. Unidad 3. Objetivo temático. El alumno reconocerá las generalidades de la especie a través de sus diferentes fases de vida de la Artemia salina para la alimentación de organismos acuáticos. Unidad 4. Objetivo temático. El alumno reconocerá las generalidades de la especie a través de las diferentes fases de vida de Panagrellus redivivus para la alimentación de organismos acuáticos Unidad 5. Objetivo temático. El alumno reconocerá la morfología de los diferentes tipos de protozoarios a través de sus características para utilizarlos como alimento para crías de peces. Índice temático Unidad 1 2 3 4 5 Temas Cultivo de microalga Cultivo de Daphnia magna Cultivo de Artemia salina Cultivo de Panagrellus redivivus (microgusano) Cultivo de protozoarios Total Horas semestre/año Teóricas Prácticas 06 0 06 0 08 0 06 0 06 0 32 0 Contenido Temático Unidad 1 2 Subtemas 1.1 1.2 1.3 1.4 1.5 1.6 1.6 1.7 1.8 2.1 2.2 2.3 2.4 2.5 2.6 2.7 Morfología Alimentación Nutrición Reproducción Sistemas de producción Metodología del cultivo de la microalga a nivel laboratorio Composición y aporte nutricional de las microalgas. Costos de producción Comercialización Morfología Alimentación Nutrición Reproducción Ecología Sistemas de producción Metodología del cultivo de Daphnia a nivel laboratorio 2 3 4 5 2.8 Composición y aporte nutricional de los diferentes etapas de vida 2.9 Costos de producción 2.10 Comercialización 3.1 Morfología 3.2 Alimentación 3.3 Nutrición 3.4 Reproducción 3.5 Ecología 3.6 Sistemas de producción 3.7 Metodología del cultivo de Artemia salina a nivel laboratorio 3.8 Composición y aporte nutricional de los diferentes etapas de vida 3.9 Costos de producción 3.10 Comercialización 3.11 Calidad nutritiva 4.1 Morfología 4.2 Alimentación 4.3 Nutrición 4.4 Reproducción 4.5 Ecología 4.6 Sistemas de producción 4.7 Metodología del cultivo de Panagrellus a nivel laboratorio 4.8 Composición y aporte nutricional de Panagrellus 4.9 Costos de producción 4.10 Comercialización 5.1 Morfología 5.2 Alimentación 5.3 Nutrición 5.4 Reproducción 5.5 Ecología 5.6 Sistemas de producción 5.7 Metodología del cultivo de protozoarios a nivel laboratorio 5.8 Composición y aporte nutricional 5.9 Costos de producción 5.10 Comercialización Actividades didácticas Exposición Trabajo en equipo Lecturas Trabajo de investigación Prácticas (taller o laboratorio) Prácticas de campo Otras (especificar) Título o grado Experiencia docente Otra característica (X) ( ) (X) (X) ( ) ( ) Evaluación del aprendizaje Exámenes parciales Examen final Trabajos y tareas Presentación de tema Participación en clase Asistencia Otras (especificar) (X) ( ) (X) ( ) (X) (X) Perfil profesiográfico Médicos Veterinarios Zootecnistas / Biólogos 3 años en el área acuícola Con experiencia en el área de acuicultura 3 Bibliografía básica: 1. AMAT F. Antecedentes, estado actual y perspectivas del empleo de Artemia salina en acuicultura. Inf. Tecn. Inv. Pesq 1980; 75. 24p 2. BARBARENA C. y MONTOYA H. Crecimiento, ciclo de vida y tolerancia a la salinidad de la microalga Dunaliella viridis Teodoresco. Rev. Fac. Ocean Pesq. Cs. Alimentarias 1990; 2: 34-53. 3. CASTRO T. Biología y cultivo de Artemia franciscana en el ex lago de Texcoco, de Ecatepec, Estado de México (tesis doctoral). D.F., México: Facultad de Ciencias, UNAM, 1993. 4. COLL MJ. Acuicultura Marina Animal. 2ª ed. Madrid, España: Mundi-Prensa, 1996:367368. 5. FIGUEREDO LJ y CABRERA PJ. Fecundidad, longevidad y talla reproductiva de Daphnia pulex cultivada en laboratorio. Rev. Lat. Acui. Lima Perú 1988; 35:13-40 6. PAGGI JC y DE PAGGI SJ. Daphnia magna: el canario de las aguas. Madrid, España: Santillana, 2000: 817. 7. Reyes BH 1999. Evaluación y optimización de la producción de microalgas, del rotífero Brachionus plicatilis y del cladócero Daphnia magna, bajo diferentes condiciones de cultivo (Tesis doctoral). D.F., México: Inst. Cienc. Mar y Limn. UNAM,1999:76 Bibliografía complementaria: 1. BARATA C, HONTORIA F y AMAT F. Estimation of the biomasa production of Artemia with regard to its use in aquaculture: temperatura and strain effect. Aquaculture 1996; 142:171-189. 2. BIEDENBACH JM, SMITH I, THOMSEN T y LAURENCE A. Use of the Nematode Panagrellus redivivus as an Artemia replacement in a larval Penaeid diet. Journal of the World Aquaculture Society 2000; 20:61-71. 3. CORREA F. BUCLE L y VOLTOLINA D. The biochemical composition of cysts of some mexican populations of Artemia franciscana Kellogg, 1906. Comp. Biochem. Physiol 2003. 4. DAWES CJ. Marine Botany. New York, U.S.A: John Wiley & Sons, 2001:672. 5. GESSNER F y SHRAMM W. Salinity Plants. P. En Marine Ecology, Environmental Factors 1999; 2:705-820. 6. GOLDMAN, JC. Nutrient transformations in mass cultures of marine algae. J. Envir. Engng Dir. Am. Soc. Cir. Engre 2002; 101: 351-364. 7. LEE RE. Phycology. New York, USA: Cambridge University Press, 1999:172 8. PENNAK, RW. Fresh-Water Invertebrates of the United States. 2ª ed. Ney York, USA: Wiley- Interscience, 2002: 350-387. 9. ROOTTMANN RW. Microworm culture for aquarium fish producers. University of Florida. Aquaculture Eng.1988; 3:221-235. 10.STARR, RC. Algal cultures sources and methods of cultivations. New York, USA: Academia Press 1999:29-53. 11. VANHAECKE P, TACKAERT W y ZORRUELOS P. The biography of Artemia: an updated review. In Artemia research and its aplications. Morphology, genetics, strain characterization, toxicology. Belgium: Universa Press, Wetteren, 2000: 129-155. 4











