Formulación Inorgánica 13: grupo 14 grupo 15
Anuncio
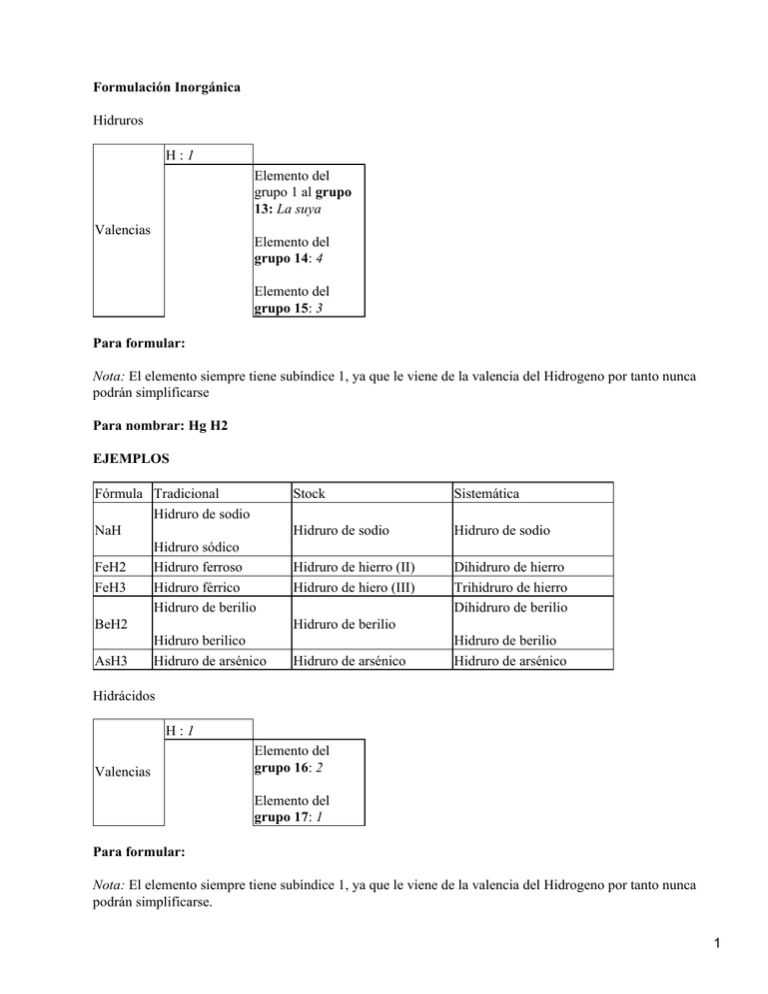
Formulación Inorgánica Hidruros H:1 Elemento del grupo 1 al grupo 13: La suya Valencias Elemento del grupo 14: 4 Elemento del grupo 15: 3 Para formular: Nota: El elemento siempre tiene subíndice 1, ya que le viene de la valencia del Hidrogeno por tanto nunca podrán simplificarse Para nombrar: Hg H2 EJEMPLOS Fórmula Tradicional Hidruro de sodio NaH Hidruro sódico FeH2 Hidruro ferroso FeH3 Hidruro férrico Hidruro de berilio BeH2 Hidruro berilico AsH3 Hidruro de arsénico Stock Sistemática Hidruro de sodio Hidruro de sodio Hidruro de hierro (II) Hidruro de hiero (III) Dihidruro de hierro Trihidruro de hierro Dihidruro de berilio Hidruro de berilio Hidruro de arsénico Hidruro de berilio Hidruro de arsénico Hidrácidos H:1 Valencias Elemento del grupo 16: 2 Elemento del grupo 17: 1 Para formular: Nota: El elemento siempre tiene subíndice 1, ya que le viene de la valencia del Hidrogeno por tanto nunca podrán simplificarse. 1 Para nombrar: H2 Se EJEMPLOS Fórmula HF H Cl H Br HI H2 S H2 Se H2 Te Tradicional ácido fluorhídrico ácido clorhídrico ácido bromhídrico ácido iodhídrico ácido sulfhídrico ácido selenhídrico ácido telurhidrico Sistemática y Stock Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Ioduro de hidrógeno Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno Nota: Estos son todos los Hidrácidos que podemos formular. Óxidos Para formular: Nota: Se debe simplificar siempre que se pueda Para nombrar: Fe 2 O3 Sólo para los óxidos metálicos EJEMPLOS Fórmula Tradicional Óxido de sodio Na2O Stock Sistemática Óxido de sodio Óxido de sodio Óxido sódico HgO Óxido mercúrico Óxido de mercurio (II) Hg2O Cl2O N2O3 Óxido mercurioso No se nombra No se nombra Óxido de mercurio (I) Óxido de cloro (I) Óxido de nitrógeno (III) Monóxido de monomercurio Monóxido de dimercurio Monóxido de dicloro Trióxido de dinitrógeno Sales binarias Para formular: Nota: Se debe simplificar siempre que se pueda, que solo será en las sales que forme los no metales del grupo 16 con la valencia 2. Para nombrar: Pb S2 EJEMPLOS Fórmula Tradicional Stock Sistemática 2 SnCl4 CdS NiN Cloruro estannico Sulfuro de cadmio Nitruro niquélico Cloruro de estaño (IV) Sulfuro de cadmio Nitruro de níquel (III) tetracloruro de estaño Sulfuro de cadmio Monitruro de mononíquel Hidróxidos Para formular: Nota1: El metal siempre tiene subíndice 1, ya que le viene de la valencia del grupo (OH) por tanto nunca podrán simplificarse. Nota2: Si el subíndice del grupo (OH) es 1 se quitan los paréntesis. Para nombrar: Fe (OH)3 EJEMPLOS Fórmula Tradicional Hidróxido de magnesio Stock Sistemática Mg(OH)2 Hidróxido de magnesio Hidróxido de magnesio Hidróxido magnésico HgOH Hidróxido mercurioso Hg(OH)2 Hidróxido mercurico Hidróxido demercurio (I) Hidróxido de mercurio (II) Monohidróxido de mercurio Dihidróxido de mercurio Ácidos oxácidos. Para formular: Proceden de los óxidos no metálicos; al sumarle agua al óxido se obtiene el ácido SO3+H20 H 2 SO4 Nota: Siempre que podamos se simplifica Para nombrar: HClO3 Nota: EJEMPLOS Fórmula HClO HClO2 HClO3 HClO4 Tradicional Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclórico Stock Ácido monoxoclórico(I) Ácido dioxoclórico(III) Ácido trioxoclórico(V) Ácido tetraoxoclórico(VII) Sistemática Monoxoclorato(I) de hidrógeno Dioxoclorato(III) de hidrógeno Trioxoclorato(V) de hidrógeno Tetraoxoclorato(VII) de hidrógeno Ácidos oxácidos. (Que forman los no metales del grupo 15) 3 A los elementos del grupo 15 (N, P y As) se les puede sumar más de una molécula de agua. Para nombrarlos se utilizan los prefijos meta (1 molécula de agua), piro (2 molécula de agua) y orto (3 molécula de agua) en la nomenclatura tradicional. Y de la misma forma que el resto de ácidos en las otras dos nomenclaturas. EJEMPLOS Fórmula H3 P O3 H4 P2 O5 H P O2 H3 P O4 H4 P2 O7 H P O3 H3 N O3 H4 N2 O5 H N O2 H3 N O4 H4 N2 O7 H N O3 H3 As O3 H4 As2 O5 H As O2 H3 As O4 H4 As2 O7 H As O3 Tradicional Acido ortofosforoso Acido Pirofosforoso Acido Metafosforoso Acido Ortofosforico Acido Pirofosfórico Acido Metafosfórico Acido Ortonitroso Acido Pironitroso Acido Metanitroso Acido Ortonitrico Acido Pironitrico Acido Metanitrico Acido Ortoarsenioso Acido Piroarsenioso Acido Arsenioso Acido Ortoarsenico Acido Piroarsenico Acido arsénico Stock Acido trioxofosforico (III) Acido pentaoxofosforico (III) Acido dioxofosforico (III) Acido tetraoxofosforico (V) Acido heptaoxofosforico (V) Acido trioxofosforico (V) Acido trioxonitrico (III) Acido pentaoxonitrico (III) Acido dioxonitrico (III) Acido tetraoxonitrico (V) Acido heptaoxonitrico (V) Acido trioxonitrico (V) Acido trioxoarsenico (III) Acido pentaoxoarsenico (III) Acido dioxoarsenico (III) Acido tetraoxoarsenico (V) Acido heptaoxoarsenico (V) Acido trioxoarsenico (V) Sistemática Trioxofosfato (III) de hidrogeno Pentaoxofosfato (III) de hidrogeno Dioxofosfato (III) de hidrogeno Tetraoxofosfato (V) de hidrogeno Heptaoxofosfato (V) de hidrogeno Trioxofosfato (V) de hidrogeno Trioxonitrato (III) de hidrogeno Pentaoxonitrato (III) de hidrogeno Dioxonitrato (III) de hidrogeno Tetraoxonitrato (V) de hidrogeno Heptaoxonitrato (V) de hidrogeno Trioxonitrato (V) de hidrogeno Trioxoarseniato (III) de hidrogeno Pentaoxoarseniato (III) de hidrogeno Dioxoarseniato (III) de hidrogeno Tetraoxoarseniato (V) de hidrogeno Heptaoxoarseniato (V) de hidrogeno Trioxoarseniato (V) de hidrogeno Nota: Estos son todos ácidos con dos y tres moléculas de agua que podemos formular. Óxisales. Para formular: Para nombrar: Cu 2 CO 3 Nota: EJEMPLOS Fórmula LiClO3 Fe(ClO2)2 Fe(ClO2)3 HgSO4 Hg2SO4 Ca3(PO3)2 Tradicional Clorato de litio Clorito ferroso Clorito férrico Sulfato mercúrico Sulfato mercúrico Ortofosfito de calcio Stock y Sistemática Trioxoclorato(V) de litio Bis−dioxoclorato(III) de hierro(II) Tris−dioxoclorato(III) de hierro(III) Tetraoxosulfato(VI) de mercurio(II) Tetraoxosulfato(VI) de mercurio(I) Bis−trioxofosfato(III) de calcio 4 Metafosfito de hierro Bis.dioxofosfato(III) de hierro Fe(PO2)2 Fosfito de hierro Formulación Inorgánica 4º E.S.O. 1 Combinaciones binarias (combinaciones de dos elementos) Nombre del elemento Palabra Hidruro Sufijo ico para la valencia mayor y oso para la menor (si tiene mas de una valencia) Nombre del elemento Palabra Hidruro Nomenclatura de Stock Nomenclatura Tradicional Nombre del elemento Intercambiar valencias Fe H 3 Hidruro de hierro (III) Hidrógeno a la derecha Elemento a la izquierda Hidruro mercúrico Al H3 ; Li H; Cu H 2 K H ; Fe H3 ; Zn H2 XHm HIDRUROS = Elemento grupo 1 al 15 − Hidrógeno Prefijo numeral que indica el número de átomos del elemento (si tiene mas de una valencia) Nombre del elemento 5 Palabra óxido Prefijo numeral que indica el número de oxígenos (si tiene mas de una valencia) Trióxido de dihierro Nomenclatura sistemática Nombre del elemento Palabra óxido Valencia, si tiene más de una, en números romanos y entre paréntesis Óxido de hierro (III) Nomenclatura de Stock Sufijo ico para la valencia mayor y oso para la menor (si tiene mas de una valencia) Nombre del elemento Palabra óxido Los óxidos no metálicos no se nombran con la tradicional Oxido férrico Nomenclatura Tradicional Óxido de hierro (III) Intercambiar las valencias Oxígeno a la derecha Elemento a la izquierda Fe 2 O 3 O:2 Valencias Metales: la suya No metales: la suya No metal + Oxígeno = Óxido no metálico CO2 ; SO3 ; N2 O5 ; CO ; Cl2 O3 ; NO2 Metal + Oxígeno = Óxido metálico Fe2 O3 ; Li2 O ; Ca O ; Ag2 O ; Al 2O3 6 XnOm OXIDOS = Elemento − Oxígeno Combinaciones binarias (combinaciones de dos elementos) Palabra hidrogeno Prefijo numeral que indica el número de Hidrógenos (si tiene mas de una valencia) Combinaciones binarias (combinaciones de dos elementos) Terminación uro Nombre del elemento Seleniuro de hidrogeno Nomenclatura sistemática y stock Nombre del elemento Sufijo hidrico Palabra ácido Ácido Selenhídrico Nomenclatura Tradicional Intercambiar valencias H 2Se Seleniuro de Hidrógeno Elemento a la derecha Dihidruro de mercúrio Nomenclatura sistemática Palabra Hidruro Valencia, si tiene más de una, en números romanos y entre paréntesis Hidruro de mercúrio(II) 7 Hidrógeno a la izquierda Con elemento grupo 16 : H2 S ; H2 Se ; H2 Te Con elemento grupo 17 : H F ; H Cl ; H Br ; H I HmX HIDRUROS = Hidrógeno − Elemento grupo 16 y 17 Nombre del metal Prefijo numeral que indica el número de átomos del no metal (si tiene más de una valencia) Disulfuro de plomo No metal terminado en URO Nomenclatura Sistematica Valencia, si tiene más de una, en números romanos y entre paréntesis Nombre del metal Terminación uro Nombre del no metal Sulfuro de plomo (II) Nomenclatura Stock Sufijo ico para la valencia mayor y oso para la menor (si tiene mas de una valencia) Nombre del metal Terminación uro Nombre del no metal Sulfuro plumboso Nomenclatura Tradicional Intercambiar valencias 8 Fe Cl 3 Metal a la izquierda No metal a la derecha Cloruro de hierro (III) No metal: Valencias Grupo 16: 2 Grupo 17: 1 Metal: la suya MnXm K Br ; Fe 2S 3 ; Ag Cl Na Cl ; Ca I2 ; Pb S2 Metal − No metal (grupo 16 y grupo17) Combinaciones binarias (combinaciones de dos elementos) Trihidróxido de hierro Nomenclatura sistemática Valencia, si tiene más de una, en num. romanos y entre paréntesis Nombre del metal Palabra hidróxido Hidróxido de hierro (III) Nomenclatura de Stock Sufijo ico para la valencia mayor y oso para la menor (si tiene mas de una valencia) Palabra Hidróxido Hidróxido férrico Nombre del metal Nomenclatura Tradicional 9 Intercambiar valencias Al (OH) 3 Hidróxido de aluminio Grupo (OH) a la derecha Metal a la izquierda Valencias El grupo (OH): 1 El metal: la suya Ag OH ; Zn (OH)2; Fe (OH) 2 Ca(OH)2 ; Na OH ; Al (OH)3 X (OH) m Hidróxidos = Metal − (OH) Combinaciones ternarias (combinaciones de tres elementos) Prefijo numeral que indica el número de grupos (OH) (si tiene mas de una valencia) Palabra hidróxido Nombre del metal Combinaciones ternarias (combinaciones de tres elementos) ÁCIDOS = Hidrógeno − No metal − Oxígeno HnXOm H2SO4 ; H2CO3 ; HNO3 ; HClO HNO2 ; H2SO3 ; HClO4 ; HClO3 Oxigeno : 2 Valencias Hidrógeno: 1 No metales: la suya Ácido sulfúrico 10 No metal: elemento central Oxígeno a la derecha Hidrógeno a la izquierda H 2 SO4 Nomenclatura Tradicional Ácido clórico Palabra ácido Nombre del elemento central (no metal) con la terminación per.ico, ico, oso, hipooso, según sea su valencia. Para poder nombrar el ácido: Es necesario saber la valencia del elemento central. Para saber la valencia del elemento central (no metal): Debemos restar la molécula de H20 al acido Así llegaremos al oxido y veremos la valencia: HClO3−H20 (no se puede esta simplificado) H2Cl2O6−H20Cl2O5 De aquí deducimos: el cloro actuó con la valencia 5 luego es clórico (ácido clórico) • Prefijos y Sufijos de la nomenclatura tradicional: • Si tiene una sola valencia: Nombre terminado en ICO. • Si tiene dos valencia: Nombre terminado en ICO : valencia mayor. Nombre terminado en OSO: valencia menor. • Si tiene tres valencias: Nombre HIPO...OSO: valencia menor Nombre terminado OSO: valencia intermedia Nombre terminado ICO: valencia mayor 11 • Si tiene cuatro valencias: Nombre HIPO...OSO: valencia menor Nombre terminado OSO: valencia intermedia menor Nombre terminado ICO: valencia intermedia mayor Nombre PERICO: valencia mayor • • Nomenclatura stock Ácido trioxonítrico (III) Prefijo numeral que indica el número de oxígenos Palabra Ácido Nombre del elemento central terminado siempre en ICO Valencia del átomo central (no metal), entre paréntesis y en números romanos Nomenclatura sistemática Trioxonítrato (III) de hidrógeno Valencia del átomo central (no metal), entre paréntesis y en números romanos Nombre del elemento central terminado siempre en ATO Prefijo numeral que indica el número de oxígenos La locución de hidrógeno es propia de los ácidos cuando son nombrados de esta forma. Ácidos del fósoro (arsénico y antimonio): Los óxidos de estos elementos pueden dar origen a tres ácidos distintos que difieren en el grado de hidratación (número de moléculas de agua que le sumemos: una, dos o tres): Por ejemplo: El oxido de fosforo (III) de lugar a tres ácidos distintos: P2O3 + H2O H2P2O4 HPO2 Ácido metafosforoso P2O3 + 2 H2O H4P2O5 Ácido difosforoso o ácido pirofosforoso P2O3 + 3 H2O H6P2O6 H3PO3 Ácido ortofosforoso o ácido fosforoso El oxido de fosforo (V) de lugar a tres ácidos distintos: 12 P2O5 + H2O H2P2O6 HPO3 Ácido metafosfórico P2O5 + 2 H2O H4P2O7 Ácido difosfórico o pirofosfórico P2O5 + 3 H2O H6P2O8 H3PO4 Ácido ortofosfórico o ácido fosfórico Combinaciones ternarias (combinaciones de tres elementos) OXiSALES = Metal − No metal − Oxígeno MnXOm CuSO4 ; CaCO3 ; KNO3 ; NaClO Ca (NO2 )2 ; Fe2 (SO3 )3 ; KClO4 O:2 Valencias Metales: la suya No metales: la suya Las sales se puede considerar que derivan de los ácidos al sustituir sus hidrógenos por metales: HNO3 KNO3 Ácido nítrico Nitrato potásico (sal) • Identifica el ácido del cual proviene la sal: • Escribe el ácido correspondiente. HNO3 • Quítale los hidrógenos al ácido. Lo que te quede, enciérralo entre paréntesis. Considera el número de hidrógenos que has quitado al ácido como la valencia del conjunto. (NO3) Con valencia1 • Escribe el metal a la izquierda (donde estaban los hidrógenos) y lo que te ha quedado entre paréntesis a la derecha e intercambia sus valencias como si fuera una combinación binaria. K(NO3) • Si el subíndice del paréntesis es uno quita el paréntesis. KNO3 • Siempre que se pueda se simplifica No metal: elemento central 13 Oxígeno a la derecha Metal a la izquierda Pb (SO4)2 Pb (SO4)2 Los paréntesis no se quitan, excepto cuando el subíndice es 1 Nomenclatura Tradicional Nombre del metal Carbonato cuproso Sufijo ico para la valencia mayor y oso para la menor del metal (si tiene mas de una valencia) La terminación depende del ácido del que proviene: Ácido Sal perico Perato ico ato oso ito hipo oso hipoito Nombre del no metal Nomenclatura sistemática y stock Trioxocarbonato (IV) de cobre (I) Valencia del no metal entre paréntesis y en números romanos Nombre del no metal terminado siempre en ATO Prefijo numeral que indica el número de oxígenos Nombre del metal y valencia entre paréntesis (si es necesario) En el ejemplo el Cu 2 CO 3 no tiene paréntesis ya que la valencia del cobre es1. En el caso de que la sal tenga paréntesis y el subíndice sea: •2 comenzamos por bis− 14 Ejemplo: Zn(IO3)2 Bis−trioxoyodato (v) de Cinc. •3 comenzamos por tris− Ejemplo: Fe2(SO4)3 Tris−tetraoxosultato (VI) de hierro (III) •4 comenzamos por tetrakis− Ejemplo: Pb(NO3)4 Tetrakis−trioxonitrato (V) de plomo (IV) 15