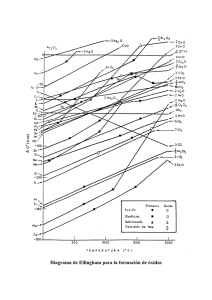
FORMULACIÓN QUÍMICA INORGÁNICA Índice: 1.− Estados de oxidación 1.2.− Tipos de Nomenclatura
Anuncio

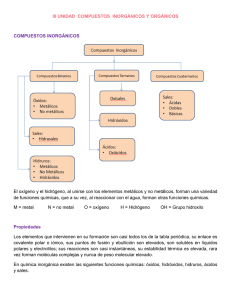
FORMULACIÓN QUÍMICA INORGÁNICA Índice: 1.− Estados de oxidación 1.2.− Tipos de Nomenclatura 2.− Compuestos Binarios 2.1.− Óxidos 2.2.− Peróxidos 2.3.− Hidruros Metálicos 2.4.− Hidruros No Metálicos 2.5.− Sales Binarias 3.− Compuestos Terciarios 3.1.− Hidróxidos 3.2.− Oxoácidos 3.3.− Sales Ternarias Neutras 1.− ESTADOS DE OXIDACIÓN 1 Estado de oxidación: es el número de cargas que tendría un átomo si se encontrara en forma de ión. 1.2.− Tipos de Nomenclatura Inorgánica. Ante la confusión surgida por el ejemplo de nombres comunes de las sustancias, diferentes para cada país, en 1947 se consolidó la Unión Internacional de Química Pura y Aplicada(I.U.P.A.C), encargada de estructurar las reglas y principios, que de manera unificada describiera los compuestos químicos. Actualmente se emplean tres sitemas de Nomenclatura: Nomenclatura Tradicional: Este sistema es utilizado para distinguir entre óxidos básicos y óxidos ácidos o anhídridos. Nomenclatura de Stock Este sistema no distingue entre óxidos básicos y anhídridos. Todos se nombran con la palabra generíca óxido, luego la preposición de y el nombre del elemento(metal o no metal); por últimos en números, romanos y entre paréntesis se anota el número de oxidación del elemento unido al O. Cuando el elemento funciona con un solo número de oxidación se suprime el número romano y el parentesís. Nomenclatura sistemática recomendado por la I.U.P.A.C.: Este sistema tampoco hace diferencia entre óxidos básicos y anhidridos . Se emplea el nombre género óxido, pero se le antepone el prefijo mono, di, tri, tera, penta, hexa, hepta según el número de átomos de O. que lleve el óxido(1,2,3,4,5,6,7, respectivamente), luego la preposición de, y el nombre específico es el del elemento unido al oxígeno. Si el elemento solo produce un óxido se suprime el prefijo mono. 2.− COMPUESTOS BINARIOS 2 2.1.− ÓXIDOS ÓXIDO: Es la combinación de cualquier otro elemento con el oxígeno (O). −2 • El estado de oxidación del oxígeno SIEMPRE ES −2. Excepto en los peróxidos, que es −1) • Su estructura será: +n −2 X+O=X+O •n • Hay dos clases de óxidos: los METÁLICOS (combinación con cualquier metal) y los NO METÁLICOS (combinación con cualquier no metal). Los óxidos no metálicos se llaman ANHÍDRIDOS en la nomenclatura funcional tradicional. 2.2.− PERÓXIDOS Es un enlace especial que se forma cuando dos átomos de oxigeno se unen. O O => O2 => el O actúa con valencia −1 • Se trata de neutarlizar la fórmula escribiendo tantos átomos cómo sean necesarios para ello. • NUNCA se simplifican Ejemplos: Peróxido de Litio: Li2O2 => Li2 porque el estado de oxidación de Li es 1, para neutralizar la fórmula necesitamos 2Li = Li2 Peróxido de Calcio: CaO2 => Ca porque el estado de oxidación de Ca es 2, con lo cual, sólo necesitamos un átomo de Ca para neutralizar la fórmula. 2.3.− HIDRUROS METÁLICOS Este enlace se realiza con Hidrógeno y un metal. X −1 M H => MHx Hidruro de Potasio: KH Hidruro de Calcio: CaH2 Dihidruro de Hierro: FeH2 3 2.4.− HIDRUROS NO METÁLICOS Hidruros No Metálicos −3 −4 13 14 BH3 CH4 SiH4 −3 15 NH3 PH3 AsH3 SbH3 Ácidos Hidrácidos (disol. Acuosa) 2 1 16 17 H2O HF H2S HCl H2Se HBr H2Te I En los Ácidos Hidrácidos, La IUPAC permite poner el Hidrógeno delante del no metal. 2.5.− SALES BINARIAS En las Sales Binarias Neutras, se sustituyen los H de los ácidos por cationes metálicos. Se escribe primero el símbolo del metal y luego el de el no metal. Ejemplos: Cloruro de Sodio: NaCl Cloruro de Magnesio: MgCl2 Sulfuro de Potasio: K2S 3.− COMPUESTOS TERNARIOS 3.1.− HIDRÓXIDOS HIDRÓXIDO: combinación de cationes metálicos con el grupo hidróxilo (OH) n+ − M (OH) => M(OH)n 4