II Examen Parcial Qca Inorg
Anuncio
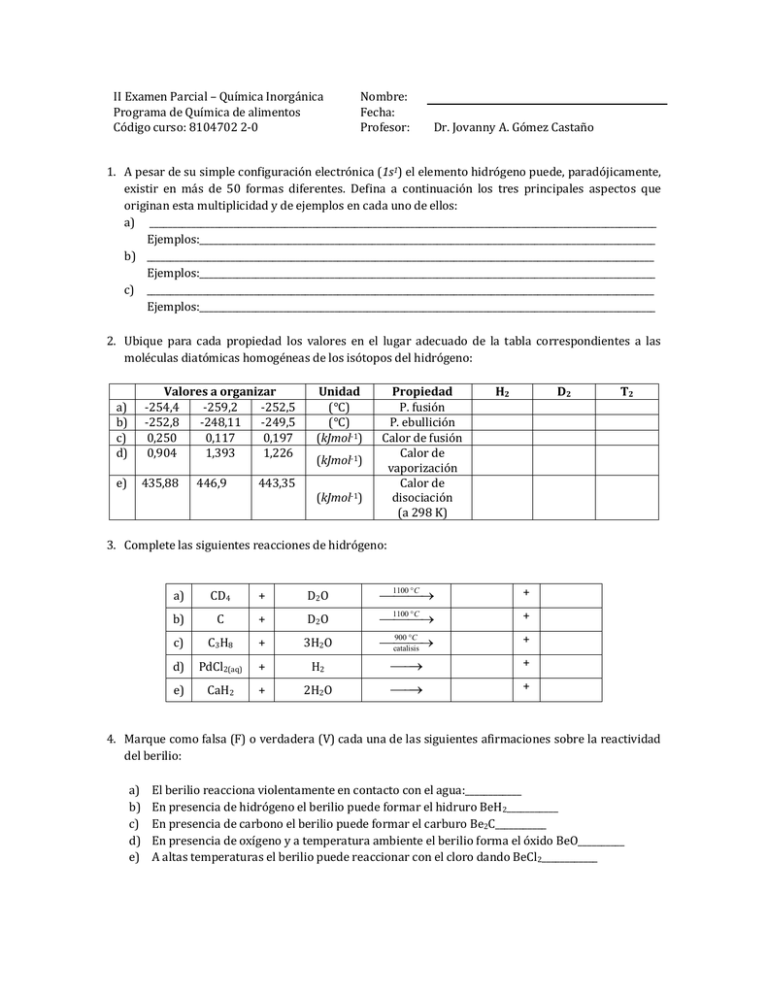
II Examen Parcial – Química Inorgánica Programa de Química de alimentos Código curso: 8104702 2-0 Nombre: Fecha: Profesor: Dr. Jovanny A. Gómez Castaño 1. A pesar de su simple configuración electrónica (1s1) el elemento hidrógeno puede, paradójicamente, existir en más de 50 formas diferentes. Defina a continuación los tres principales aspectos que originan esta multiplicidad y de ejemplos en cada uno de ellos: a) _____________________________________________________________________________________________________________ Ejemplos:__________________________________________________________________________________________________ b) _____________________________________________________________________________________________________________ Ejemplos:__________________________________________________________________________________________________ c) _____________________________________________________________________________________________________________ Ejemplos:__________________________________________________________________________________________________ 2. Ubique para cada propiedad los valores en el lugar adecuado de la tabla correspondientes a las moléculas diatómicas homogéneas de los isótopos del hidrógeno: a) b) c) d) Valores a organizar -254,4 -259,2 -252,5 -252,8 -248,11 -249,5 0,250 0,117 0,197 0,904 1,393 1,226 e) 435,88 446,9 Unidad (°C) (°C) (kJmol-1) (kJmol-1) 443,35 (kJmol-1) Propiedad P. fusión P. ebullición Calor de fusión Calor de vaporización Calor de disociación (a 298 K) H2 D2 T2 3. Complete las siguientes reacciones de hidrógeno: a) CD4 + D2O 1100 C + b) C + D2O 1100 C + c) C3H8 + 3H2O 900 C catalisis + d) PdCl2(aq) + H2 + e) CaH2 + 2H2O + 4. Marque como falsa (F) o verdadera (V) cada una de las siguientes afirmaciones sobre la reactividad del berilio: a) b) c) d) e) El berilio reacciona violentamente en contacto con el agua:____________ En presencia de hidrógeno el berilio puede formar el hidruro BeH2___________ En presencia de carbono el berilio puede formar el carburo Be2C___________ En presencia de oxígeno y a temperatura ambiente el berilio forma el óxido BeO__________ A altas temperaturas el berilio puede reaccionar con el cloro dando BeCl2____________ 5. Escriba cuatro compuestos de magnesio que se esperarían se formasen si se quemara un trozo del metal dentro de una atmósfera conteniendo aire, cloro y bromo: Compuesto 1 Compuesto 2 Compuesto 3 Compuesto 4 6. Ordene en forma creciente de sus puntos de ebullición los siguientes haluros alcalinos: LiI; CsI; LiCl; LiF; LiBr. 7. Marque en cada caso el o los compuesto(s) que SI se esperaría(n) que se formase(n) al quemar en presencia de oxígeno los siguientes metales alcalinos: Cs Quemar Aire Cs2O Cs2O2 CsO2 K Quemar Aire K2O K2O2 KO2 Na Quemar Aire Na2O Na2O2 NaO2 Li Quemar Aire Li2O Li2O2 LiO2 Rb Quemar Aire Rb2O Rb2O2 RbO2 8. Complete los espacios dentro de los corchetes indicando la formula química del compuesto que se forma en cada uno de las etapas de la siguiente síntesis inorgánica: Una muestra de potasio [____K____] reacciona dentro de una atmósfera de hidrógeno formando un sólido iónico blanco [__________], que después es agregado cuidadosamente a un reactor conteniendo agua, formando así una solución de [__________]; a través de la cual se hace burbujear vigorosamente una corriente de CO2, que finalmente, y después de la evaporación del agua, produce un sólido blanco correspondiente al compuesto [__________] 9. Encierre dentro de un círculo cuál de los compuestos siguientes tiene: a) Menor solubilidad: Ba(OH)2, Ca(OH)2 b) Menor acidez: Be(OH)2, Mg(OH)2 c) Mayor reactividad frente al oxígeno: SrO2, CaO2 d) Mayor reactividad en presencia de agua: KH, NaH Concentración de M 10. Explique al frente de cada equilibrio su repercusión sobre la conductividad de la solución amoniacal M am M am eam M am M am eam ( M 2 )am 2 M am M= metal alcalino










