Grupo 14
Anuncio

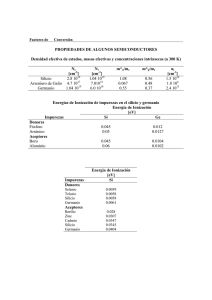
Los elementos del grupo 14 C, Si, Ge, Sn y Pb Algunas generalidades del grupo 14 • Gran diversidad en sus propiedades, que van del carbono no metálico a los bien conocidos metales estaño y plomo. • Como sugiere la configuración ns2np2, el estado de oxidación +4 es el dominante en los compuestos de los elementos. La principal excepción es el plomo, para el cual el estado de oxidación más común es +2 (por efecto del par inerte). • El carbono y el silicio son oxófilos y fluorófilos muy fuertes (tienen grandes afinidades por los aniones O2- y F-). • Todos los elementos del grupo, excepto el plomo, tienen por lo menos una fase sólida con una estructura tipo diamante. Estructura cúbica de diamante Estructura cúbica del grafito Presencia en la naturaleza y extracción • El diamante y el grafito (formas puras del carbono) se extraen de minas. • Existen formas menos puras del carbono. El coque, que se prepara por pirólisis del carbón, y el negro de humo, que es el producto de la combustión incompleta de hidrocarburos. • Es silicio presenta el 26% de la masa de la corteza terrestre. Se encuentra en la arena, cuarzo, amatista, ágata y ópalo y también se encuentra en asbestos y arcillas. • El silicio elemental se puede producir a partir de la sílice, SiO2, por reducción con carbono en una horno de arco eléctrico: SiO2 C Si( s ) 2CO( g ) • El SiO2 en utilizado en exceso para prevenir la formación del SiC: SiO2 2SiC 3Si( s ) 2CO( g ) Presencia en la naturaleza y extracción • El germanio es poco abundante. Se obtiene por reducción de GeO2 con monóxido de carbono o hidrógeno. • El estaño se produce por la reducción del mineral casiterita, SnO2, con coque en un horno eléctrico. • El plomo se obtiene de sus sulfuros minerales, que se convierten en el óxido y se reducen por medio de carbono en un horno de alta temperatura. PbS 1.5O2 PbO SO2 PbO C Pb(liq ) CO; PbO CO Pb(liq ) CO2 Los fulerenos • El Premio Nobel de Química de 1996 se otorgó a Richard Smalley, Robert Curl y Harold kroto por el descubrimiento de un nuevo alótropo de carbono, C60, denominado buckminsterfulereno, en honor a los domos geodésicos diseñados por el arquitecto Buckminster Fuller. Los fulerenos • Cuando se hace pasar un arco eléctrico entre electrodos de carbono en una atmósfera inerte, se forma una gran cantidad de hollín junto con cantidades significativas de C60 y cantidades mucho más pequeñas de otros fulerenos, como C70, C76, C84. • Los fulerenos pueden disolverse en un hidrocarburo (ejemplo: benceno o tolueno; soluciones magenta) o en hidrocarburos halogenados y ser separados por cromatografía en una columna de alúmina. • La estructura de C60 se ha determinado por cristalografía de rayos X en un sólido a baja temperatura y por difracción de electrones en fase gaseosa. Compuestos simples Hidruros • El metano, CH4, es el hidrocarburo más simple. Se trata de un gas inodoro e inflamable que se encuentra en grandes depósitos naturales bajo la superficie de la Tierra, de donde se extrae como gas natural y se utiliza como combustible doméstico e industrial: CH 4 ( g ) 2O2 ( g ) CO2 ( g ) H 2O H 882 kJmol 1 •El metano reacciona con halógenos sólo cuando se expone a radiación ultravioleta: hv CH 4 ( g ) Cl2 ( g ) CH3Cl ( g ) HCl Compuestos simples Hidruros • El silano, SiH4, se prepara a través de la reducción de SiO2 con aluminio bajo una alta presión de hidrógeno en una mezcla de sales fundidas de NaCl y AlCl3: 6H 2 ( g ) 3SiO2 (s) 4 Al (s) 3SiH 4( g ) 2 Al2O3 (s) Los silanos son mucho más reactivos que los alcanos y su estabilidad disminuye con el aumento en la longitud de la cadena. El SiH4, se inflama espontáneamente al contacto con el aire, reacciona en forma violenta con halógenos y se hidroliza al contacto con el agua. Compuestos simples Hidruros • La estabilidad decreciente de los hidruros al descender en el grupo limita en forma drástica las propiedades químicas a las que se puede tener acceso para estananos y plumbanos. • El germano, GeH4, y el estanano, SnH4, pueden sintetizarse por la reacción entre el teracloruro correspondiente con LiAlH4 en solución de tetrahidrofurano Compuestos simples Compuestos con halógenos • Los elementos del grupo 14 reaccionan con todos los halógenos para formar tetrahalogenuros. El plomo también forma dihalogenuros estables. • Los tetrahalometanos varían del altamente estable y volátil CF4 al CI4, sólido y térmicamente inestable. • Todos los tetrahalometanos son termodinámicamente inestables respecto a la hidrólisis: CX 4 ( g; l ) 2H 2O(l ) CO2 ( g ) 4HX (aq) Compuestos simples Compuestos con halógenos • Los halogenuros de carbonilo poseen moléculas planas y son útiles intermediarios químicos. El OCCl2, fosgeno, es un gas altamente tóxico que se prepara en gran escala mediante la reacción de cloro con monóxido de carbono: CO( g ) Cl2 ( g ) Cl2CO( g ) • La utilidad del fosgeno reside en la facilidad del desplazamiento nucleofílico de cloro para producir compuestos carbonílicos e isocianatos Reacciones con fosgeno O=C=O (H2N)2C=O (RO)2CO H2O NH3 ROH (Cl)2C=O R2NH SbF3 + Cl2 RNH2 F2C=O (R2N)(Cl)C=O RN=C=O Compuestos simples Compuestos con halógenos • Se conocen todos los tetrahalogenuros de silicio y de germanio, siendo todos ellos compuestos moleculares volátiles. El germanio muestra signos de un efecto de par inerte en el hecho de que también forma dihalogenuros no volátiles. Entre los tetrahalogenuros de silicio el más importante es el tetracloruro, que se prepara mediante reacción directa entre los elementos: Si(s) 2Cl2 ( g ) SiCl4 ( g ) • La hidrólisis de los tetrahalogenuros de silicio y de germanio es rápida y se representa esquemáticamente como sigue: EX 4 2 H 2O EX 4 (OH 2 )2 EO2 4 HX (E=Si o Ge, X=halogeno)