ITRACONAZOL - LABORATORIOS NORVET productos
Anuncio

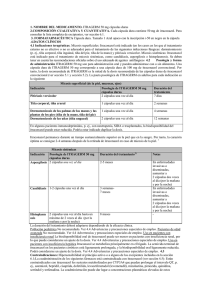
ITRACONAZOL Química • Antimicótico, triazole sintético. El itraconazol es estructuralmente relacionado al fluconazol y al terconazol. El itraconazol presenta un peso molecular de 706 y un pka de 3.7. Fundamento • Los hongos patogénicos que afectan a humanos y animales son eucariotes, generalmente existiendo ya sea como moho filamentoso (hifa o micelos [plural]), o como levaduras u hongos ascomicetos intracelulares. Los hongos di-mórficos crecen en el huésped en forma similar a levaduras, pero «in vitro», a temperatura ambiente, como moho. Algunos hongos (p.e., Coccidioides immitis, Histoplasma y especies Rhinosporidium) crecen dentro de las células del huésped, dividiéndose en esporas hasta ser liberadas posterior a la ruptura de estas. • Las infecciones fúngicas difieren de las bacterianas en diversos aspectos. Además los hongos patogénicos presentan desarrollo de diversas características que complican la terapia antimicrobiana. Por ejemplo, Cryptococcus y ocasionalmente Sporithrix schenkii, producen una cubierta externa que encapsula a las células y propicia la adherencia de estas y su conglomeración. La pared celular fúngica es rígida y contiene chitina y polisacáridos, los cuales generalmente evitan la tinción de Gram y sirven como una barrera a la penetración del fármaco. La membrana celular es compleja y a diferencia de la bacteriana, y al igual que la de los eucariotes superiores, contiene esteroles. En contraste a las bacterias, diversos organismos fúngicos no producen exotoxinas («in vivo») y no existe evidencia concluyente que los hongos produzcan endotoxinas. • Los organismos fúngicos son caracterizados por una baja invasividad y virulencia. De hecho la mayoría de los animales resuelven «per se» las infecciones fúngicas. Al parecer, la inmunidad hacia organismos fúngicos es mediada por células, no obstante, todos los dermatofitos asimismo estimulan la producción de anticuerpos. Los factores que predisponen al huésped a infección tejido necrótico, medio-ambiente húmedo e inmuno-depresión. Las infecciones fúngicas pueden ser primariamente superficiales e irritantes (p.e., dematofitosis) o sistémicas y ser una amenaza para la vida (p.e. infecciones di-mórficas fúngicas incluyendo blastomicosis, criptococcosis, histoplasmosis y coccidioidomicosis). Los organismos fúngicos pueden exhibir afinidad por determinados tejidos, tal como los dermatofitos hacia la queratina e Histoplasma capsulatum hacia los macrófagos. • A diferencia de la terapia antibacteriana, las pruebas de cultivo y susceptibilidad anti-microbiana no han sido adecuadamente desarrolladas como una herramienta para el tratamiento de enfermedades fúngicas. Las pruebas de susceptibilidad «in vitro» para agentes antifúngicos, son altamente dependientes sobre las condiciones de la prueba, y los resultados inter-laboratorio resultan marcadamente variables. La interpretación de los datos de cultivo y susceptibilidad son limitados por una carencia de unificación en los métodos de prueba. • A igual que con las bacterias, la concentración mínima inhibidora (MIC) para un organismo fúngico, es la concentración de fármaco antifúngico que inhibe el crecimiento de hongos bajo condiciones convencionales. La concentración letal mínima, es la concentración que destruye a los organismos. La correlación ente MIC y la respuesta clínica es pobre, y la evaluación de los agentes anti-fúngicos, al parecer, es mejor realizada a través de estudios eficaces en modelos animales. Afortunadamente, la necesidad de pruebas de cultivo y susceptibilidad fúngica puede no ser crítica para dichos organismos, al igual que para organismos bacterianos, dado que con excepción de la 5-flucitosina, el desarrollo de resistencia fúngica a la terapia anti-microbiana no es común. La resistencia es más probable con un organismo en rápido crecimiento expuesto a altas concentraciones de antifúngico durante un largo periodo de tiempo. Los mecanismos de resistencia de los organismos fúngicos son similares a aquellos de los organismos bacterianos. • El desarrollo de medicamentos orales para ser empleados en el tratamiento de infecciones micóticas invasivas ha representado un inmenso parte-aguas medico. Con un tratamiento oral disponible, los pacientes humanos no requieren una extensa hospitalización de varios días a semanas para el tratamiento endovenoso de su padecimiento. Además, los perfiles de toxicidad de los recientes fármacos orales representan una amplia mejora sobre aquellos inyectables. • El ketoconazol fue el primero de tales fármacos antimicóticos orales, pero este fue desplazado dados sus potenciales efectos colaterales. Este presentaba problemas de nausea, toxicidad hepática y feminización en pacientes masculinos. El itraconazol fue desarrollado en respuesta a estos aspectos, siendo sus potenciales efectos adversos sumamente bajos. • El itraconazol puede ser empleado en medicina veterinaria en el tratamiento de micosis sistémicas, incluyendo aspergillosis, meningitis por criptococos, blastomicosis e histoplasmosis. Este puede ser asimismo útil en candidiasis (vaginal y sistémica), dermatofitosis (Microsporum, Trichophyton, Epidermophyton) y queratitis micótica. El itraconazol no presenta apreciables efectos sobre la síntesis de hormonas, a diferencia del ketoconazol, y en pequeñas especies puede presentar menos efectos colaterales que este último. Dosis PERROS En micosis sistémicas 5 mg/kg PO una o dos veces al día; considerar adicionar amfotericina en infecciones de progresión rápida que pongan en peligro la vida del paciente. (Sherding & Johnson 1994b) 5 mg/kg PO una o dos veces al día; generalmente se recomienda altas tasas de dosificación y reducir sí toxicidad se desarrolla. (Legendre 1995) En blastomicosis: 5 mg/kg dosis de ataque dos veces al día, o 10 mg dosis de ataque 1 vez al día durante 3 a 4 días, entonces 5 mg/kg una vez al día. (Martin 1999) En criptococosis, histoplasmosis, aspergilosis, sporotricosis: 5 mg/kg dos veces al día. (Martin 1999) En dermatitis por Malassezia: 5-10 mg/kg una o dos veces al día. (Martin 1999) GATOS En micosis sistémicas susceptibles: 5 mg/kg PO una o dos veces al día; generalmente se recomienda altas tasas de dosificación y reducir sí toxicidad se desarrolla (Legendre 1995) En dermatofitosis generalizada: 10 mg/kg PO una vez al día (Medleau & Moriello 1992) En micosis sistémicas: 5 mg/kg PO una o dos veces al día; considerar adicionar amfotericina en infecciones de progresión rápida que pongan en peligro la vida del paciente. (Sherding & Johnson 1994b); En micosis sistémica y dermatofitosis generalizada: 5 - 10 mg/kg PO q12-24h (Wolf 1994) En blastomicosis, histoplasmosis: 5 mg/kg dos veces al día. (Martin 1999) En criptococosis: 50 mg/día para gatos pesando <3.2 kg, 100 mg/día para gatos pesando >3.2 kg. (Martin 1999) Interacciones Medicamentosas • El itraconazol requiere un medio ambiente ácido para su máxima absorción, en consecuencia, los antiácidos, bloqueadores-2 a la histamina (cimetidina, ranitidina, etc.) o didanosina causaran marcada reducción en la absorción del itraconazol. El itraconazol puede causar incremento en el tiempo de protrombina en pacientes recibiendo warfarina u otro anticoagulante coumarinico. La rifampicina puede incrementar la tasa de metabolismo del itraconazol, ajuste en la dosificación del itraconazol puede ser requerida. El itraconazol puede disminuir el metabolismo de la fenitoina o la ciclosporina, el significado de esto en medicina veterinaria aún es incierto. El itraconazol puede incrementar el riesgo de ocurrencia de efectos cardiovasculares sí es empleado concurrentemente con terfenadina, o astemizol, sí itraconazol es requerido, lo mejor es cambiar a otro antihistamínico. El criterio anterior es asimismo aplicable a la cisaprida. El itraconazol puede incrementar las concentraciones séricas de digoxina; monitoree los niveles séricos de digoxina. El itraconazol puede incrementar los niveles séricos de los agentes antidiabéticos orales (p.e., clorpropramida, glipzida, etc.), lo cual puede resultar en hipoglicemia. Elevadas concentraciones de cisaprida con la resultante arritmia ventricular, puede resultar en la co-administración de con ketoconazol, itraconazol, miconazol IV o troleandomicina. El itraconazol causara elevación en los niveles plasmáticos de calcio-antagonistas (p.e., amlodipine, nifedipino), midazolam y quinidina. Parámetros a Monitorear • Eficacia clínica • En terapia a largo plazo, pruebas de función hepática rutinarias son recomendadas (ALT mensualmente) • Apetito • En perros, evaluación física en busca de lesiones cutáneas ulcerativas Farmacología • El itraconazol es un compuesto triazole fungistático. Los agentes triazole derivados (itraconazol, fluconazol & terconazol, al igual que los imidazoles (clotrimazol, ketoconazol, etc.), presumiblemente actúan a través de la alteración en la membrana celular de hongos susceptibles, en consecuencia, incrementando la permeabilidad de la membrana celular permitiendo el escape de contenido celular, además de alterar la captación de precursores purina y pirimidina. Otro mecanismo propuesto para la acción del Itraconazol, y los otros triazoles, es por medio del incremento en la permeabilidad de la membrana celular micótica a través de la inhibición en el sistema enzimatico del citocromo P-450 del microorganismo, en consecuencia alterando la producción de ergosterol, el cual es un elemento formador de la pared celular de los hongos. El itraconazol es lipofilico, y concentraciones del fármaco en tejido graso, omento, hígado, riñones y tejido cutáneo son de 2 a 20 veces la correspondiente a la concentración plasmática. Asimismo cantidades cuantificables pueden ser encontradas en pelo, sebo y uñas; solo cantidades insignificantes son encontradas en fluido cerebroespinal. El itraconazol presenta efectividad contra una variedad de hongos patogénicos, incluyendo levaduras y dermatofitos. Estudios in vivo empleando modelos de laboratorio han mostrado que el itraconazol presenta actividad en contra de Candida albican, Aspergillus flavus, Aspergillus fumigatus, Cryptococcus neoformans, Histoplasma capsulatum, Histoplasma capsulatum var. duboisii, Blastomyces dermatitidis, Coccidioides immitis, Parcoccidioides brasiliensis, Sporothrix schenckii y Trypanosoma cruzi. Farmacocinética • La absorción del itraconazol es altamente dependiente del pH gástrico y la presencia de alimento. Cuando es administrado en un estomago vació la biodisponibilidad puede ser únicamente del 50% o menos, con alimento esto puede aproximarse al 100%. • El itraconazol presenta sumamente alto aglutinamiento proteico y es ampliamente distribuido a través del organismo, particularmente a tejidos altos en lípidos (el fármaco es altamente lipofilico). La piel, el tracto genital femenino y el material purulento presentan concentraciones superiores a las encontradas en el suero. Sin embargo, solamente concentraciones mínimas son encontradas en sistema nervioso central, humor acuoso y saliva. • El itraconazol es metabolizado por el hígado a múltiples metabolitos diversos, incluyendo hydroxyitra-conazole el cual es activo. En humanos, la vida media sérica del itraconazol varía de 2164 horas. La eliminación puede ser un proceso saturable. Efectos Adversos & Advertencias • Aunque generalmente bien tolerado, algunos de los más comunes efectos adversos asociados con el empleo de itraconazol en humanos son nausea, vomito, sarpullido, y elevación en las enzimas hepáticas. Los efectos adversos son usualmente dosis-relativos y generalmente se desarrollan posteriores a 30 días de terapia. De ser necesario dada reacción adversa o toxicidad, el tratamiento puede ser descontinuado y entonces restablecido a la mitad de la dosis original posterior a que la problemática haya resuelto. • Las enzimas hepáticas deberán ser evaluadas mensualmente cuando el paciente sea tratado con itraconazol. Aquellos con alteración hepática deberán ser cuidadosamente monitoreados sí itraconazol es administrado. Insuficiencia renal no afecta los niveles plasmáticos de itraconazol. • En perros, al parecer, la toxicidad hepática es el efecto adverso más significativo. Aproximadamente 10% de los perros recibiendo 10 mg/kg/día y 5% de los perros recibiendo 5 mg/kg/día desarrollan toxicidad hepática, lo suficiente severa para descontinuar (al menos temporalmente) el tratamiento. El daño hepático es determinado a través de un incremento en la actividad de ALT. La anorexia es frecuentemente el signo que merca la toxicidad y generalmente ocurre durante el segundo mes de tratamiento. Algunos perros prescritos con itraconazol a una tasa de dosificación alta (10 mg/kg/día) pueden desarrollar lesiones ulcerativas cutáneas/vasculitis y edema de las extremidades que puede requerir disminución en la dosificación. • En gatos, al parecer, los efectos adversos son relacionados a la dosis. Efectos gastrointestinales (anorexia, perdida de peso, vómito), hepatotoxicidad (ALT incrementada, ictericia) y depresión han sido notados. Sí efectos adversos ocurren y ALT se encuentra elevada, el fármaco deberá ser descontinuado. Una vez que los niveles de ALT retornen a la normalidad y otros efectos adversos hallan disminuido, y de ser necesario, el fármaco podra ser restablecido a una dosificación lo más bajo posible o alargar el intervalo de dosificación, esto con intenso monitoreo. Contraindicaciones - Precauciones & Seguridad Reproductiva • El itraconazol solo deberá ser empleado cuando los beneficios potenciales sobrepasen a los riesgos en: pacientes hipersensibles a este u otros agentes antimicóticos azoles, pacientes con alteración hepática o pacientes en estado de aclorhidria o hipoclorhidria. En animales de laboratorio, el itraconazol ha causado materno-toxicidad, fototoxicidad y teratogenicidad, siendo esto dosisrelacionado a altas dosificaciones (5-20 veces las recomendadas). El itraconazol no penetra a la leche materna, el significado de este hecho es desconocido. El empleo de itraconazol deberá ser evitado en hembras gestantes. Sobredosificación & Toxicidad Aguda • Existe sumamente limitada información acerca de la toxicidad aguda del itraconazol. La administración oral de antiácidos puede auxiliar reduciendo su absorción. Sí amplia sobre-dosificación ocurre, considerar vaciado intestinal y proporcionar terapia de sostén conforme sea necesario. El itraconazol no es eliminado a través de diálisis. En estudios de toxicidad crónica, perros recibiendo 40 mg/kg PO diariamente durante 3 meses, no demostraron sobre-toxicidad. Incremento en las concentraciones de ALT y anorexia fármaco-inducida son signos de toxicidad por itraconazol. El tratamiento con itraconazol deberá ser descontinuado en perros con concentraciones séricas superiores a 250 UI/L o si el paciente se torna anoréxico. Consideraciones de Laboratorio • El itraconazol puede causar hipokalemia o incremento en las pruebas de función hepática en un pequeño porcentaje de pacientes. Referencias & Lectura Consultada • Elaboración Horacio Mariño Munguía MVZ Egresado Universidad Autónoma Metropolitana – Xochimilco