Tema 5- Equilibrio Material de Fases
Anuncio

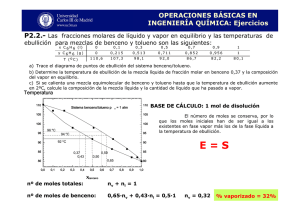
Tema 5. Equilibrio Material de Fases 1.- Cierta sustancia tiene una CP cuyo valor en cal.mol-1.K-1 está dado por las expresiones: CP (s)= 4. 10-5 T3 0 < T < 50 K CP (s)= 5 50 T < 150 K CP (l)= 6 50 T < 400 K En el punto de fusión normal, 150K, Hfus= 300 cal. mol-1. a) Calcular la entropía molar de esta sustancia para el líquido a 300 K b) Calcular la entalpía molar de fusión, la entropía molar de fusión y la energía libre molar de Gibbs de fusión a 100 K. ¿Es razonable el signo que resulta para G ?. Sol. a) S= 13,32 cal K-1 mol-1 b) H100=250 cal/mol S100 =1,59cal/Kmol G100=91 cal/mol 2.- La temperatura de transición entre el azufre rómbico y el azufre monoclínico es 95,5ºC. Las entropías de las dos formas cristalinas vienen dadas por las expresiones: SS rómbico = - 61,13 + 14,98 Ln T + 26,11 10-3 T J.K-1mol-1 SS monoclínico= - 60,88 + 14,9 Ln T + 29,12 10-3 T J.K-1mol-1 Calcular la variación de la entalpía y de la energía de Gibbs para el proceso (a 25 ºC y 1 at): Srómbico Smonoclínico Sol. H= 261,9 J/mol G=55,6 J/mol 3.- El valor de H de vaporización del agua es 539.4 cal/gr en el punto de ebullición normal. a) Muchas bacterias pueden sobrevivir a 100ºC formando esporas. La mayor parte de las bacterias mueren a 120ºC. Por lo tanto, en los autoclaves empleados para esterilizar instrumentos médicos y de laboratorio, se aumenta la presión para alcanzar el punto de ebullición del agua a 120ºC ¿ A que presión hierve el agua a 120ºC? b) ¿ Cual es el punto de ebullición del agua en lo alto de una montaña donde la presión atmosférica es de 446 torr?. Sol. a) 1,95 atm, b) 358,5 K 4.- El calor de fusión del Hg en su punto de fusión normal (-38.9ºC) es de 2.82 cal/gr. Las densidades del Hg(s) y del Hg(l), a –38.9ºC y 1 atm, son 14.193 y 13.690 gr/cc respectivamente. Calcule el punto de fusión del Hg a : a) 100 atm; b) 800 atm. Sol. a)TB = 234.7, b) TB = 238.4 K 5.- Tomando la entropia de vaporización en la temperatura de ebullición normal (p=1atm) como Sv 21 cal/Kmol. A) calcular el valor de la presión de vapor a cualquier temperatura T. B) La temperatura de ebullición del éter dietílico es 34.6ºC. Calcular su presión de vapor a 25ºC. Sol. a) ln P/1atm = 10.57(1-TB /T), b) P = 541 torr 6.-La presión de vapor del agua a 25ºC es de 23.76 torr. A) Si se ponen, en un recipiente de V=10 l, 0.360 gr de agua a 25ºC, determine las fases que están presentes en el equilibrio y la masa de H2O en cada una de ellas. b) Haga lo mismo que en el apartado anterior suponiendo que V= 20l. Sol. a) grl = 0.130, b) grl =0 y grv = 0.360 7.- ¿Verdadero o falso? a) Cuando un sistema de un solo componente está formado por dos fases en equilibrio, basta con fijar su temperatura para que todas las demás propiedades termodinámicas intensivas queden establecidas. b) El potencial químico i de un componente i en una fase es una función de estado. c) Durante un cambio de fase no se producen cambios de temperatura ni de volumen del sistema. d) El número de fases de un sistema formado por AgBr(s), AgCl(s) y una disolución acuosa saturada de dichas sales es 2 e) Si , el componente i fluye espontáneamente desde la fase hasta la fase 8.- Los líquidos A y B forman disoluciones ideales. Una mezcla de vapores, que es 40% molar en A, está contenida en un dispositivo de cilindro y pistón que se mantiene a una determinada temperatura constante T. El sistema se comprime luego lentamente. Supuesto que PA0 y PB 0 son 0.4 y1.2 atm, respectivamente a la temperatura T, a) calcular la presión total a la cual empieza a condensarse vapor y también la composición de este líquido. b) Calcular la composición de la solución cuyo punto de ebullición normal es T. Sol. a) P=0,67at, A =0,67 b) A =0,25 9.- El benceno y el tolueno forman disoluciones esencialmente ideales, y una mezcla particular que se compone de dos moles de benceno y tres de tolueno tiene una presión de vapor total de 280 mmHg a 60º C. Si se añade un mol de benceno más a la disolución, la nueva presión de vapor total es ahora 330 mmHg. Calcular las presiones de vapor del benceno y tolueno puros a 60º C. Sol. a) P* benceno =462mmHg P* tolueno =158mmHg 10.- Los líquidos A y B forman disoluciones ideales. Son isómeros, de modo que sus pesos moleculares son los mismos. Una disolución de composición A se encuentra que tiene una presión de vapor de 650 mmHg a 50º C. Se destila después hasta que la mitad se ha recogido como condensado. El condensado tiene una composición de A =0.6, y el líquido residual una composición A = 0.4 y una presión de vapor de 600 mmHg a 50º C. Calcular P* A y P* B Sol. a) P* A =900mmHg P*B =400mmHg 11) Una mezcla de 50 g de hexano (C6 H14 ) y 50 g de nitrobenceno (C6H5 NO) fue preparada a 290K. Teniendo en cuenta el diagrama de la figura ¿Cuál es la composición de las fases que se forman, y en que proporción lo hacen? ¿A qué temperatura deberá ser calentada la mezcla para obtener una única fase? 12.- Discutir, a la vista del diagrama de la figura qué ocurre al calentar una mezcla de composición χB =0.95 (a1) hasta 350K. ¿Cuál es la composición del vapor?. A 370K ¿Cuáles serían las composiciones del líquido y del gas?. Si se preparara una mezcla de composición χB =0.40, y se calentara hasta 320K, ¿cuantas fases podrían coexistir?