Tema 2: Oxidoreducción biológica y fosforilación oxidativa
Anuncio

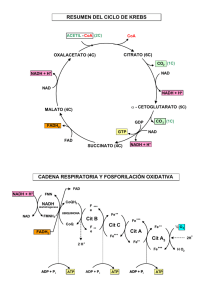
Oxidoreducción Tema 2: Oxidoreducción biológica y fosforilación oxidativa Oxidorreducción biológica •Potencial de oxido-reducción y ∆ de energía libre. •Cadena respiratoria: composición y localización subcelular •Fosforilación oxidativa: teoría quimiosmótica • Acoplamiento y rendimiento energético en la formación de ATP •ATP-sintasa: estructura y función Oxidoreducción Tema 2: Oxidacción biológica de nutrientes NADH + H+ NADH transporta e- a la cadena respiratoria El transporte de e- genera gradiente de H+ en la membrana Esos H+ activan a la ATP-sintasa (fosforilación oxidativa) Objetivos de aprendizaje: Entender que la oxidación del NADH transcurre en múltiples pasos efectuada por tres complejos de proteínas transmembrana con varios grupos red-ox activos en cada uno. Comprender que la Coenzima Q y el citocromo c son transportadores móviles de e- entre los complejos proteícos. Comprender que los H+ son traslocados a través de la membrana mitocondrial por los complejos I, III y IV. Entender como la energía libre de la oxidación del NADH se conserva como un gradiente electroquímico de H+. APLICAR EL BALANCE: 2NADH + 2H+ + O2 4e- 4 H2O Entender que la reducción de cada molécula de O2 por los e- aportados por 2 NADH hasta formar 2 H2O , requiere 4 e- y produce la translocación de 20 H+ al espacio intermembranoso. Oxido-reducción biológica Las células oxidan los nutrientes orgánicos para generar ATP, necesario para su trabajo útil. Perdida de electrones = Oxidación A A+ + e oxidado Ganancia de electrones = Reducción reducido El flujo de electrones en el metabolismo se canaliza a través de intermediarios metabólicos y de transportadores (COENZIMAS REDOX) que convierten la energía del flujo de e- (∆ Eo) en energía química (∆ Go): ATP. Ejemplo: La glucosa es un nutriente reducido, una fuente de electrones. Su degradación producirá NADH CO2 NAD+ FAD NADH FADH2 ∆ Eo ∆ Go ∆ Go H2O ATP Reacciones de oxidación reducción A + B+ A+ + B reducido oxidado oxidado A: pierde e-, se oxida Reductor B: gana e-, se reduce Oxidante A (red) reducido A (ox) + e- B (ox) + e- B (red) Fe2+ + Cu2+ Fe3+ + Cu+ Fe2+ Fe3+ + eCu2+ + e- Cu+ Fe2+ (donador) / Fe3+ (aceptor): par redox conjugado NADH (donador) / NAD+ (aceptor): par redox conjugado Potencial de reducción: Eo Potencial de reducción ( E ): tendencia de un reductor a ceder e En condiciones estándar ( Eo ): 25º C, 1 atm presión, [oxidante] y [reductor] = 1 M H+ + e- Eo = 0 V ½ H2 En condiciones fisiológicas pH = 7 ( Eo´ ) Patrón o par estandar Eo(H+/1/2H2) = 0,42 V •Tendencia a adquirir e- > par estándar Eo´ + Mucha afinidad por e- ->OXIDANTE •Tendencia a adquirir e- < par estándar Eo´ - Poca afinidad por e- ->REDUCTOR Los e- fluyen desde las especies reductoras, con un Eo´ más electronegativo (- Eº’) a las especies oxidantes, con un Eo´ más electropositivo (+ Eº’). Potencial de reducción e ∆G [aceptor electrones] RT E = Eo + ln nF [donador de electrones] n = nº de e- cedidos F = cte de Faraday = 96,48 kJ/mol V El flujo de e- produce una energía libre (∆ ∆G ) capaz de realizar trabajo útil ∆Go´´ es proporcional a ∆Eo´ ∆Go´ = - n F ∆E ∆ o´ ∆Eo´ + ∆Go´´ - ∆G = - n F ∆E ∆ Reacción espontánea Potencial de reducción e ∆G Los potenciales de reducción estándar de los compuestos permiten calcular la ∆Gº de la reacción redox Piruvato + NADH + H+ Lactato + NAD+ Semirreacciones: Piruvato + 2H+ + 2e- Lactato NADH - 2H+ - 2e- NAD+ Eo´ = -0,19 V Eo´ = -0,32 V ∆Go´ = - n F ∆E ∆ o´ n = nº de e- cedidos = 2, ∆Eo´ = Eo´ (aceptor e-) – Eo´ (donador e-) ∆Eo´ = Eo´ (oxidante) – Eo´ (reductor) F = 96,48 kJ/mol V ∆Eo´ = -0,19 – (-0,32) = 0,13 V Piruvato acepta e- del NADH ∆Go´´ = -2 (96,5 kJ/mol V) (0,13 V) = -25,09 kJ/mol La reacción es espontánea en condiciones estándar: [ ]= 1M, 25ºC y pH 7 Respiración mitocondrial • Las células aeróbicas consumen O2 y lo reducen a H2O con los e- procedentes de la oxidación de nutrientes (NADH, FADH2). TRANSPORTE ELECTRÓNICO MITOCONDRIAL: Se da en la membrana interna mitocondrial a través de una serie de transportadores de e- (componentes de la cadena respiratoria) que llevan los e- desde las coenzimas reducidas (NADH, FADH2) hasta el O2. Durante la transferencia de e- desde el NADH, o el FADH2 , hasta el O2 se genera un bombeo de H+ hacia el espacio intermembranoso, originando una fuerza protomotriz (H+-motriz) que activa a la ATPsintasa. • La fosforilación oxidativa consiste en la fosforilación del ADP hasta ATP por la ATP-sintasa, activada por los H+. • constituye la fuente más importante de ATP en los organismos aerobios Mitocondria La fosforilación oxidativa se produce en la membrana interna de la mitocondria La mitocondria posee dos membranas muy estructuradas, que rodean a la matriz. Membrana externa Es bastante permeable a iones y moléculas pequeñas Membrana interna Es impermeable a casi todos los iones, Se pliega en crestas Contiene los componentes de la cadena de transporte de e y la ATP sintasa Matriz Interior mitocondrial donde tienen lugar el ciclo del ácido cítrico y la oxidación de los ácidos grasos, etc. Crestas Espacio intermembrana Matriz Membrana externa Membrana interna La oxidación del NADH se produce en la cadena respiratoria mitocondrial Formada por Complejos proteicos 1.- Transporte de electrones desde el NADH • Complejo I: NADH CoQ oxidorreductasa • Complejo III: Ubiquinol citocromo c oxidorreductasa • Complejo IV: Citocromo c oxidasa 2.- Transporte de electrones desde el FADH2 • Complejo II: Succinato CoQ reductasa • Otros Compuestos redox Componentes de la cadena respiratoria Transportadores de electrones Coenzimas: NAD+ NADP+ Coenzimas SOLUBLES de enzimas deshidrogenasas FMN FAD UNIDAS covalentemente a flavoproteínas (grupo prostético) Quinonas: Transportadores en medio no acuoso (membranas) Ubiquinona = Co Q = Q Citocromos: Proteínas con grupo prostético hemo Centros ferro-sulfurados Proteínas con Fe asociado a átomos de S algunos transportadores de e- están asociados a proteínas y forman lo que llamamos Complejos: I, II, III y IV Coenzimas transportadoras de e- : DINUCLEOTIDOS DE ADENINA y NICOTINAMIDA NADH (coenzima soluble) o NADH (reducido) NAD+ (oxidado) Adenina NAD+ + 2H+ + 2e- AH2 + NAD+ Coenzima de oxidorreductasas o deshidrogenasas Responsable entrada e- por el complejo I NADH + H+ A + NADH + H+ MONONUCLEOTIDOS DE FLAVINA y DINUCLEOTIDOS DE FLAVINA y ADENINA FMN y FAD (coenzimas NO solubles, ligadas a proteínas) Anillo de isoaloxazina FMN . . FADH (FMNH ) (semiquinona) FADH2 (FMNH2) (totalmente reducido) FAD FMN presente en complejo I FADH2 entrada de e- por el complejo II FAD + 2H+ + 2e- FADH2 FMN + 2H+ + 2e- FMNH2 COENZIMA transportadora de e- : Ubiquinona, Coenzima Q, CoQ Unidades de ISOPRENO Ubiquinoa (Q) Totalmente oxidada Lípido isoprenoide Radical Semiquinona Parcialmente oxidado QHo Difunde libremente por la membrana No está ligado a ninguna proteína Ubiquinol Totalmente reducido QH2 Puede transferir 1 e- o 2 e- Método: Extraible con isooctano Proteínas con transportadores de e- : Citocromos (HEMO) Proteínas con un grupo hemo Transfieren 1 e- mediante la oxidorreducción del Fe (2+, 3+) Clasificación según su espectro de absorción: a, b, c Citocromos a y b están en LOS complejos III y IV Citocromo c es una proteína soluble, se asocia con la membrana interna Proteínas con centros ferro-sulfurados Proteínas con Fe en forma NO HEMO sino asociado a átomos de S Transfieren 1 e- mediante la oxidorreducción del Fe Fe-S 2Fe-2S 4Fe–4S TRANSPORTE en Complejo I: NADH CoQ reductasa Transfiere 2 edesde el NADH hasta la CO Q, pasando por FMN y por grupos ferosulfurados (Fe-S) TRANSPORTE en Complejo II: • succinato CoQ reductasa • Glicerol-3-P desHasa • Acil-CoA desHasa Transfieren 2 e- desde diversos sustratos (succinato, glicerol-3-P, AcilCoA) que son oxidados por estas enzimas, y los e- van a través de FAD y por grupos ferrosulfurados hasta la CoQ TRANSPORTE en Complejo III: CoQ cit c reductasa Transfiere 2 edesde la CO Q hasta el cit c, pasando por los cit b y c1 y por grupos ferosulfurados Los e- se transfieren aquí de 1 en 1 TRANSPORTE en Complejo IV: Cit c oxidasa Transfiere e- desde el citocromo c (4 viajes) hasta el O2, pasando por dos grupos de Cu y por los citocromos a y a3. Secuencia del transporte de e- en la cadena respiratoria Complejo I [ H +] FADH2 Complejo III [ H +] Complejo IV NADH → FMN FADH2 [ H +] Q → cito b → cito c1 → cito c → cito a → cito a3 → O2 Potenciales de reducción de los pares red-ox transportadores de e- en la cadena respiratoria REACCIÓN E0‘ •NAD+ / NADH + H+ -0.32 •Flavoproteina-FMN (ox) / Flavoproteina-FMNH2 (red) -0.30 Piruvato / Lactato –0.18 Acetaldehido / Etanol -0.16 Oxalacetato / L - malato -0.166 •Coenzima Q (ox) / Coenzima Q (red) +0.04 •Citocromo C (ox) / Citocromo C (red) +0.25 •Citocromo a3 (ox) / citocromo a3 (red) +0.55 •½ O 2 / H2O +0.82 Determinación de la secuencia con Inhibidores del transporte electrónico NADH → FMN CoQ → cit b → cit c1 → cit c → cit a → cit a3 → O2 FADH2 Rotenona barbitúricos Amital Azida Sugars Glycolysis Inhibidores del T.E.M. Impiden el paso de e- a través de los transportadores respiratorios, interrumpiendo en consecuencia la forforilación oxidativa. TCA Cycle Rotenona insecticida Electron Transport Oxidative Phosphorylation Teoría quimiosmótica de Mitchel: Los Complejo I, III, y IV generan un gradiente de H+ (fuerza protón-motriz) que que activa la ATP sintasa La FUERZA PROTÓNMOTRIZ, en el espacio intermembrano so, tiene dos componentes El gradiente de carga potencial eléctrico = ∆Ψ El gradiente de [ H+ ] potencial químico = 2,3 RT ∆pH / F Espacio intermembrana Fumarato Succinato Mitocondri a Potencial químico ∆pH (dentro alcalino) Síntesis de ATP guiada por la fuerza H+motriz) Potencial eléctrico ∆ψ (dentro negativo) Balance energético en la cadena respiratoria A) 2NADH 4e- O2 H2O 20 H+ 6 ATP B) 2 FADH2 4 e- O2 H2O 12 H+ 4 ATP Agentes desacoplantes DISIPAN LA FUERZA PROTÓN-MOTRIZ y p-DNF desacoplan la fosforilación oxidativa del TEM, por tanto bajan el rendimiento de la síntesis de ATP p-dinitrofenol Los agentes desacoplantes son sustancias que introducen H+ hacia el interior mitocondrial. El p-DNF entra en las células en estado molecular y en el interior se disocia. En el espacio intermembranoso (pH inferior) se protona y entra a la mitocondria, en el interior hay un pH superior y se disocia. UCP1 o termogenina (adiposo pardo) Obesidad y Proteínas desacoplantes (UCPs) La gramicidina A es un ionóforo ATP sintasa: la subunidad F0 la ancla a la membrana y la F1 en la matriz mitocondrial F1= α3 β3 γ δ ε El anillo c gira con el paso de H+ El giro de “γε γε” γε provoca cambios conformacionales en las subunidades αβ F0= a b2 c12 Mecanismo de actuación de la ATP sintasa T L O Las 3 unidades β de la ATP sintasa no son equivalentes, la rotación de “γγ−ε” las cambia la conformación. Según va girando el complejo por el paso de H+ las unidades β cambian de conformación: L: une ADP y Pi T: sintetiza ATP O: libera ATP O L O T L T Transportadores de iones a través de la membrana interna Espacio intermembranoso El ATP sintetizado en el interior mitocondrial debe de exportarse al citoplasma para cumplir allí con las necesidades propias Traslocasa de nucleotidos de adenina (antiporte) ATP sintasa -Esto se hace con un sistema antiporte: 1 ATP sale y 1ADP entra a refosforilarse - Hay otro sistema simporte que importa Pi y H+ Traslocasa de fosfato (simporte) DENTRO de la Matriz