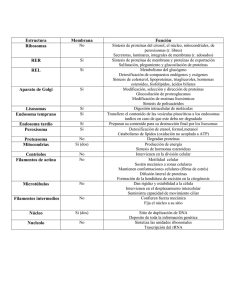
teoría del envejecimiento por reducción de gradientes de ph
Anuncio

TEORÍA DEL ENVEJECIMIENTO POR REDUCCIÓN DE GRADIENTES DE PH. (PROTONÓFOROS ENDÓGENOS COMO CAUSA PRIMARIA). INTRODUCCIÓN El tema del envejecimiento empieza a estar de moda, tratándose con frecuencia en periódicos y revistas de gran tirada. Incluso laboratorios farmacéuticos importantes, conocedores de la buena prensa que van a conseguir, hacen propaganda sobre los estudios que pretenden llevar a cabo sobre el tema. Actualmente existen más de 300 teorías sobre el envejecimiento que merecen haber sido publicadas, y este número aumenta día a día. La teoría que yo expongo se basa en unos cambios que nuestras células sufren con la edad. No puedo asegurar que la teoría sea original, pero en los artículos que he leído no he encontrad ningún indicio que permita pensar que sea una idea conocida. Las principales teorías sobre el envejecimiento han surgido de hipótesis, y las investigaciones que les han seguido han dado siempre resultados contradictorios (36). No hay ninguna teoría que tenga pruebas concluyentes, y todas tienen datos en contra (49,23,58). Sobre la acumulación de toxinas como causa del envejecimiento se ha escrito bastante, pero no se ha experimentado exhaustivamente su búsqueda, ni se ha dado una explicación convincente de porqué no son eliminadas como hace el cuerpo con otros metabolitos sobrantes, ni como actúan sobre las funciones celulares llevándolas a la pérdida de la homeostasis original (23). En esta teoría doy por supuesto que los efectos que provocan las sustancias lisosomotrópicas, los protonóforos y los ionóforos monensina y nigericina (intercambian cationes por protones (104)) se deben a la reducción de los gradientes de pH (88), y que otros efectos son de menor importancia (93). Me baso en que en los experimentos que han comparado los efectos de estas sustancias, los resultados son muy similares, y que todos ellos tienen en común su capacidad de reducir los gradientes de pH. La teoría que propongo cumple el criterio de Strehler (1977) (49) para considerar la causa del envejecimiento aceptable: a) Universal b) Intrínseca c) Progresiva d) Perjudicial para el individuo e) Primaria, es decir, no se puede deber a otra causa anterior. Voy a exponer los siguientes puntos: a) b) c) d) Teoría. Originalidad de la idea. Datos experimentales que apoyan la teoría. Algunos datos que pueden tener relación con la teoría. e) f) g) h) Conocimientos necesarios para confirmar o rechazar la teoría. Metodología experimental. Utilidad de los resultados. Bibliografía. TEORIA La pérdida de gradientes de pH que presento como hipótesis puede ocurrir de diversas formas. Unas dependen de la alteración del efecto Donnan y otras de la disminución de la actividad de las bombas de protones. El efecto Donnan puede modificarse por: a) Acumulación de metales impermeables a la membrana lisosomal (Fe, Cu, Zn, Ca, Pb, Hg, etc.) (57). b) Alteración de la concentración de grupos ácidos de las proteínas responsables del efecto Donnan (-COOH,-SO3H y -PO3H2). La acción de la bomba de protones puede verse afectada por: c) Disminución de la concentración de ATP (35,58). d) Reducción de la densidad superficial de bombas de protones activas. e) Presencia de inhibidores de la bomba. f) Disminución del pH citosólico, lo cual reduce toda actividad ATPásica. g) Aumento de la permeabilidad general de la membrana por cambio de composición o cualquier otra causa. h) Acumulación de toxinas protonóforas. Los puntos b),f) y g) se pueden explicar por la teoría de los radicales libres. El punto a) no es intrínseco. c) y d) no pueden ser causas primarias. El punto e) es muy difícil que se produzca, puesto que hay diferentes bombas en cada célula, que requieren un tipo de inhibidores específicos para cada una. Además cada ser vivo puede tener bombas con propiedades diferentes. Aunque parece bien probado que los radicales libres participan en la destrucción de todos los componentes celulares, no son la única causa, y el hecho de que se acumulen proteínas desnaturalizadas por esas otras causas, en proporciones de incluso el 30 % en ancianos, me hace pensar que lo que falla son los mecanismos de degradación del material deteriorado. La acumulación de metales se puede explicar por la previa reducción de acidez en los lisosomas: por el mismo mecanismo que actúan las resinas de intercambio catiónico, absorbiendo cationes a pH cercano a la neutralidad y liberándolos a pH más ácido. Si estos metales estuvieran en forma de cationes libres, serían excretados por el sistema de vesículas que continuamente se desprenden de los lisosomas y de los endosomas, y que se funden con la membrana celular, donde segregan su contenido al exterior. Un aumento de permeabilidad de la membrana por cambio de composición o por deterioro, aparte de no ser una causa primaria, difícilmente dará lugar a un aumento tan grande que no pudiera ser compensado por la acción de las bombas de protones. Creo que sólo el punto h) puede calificarse de causa primaria que cumple los criterios de Strehler. Hipótesis: El envejecimiento celular de los mamíferos es causado por la reducción de los gradientes de pH celulares a causa del aumento de permeabilidad de las membranas a los protones, debida la acción de unas toxinas protonóforas endógenas que se acumularían progresivamente con la edad. La suposición de la acumulación de toxinas protonóforas se basa en: La incapacidad de las células para eliminar todos los tipos de residuos. En la alta probabilidad de que una molécula sea protonófora (Un protonóforo es un ácido débil lipofílico con su carga deslocalizada por dobles enlaces y átomos electrófilos (N, O), por lo que puede atravesar una membrana biológica tanto en su forma protonada como en la forma iónica (81,104)). En la baja concentración a la que actúan: 0,01 mM (Una molécula de protonóforo es capaz de desacoplar completamente 5 cadenas respiratorias de mitocondria)(81). En la posibilidad de que se formen un tipo de protonóforos derivados de las bases del ADN y de los ARN, comunes a todos los seres vivos. Estas toxinas protonóforas se pueden formar por condensación entre bases púricas y pirimidínicas a través de sus grupos amino (82) (ver esquemas más adelante). Serían difíciles de eliminar porque a pesar de ser sustancias liposolubles, tendrían una cierta solubilidad en agua, con la que mantendrían un coeficiente de partición muy favorable a la solubilidad en lípidos (para la Valinomicina es de 400/1). Cualquier protonóforo que llegase a la sangre sería reabsorbido por las LDL y por los leucocitos, que por ser de nueva síntesis no estarán saturados en origen, volviendo a descargar las toxinas en las células que asimilen estas LDL o que degraden a los leucocitos. Las proteínas del suero también podrían participar de este reciclaje de las toxinas, debido a su capacidad de absorción superficial. Todo ello impediría que las toxinas protonóforas sean eliminadas a través de la orina. Del mismo modo, células que se dividen lentamente adsorberían los protonóforos del plasma, pudiendo llegar a alcanzar concentraciones cercanas a las de las células postmitóticas. Este podría ser el caso del hígado, riñón, timo, páncreas, piel, etc. Por último, existe la posibilidad de que estas sustancias, cuando aún se encuentran a bajas concentraciones, actúen como moduladores de enzimas y de receptores en las membranas celulares. Serían como un reloj de arena, que iría señalando la edad por la concentración que progresivamente van alcanzando, activando y desactivando funciones al alcanzar un nivel crítico para cada enzima o receptor. De este modo regularían el crecimiento, el desarrollo y el envejecimiento. Téngase en cuenta que puede haber docenas de estas toxinas, cada una acumulándose a diferente velocidad; que los receptores de superficie modulan la expresión genética en muchos casos; y que estas "toxinas", por ser ácidos, pueden esterificarse con colesterol, con inositol y con glicerol, por lo que pueden quedar fijadas a las membranas. En apoyo de esta hipótesis están los siguientes hechos: Hay una estrecha relación entre la edad a la que una especie llega a la madurez sexual y su longevidad (51). El único experimento que ha conseguido aumentar la longevidad en animales de experimentación, (la restricción alimenticia) también ha aumentado proporcionalmente la edad a la que se alcanza la madurez sexual. Si la teoría es correcta, estos protonóforos se acumularían en la grasa corporal, a la que llegarían disueltos en los LDL. No podrían escapar de allí puesto que los lípidos salen de estos depósitos en forma de ácidos grasos libres y no en forma de gotitas o de LDL. Por su estructura estas moléculas deben tener un color intenso. Sería curioso comprobar si la grasa de animales viejos es más oscura que la de los jóvenes. Téngase en cuenta que la grasa puede acumular lipocromos. Estas son sustancias de origen vegetal asimiladas con los alimentos, y son de color amarillo. Los gradientes de pH los encontramos en: los lisosomas, endosomas, vacuolas autofágicas, fagosomas, vesículas revestidas, vesículas trans del aparato de Golgi, vesículas excretoras de hormonas polipeptídicas, vesículas de sinapsis nerviosas y por último entre el citosol y el exterior celular. Los lisosomas son el principal centro de degradación de material celular y extracelular. Necesitan un pH ácido para el correcto funcionamiento de sus hidrolasas y para poder fusionarse con otras vacuolas. (Su pH está comprendido entre de 4,8 y 5,5). Los endosomas transportan material a los lisosomas. La acidez es necesaria, entre otras cosas, para la correcta disociación entre los ligandos (LDL, Fe III, Vitamina B12, Albúmina, etc.) y los receptores endocitados, permitiendo que sean reciclados a la membrana celular (88,89). Las vacuolas autofágicas y los fagosomas se unen a los lisosomas secundarios por un mecanismo dependiente de pH ácido. Las vesículas del aparato de Golgi encuentran su destino en los lisosomas o la superficie celular dependiendo de su pH. Además, las células que excretan proteínas al exterior celular necesitan un medio ácido adecuado para la correcta actividad de peptidasas que convierten las pre-proteínas en su forma activa. Este mecanismo de maduración ocurre con la albúmina (89), las inmunoglobulinas, el colágeno y la fibronectina, entre muchas otras proteínas. Lo mismo aplica a las hormonas polipeptídicas como la insulina y la ACTH, que sufren proteólisis (94) y acondicionamiento dentro de las vesículas secretoras para convertirse en su forma activa (94,83). Esto se consigue por unas peptidasas que actúan en medio ácido. (pH óptimo:5,5) (83). Los neurotransmisores que son aminas (acetilcolina, epinefrina, norepinefrina, dopamina, serotonina, etc.) entran dentro de las vesículas secretoras gracias a unos transportadores de membrana que aprovechan el gradiente de protones como fuerza motriz (103,79,77,83,84,90,92). Además en algunos casos el último proceso biosintético se produce dentro de las vesículas por enzimas que necesitan un medio ácido (pH: 5.3 / 5.7). A pH extracelular de 7.4 el pH intracelular de equilibrio es 6.4 (77,95). Esto es así por el efecto Donnan y por el potencial eléctrico negativo del interior celular. Para poder mantener el pH a su valor fisiológico medio de 7.1 la membrana contiene una proteína de contraporte de Na+/H+ que aprovecha el gradiente de Na+ como fuerza motriz. Paralelamente una bomba de Na+/K+ devuelve los iones sodio al exterior. El equilibrio se mantiene en su estado ideal gracias a que la membrana es impermeable a los protones. Hay otros mecanismos de regulación del pH intracelular, pero son menos activos o son específicos de actividades y órganos muy concretos (99,95,77). Disminuciones mínimas de pH en el citosol provocan cambios dramáticos en toda una serie de componentes y actividades celulares (77,78,95,96,A22): La glucólisis se reduce, las estructuras de filamentos se descomponen, los microtúbulos quedan ensamblados (descomponen al alcalinizar), los enzimas pierden actividad, los valores de Ca++ libre disminuyen, los de cAMP aumentan, los músculos pierden fuerza y excitabilidad, la síntesis de proteínas se reduce, los lisosomas se acumulan en la periferia (cerca de la membrana) y su capacidad para fusionarse se reduce. Probablemente También afecte a la capacidad de transcripción de los genes, al actuar sobre la fuerza de unión de las Histonas con el ADN. Es importante el hecho de que para dividirse las células necesitan aumentar su pH en cerca de 0.3 unidades (87,85,86), que todavía está más lejos del valor de equilibrio 6.4, aumentado la efectividad de los protonóforos. Esta alcalinización es indispensable para la replicación del ADN (86). Efectos de los protonóforos: Reducen la acidez interna de los lisosomas (18,37 pág.529) y de cualquier vacuola que tenga un gradiente de pH diferente del que corresponde al efecto Donnan (81). Causan despilfarro de energía al cortocircuitar la bomba de protones (H+ ATPasa) (16,37 pág. 529) y cualquier otro medio de bombeo de protones con consumo de ATP. La reducción de acidez en los lisosomas disminuye la actividad hidrolítica de la mayoría de sus enzimas (5,15,26), por tanto, la renovación de las proteínas, de las membranas y de los orgánulos se verá reducida (9,16,26). También saldrá perjudicada la renovación del material extracelular (75) y de los huesos. Pueden reducir la presentación de antígenos (93). Por su efecto en el aparato de Golgi, el procesamiento y la distribución de proteínas a sus diferentes destinos celulares se vera afectada: por ejemplo los enzimas lisosomales, los receptores de la superficie de la membrana y las proteínas de transporte (bombas de Na+,K+,H+; transportadores de aminoácidos; transportadores glucosa; etc ) (89,93,100,101). Además, enzimas dirigidos a los lisosomas serán desviados al exterior celular (93,100,101), donde pueden crear problemas de artrosis y de autoinmunidad. El reciclado de receptores de la membrana celular por los endosomas se reducirá, disminuyendo su concentración. Esto dejara a las células con menor sensibilidad a los estímulos hormonales y con menor capacidad para captar metabolitos del exterior como las LDL (88,101), hierro, etc; creando problemas como aumento de colesterol. Hormonas de gran importancia verán perturbada su procesamiento final así como su secreción (91). Sobre todo se reducirá la capacidad de respuesta de las glándulas a un aumento de la demanda (insulina, ACTH, etc.). (83,93) Disminuirá la secreción de proteínas como la albúmina y las globulinas. (89,100) La concentración de neurotransmisores que se alcanza dentro de una vesícula de almacenamiento es dependiente de su gradiente de protones (77,79, 83, 84, 90, 92, 103).(Por ejemplo, el FCCP 4 uM reduce la concentración de acetilcolina intravesicular a un 23 % de su valor normal (83)). A cada impulso nervioso le seguirá una descarga de neurotransmisor en la sinapsis inferior a lo normal. En consecuencia el sistema nervioso, los sentidos, la estimulación simpática y parasimpática, y la actividad muscular se verán afectados. Los protonóforos reducen el pH citoplasmático (96). Con un cambio de pH de 0.1 unidades, un enzima pasa de la máxima actividad a ser completamente inactivo (78). Este es un caso extremo, pero lo que es seguro es que los enzimas son muy sensibles a pequeños cambios de pH, de ahí se deduce que los protonóforos pueden afectar gravemente la actividad metabólica celular. Ejemplos: en extractos de huevos de L. Pictus la síntesis proteica es entre 10 y 20 veces más elevada a pH 7.4 que a pH 6.9; el estado de latencia de diversos organismos se consigue por la reducción del pH en aproximadamente una unidad (78); la glucólisis se reduce tanto con el pH que llega a desaparecer a pH 6.1 (77); al disminuir el pH citoplasmático la permeabilidad al Na+ y K+ se reduce abruptamente en neuronas (y posiblemente en el retículo sarcoplasmático muscular, pues comparten la misma Na+/K+ ATPasa y los mismos canales de Na+ y de K+), y a la vez que aumenta la permeabilidad al Cl- (77); al reducir el pH de 7.2 a 6.5 ya no se producen potenciales de acción de Ca++; el crecimiento de células de mamífero en cultivo es máximo a pH citosólico comprendido entre 8.0 y 8.3 (86); la energía que se puede obtener del ATP se reduce con el pH; etc. Las células con capacidad para dividirse, pero que normalmente no lo hacen, como los hepatocitos, perderán poco a poco esta facultad debido a que no podrán conseguir el pH alcalino necesario para iniciar la replicación del ADN (78). En cambio las células que sufren mitosis con regularidad conservarán su potencial intrínseco de duplicación (fibroblastos, células endoteliales, enterocitos, células sanguíneas), pues al dividirse diluyen la toxina protonófora. Digo intrínseco porque la mitosis necesita del estímulo previo de hormonas que se encuentran en el suero, como los factores de crecimiento y la insulina, las cuales son polipéptidos procesados y secretados por vesículas dependientes de un medio ácido, por tanto sensibles a la afectividad de los protonóforos. La entrada masiva de protones al citoplasma por la acción de los protonóforos, implica un incremento de concentración citosólico de Na+ y de K+ debido a la respuesta del cotransportador de Na+/H+ y de la bomba de Na+/K+. Estos aumentos de Na+ y de K+ probablemente tengan efectos negativos en la actividad celular, que se sumarán a los causados por el aumento de concentración de H+. Por ejemplo se sabe que el aumento de la concentración de Na+ intracelular inhibe el intercambio de Na+ por protones,(seguramente como mecanismo de protección que impide un excesivo aumento de Na+ (99) ) situando el umbral de activación de la proteína intercambiadora a valores de pH más ácidos (97,98). Hay otros mecanismos de regulación del pH que son menos activos o que no se encuentran más que en células muy especializadas (99,95,77). El sistema Cl-/HCO3-, si no va asociado a la entrada de Na+, sólo puede transportar protones de fuera a dentro (95), por lo que no puede sustituir al sistema Na+/H+. Es posible que el potencial electroquímico intermembrana disminuya por la entrada neta de cationes, en consecuencia el umbral de estímulo muscular y neuronal se reducirá, así como la velocidad de despolarización y repolarización de las neuronas y retículo sarcoplasmático. Podría pensarse que el aumento de concentración de K+ y de Na+ citosólicos podría provocar la entrada de agua para compensar el aumento de presión osmótica. No es así, puesto que otro efecto de los protonóforos es reducir la velocidad de recambio proteico, por lo que se acumulan proteínas entrecruzadas (42) y oxidadas (mayor número de grupos carboxilo por gramo de proteína (65)) disminuyendo la osmolalidad y aumentando el número de cargas negativas que neutralizan a los cationes. Además el aumento de grupos carboxilo acidificará el citosol por efecto Donnan. Los siguientes datos del artículo de Zs. Nagy,I.(42) confirman lo dicho: en neuronas de ratón hay un 50% de pérdida de permeabilidad para K+; 30-40% incremento de contenido de K+; el contenido de agua se reduce del 80% al 70-73% y la presión osmótica coloidal se reduce de 810 a 596 mm Hg. Para el hígado se obtienen resultados parecidos. Casi todos los trastornos que pueden provocar los protonóforos se observan en la vejez. En otro apartado expondré algunos ejemplos. Un efecto inducido por la inhibición de los lisosomas es el aumento de la actividad proteolítica del sistema enzimático citosólico dependiente de la ubiquitina, cuyos sustratos preferentes son los enzimas de rápida renovación (y también las proteínas oxidadas), que por otra parte son los enzimas clave que regulan el metabolismo celular. A consecuencia de ello la concentración de estos enzimas disminuirá, afectando las principales funciones del metabolismo celular (1,16,43). Por otra parte se ha comprobado que los lisosomas no sólo se encargan de la degradación de las proteínas de larga vida media, sino también de algunas de muy corta vida (A2). Al reducirse la velocidad de renovador de la mayor parte de los componentes celulares, tienen más probabilidades de verse modificados por cualquiera de los mecanismos de degradación que existen y por tanto, de quedar inutilizados (1,47,A7,66,67). Parece que eso es lo que ocurre en las células viejas (12,58,66,67). Se sabe que las proteínas y metabolitos ejercen una acción activadora o inhibitoria sobre la expresión de ciertos genes (1), lo cual pienso que puede confundirse con un programa ordenado desde el núcleo. Se ha demostrado que al envejecer la concentración de ATP disminuye (35,58). Esto repercute en todos los procesos celulares ATP dependientes incluida la degradación proteica (4). Esta falta de ATP no se debe al envejecimiento de las mitocondrias, sino a la falta de ciertos metabolitos de procedencia citosólica. La causa de esta falta de metabolitos puede ser la disminución en la actividad de ciertos enzimas clave (33,A20,66), probablemente porque son degradadas demasiado rápidamente por las hidrolasas citosólicas ubiquitina-dependientes, o porque su actividad se encuentra reducida por el envejecimiento (66) o por aumento de acidez del citosol. Los protonóforos no afectarán a las mitocondrias por varias razones: Por la composición de su membrana los protonóforos son 10 veces menos efectivos en reducir el gradiente de pH de las mitocondrias que por ejemplo, el gradiente de una vesícula presináptica (79). El gradiente de pH está establecido entre niveles más altos de pH (7.1 el citosol y 7.6 la mitocondria) (77) lo que repercute en el grado de ionización y saturación del protonóforo (81) disminuyendo su efectividad (83 fig.8). Por último, la membrana mitocondrial es la única membrana en toda la célula que no está en contacto con las demás, (físicamente o por medio de intercambio de vesículas) pues sus componentes le llegan por difusión libre o por proteínas de transporte, de modo que una toxina poco soluble en agua sólo podría llegar a concentrarse en ellas en un tiempo muy largo, y esto no es posible, puesto que las mitocondrias se renuevan con rapidez. Se conoce un conjunto de enzimas llamados sistema MOS, cuya misión es marcar a determinadas proteínas oxidando ciertos restos de aminoácidos para que sean reconocidas por los sistemas de degradación (12,65). Además hay otros mecanismos de desnaturalización que ocurren espontáneamente y que afectan a cada proteína según su susceptibilidad y que dan cuenta de un tanto por ciento muy elevado de los defectos proteicos encontrados con la vejez: desaminación, oxidación, glicosilación, racemización y sobre todo cambios de conformación espacial (58,66,67,68). Por tanto no hace falta recurrir a la teoría de los radicales libres para explicar por qué aparecen tantas proteínas inactivas y oxidadas con la vejez celular (47, 58, 1). Otra consecuencia de la reducción de actividad lisosómica, y que también se observa en la vejez, es el aumento de la concentración de proteína total en el citosol (16,42,47), lo cual por si sólo ya reduce en gran medida la actividad de los enzimas catalíticos (42). Los materiales defectuosos indigeribles acumulados dentro de los lisosomas se van oxidando lentamente dando lugar a la lipofuscina (39). Los teóricos piensan que la muerte es un hecho imprescindible para que exista evolución, y por tanto para la supervivencia de la especie (51) (23). La evolución selecciona a los individuos que llegan en plenas facultades a la edad de reproducción. A partir de este punto lo que suceda afecta poco a la evolución (52). Se piensa que los animales gregarios como los primates, que viven muchos años después de la reproducción, han evolucionado así para poder defender a la progenie de los depredadores y de la competencia externa por el alimento (51). La acumulación de toxinas debe ser un hecho lento, que no afecta las capacidades del individuo hasta pasada la edad de reproducción. De no ser así el organismo habría desarrollado los mecanismos detoxificadores apropiados (según se deduce de la lectura de (52)). Esta idea está apoyada por el hecho de que la lipofuscina empieza a acumularse a partir de la madurez sexual en los mamíferos.(A19) Las toxinas protonóforas no sólo se pueden formar a partir de Adenina, Guanina y Citosina. Se conocen al menos 40 bases minoritarias, producidas por alquilación, sulfuración y por hidroxilación de las 4 bases mayoritarias, y que forman parte de los tARN del citosol y de las mitocondrias (37 pág. 318). Todos estos tARN acaban en los lisosomas (58), donde son hidrolizados liberando los nucleósidos correspondientes. Combinando las bases minoritarias calculo que se pueden formar unas 900 toxinas diferentes, muchas con estructura de protonóforos. Otro aspecto de las bases minoritarias es que si llegan al citosol, tanto ellas como sus productos de oxidación podrían ser incluidas en el ADN y causar problemas de mutaciones y/o de activación/inhibición genética. No siempre es beneficioso metabolizar rápidamente una toxina. Se ha estudiado el ejemplo del citocromo P448 que hidroxila en dos posiciones a ciertas moléculas aromáticas policíclicas. Los productos de oxidación son altamente mutagénicos y se ha comprobado que la concentración del P448 es menor en los animales más longevos, siendo inexistente en fibroblastos humanos (21). No es de extrañar que a la célula le puede ser más beneficioso almacenar algunos residuos en las membranas que dejarlos llegar al citosol. A este respecto es interesante que los hongos tienen un enzima lisosomal capaz de romper el enlace iminopropeno de la lipofuscina (71, pág.90). ¿Por qué no lo tienen los demás organismos? En resumen, estas toxinas habrán llegado a acumularse por tres razones: Porque actúan a muy baja concentración (0.01 uM). Porque no alcanzan una concentración perniciosa hasta bastante después de acabada la edad de reproducción, cuando los mecanismos de selección natural ya no actúan para desarrollar las correcciones adecuadas. Porque pueden tener un rol importante en el control cronológico del desarrollo y crecimiento. Porque para eliminar las toxinas más rápidamente de lo que se forman habría que aumentar su solubilidad por hidroxilación y conjugación. Esto haría que sus concentraciones en el citosol fueran peligrosamente altas, pues pueden tener efectos mutagénicos por ser compuestos derivados de bases del ADN y ARN. Aunque no existan estos hipotéticos protonóforos, es muy posible que sí se produzcan las reducciones de gradientes de pH, por todo lo dicho con anterioridad y porque prácticamente cualquier parámetro que se ha comparado entre células viejas y jóvenes varía con la edad (58). ORIGINALIDAD DE LA IDEA Ya en 1904 Metchnikoff propuso que el envejecimiento era causado por la acumulación de toxinas originadas en el intestino por determinada flora. Propuso como solución tomar mucho yogurt, cuyas bacterias lactófilas desplazarían a las bacterias perjudiciales (23). En 1914 Ribbert y Mullman (48) consideraron que con el tiempo, productos del metabolismo normal se podrían acumular en y entre los espacios celulares, y producir degeneración senil y atrofia. Indicaron que los órganos más sensibles Serían el cerebro y el corazón. Pero debido a la falta de conocimientos de la época, sólo tuvieron en cuenta la lipofuscina. En 1956 Korenchevsky (48) anunció su teoría de envejecimiento por acumulación de productos normales del metabolismo celular y de la putrefacción intestinal. Se basaba en experimentos de sobredosis de metabolitos normales (aminoácidos, ATP, Adenosina, Guanosina y sus metil y dimetil derivados, histamina, colina, acetilcolina, glutation, indol y escatol) en los que comprobó que producían efectos fisiológicos perjudiciales. Luego extrapoló y propuso que a dosis normales estos metabolitos tendrían efectos nocivos por el largo tiempo que han estado en contacto con las células (desde el nacimiento hasta la muerte). Yo supongo que en 1956 no se sabía que todos los metabolitos en exceso son perjudiciales: el agua, las sales, la glucosa, colesterol, amoníaco, urea, ácido úrico, oxígeno, vitaminas, etc. En 1974 Sheldrake (8) publicó su teoría de envejecimiento causada por intoxicación por sustancias producidas en la propia célula. Sheldrake propone que se pueden producir por efecto de los radicales libres sobre las membranas celulares y que se acumularían tanto en el citosol como en las membranas, y da una serie de razones bien fundamentadas que apoyan su teoría. Reiss y Rothstein (1974) proponen que el envejecimiento se podría deber a una acumulación de proteínas de conformación defectuosa a causa de la reducción de su "turnover" (66). Fred Dice publica en 1989 un artículo (1) en el que propone que la causa de que las células pierdan progresivamente la capacidad de dividirse sería por la probada reducción del ritmo de degradación de las proteínas en los lisosomas. Según el autor los lisosomas no pierden capacidad de digestión, puesto que parece haber demostrado que la velocidad de degradación de proteínas endocitadas no disminuye con la edad (54). Lo que si demuestra que disminuye es la capacidad de internalización de proteínas en los lisosomas. Concretamente estudia un mecanismo de transporte individual facilitado por una proteína, que en la senescencia prácticamente desaparece. Pero el autor parece no tener en cuenta que este mecanismo de internalización proteica es bastante raro, en el sentido de que sólo existe en los órganos menos importantes para el mantenimiento de la vida, (músculos esqueléticos, fibroblastos, piel, hígado y poco más ), sólo afecta a un 30 % de las proteínas citosólicas, cuando los lisosomas se encargan del 70-80 % de la proteólisis total (A15,A16,A17), y sobretodo, solamente se activa cuando la célula se ve sometida a ayuno prolongado, lo cual no es un caso frecuente ni general en la vida. Tampoco parece tener en cuenta lo que se conoce sobre la anatomía de los lisosomas al envejecer, ni que los fibroblastos son células que en la práctica no llegan a envejecer en el cuerpo humano, pues no les da tiempo (53). Por otra parte hay dudas razonables sobre si la senescencia de los fibroblastos son un modelo aceptable de envejecimiento celular. La causa primaria del hecho explicado por Dice habría que buscarla en modificaciones de la expresión genética que afectarían la funcionalidad de los lisosomas. En un artículo de Agosto de 1990 Medvedev clasifica la mayora de las teorías publicadas sobre el envejecimiento, que son más de 300 y entre ellas sólo las antes anunciadas tienen que ver con la mía (23). En un artículo sobre lisosomas y envejecimiento publicado en 1984 no se relaciona la reducción de la capacidad lisosómica con la acumulación de toxinas ni reducción de su acidez (27). Cabe decir que el autor de la revisión dice que la actividad lisosómica aumenta con la vejez celular. Con un dato tan equivocado es difícil pensar en los lisosomas como causa del envejecimiento. De Duve (7) considera que los lisosomas pueden ser la causa de la muerte celular por rotura de su membrana y posterior lisis por los enzimas liberados. Considera que el proceso desencadenante puede ser una orden genética o la acumulación de metales pesados. Todos los experimentos al respecto contradijeron su teoría. Algunos autores han propuesto que la reducción de la capacidad de los lisosomas se podría deber a la falta de enzimas lisosómicos o a la presencia de algún inhibidor enzimático (A6,58). En un interesante artículo Anderson y Orci proponen que el estudio en vivo del pH de diferentes partes de los sistemas acídicos de las células, permitiría descubrir la causa de algunas enfermedades (11). Según todo lo visto, la teoría que yo expongo tiene de original la propuesta que la reducción de actividad lisosómica y las perturbaciones en las otras funciones y compartimentos acídicos, podrían ser causados por la pérdida del gradiente de pH, debido a la presencia de protonóforos y que ésta sería la causa primaria del envejecimiento. DATOS EXPERIMENTALES QUE APOYAN LA TEORÍA Ciertos autores que trabajan en la teoría de los radicales libres subrayan que con la edad debe producirse algún deterioro en los mecanismos de renovación intracelulares (lisosomas) para explicar por qué los organismos jóvenes no acumulan productos de oxidación por radicales libres (45,44). Las proteínas inactivadas por otros mecanismos también se acumulan con la edad y se supone que la causa es un fallo en los lisosomas (58). Parece demostrado que la sobrecarga de los lisosomas es la causa de la acumulación de “cuerpos residuales”, que con el tiempo se convierten en lipofuscina debido a la falta de enzimas antioxidantes y a la acumulación de hierro dentro de los lisosomas (70). La sobrecarga de los lisosomas viejos no se debe a un aumento del "turnover" del material celular, pues este, por el contrario, disminuye. Tampoco se debe a la falta de enzimas, pues en general aumentan con la edad. La otra posibilidad que queda es la disminución de su acidez, lo cual reduce enormemente la capacidad hidrolítica de sus enzimas. Está comprobado que la reducción de acidez y, por tanto, de actividad hidrolítica en los lisosomas, provoca un aumento de proteasas tanto lisosomales (26,16) como citosólicas (16,47); mientras que la fosfatasa ácida no varía y las demás hidrolasas aumentan o disminuyen sin ningún orden concreto (16,47). Esto mismo es lo que se encuentra con la vejez celular (27, A3,A4, A8, A9,A10). Creo que la diferente susceptibilidad de las hidrolasas a la desnaturalización y degradación, en las condiciones internas de los lisosomas viejos, tiene mucho que ver con el aumento de actividad de una u otra enzima. También se sabe que no todos los enzimas llegan a los lisosomas por el mismo camino. Algunas lo hacen transportadas por vesículas que provienen del aparato de Gogi trans; y se ha demostrado que el envío de estos enzimas se altera por la acción de sustancias que alcalinizan los orgánulos ácidos. También se cree que los enzimas dirigidos a los lisosomas por el grupo manosa-6-fosfato ven perturbada su fijación a los receptores cuando el pH lisosomal aumenta. En enfermedades de carencias de algún enzima de lisosomas se observa un aumento de todos los demás enzimas. Probablemente haya algún mecanismo de retroalimentación que detecta la acumulación de residuos en los lisosomas ( 7, 16). La reducción de la acidez lisosomal mediante sustancias lisosomotrópicas reduce la capacidad de los autofagosomas para fusionarse con los lisosomas secundarios (20,9,17), siendo éste el principal medio de transporte de material citosólico a su lugar de degradación(4,14). Esto explicaría el aumento de vacuolas autofágicas en las células viejas (27, A6), hecho que está en contradicción con la conocida reducción de la actividad global de sus lisosomas (1,60,42,A6). También la reducción de la acidez lisosomal provoca la acumulación de productos residuales, los cuales, sino se restauran pronto las condiciones ideales, se transforman en sustancias no degradables de características muy semejantes a la lipofuscina (39), que es el pigmento lisosómico residual característico de la vejez (27,36,39,41,47). De momento tengo conocimiento de dos tipos de células en las que se ha detectado un pH intralisosomal anormalmente alto. Se trata de células con lisosomas hipertrofiados por sobrecarga (A14) y un tipo de fibroblastos de ratón transformados malignamente por virus (A21). En un artículo en el que parece que se usan lisosomas de células viejas (según se desprende de la sección "Materiales y métodos"), (19)se describe una relativamente alta permeabilidad de la membrana a los protones, así como un pH que sólo se debe al efecto Donnan; mientras que otros investigadores dan cuenta de la poca permeabilidad de los lisosomas respecto de los protones y que han de añadir protonóforos al medio para que el pH de los lisosomas quede reducido al causado por efecto Donnan (26). Las células pueden escapar de la senescencia si son capaces de proliferar (27,44). Esto yo lo explicaría por el efecto dilución de toxinas que implica el crecimiento y división celular. Las mitocondrias se renuevan a una velocidad independiente de la edad de la célula (60,22,30), mientras que se observa que al envejecer el número de mitocondrias que están en proceso de degradación está aumentado (lo deduzco de 55). Esto sólo se puede explicar considerando que la capacidad de captación de mitocondrias por los lisosomas no cambia con la edad, mientras que la capacidad de digestión está disminuida. Por otra parte hay evidencias de que un camino alternativo para degradar las mitocondrias es mediante su fusión directa con lisosomas primarios, los cuales se cree que son diferentes a los que se fusionan con los lisosomas secundarios (55). Se sabe que la concentración de ATP disminuye en la vejez (58,35), y que el proceso de digestión lisosómica es muy dependiente del nivel de ATP, sobretodo la auto fagocitosis y en menor medida el pH intralisosomal (4,17). La disminución de capacidad hidrolítica de los lisosomas podría deberse a esta reducción de ATP, pero los experimentos demuestran que lo que más se reduciría sería el número de vacuolas autofágicas (4) y por tanto no le llegaría material a los lisosomas para ser digerido, mientras que la observación al microscopio muestra un aumento de vacuolas autofágicas y de material en proceso de digestión (55). Por tanto, la falta de ATP no es lo que limita la digestión de material en los lisosomas. Otra cosa que tienen en común la senescencia celular y la reducción de actividad lisosómica es que la concentración de proteínas citosólicas aumenta mucho, hasta un 40% en las células viejas (16,42). Hay algunas enfermedades genéticas en las que se halla ausente un sólo enzima lisosómico y cuyas consecuencias son catastróficas: disminuciones físicas y mentales y muerte prematura (47). En la Progeria y el síndrome de Werner (síndromes de envejecimiento precoz) hay una gran proporción de proteínas desnaturalizadas por falta de renovación (58,65), aunque en estos casos se cree que la causa podría ser la falta de Catepsina B (58), yo pienso que también se podría deber a un defecto genético en los mecanismos de mantenimiento de gradientes de pH (léase bombas de protones). Parece que crecer conlleva no envejecer. No hay síntomas de envejecimiento mientras se crece. Peces y reptiles que crecen indefinidamente alcanzan edades extraordinarias (51). Una explicación, como he comentado antes, sería la dilución de toxinas por crecimiento. Las células de hígado, riñones y piel, entre otras, tienen una gran capacidad de proliferación, pero no se dividen si no es necesario. A medida que el órgano envejece sus células pierden esa capacidad (51). No pueden alcanzar su potencial innato de duplicaciones. Esto se puede explicar por las toxinas que acumulan, asimiladas del medio exterior junto a las LDL y a complejos proteína-toxina, las cuales interferirían en el proceso de alcalinización necesario para la replicación del ADN. La administración de venenos, drogas y toxinas en pequeñas dosis prolonga la vida de animales de experimentación (51). Esto puede tener relación con la inducción de enzimas detoxificadores provocada por substancias extrañas a la célula. Estos mismos enzimas tendrían capacidad para eliminar toxinas endógenas. La inhibición de proteasas sensibles a la leupeptina produce efectos semejantes a la vejez en ratas. La reducción en el gradiente de pH lisosomal reduce la permeabilidad de su membrana a ciertas moléculas producidas durante la hidrólisis intralisosomal (69). Esto explicara en parte por qué se inflan los lisosomas con la vejez. Es bien conocida la pérdida de capacidad mental y de los sentidos al envejecer, que se explicaría por la reducción de la concentración de neurotransmisores dentro de las vesículas presinápticas, situación que puede ser causada por protonóforos. Se sabe que la mayoría de hormonas sufren cambios de concentración al envejecer y las que mantienen unos niveles normales son incapaces de actuar adecuadamente frente a los aumentos de demanda (insulina, ACTH, cortisol y adrenalina ) (102, 50 Vol.20 Pág.437). Se ha comprobado que los receptores de membrana para el factor de crecimiento epitelial EGF y para las LDL disminuyen mucho con la edad. Este hecho se puede explicar por un defecto en la distribución por el aparato de Golgi y en el gran aumento del volumen de los endosomas. Esto se puede provocar artificialmente por disipadores de gradientes de pH (como los ionóforos). Es interesante el caso de la albúmina, cuya concentración en sangre disminuye al envejecer. Su síntesis se encuentra reducida a nivel de traducción del mRNA por un mecanismo desconocido. Los niveles citoplasmáticos de mRNA son más altos de lo normal y su traducción se produce adecuadamente en lisados de reticulocitos, pero no en la célula intacta (49 Pág.78). Yo creo que el punto del bloqueo puede estar entre el aparato de Golgi y las vesículas de secreción (89), donde se produce la maduración de la proalbúmina y el empaquetamiento para su secreción. Estos dos procesos finales son muy dependientes del pH. También puede influir el pH y las concentraciones de K+ y Na+ a ambos lados del retículo endoplasmático, que según la teoría varían al envejecer. En neuronas de organismos viejos se encuentra una concentración de K+ que es un 30-40% más elevada que en los mismos organismos jóvenes, a la vez que la permeabilidad de la membrana para el mismo catión también se reduce en un 40 % (42). En condiciones normales la permeabilidad pasiva de la membrana de las neuronas es muy elevada para el K+, de modo que hay equilibrio entre el interior y exterior. Pero según mi teoría, el pH del citoplasma disminuye con la edad, y se sabe que la permeabilidad de la membrana al K+ y al Na+ se reduce mucho al disminuir el pH citosólico (77 pág. 408). La relación es sigmoidal y con puntos de inflexión en 6.9 y 6.6 respectivamente. Por otra parte si el pH interno de las neuronas disminuye respecto al valor ideal, el cotransporte de Na+/H+ se activa, el influjo de Na+ se acoplar a la bomba de 3Na+/2K+ y el resultado final será que el aumento de permeabilidad a los protones puede producir la elevada concentración de K+ intracelular. En muchas células la permeabilidad del H+ es 1000 veces mayor que para K+, mientras que la concentración de K+ intracelular es de 140 mM y la de H+ extracelular es de 4x10-8. De aquí se deduce que la capacidad de flujo para un mismo gradiente es 3.500 veces mayor para el K+ que para el H+. Esta deducción es para demostrar que en condiciones normales el influjo pasivo de H+ no puede provocar una acumulación intracelular de K+. Pero la situación cambia si se reduce la permeabilidad a los K+ y a la vez se aumenta para los protones, puesto que no se conoce ningún mecanismo que permita la fuga de un exceso de K+, excepto la difusión pasiva, de modo que se comprueba que cuando la bomba de Na+/K+ se activa, se acumula K+ (78 pág. 421). Se ha comprobado que el problema principal de los músculos del corazón al envejecer se debe al retículo sarcoplasmático que le impide secretar y recaptar Ca++ a la velocidad normal (35). Teniendo en cuenta el efecto de una reducción del pH sobre la permeabilidad de la membrana a los cationes, sobre la concentración de Ca++ libre, sobre la distribución de cationes en los diferentes espacios celulares y sobre la actividad enzimática, no es de extrañar que haya problemas con el tráfico de Ca++ a través de la membrana del sarcoplasma. El autor del artículo cree que el problema tiene que ver con la Na+/K+ ATPasa. La excitabilidad del músculo por las catecolaminas disminuye con la edad. Por otra parte, la descarga de Ca++ por el sarcoplasma ante un mismo estímulo es menor en organismos viejos (35). La concentración de catecolaminas en el músculo cardíaco se reduce al envejecer. Ello se debe tanto a la menor síntesis como a la menor reabsorción en las terminaciones nerviosas (35). La duración del potencial de acción es mayor en la vejez, tanto para la despolarización como para la repolarización, lo que probablemente sea causado por la mayor lentitud en descargar y readsorber el Ca++ (35). Hay que tener en cuenta que la Ca++/ATPasa, que bombea protones al retículo sarcoplasmático, puede ser muy sensible al cambio de pH del citoplasma, tal como ocurre con la ATPasa miofibrilar (77). Con la edad también disminuye la actividad de la ATPasa miofibrilar (35). El envejecimiento y la hipertrofia muscular se producen de igual forma aunque el corazón no produzca trabajo. Un corazón de ratón trasplantado al abdomen de otro ratón, a los 24 meses presenta los mismos síntomas de vejez que si hubiera estado bombeando sangre toda la vida (35). Los anteriores datos no sólo son teóricos, ya que se ha comprobado el efecto que la acidosis produce sobre las características de los músculos (77), habiendo una asombrosa coincidencia con la vejez (35). Por ejemplo se ha comprobado que: la máxima tensión muscular para una determinada concentración de Ca++ disminuye al disminuir el pH; para el corazón, una ligera disminución de pH produce insensibilización de los miofilamentos al Ca++ y la descarga de Ca++ por el retículo sarcoplasmático se hace más lenta; y que la actividad ATPasa miofibrilar decrece con el pH (77). ALGUNOS DATOS QUE TIENEN RELACION CON LA TEORIA Según Fred Dice (1) la capacidad hidrolítica de los lisosomas no disminuye con la edad, y se basa en las siguientes referencias: Lee(1982) (en ninguna parte del artículo se afirma que la capacidad de los lisosomas permanece constante con la edad); Philips and Cristofalo (1987) en el que sólo se dice que el factor de crecimiento GFE es metabolizado por la célula sin dificultades en la vejez (según otro trabajo de 1982). En una publicación en colaboración con Gurley (1988) (54), Dice demuestra que la capacidad proteolítica de los lisosomas de los fibroblastos permanece constante con “el pasaje” (número de divisiones acumuladas por las células), considerándose células senescentes las que llevan efectuadas unas 50 divisiones. En mi opinión esto no es aplicable a las células postmitóticas por dos razones. En primer lugar los fibroblastos de donantes de más de 90 años todavía tienen la capacidad de dividirse unas 30 veces sobre un total de más de 50, por lo que sus fibroblastos aún son jóvenes (53). Así que los síntomas de vejez hay que estudiarlos en células postmitóticas (Martin 1970) (36). En segundo lugar se ha comprobado que los fibroblastos sufren un aumento de la proteólisis celular en los últimos pasajes (A5), exactamente lo contrario que ocurre en las células no divisibles. En un experimento sobre la proporción de una proteína que se encuentra desnaturalizada en relación con la edad del donante, las muestras de fibroblastos difieren poco con la edad, mientras que para el resto de tejidos examinados se pasa de valores de 0 % de defectos a 51.8 % (58). Esto lo interpreto como una prueba de que los fibroblastos de un donante joven y de uno viejo difieren poco. Además el envejecimiento en placa de cultivo no se puede equiparar al sufrido en vivo (53), por la sencilla razón que en vivo los fibroblastos humanos se dividen unas 20 veces en 90 años, mientras que en laboratorio se consuman las 50 divisiones posibles en un tiempo que supongo (no he encontrado ninguna publicación que lo indique) que no superará los dos años. En este sentido es remarcable el hecho de que el nivel de oxidación de las proteínas es independiente del número de divisiones celulares, mientras que los niveles de oxidación en células de donantes viejos y de enfermos de Progeria son más elevados que en jóvenes sanos (65). Aunque hubiera estudios que demostraran que el sistema ligando/receptor no se ve afectado con la senescencia celular, esto no descartaría un descenso de la máxima acidez lisosomal, ya que se ha comprobado que los ligandos no llegan a los lisosomas más ácidos, sino que se quedan en los endosomas que tienen pH intermedios (31). Es bien conocido el efecto de los corticoides sobre la actividad lisosómica y que éstas hormonas tienen un ciclo circadiano con notables oscilaciones (62 pág. 1124). Es posible que los estudios que se hacen sobre los lisosomas y el catabolismo proteico no lo tengan en cuenta y, por tanto, puede alterar los resultados obtenidos con cultivos celulares, con órganos y con animales. Cuando se hacen extractos con disolventes orgánicos de células viejas enteras, se obtiene un par de bandas de color azul que no aparecen en los extractos de los gránulos de lipofuscina de las mismas células (40). Ya que son pigmentos lipófilos y no se encuentran en la lipofuscina, deben estar disueltos en las membranas de la célula. Estas bandas no siempre aparecen, por lo que el autor piensa que debe tratarse de metabolitos de medicamentos tomados durante la vida del donante (40). Lo que está claro es que las células no siempre pueden metabolizar las toxinas, pero también podemos pensar que el autor no efectuaba las extracciones en unas condiciones suficientemente reproducibles. Los mismos investigadores de la lipofuscina se quejan de que los datos que aporta cada autor no son lo coherentes que sería de esperar (71). En vista de los heterogéneos resultados que se han obtenido en los extractos de órganos enteros, en comparación con los extractos de gránulos de lipofuscina aislados, se cree que algunos de los pigmentos obtenidos pueden proceder de las membranas de los orgánulos celulares (71, pag.207). El autor trabajó con cromatografías sobre placa (TLC). Pienso que el mismo experimento usando HPLC daría resultados más precisos e interesantes. Varios autores proponen que los lisosomas deben tener un rol importante en la teoría de los radicales libres, puesto que es donde se degradan la mayor parte de los componentes celulares antes de ser regenerados (44,45,70). Un fallo en los lisosomas explicara porqué los individuos jóvenes no acumulan lipofuscina a pesar de que tienen un mayor consumo específico de oxígeno (42). Los invertebrados que viven pocos días también pierden capacidad de renovación de estructuras celulares (turnover). En este caso se encuentra que la concentración de enzimas proteolíticos disminuye hasta la décima parte en algunos casos (A12). Esto es lo contrario de lo que ocurre en los mamíferos, donde la concentración de enzimas proteolíticos aumenta varias veces (27,A8,A10,A3,A4), mientras que la actividad proteolítica disminuye a la mitad aproximadamente (1). En ningún lugar he encontrado explicación a esta paradoja. Si los lisosomas de organismos viejos estuvieran vacíos (A6,A9,A11) se podría pensar que hay un impedimento en la fusión lisosoma-endosoma. Si hubiera pocos autofagosomas se pensaría en ellos como la causa de la reducción de degradación proteica. Pero al contrario, se observa un aumento con la edad. Por tanto, queda la posibilidad que los lisosomas estén inhibidos. Parece que no toda las personas tienen la misma capacidad de metabolizar sustancias extrañas al organismo, puesto que el conjunto de citocromos P450 vara mucho entre individuos (A18). Pero hay que considerar que lo que yo propongo son toxinas endógenas, no exógenas. El producto antienvejecimiento ASLAVITAL ejerce un efecto positivo sobre la capacidad proteolítica de los lisosomas, dejándola aumentada por un período de varios meses después de la administración del tratamiento (A13). ASLAVITAL contiene procaína, la cual es un anestésico que posee efecto lisosomotrópico, por lo que produce una alcalinización del citoplasma (78) y de los lisosomas (la procaína atraviesa la membrana celular en forma neutra, y una vez dentro se une a un protón, por lo que alcaliniza el citosol). Como consecuencia de la alcalinización se debería producir un aumento de la actividad celular (77), con incremento de síntesis proteica y de ADN, entre otros (78). También se puede esperar un aumento de la concentración general de hidrolasas lisosomales, pues es uno de los efectos secundarios de la inhibición de la actividad de los lisosomas. Las citocininas son unas hormonas vegetales que promueven el crecimiento y la división celular (50 Vol.14 pag.917). Son derivados por alquilación de la adenina y también se encuentran como bases minoritarias en los tRNAs de las células de diferente procedencia, incluidos los animales, (63,37 pag.318). Se conocían más de 40 de estas bases a mediados de los años 70 (37 pág. 318) y hoy día todavía se siguen descubriendo de nuevas (A1). Estas bases podrían afectar la actividad de las células animales. Apoyan esta hipótesis el hecho que la 3-metiladenina sea un potente inhibidor de la autofagia (4) y que las metilxantinas (25) (cafeína, teobromina y teofilina) activan la fusión de los lisosomas con las vacuolas autofágicas. Se han detectado en la orina productos de oxidación de bases como el hidroximetiluracilo (38), el cual es una base minoritaria de los tRNAs (37 pág. 318). En el ratón se encuentran en su orina de 10 a 15 veces más bases oxidadas que en el hombre (38). Esto puede indicar que hay mucha más oxidación de los ácidos nucleicos por radicales libres, pero también puede que se deba al metabolismo mucho más acelerado de los tRNAs, por lo que la acumulación y/o excreción de bases minoritarias debe ser mayor. La investigación de la acumulación de bases minoritarias en las células sería un buen tema de estudio, junto a la acumulación de productos de condensación de bases normales, pero es importante tener en cuenta que la permeabilidad de la membrana lisosomal a las bases y a sus nucleósidos es muy elevada,(59,64) por lo que no hay posibilidad de que se acumulen como tales en los lisosomas. Uno de los hechos más intrigantes es el conjunto de pruebas que indican que todos los organismos tienen asignada una cantidad de calorías a consumir desde el momento del nacimiento y que marcan el límite de su longevidad (36,51). El experimento más sobresaliente es el de aumentar al doble la longevidad por la restricción del alimento (36,44). La teoría de los radicales libres argumenta con lógica que el consumo de calorías es paralelo al consumo de oxígeno, y que la producción de radicales libres y otros oxidantes es proporcional a su consumo. Otra explicación que propongo es que el consumo de oxígeno va asociado a la oxidación de las mitocondrias y demás material celular. Cuanto más rápido se consuma el oxígeno más rápido deberán renovarse las mitocondrias y por tanto antes se llegan a acumular las bases que pueden ser tóxicas o que por oxidación producen los protonóforos. El aumento de colesterol en la sangre es progresivo con la edad. Se cree que se debe a la reducción del número de receptores celulares para las LDL (53). Esto se puede explicar según la teoría de los protonóforos. Si se reduce la acidez intralisosomal, los LDL tendrán dificultades para separarse de sus receptores, no podrían ser completamente reciclados (88), y se acumularán en los endosomas o serán degradados (56,15,31,32,11). La conocida intolerancia a la glucosa por los ancianos también puede explicarse. Se ha demostrado que la proinsulina necesita de un procesamiento con proteasas que actúan a pH ácido dentro de las vesículas secretoras. También la cristalización y la exocitosis se cree que necesitan de un medio ácido adecuado para poder llevarse a cabo (74). Además, a los receptores celulares de Insulina les puede ocurrir lo mismo que a los receptores de LDL. Los osteoclastos necesitan secretar ácido junto a las proteasas para disolver el hueso. El pH que podrán conseguir en su medio externo puede verse afectado por la presencia de protonóforos. Simultáneamente los osteoblastos (que se encargan de regenerar el hueso) seguramente empaquetan las proteínas a secretar en vesículas ácidas, del mismo modo que se hace con la insulina, la fibronectina (74), la albúmina, el colágeno, etc. Con la edad también se pierde capacidad para secretar ácido Clorhídrico por el estómago (50 Vol.20 pg.437) CONOCIMIENTOS QUE SON NECESARIOS PARA CONFIRMAR LA TEORIA Para comprobar o descartar esta teoría sólo hacen falta tres cosas. Que al envejecer: Los gradientes de pH celulares se reducen. Las membranas aumentan su permeabilidad a los protones. Se acumulan toxinas protonóforas. La metodología para medir el pH de cualquier orgánulo celular en vivo es relativamente compleja y basada en técnicas que combinan tratamientos con bases lisosomotrópicas, fijación, anticuerpos contra esas bases y recuento por microscopía electrónica (11,26). Este método tiene la ventaja de permitirnos conocer el pH de cada orgánulo individual. Esto es positivo en el sentido de que el pH varía no sólo entre diferentes células de un mismo organismo, sino también en una misma célula según su estado de actividad y según el compartimento estudiado (69,11). El método más usado y exacto hace uso de bases lisosomotrópicas marcadas con Carbono 14,( cloroquina 1 uM o metilamina 10 uM ): lisosomas aislados y libres de otros orgánulos se ponen en contacto con una disolución de la base, luego se centrifuga o filtra y se compara la radiactividad de los lisosomas con la del medio remanente. Mediante glucosa y sacarosa marcadas isotópicamente se determina la relación volumétrica entre los lisosomas y el medio. Con estos datos y una fórmula matemática se deduce el pH intralisosomal. En (31) hay bibliografía sobre esta metodología. Un método muy ingenioso, que da resultados muy exactos y que no requiere una gran pureza en los preparados de lisosomas es el método de Ohkuma (73). Este se basa en el uso de fluoresceína isotiocianato unida a moléculas de dextrano (FITCdex), que penetra en los lisosomas por endocitosis después de inyectarlo al animal de experimentación. En los lisosomas aislados se mide la fluorescencia a determinadas longitudes de onda y por medio de unas tablas de deduce el pH. En METODOLOGIA resumo este método. También propongo métodos para comprobar la permeabilidad de las membranas lisosomales y citoplasmáticas con la edad y si ésta se debe a la acumulación de transportadores de protones (protonóforos). En caso de comprobar afirmativamente que los lisosomas de animales viejos tienen un pH menso ácido que los de los jóvenes, y que existen protonóforos, se procedería a su aislamiento y caracterización. Teniendo en cuenta que estos protonóforos se concentrarán en los tejidos grasos, sería fácil conseguir una cantidad suficiente de ellos para su estudio. También se puede determinar fácilmente si el pH citoplasmático de las células viejas es más ácido que en las células jóvenes, lo cual, según la teoría, puede ocurrir. El estudio de los pigmentos en células viejas es una práctica que se lleva a cabo desde hace tiempo, pero se centra en la lipofuscina y otros pigmentos que se encuentran en grandes cantidades, y la metodología no está estandarizada (71). Yo propongo el estudio sistemático de la acumulación de pigmentos mediante la extracción de diferentes órganos (depósitos de grasa, cerebro, hígado y corazón) con varios disolventes, su posterior separación por cromatografía liquida, y comparación de los resultados obtenidos con animales de diferente edad. Al mismo tiempo se experimentaría el tratamiento de nucleosidos y bases con diversos medios oxidantes. Los productos obtenidos se usarían como patrones internos en las cromatografías de extractos de órganos. Hay que tener en cuenta que los protonóforos pueden tener efecto sobre el pH a concentraciones de sólo 0,01 uM para el inonóforo S13 a pH externo 7,4 y a 25ºC en vesículas de acetilcolina (79). El trabajo se podría continuar con la resolución de la fórmula de las sustancias obtenidas y la comprobación de sus efectos fisiológicos sobre animales de experimentación y sobre células. METODOLOGIA En este apartado voy a exponer una idea aproximada de la experimentación que propongo para comprobar las hipótesis de la teoría. a) Medida del pH interno de los lisosomas Hay varias maneras de introducir un colorante sensible al pH en el interior de los lisosomas. Algunas son muy simples, pero tienen sus inconvenientes (73). Según el método de ohkuma (80,73) se inyectara FITC-dextrano comercial a ratas (20 mg/150 gr peso corporal). A las 12-24 horas se sacrifican y se les extrae el hígado y/o riñones, de los cuales se aislarán y purificarán los lisosomas por gradiente de Percoll, siguiendo un procedimiento estándar. En este momento tenemos lisosomas cargados con un colorante cuya fluorescencia varía con el pH. Ponemos la suspensión en un espectrógrafo de fluorescencia, usando las frecuencias 450 y 495 nm para excitación y 519 nm para emisión. El cociente de los valores de excitación permite deducir el pH (usando una gráfica), de una forma independiente de la concentración de colorante o de cualquier otra variable. Debido a que siempre aparece una pequeña cantidad de colorante en el exterior de los lisosomas hay que aplicar una sencilla corrección. Para ello sólo hay que provocar un cambio rápido de pH en el medio. El cambio de excitación a 495 nm nos permitir calcular la fluorescencia total del medio externo. Luego, para calcular el verdadero pH de los lisosomas, sencillamente hay que restar la fluorescencia externa de la interna. Para saber la contribución del efecto Donnan y de la bomba de protones en el pH interno de los lisosomas, procederemos como sigue: primero enfriaremos la suspensión de lisosomas a 0ºC durante 1 hora en un medio osmóticamente parecido al citoplasma (150 mM KCl y 150 mM sacarosa). A esta temperatura la membrana es permeable a los protones, por lo que se establecerá un gradiente de pH debido al efecto Donnan. Seguidamente calentaremos a 37ºC y tomaremos los datos de excitación a 495 y 450 nm. A continuación añadiremos MgCl2 1 mM y ATP 1 mM, por lo que empezará a actuar la bomba de protones. Registraremos el cambio de fluorescencia a 495 nm hasta que se estabilice, momento en que también mediremos la fluorescencia a 450 nm. A continuación provocaremos el cambio de pH en el medio externo que nos permitir corregir los datos; restituimos el pH inicial e inhibimos la H+/ATPasa con NEM 1mM, registrando el cambio de fluorescencia que se produce por la lenta difusión de protones. Los lisosomas viejos son de mayor tamaño que los jóvenes, por lo que a una misma densidad de flujo de protones a través de la membrana le corresponderá un menor cambio de pH. También el efecto tampón puede ser diferente. Para saber como afecta un flujo de protones determinado al pH de los lisosomas, efectuaremos el siguiente experimento. A una suspensión de lisosomas le añadimos una determinada concentración de protonóforo. Dejamos un tiempo para que se equilibren el exterior con el interior. Añadimos un tampón que cambie el pH aproximadamente en una unidad y con el espectrógrafo medimos el tiempo que tarda en llegar a un nuevo equilibrio. Este tiempo será directamente proporcional al tamaño de los lisosomas y a su capacidad tampón, puesto que la densidad de flujo será siempre la misma, pues trabajaremos con una concentración de protonóforo y un gradiente inicial de pH iguales en cada experimento. Efectuaremos los experimentos con animales jóvenes y con viejos. Con los datos obtenidos podremos comparar la contribución del efecto Donnan y de la bomba de protones al pH intralisosomal en función de la edad. De las gráficas de aumento y disminución de pH por H+/ATPasa y por difusión, rectificados con los datos del experimento con protonóforo, podremos saber la capacidad de la bomba de protones y la permeabilidad de la membrana en relación con la edad. b) Medida pH intracelular a diferente edad El método más sencillo pero menos exacto de medida del pH intracelular es midiendo con un pHmetro el homogeneizado de un órgano (77). Para ello introducimos el órgano recién extraído en unos 100 volúmenes de agua con hielo y lo homogeneizamos. El error de pH por dilución es despreciable a pH cercano a 7, puesto que las células tienen un poder de tampón superior a 25 mM por unidad de pH. Para nuestro propósito no interesan los valores exactos, sino los valores relativos entre un órgano viejo y uno joven, para ello supondremos que si repetimos el experimento siempre de la misma forma los errores serán los mismos y se anularán al hacer la diferencia. Una diferencia de pH entre órganos jóvenes y viejos, de 0.1 unidades justificará el experimento. (Los instrumentos normales de laboratorio miden variaciones de 0.01 unidades). c) Permeabilidad de la membrana y presencia de protonóforos. Experimento A: Un órgano fresco se introduce en una solución tamponada a pH 5 durante varias horas. Se lava y homogeneiza. Se mide el pH. El pH será proporcional a las reacciones metabólicas que se hayan producido y a la difusión de los protones a través de la membrana celular. Comparando los valores obtenidos en las mismas condiciones para órganos viejos y para jóvenes, tendremos una idea de si varía la permeabilidad de la membrana con la edad. Yo estimo que la permeabilidad de la membrana a los protones al envejecer debe aumentar del orden de 1000 veces para que se produzcan efectos fisiológicos significativos, podemos pensar que el resultado experimento no se verá influido por los errores que puedan inducir otras variables en las propiedades fisicoquímicas de los órganos. Experimento B: Se disuelven membranas en un disolvente apropiado (cloroformo, hexano,..). Se le añade Nonactina la cual interactúa poco con los protonóforos (81). Se deposita una gota en el poro de una cámara de medición de permeabilidad (un recipiente con un tabique de teflón que separa dos cámaras. (El tabique tiene un poro de 1 mm2), se deja evaporar el disolvente y se llena de solución de KCl 150 mM. El K+ con la nonactina eliminarán los potenciales eléctricos. Una de las cubetas se lleva a pH 9 (A) y la otra a pH 5 (B). El cambio de pH que mediremos en A ser proporcional al flujo de protones a través de la membrana que hemos colocado en el poro, mientras que el pH de B será constante, ya que la concentración de protones en B es 104 veces mayor. Al ser el pH de A tan alto, un mínimo flujo de protones a través de la membrana provocará un notable cambio de pH. Repitiendo el experimento y comparando la permeabilidad a los protones de membranas de lisosomas jóvenes y viejos podremos saber si se acumulan protonóforos con la edad. Para confirmar la existencia de protonóforos se pueden hacer experimentos a diferentes pHs de B, para averiguar si el transportador se satura. Esta es la prueba para distinguir entre la difusión simple y el transporte facilitado (37 pag.794,62 pag.51,76). El transporte facilitado obedece las leyes de Mikaelis Menten de reacciones enzima-sustrato. También se puede medir la conductividad eléctrica de la membrana a diferente pH y comprobar si los datos siguen las leyes del transportador simple. Se han hecho estudios sobre sobre el tema. Debe tenerse en cuenta que las membranas reconstituidas a partir de disoluciones, contienen pequeñas cantidades de disolvente que afectan enormemente la permeabilidad provocada por protonóforos (de 10 a 100 veces) (81). Experimento C: Los protonóforos endógenos que propongo, por su estructura de múltiples enlaces dobles conjugados, y por su parecido con la fluoresceína, deben tener unas buenas cualidades para ser detectados por espectroscopia de fluorescencia, la cual es muy apropiada por su altísima resolución (una parte en mil millones). La misma Adenina y Guanina poseen fluorescencia. Mucha más tendrá sus derivados con enlaces dobles conjugados. Como los protonóforos son ácidos débiles, su fluorescencia aumentar con el pH y su pico máximo se desplazará al rojo. Si detectamos estos cambios al jugar con el pH de los homogeneizados de órganos de animales jóvenes y de viejos, tendríamos un indicio de la presencia de protonóforos antes de efectuar los experimentos más complejos. c) Extracción de protonóforos. Se tratara de extraer diversos órganos de ratones viejos con disolventes orgánicos y purificar las substancias pigmentadas, separándolas en sus componentes. Se repetiría el experimento con animales jóvenes. Comparando los resultados sabríamos si se acumula algún tipo de pigmento con la edad. De ser así, se estudiarían las propiedades protonóforas de estos pigmentos. UTILIDAD DE LOS RESULTADOS Si el resultado de la experimentación demuestra que los gradientes de pH se reducen con la edad, tendríamos una explicación a muchos de los problemas que acompañan al envejecimiento, y una vez conocidas las causas, se pueden buscar las soluciones. Si la causa es la presencia de protonóforos se podría: Probar sustancias que estimulen respuestas detoxificadoras de citocromos P450 específicos que eliminen esos protonóforos. Implantar resinas para absorberlos. Otras medidas independientes de la causa de la reducción de los gradientes de pH podrían ser: Probar drogas que activen los mecanismos celulares propios de regulación de pH. Por ejemplo el ácido Indolacético aumenta la actividad de H+/ATPasas de la membrana celular en los vegetales. Sintetizar sustancias que por efecto lisosomotrópico o por efecto Donnan produzcan variaciones en el pH de orgánulos y del citoplasma, de tal manera que sus funciones se recuperen. Por ejemplo, los ésteres fosfóricos traspasarían las membranas celulares entrando en los lisosomas, donde serían hidrolizados, liberando ácido fosfórico que aumentaría la acidez. Lo mismo se conseguiría con anhídridos de ácidos. Para aumentar el pH citoplasmático se podrían utilizar bases lisosomotrópicas (procaína, cloroquina). Lo ideal sería una base con carga positiva permanente, que se acumulara por la fuerza del potencial eléctrico negativo del interior celular, de este modo no afectaría a los orgánulos ácidos, los cuales por ser eléctricamente positivos repelerán a tales bases. Con referencia a la actividad de los lisosomas es interesante el estudio llevado a cabo en Valencia, mediante liposomas se ha conseguido introducir proteasas lisosomales de células de ratón en lisosomas de células humanas en cultivo, logrando un notable incremento de la actividad de los lisosomas (2). Sea cual sea la causa de la reducción de gradientes de pH, se abre una puerta al estudio de tratamientos que pueden aliviar algunos los problemas de la vejez. Teniendo en cuenta que el pH óptimo para la actividad metabólica es próximo a 8, cualquier aumento de pH citoplasmático puede ser positivo para las funciones celulares. El resultado debe ser un aumento de la energía disponible y del bien estar general, tanto en ancianos como en jóvenes. BIBLIOGRAFIA 1) Altered intracellular protein degradation in aging: a possible cause of proliferative arrest. Fred Dice Experimental gerontology. Vol. 24, 451459; 1989 2) Endocytosis of Liposomes containing Lisosomal proteins increases intracellular protein degradation y growing L132 Cells. José Luis Vargas, Erwin Knech y Santiago Grisola European Journal Biochem. 188, pag. 99109; 1990 3) Dynamics of membrane Lipid metabolism and turnover E.A. Dawidiwicz Annu. Rev. Biochem. 56, pag. 4361 ;1987 4) Energy dependence of different steps in the autiphagic lisosomal pathway. Peter J.A.M. Plomp, Paul B. Gordon, Alfred Meijer, etc. The J. of Biol. Chem. ;264 ,66996704 (1989). 5) Intracellular proteases Judith S. Bond and P. Elaine Butler Ann. Rev. Biochem. 56 pag. 333364 7) Lysosomes revisited Christian de Duve Eurp. J. Biochem. 137, 391397, 1983 8) The aging, growth and death of cells. A. R. Sheldrake Nature Vol 250 381385, 1974 9) Comparison of different autophagic vacuoles with regard to ultraestructure, enzimatic composition and degradation capacity. Formation of crinosomes. Hans Glauman and Jeanne Ahlberg Experimental and molecular pathology 47, 346362, 1987 11) A view of acidic intracellular compartments Richard G.W. Anderson and Lelio Orci The J. of Cell Biology 106 539543, 1988 12) Oxidation of proteins by mixed function oxidation systems: Implication in protein turnover, aging and neutrophil function. E.R. stadtman TIBS; 11, Enero 1986. Pag. 1112. 13) Proteolysis in isolated autophagyc vacuoles from rat liver Jeanne Ahlberg, Frederik Henell and Hans Glauman. Experimental Cell research 142, 373383, 1982 14)Hepatic autophagy and intracellular ATP Schellens at all. Experimental Cell Research 177, 103108, 1988 15) Macrophage endosomes contain proteases witch degrade endocytosed protein ligands. Stephanie Diment and Philippe Stahl The j. of Biological Chemistry Vol. 260, 1531115317, (1985) 16) Degradation of intracellular proteins in muscle. Lysosomal response to modified proteins and cloroquine. Kenneth W. Gerard, Alan R. Hipkiss and Donald L. Schneider The j. of Biological Chemistry; 263,1888618890, (1988). 17) Energy dependence of autophagyc protein degradation in isolated rat hepatocytes Peter J.A.M. Plomp and al. Europ. J. of Bioch.;164, pag 197203 (1987) 18) The Lysosomal proton pump P. Harikuma and John P. Reeves New insigt into Cell and Membrane. Transport processes. Ed. George Poste and Stanley T. Crook. 19) The Lysosomal proton pump is electrogenic Padmanabhakurup Harikuma and John P. Reeves The J. of Biolog. Chemis. Vol 258 1040310410 (1983) 20) Accumulation of autophagosomes after inhibition of hepatocytic protein degradation by Vinblastine, Leupeptin or alisosomotropic amine. Attila L. Kovacs, Albreicht Reith and Peter O. Seglen Experimental cell research 137, 191201,(1982) 21) Inverse correlation between species life span and specific Cytochrome P488 contend of cultured fibroblasts. Laura L. Pashko and Arthur G. Schwartz Journal of Gerontology Vol 37 No 1 3841 (1982) 22) The turnover of mitochondria in a variety of tissues of young, adult and aged rats. Robert A. Menzies and phillip H. Gold The J. of Biolog. Chem. Vol 246 No 8, 24252429, (1971) 23) An attempt at a rational classification of theories of aging Zhores A. Medvedev Biolog. Rev. 65, 375398,(1990) 24) Degradation and regurgitation of extracellular proteins by cultured peritoneal macrophages and baby hamster kidney fibroblasts. Susan Buktenica at all. The J. of Biolog. Chem. Vol 262, No 20, 94699476, (1987) 25) Intracellular membrane fusions Paul Quinn Lysosomes in Biology and pathology. 1984. Elsevier Science publishers E.V. 26) The mechanims of Lysosomal acidification. John P. Reeves Lysosomes in Biology and Patology.1984. Elsevier Science Publishers. 27) Lysosomes and Aging. S.A. Wharton and P.A. Riley Lysosomes in Biology and Pathology.1984. Elsevier Science Publishers. 28) The DNA damage Hypothesis of Aging. Gensler at all. Review of Biolog. Research in Aging 3:451465, (1987) 29) Effect of aging on translation and transcription. Arlan Richardson and Imre Semásei Review of Biol. Research in Aging 3: 467483. (1987) 30) Bioenergetics in Aging. Richard G. Hansford Biochimica et Biophysica Acta. 726. 4180. (1983) 31) Acidification of the endocytic and exocytic pathways. Ira Mellman, Renate Fuchs and Ari Helenius. Ann. Rev. of Bioch. 1986. 663700. 32) Membrane recycling during endocytosis. Ira Mellman Lysosomes in Biology and Pathology. Elsevier Science Publishers.1984. 33) Mitochondrial Function and Superoxide generation from submitochondrial particles of aged Rat hearts. Claudio Muscari at all. Biochimica et Biophysica Acta. 1015. 200204. (1990). 34) Decline in skeletal muscle Mitochondrial respiratory chain function: possible factor in Aging. Ian Trounce at all. The Lancet, March 25, 1989. 35) Myocardial Aging: functional alterations and related cellular mechanisms. Edward G. Lakatta and Frank C.P. YIN Am. J. physiology. 242, H927H941.(1982). 36) The free radical theory of Aging: A critique. R.S. Sohal Rev. of Biol. Research in Aging 3. 431449. (1987). 37) Legninger. 38) Damage to Biological molecules by Iron and Copper complexes. Gutteridge J.M.C. Lipofuscine. 1988 Elsevier Science Publishers. Amsterdam. 39) Inhibitors of Lysosomal Enzymes. Accumulation of Lipofuscin like dense bodies in the Brain. G.O. IVY et all. Science Vol 226. 985987.(1984). 40) Lipofuscin: Resolution of discrepant fluorescence data. Graig E. Eldred et all. Science 216. 757759. (1982). 41) Differential features between Lipofuscin (Age Pigment) and various experimentally produced "Ceroid Pigments". Porta E.A. et al. Lipofuscin. 1987. Elsevier Science Publishers. Amsterdam. 42) The theoretical background and cellular autoregulation of Biological Waste product formation. ZsNagy I. Lipofuscin. 1987. State of the Art. Elsevier Science Publishers. 43) Repression of cfos transcription and an altered genetic program in senescent Human fibroblasts. Tara Seshadri and Judith Campisi. Science. Vol 247. 205209. 44) Experimental manipulations of lipofuscin formation in Aging mammals. Nandy K. et al. Lipofuscin. 1987. State of the Art. Elsevier science Publishers. 45) Protein oxidation, protein crosslinking and proteolysis in the formation of lipofuscin: Rationale and methods for the measurement of protein degradation. Davies K.J.A. Lipofuscin. 1987. Elsevier Science Publishers 46) Lipofuscin. 1987. Sohal R.S. Elsevier Science Publishers. 47) A proteinase inhibition model of lipofuscin formation. IVY G.O. and J.W. Gurd Lipofuscine. 1987. Elsevier Science Publishers. 48) Problem of autointoxication in gerontology. V. Korenchevsky Experientia supl.IV. 216225 49) Gerontology: Approaches to Biomedical and Clinical Research. Edited by Michael A. Horan and Adrian Bronwer. 50) Enciclopedia Britannica. 51) El envejecimiento David P. Darash. Biblioteca Científica Salvat 52) El Gen Egoísta. Richard Dawkins Biblioteca Científica Salvat 53) Low density lipoprotein receptor binding in Aging Human diploid fibroblasts in culture. Hon Chi Lee et al. The J. of Biolo. Chem. Vol 257 No 15. 89128918. (1982). 54) Degradation of endocytosed proteins is unaltered in senescent Human fibroblasts. Richard Gurley and J. Fred Dice. (1988). Cell Biology international reports. Vol 12 No 10. 885893. 55) Ultra structural changes in the left ventricular Rat Myocardial Cells with Age. Dorothy F. Travis and Alfred Travis. J. of Ultra structure research. 39. 134138. (1972). 56) LA CELULA. Bruce Alberts et al. Ver pag. 807. 57) The potential intermediate role of lysosomes in Oxygen free radical pathology. Ulf Brunk and Enrique Cadenas APMIS 96: 313, (1988). 58) Impaired protein degradation may account for that accumulation of "abnormal" proteins in aging cells. R.W.Gracy et al. Modification of proteins during aging, pag. 118 1985, Alan R.Liss, inc. 59) Detection and characterization of nucleoside transport systems in Human fibroblasts Lysosomes. Ronald L. Pisoni and Jess G. Thoene The J. of Biol. Chem., 264, 48504856, (1989) 60) Protein synthesis and degradation during aging and senescence Savvas C. Makrides Biol. Rev. (1983), 58, 343422. 62) Tratado de Fisiología Médica A.C.Guiton. Nueva Editorial Interamericana.63) Botánica Strasburger. Ed. Marin. Ver pag. 395. 64) Passive diffusion of nonelectrolytes across the lysosome membrane. Iveson P., Susan J. Bird and John B. Lloyd. Bioch. J., 261,4516, (1989). 65) Age related alterations of Enzymes may involve Mixed function Oxidation reactions. C.N. Oliver at al. Modification of Proteins During Aging. 3952. 1985. Alan Liss, Inc. 66) The alteration of enzymes in aging. Morton Rothstein, pH.D. Modification of proteins during aging. 5367. 1985. Alan R. Liss, Inc. 67) Defective enzyme molecules in cells of aging animals are partially denatured, totally inactive. Normal degradation intermediates. A.Z. Rethnick et al. Modification of proteins during aging. 6981. 1985. Alan R. Liss, Inc. 68) Osteocalcin: The vitamin K dependent protein of bone. Caren M. Gundberg and Paul M. Gallop. Modification of proteins during aging. 1985. Alan R. Liss, Inc. 69) Solute translocation across the mammalian lysosome membrane. Susan Foster and John B. Lloyd. Bioch. et Biophysica Acta, 947 (1988), 465491. 70) Lysosomes and age pigments in cultured cells. Ulf T. Brunk and Vincent P. Collins. Age Pigments. R.S.Sohal Editor. Elsevier North Holland Biomedical Press, 1981. 71) Age Pigments. R.S.Sohal. Editor Elsevier North Holland Biochemical Press,1981. 72) The permeability of the lysosomal membrane to small ions. Robert P. Casey, Marja Hollemans and Joseph M. Tager. Bioch. et Biophysica Acta, 508(1978), 1526. 73) Use of fluorescein isothiocyanatedextran to measure proton pumping in lysosomes and related organelles. Ohkuma Shoji Methods Enzymology, 1989, 174, 131154 74) Conversion of pro insulin to insulin occurs coordinately with acidification of maturing secretory vesicles. Lelio Orci et al. The J. of Cell Biology, 103, (1986), 22732281. 75) ATP dependent acidification of intact and disrupted lysosomes. Donald L. Schneider. The J. of Biolog. Chem., 256, (1981), 38583864. 76) Formation of Bimolecular Membranes from Lipid monolayers and an study of their electrical properties. M. Montal and P. Mueller. Proc. Natl. Acad. Sci. 69, 3561 , (1972).77) Intracellular pH Albert Roos and Walter F. Boron physiological reviews. Vol. 61,No 2, April 1981.297421* 78) Metabolic regulation via intracellular pH Busa, William B. and Richard Nuccitelli Am. J. physiology, 246, R409R438, 1984 79) Uncoupling of acetylcholine uptake from the Torpedo cholinergic synaptic vesicle ATPase. D.C. Anderson, Steven C. King and Stanley M. Parsons Bioch. and Biophysical research communications. Vol. 103, No 2 1981. 422428 80) Identification and characterization of a proton pump on lysosomes by fluorescein isothiocyanatedextran fluorescence. Shoji Ohkuma, Yoshinori Moriyama and Tatsuya Takano Proc. Natl. Acad. Sci. USA, Vol 79, 27582762. 81) Transport of Protons Across Membranes by Weak Acids Stuart G. McLaughlin and James P. Dilger physiological Reviews, Vol 60, 825863. 82) Advanced Organic Chemistry Jerry March Ver reacciones 924, 925 y 938 83) pH , H+ Diffusion Potentials, and Mg++ ATPase in Neurosecretory Vesicles isolated from Bovine Neurohypohyses. James T. Russell The J. of Biological Chemistry, 259, 94969507. 84) Evidence that an ATPase and a proton motive force function in the transport of Acetylcholine into storage vesicles. Lawrence Toll and Bruce Howard. The J. of Biological Chemistry, 255, 17871789. 85) Effects of growth factors on intracellular pH regulation Wouter H. Moolenaar Ann. Rev. physiol. 1986, 48: 36376 86) A specific mutation abolishing Na+/H+ antiport activity in Hamster fibroblasts precludes growth at neutral and acidic pH Jacques Pouyssgur, Claude Sardet, Arlette Franchi, Gilles L'Alleman and Sonia Paris Proc. Natl. Acad. Sci. USA. Vol.81, 483337. 1984 87) Growth factor action and intracellular pH regulation in Fibroblasts. Gilles L'Alleman, Sonia Paris and Jacques Pouyssegur The J. of Biol. Chemistry. Vol.259, 58095815. 1984 88) Weak bases and ionophores rapidly and reversibly raise the pH of endocytic vesicles in cultured Mouse Fibroblasts Frederick R. Maxfield The j. of Cell Biology. Vol.95, 1982. 676681 89) Effect of lysosomotropic amines on the secretory pathway and on the recycling of the Asialoglycoprotein Receptor in Human Hepatoma Cells Ger J. Strous, Atala Du Maine, Jos E. ZijderhandBleekemolen, Jan W. Slot and Alan L. Schwartz The J. of Cell Biology. Vol. 101, 1985, 531539 90) Bioenergetics of Serotonin transport by membrane vesicles derived from Platelet dense granules Hanna Fishkes and Gary Rutnick The J. of Biological Chemistry Vol. 257, 56715777.1982 91) Chloroquine diverts ACTH from a regulated to a constitutive secretory pathway in AtT20 cells Hsiao Ping Moore, Barry Gumbiner and Regis B. Kelly Nature. Vol. 302, 4346. 1983 92) ATP_driven Proton fluxes across membranes of secretory organelles Shulamit Cidon, Hilla Ben David and Nathan Nelson The J. of Biological Chemistry. Vol.258, 1168488. 1983 93) Effects of exogenous amines on mammalian cells, with particular reference to membrane flow Roger T. Dean, Wendy Jessup and Clive R. Roberts Biochemical J. (1984) 217, 2740 94) Proteolysis in neuropeptide processing and other neural functions Y. Peng Loh, Michael J. Brownstein and Harold Gainer Ann. Rev. Neurosci. 1984. 7:189222 95) Regulation of intracellular pH in eukaryotic cells Inger Helene Madshus Biochem. J. (1988). 250: 18 96) Mechanisms and consequences of pH mediated cell regulation William B. Busa Ann. Rev. physiology. (1986). 48:389402 97) Cytoplasmic pH regulation in Thymic Lymphocytes by an Amiloride sensitive Na+/H+ antiport. S. Grinstein, S. Cohen and A. Rothstein J. Gen. physiology (1984). 83:341369 98) The Amiloride sensitive Na+/H+ exchange System in Skeletal Muscle cells in culture Paul Vingne, Christian Frelin and Michel Lazdunski The J. Biolog. Chem. (1982). 257:93949400 100) Perturbation of vesicular traffic with the carboxylic ionophore Monensin. Alan M. Tartakoff CELL. (1983). 32:10261028 101) Monensin interrupts the recycling of Low density Lipoprotein receptors in Human Fibroblasts Sandip K. Basu, JosepH L. Goldstein, Richard G. W. Anderson and Michael S. Brown. CELL. (1981). 24:493:502 102) Tratado de medicina interna Cecil 17 edicin. Ed. Interamericana 103) H+ATPase of Chromaffin granules Robert G. Johnson, Michael F. Beers and Antonio Scarpa The J. of Biolog. Chemistry. (1982). 257:1070110707 104) Biological applications of IonpHores. Berton C. Pressman physiological reviews. 1976 ABSTRACTS A1) 110:90683s. Post transcriptional modification of tRNA and molecular mechanisms of genetic code decoding. (1988) A2) 109:20648q. Lysosomal proteolysis in cultured hepatocytes. (1987) A3) 87:149407s. Age related alterations in cardiac lysosomes. (1977) A4) 86:40814a. Lysosomal enzyme activities in parenchymal and non parenchymal Liver Cells isolated from young adult and old rats.(1976) A5) 86:40815b. Altered protein metabolism in arrested populations of aging Human diploid fibroblasts.(1976). A6) 89:177010s. Renal age changes. Observations on the rat kidney cortex with special reference to structure and function of the Lysosomal system in the proximal tubule. (1978). A7) 90:165569p. Search for alterations of three enzymes with a different turnover rate in the Liver of senescent rats. (1978). A8) 90:165573k. Lysosomes in Kupffer Cells isolated from young and old rats. (1978). A9) 92:38653c. Lysosomal enzyme activities during aging of adult human liver Cell lines. (1979). A10) 104:222531d. Activity of lysosomal enzymes in the liver at different stage of ontogenesis. (1986). A11) 92:91688u. Fine structural changes in the aging mouse.(1980) A12) 110:209852p. Decline in protease activities with age in the nematode Caenorhabditis elegans. (1988). A13) 102:106283j Duration of the effects induced by Aslavital treatment on aged rat spleen and liver lysosomal protease activity.(1983). A14) 112:155651t A pH increase in human fibroblast lysosomes during accumulation of non-hydrolysable compounds. (1990). A15) 103:51711k Degradation of short and longtime labeled proteins by rat liver lysosomes. (1985). A16) 103:51713n Pathways of intracellular sequestration and protein degradation in isolated rat hepatocytes. (1985). A17) 103:51715q Comparison of proteolysis in perfused rat liver and in isolated autophagic vacuoles. (1985). A18) 113:53189b Evolution of the P450 gene superfamily: animal plant "Werfare", molecular drive and human genetic differences in drug oxidation. (1990). A19) 112:136497f Accumulation of cardiac lipofuscin in mammals: correlation between sexual maturation and de first appearance of lipofuscin. (1990). A20) 112:136486b Reduced transcription of mitochondrial DNA in the senescent rat. Tissue dependence and effect of L-Carnitine. (1990) A21) 112:196048v. Alkalization of the lysosomes is correlated with ras transformation of murine and human fibroblasts. A22) 170869x Changes in lysosome shape and distribution correlated with changes in cytoplasmic pH. Francesc Borrell Borrell Escrito en 1991 Revisión finalizada el 05-09-12