Presentación de PowerPoint
Anuncio

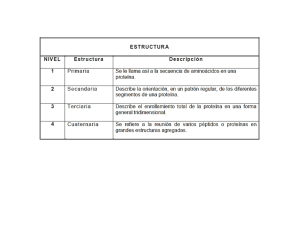
La estructura primaria de una proteína es la secuencia de aminoácidos en la cadena y en la ubicación de todos los puentes disulfuro. La estructura secundaria describe las conformaciones repetidas que asumen los segmentos de la cadena de la columna vertebral de la proteína. La estructura terciaria describe la estructura tridimensional de todo el polipéptido. La estructura cuaternaria de una proteína es la forma en que las cadenas de proteínas individuales se ordenan con respecto una de otra. La estructura secundaria describe cómo se pliegan los segmentos de la columna vertebral. Las conformaciones se estabilizan por el puente de hidrógeno entre los grupos peptídicos, entre el hidrógeno unido a un nitrógeno de un residuo de aminoácido y el oxígeno carbonilo de otro. Un tipo de estructura secundaria es la hélice a. En una hélice a, la columna vertebral del polipéptido se enrolla alrededor del eje largo de la molécula de la proteína. Los sustituyentes de los carbonos α de los aminoácidos se proyectan hacia fuera de la hélice; por tanto, se minimiza el impedimento estérico. Cada hidrógeno unido a un nitrógeno se enlaza a un oxígeno carbonilo de un aminoácido alejado a una distancia de cuatro aminoácidos. Recuerde que un puente de hidrógeno puede tener lugar entre un hidrógeno enlazado a un nitrógeno y un par electrones no compartidos del oxígeno. La lana y la proteína fibrosa muscular son ejemplos de proteínas con estructuras secundarias que son casi todas hélices α. En consecuencia, estas proteínas pueden estirarse. El segundo tipo de estructura secundaria es una hoja plegada β. En una hoja plegada β la columna vertebral del polipéptido se extiende en una estructura en forma de zigzag que se asemeja a una serie de pliegues. El puente de hidrógeno en una hoja plegada β tiene lugar entre las cadenas peptídicas adyacentes Puesto que los sustituyentes (R) en el carbono a de los aminoácidos de las cadenas adyacentes están cerca unos de otros, las cadenas pueden acercarse bastante como para formar puentes de hidrógeno sólo si los sustituyentes son pequeños. Por ejemplo, la seda y las telarañas, que es una proteína con un gran número de aminoácidos relativamente pequeños (glicina y alanina), tiene grandes segmentos de hojas plegadas β. Las proteínas con estructuras secundarias que predominan como hojas plegadas β, no pueden estirarse porque la hoja plegada β está casi totalmente extendida. La estructura terciaria de una proteína es la disposición tridimensional de todos los átomos de la proteína. Las proteínas se pliegan de manera espontánea cuando están en disolución para elevar al máximo su estabilidad. Cada vez que hay una interacción estabilizadora entre dos átomos, se libera energía. Cuanta más energía se libera, más estable es la proteína. De modo que una proteína tiende a plegarse en una forma que eleva al máximo el número de interacciones estabilizadoras. Las interacciones estabilizadoras incluyen los puentes disulfuro, los puentes de hidrógeno y las atracciones electrostáticas (atracciones entre cargas opuestas), y las interacciones hidrofóbicas (atracción entre grupos no polares). Las interacciones estabilizadoras pueden tener lugar entre grupos peptídicos (átomos en la columna vertebral de la proteína), entre sustituyentes α y entre grupos peptídicos y sustituyentes α. Debido a que los sustituyentes α ayudan a determinar la forma en que se pliega una proteína, la estructura terciaria de una proteína se determina por su estructura primaria. La mayor parte de las proteínas existen en ambientes acuosos. En consecuencia, tienden a plegarse de una forma que dejan expuestos al máximo número de grupos no polares en un ambiente acuoso y los ocultan en el interior de la proteína, lejos del agua. Algunas proteínas tienen más de una cadena peptídica. Las cadenas individuales se llaman subunidades. Las subunidades se mantienen juntas por medio de los mismos tipos de interacciones que mantienen unidas a las cadenas de proteína individuales en una conformación particular tridimensional: interacciones hidrofóbicas, puentes de hidrógeno y atracciones electrostáticas. La estructura cuaternaria de una proteína describe la forma en que las subunidades están ordenadas en el espacio. Algunas de las formas posibles en que se ordenan las seis subunidades de un hexámero se muestran a continuación: Una representación de la estructura cuaternaria de la hemoglobina. Los colores naranja y verde representan las cadenas polipéptidas; hay dos subunidades idénticas color naranja y dos subunidades idénticas de color verde. Dos de los anillos de porfirina (en gris) son visibles unidos al hierro (en rosa) y enlazados al oxígeno (en rojo). CLASIFICACIÓN DE LAS PROTEINAS Las proteínas pueden clasificarse de acuerdo con su composición química, su forma o su función. Por ahora, examinamos brevemente los tipos de proteínas y sus clasificaciones generales. Las proteínas se agrupan en proteínas simples y conjugadas de acuerdo con su composición química. Proteínas simples son aquellas que se hidrolizan para dar solamente aminoácidos. Todas las estructuras de las proteínas que hemos considerado hasta ahora son proteínas simples. Ejemplos son la insulina, la oxitocina, y bradiquinina. Proteínas conjugadas están unidas a un grupo prostético no proteico tal como un azúcar, un ácido nucleico, un lípido, o algún otro grupo. Las proteínas se clasifican como fibrosas o globulares dependiendo de si se forman largos filamentos o se enrollan entre sí mismas. Las proteínas fibrosas son resistentes y por lo general son insolubles en agua. Funcionan principalmente como partes estructurales del organismo. Los ejemplos de proteínas fibrosas son la queratina en el pelo y las uñas, y el colágeno en los tendones. Las proteínas globulares se pliegan en formas más o menos esféricas. Ellas usualmente función como enzimas, hormonas, o proteínas de transporte. Las enzimas son proteínas que contienen catalizadores biológicos; un ejemplo es la ribonucleasa, que escinde RNA. Las hormonas ayudan a regular los procesos en el cuerpo; un ejemplo es la insulina, que regula la glucosa en la sangre y su absorción por las células. Las proteínas de transporte se unen a moléculas específicas y transportan a través de la membrana celular o en la sangre; un ejemplo es la hemoglobina, que transporta oxígeno en la sangre de los pulmones a los tejidos El glucagón es una hormona peptídica de 29 aminoácidos que actúa en el metabolismo del glucógeno. Esta hormona es sintetizada por las células alfa del páncreas (en la estructura anatómica denominada islotes de Langerhans). NH2-His-Ser-Gln-Gly-Thr-Phe-Thr-Ser-Asp-Tyr-Ser-Lys-Tyr-Leu-Asp-Ser-Arg-Arg-Ala-Gln-Asp-Phe-Val-Gln-Trp-LeuMet-Asn-Thr-COOH El glucagón es una hormona producida en el páncreas. El glucagón se usa para aumentar el nivel bajo de azúcar en la sangre. El glucagón también se usa para realizar exámenes de diagnóstico en el estómago y en otros órganos del sistema digestivo La hormona antidiurética (HAD o por sus siglas en inglés ADH), también conocida como arginina vasopresina (AVP), o argipresina, es una hormona hipotalamica almacenada en neurohipofisis presente en la mayoría de mamíferos, incluyendo a los humanos. La vasopresina es una hormona peptídica que controla la reabsorción de moléculas de agua mediante la concentración de orina y la reducción de su volumen, en los túbulos renales, afectando así la permeabilidad tubular. La vasopresina es liberada principalmente en respuesta a cambios en la osmolaridad sérica o en el volumen sanguíneo incrementando la resistencia vascular periférica y a su vez la presión arterial. Recibe su nombre debido a que cumple un papel clave como regulador homeostático de fluidos, glucosa y sales en la sangre. Es una hormona pequeña (oligopéptido) constituida por nueve aminoácidos: NH2-Cys-Tyr-Phe-Gln-Asn-Cys-Pro-Arg-Gly-COOH