Control positivo MRSA AcroMetrix
Anuncio

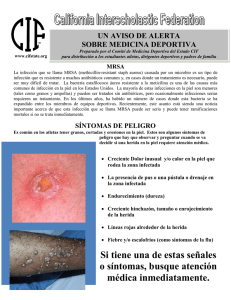
Control positivo MRSA AcroMetrix™ Para uso en diagnóstico in vitro 960091 Control positivo MRSA AcroMetrix Uso previsto El control positivo MRSA AcroMetrix ha sido desarrollado para evaluar el rendimiento de los procedimientos de análisis de ácido nucleico y detectar la presencia del ADN MRSA. El uso rutinario de controles de ejecución externos permite a los laboratorios controlar la variación diaria de la prueba, el rendimiento entre lotes de los kits de prueba y el cambio de operadores, además, permite detectar un aumento de errores aleatorios o sistemáticos. El producto es para uso diagnóstico in vitro. Resumen y explicación El control positivo MRSA AcroMetrix contiene partículas bacterianas MRSA inactivas. El control positivo ha sido producido diluyendo reservas cuantificadas de MRSA en una solución bacteriana compatible con una enzima propia. El Staphylococcus aureus resistente a la meticilina (MRSA) es un tipo de bacteria resistente a determinados antibióticos. Las infecciones por estafilococos, incluido el MRSA, se propagan con mucha frecuencia entre los pacientes de hospitales y centros sanitarios (como residencias de ancianos y centros de diálisis), debido a la vulnerabilidad de su sistema inmunológico. Las infecciones por MRSA que afectan a personas sanas que no han estado hospitalizadas recientemente (durante el año pasado) o se han sometido a tratamiento médico (como diálisis, cirugía, catéteres) se conocen como infecciones MRSA asociadas a la comunidad. Normalmente, estas infecciones afectan a la piel, en forma de abscesos, forúnculos y otras lesiones con acumulación de pus1. El control positivo MRSA AcroMetrix ha sido diseñado como un control no ensayado para su uso en procedimientos de análisis molecular para determinar la calidad del ADN MRSA. Principio del procedimiento El control positivo MRSA de AcroMetrix ha sido formulado para reproducir los especímenes generados naturalmente en humanos infectados con MRSA. Además, el formato intacto de la bacteria del control positivo MRSA AcroMetrix permite verificar y purificar un procedimiento de extracción del ADN bacteriano efectivo. Los controles han sido diseñados para monitorizar todos los pasos de los procedimientos de las pruebas para detectar la presencia del ADN MRSA en especímenes humanos. Dado que el control positivo MRSA AcroMetrix contiene bacterias intactas, la metodología de la prueba deberá incluir un paso de extracción que libere el ADN bacteriano dejándolo disponible para su transcripción, amplificación o detección, según corresponda a la prueba. El diseño del control positivo MRSA AcroMetrix permite garantizar la calidad de los resultados de las pruebas de ácido nucleico y supervisar el rendimiento del ensayo. Las analíticas frecuentes de muestras de control de calidad individuales facilitan al analista los métodos de supervisión del rendimiento de los ensayos clínicos. El uso rutinario de estos controles permite a los laboratorios controlar la variación diaria de la prueba, el rendimiento entre lotes de los kits de prueba y el cambio de operadores, además, permite detectar un aumento de errores aleatorios o sistemáticos. Reactivos del control Número de catálogo Nombre del control Cantidad 960091 Control positivo MRSA AcroMetrix 5 x 0,2 ml Precauciones y advertencia Aunque el control positivo MRSA AcroMetrix contiene material MRSA inactivo, no obstante, puede suponer un riesgo biológico. Respete las normas de precaución internacionales sobre transmisión de agentes infecciosos cuando manipule los materiales2, 3, 4. No pipetear con la boca. Utilice un equipo de protección adecuado que incluya bata de laboratorio, guantes y protección ocular. No fumar, comer ni beber en las áreas en las que se manipulen paneles y muestras del equipo. Desinfectar los líquidos, materiales o vertidos con una solución de hipoclorito sódico al 0,5%. Desechar todos los materiales y líquidos utilizados para realizar las pruebas como si contuvieran agentes infecciosos. Este producto contiene ProClin™ 300 al 0,05% como conservante. Instrucciones de conservación Se recomienda almacenar el control positivo MRSA AcroMetrix entre 2 y 8 °C para garantizar una conservación óptima. No utilice este producto después de la fecha de caducidad impresa en la etiqueta del tubo. Instrucciones de uso El usuario final determinará el volumen adecuado del control positivo MRSA AcroMetrix que se debe utilizar según sus propios requisitos, ya que las cantidades necesarias varían según el método utilizado. Además, en sus técnicas de ensayo utilizará una torunda estéril compatible para absorber el material del control, que deberá manipularse y probarse en las mismas condiciones exigidas para las muestras clínicas ensayadas en el procedimiento de prueba de ADN MRSA evaluado. Siga las instrucciones y recomendaciones del fabricante para la manipulación y los ensayos con muestras. El control positivo MRSA AcroMetrix ha sido concebido para un solo uso, por lo que deberán desecharse todos los materiales sobrantes. Resultados esperados Un lote del control positivo MRSA AcroMetrix ha sido analizado como una muestra desconocida en los ensayos GeneXpertTM MRSA Assay y LightCyclerTM MRSA mecA M grade Assay. En la tabla siguiente se muestra el rango Ct con los resultados correspondientes. Los resultados previstos por el uso del control positivo MRSA AcroMetrix deberán ser establecidos por el usuario final en función del ensayo de ADN MRSA concreto, por lo que se suministran con carácter exclusivamente informativo. Ensayo Método de extracción Rango Ct Resultado LightCycler MRSA mecA MGrade Enzymatic Lysis 27,41 a 27,95 Reactivo Cepheid GeneXpert MRAS Assay Fuerzas de corte 27,31 a 27,99 Reactivo Limitaciones El control positivo MRSA AcroMetrix ha sido desarrollado para uso diagnóstico in vitro. El control positivo MRSA AcroMetrix no debe utilizarse como sustituto de otros controles internos proporcionados por fabricantes de kits de diagnóstico in vitro. Referencias bibliográficas Leyenda y símbolos de las etiquetas 1. Centers for Disease Control (CDC). Healthcare Associated Methicillin Resistant Staphylococcus aureus Infections. 2007. 2. Centers for Disease Control (CDC). Recommendations for prevention of HIV transmission in health care settings. MMWR 1987; 36 (suplemento n.º 2S). 3. Centers for Disease Control (CDC). Actualización: Universal precautions for prevention of transmission of human immunodeficiency virus, hepatitis B virus, and other bloodborne pathogens in health-care settings. MMWR 1988; 37:377-388. 4. Centers for Disease Control (CDC). Guidelines for prevention of transmission of human immunodeficiency virus and hepatitis B virus to health-care and public-safety workers. MMWR 1989; 38(S-6): 1-36. Código de lote Fecha de caducidad Fabricante Limitación de temperatura Riesgo biológico Precaución Número de catálogo Uso diagnóstico in vitro Marca de conformidad europea Representante autorizado + Control positivo Microgenics Corporation 46500 Kato Road Fremont, CA 94538 USA Servicio al cliente y asistencia técnica en EE. UU.: 1-800-232-3342 Microgenics GmbH Spitalhofstrasse 94 D-94032 Passau, Germany Tel: +49 (0) 851 886 89 0 Fax: +49 (0) 851 886 89 10 Para obtener actualizaciones de prospectos, visite: www.thermoscientific.com/qualitycontrols Microgenics Corporation es una empresa filial cien por cien propiedad de Thermo Fisher Scientific Inc. © 2015 Thermo Fisher Scientific, Inc. Todos los derechos reservados. ProClin es una marca comercial de Rohm and Haas Company. LightCycler es una marca comercial de Roche Diagnostics GmbH. GeneXpert es una marca comercial de Cepheid Corporation. Todas las demás marcas comerciales son propiedad de Thermo Fisher Scientific o de sus empresas subsidiarias. MAN0004740-3-ES 2015 01 2