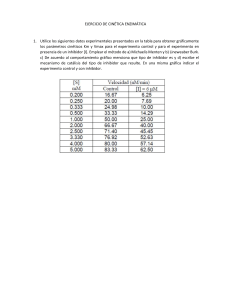
Enzimología 1. Iztapalapa, D.F. a 27 de septiembre de 2013
Anuncio

División de Ciencias Biológicas y de la Salud Posgrado en Biotecnología Enzimología (Ejercicios) Iztapalapa, D.F. a 27 de septiembre de 2013 1. Las propiedades cinéticas de la enzima ATPasa, aislada de levadura, la cual cataliza la hidrólisis de ATP para formar ADP y Pi, son obtenidas midiendo las tasas iniciales de reacción en solución, con varias concentraciones de ATP, S0, y una concentración total de ATPasa, E0 = 0.60 μM. De estos experimentos, se determinó que: Vmax = 1.20 μM s-1; KM = 40 μM. a). Calcula los valores de kcat y el coeficiente de especificidad para la ATPasa bajo estas condiciones. b). Una molécula de inhibidor es adicionada a una concentración de 0.1 mM, y los experimentos son repetidos. La Vmax y KM aparentes obtenidas son 0.6 μM s-1, y 20 μM, respectivamente. Indique el tipo de inhibidor y calcule el valor de KI. 2. En un experimento se midió la tasa inicial de una reacción enzimática, v, a varias concentraciones de substrato [S]. La concentración de la enzima es 10 M. Se graficó [S]/v versus [S] y se observó una línea recta con ordenada al origen (b) es 500 s y la pendiente (m) es 0.25 s M-1. ¿Cuál es el valor de KM y el de Vmax para esta reacción enzimática? ¿Cuál es el valor de kcat para esta enzima? ¿Determina el coeficiente de especificidad? Al medir las tasas iniciales en presencia de 50 M de un inhibidor, A, se observó que la ordenada al origen (b) es 625 s y la pendiente (m) es 0.25 s M-1. ¿Qué tipo de inhibición se observó? ¿Cuál es el valor de Ki para el inhibidor con esta enzima? 3. Considere una reacción enzimática, en presencia de un inhibidor competitivo, a una concentración de sustrato [S] de 2.5 x 10-3 M, la constante de inhibición (Ki) es 1.7 x 10-5 M y la concentración del inhibidor [I] es 7.5 x 10-5 M. Calcula la constante de Michaelis (KM) el grado de inhibición observado es del 40%. 4. Para una reacción enzimática en presencia de un inhibidor competitivo, la velocidad de reacción observada a una concentración de sustrato [S]i = 1.5 x 10-3 M es igual a la velocidad de reacción sin el inhibidor a una concentración de sustrato [S]0 = 7.5 x 10-5 M. Calcule la constante de inhibición, Ki, del inhibidor si su concentración [I] = 3.5 x 10-4 M.