El número de oxidación
Anuncio
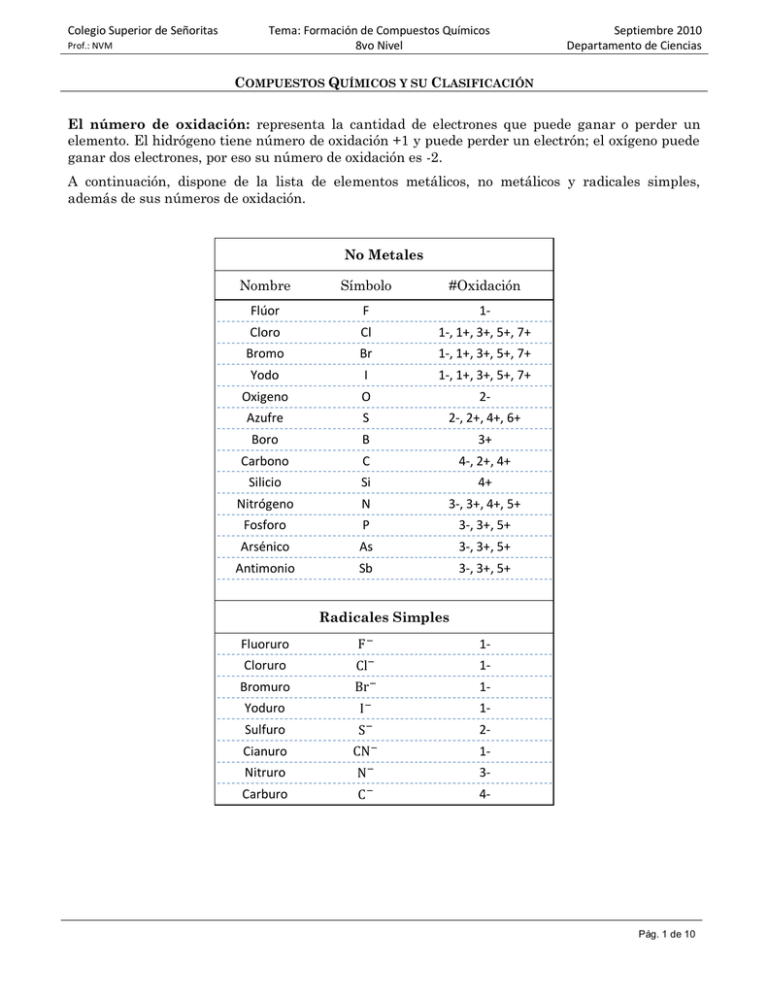
Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias COMPUESTOS QUÍMICOS Y SU CLASIFICACIÓN El número de oxidación: representa la cantidad de electrones que puede ganar o perder un elemento. El hidrógeno tiene número de oxidación +1 y puede perder un electrón; el oxígeno puede ganar dos electrones, por eso su número de oxidación es -2. A continuación, dispone de la lista de elementos metálicos, no metálicos y radicales simples, además de sus números de oxidación. No Metales Nombre Símbolo #Oxidación Flúor F 1- Cloro Cl 1-, 1+, 3+, 5+, 7+ Bromo Br 1-, 1+, 3+, 5+, 7+ Yodo I 1-, 1+, 3+, 5+, 7+ Oxigeno O 2- Azufre S 2-, 2+, 4+, 6+ Boro B 3+ Carbono C 4-, 2+, 4+ Silicio Si 4+ Nitrógeno N 3-, 3+, 4+, 5+ Fosforo P 3-, 3+, 5+ Arsénico As 3-, 3+, 5+ Antimonio Sb 3-, 3+, 5+ Radicales Simples Fluoruro 1- Cloruro 1- Bromuro 1- Yoduro 1- Sulfuro 2- Cianuro 1- Nitruro 3- Carburo 4- Pág. 1 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Metales Nombre Símbolo #Oxidación Potasio K 1+ Sodio Na 1+ Plata Ag 1+ Litio Li 1+ Cesio Cs 1+ Rubidio Rb 1+ Calcio Ca 2+ Estroncio Sr 2+ Bario Ba 2+ Radio Ra 2+ Magnesio Mg 2+ Zinc Zn 2+ Cadmio Cd 2+ Aluminio Al 3+ Galio Ga 3+ Cobre Cu 1+,2+ Mercurio Hg 1+,2+ Oro Au 1+,3+ Hierro Fe 2+,3+ Cobalto Co 2+,3+ Níquel Ni 2+,3+ Cromo Cr 2+,3+,6+ Estaño Sn 2+,4+ Plomo Pb 2+,4+ Platino Pt 2+,4+ Bismuto Bi 3+,5+ Uranio U 6+ Manganeso Mn 2+,3+,4+, 6+,7+ Fórmulas químicas Una fórmula química es la representación gráfica de un compuesto químico, indica la clase y la cantidad de átomos que forman la molécula. Una molécula es la unidad más pequeña de sustancia pura (elemento o compuesto) capaz de existir independientemente, en este caso una molécula de compuesto está representada por su fórmula. Pág. 2 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Una molécula de agua se representa como: H2O; esta fórmula indica que está compuesta por dos elementos diferentes: el hidrógeno y el oxígeno, y que la proporción es de dos átomos de hidrógeno por uno de oxígeno. Si se deben representar dos o más moléculas de agua se antepone la cantidad a la fórmula, y se multiplica el número de átomos. → dos moléculas de agua 4 átomos de hidrógeno 2 átomos de oxígeno Nombres químicos Los nombres son de gran importancia y necesidad en la comunicación científica y cotidiana, recuerde que la mayoría de los productos que se encuentran en el entorno están hechos básicamente de compuestos. Los nombres varían de un idioma a otro, pero significan lo mismo. En Química se utilizan los sistemas generales de nomenclatura aceptados por IUPAC: El sistema de Stoke o moderno. El sistema estequiométrico o de prefijos griegos. Sistema de Stoke o moderno Este sistema se utiliza para dar nombre a los compuestos en los cuales intervienen elementos metálicos que forman cationes (+). Consiste en nombrar primero al elemento o radical electronegativo, luego la preposición "de" y por último, al elemento metálico. En caso de que el metal tenga solamente un número de oxidación, éste no se menciona, pero si el metal tiene dos o más números de oxidación, debe mencionarse el que se está utilizando, indicándolo con números romanos dentro de un paréntesis que se coloca inmediatamente después del nombre del metal. La mayoría de los elementos tiene dos o más números de oxidación por ejemplo: el hierro Fe+2 y +3, el plomo Pb+2 y +4, el manganeso Mn+2 +3 +4 +6 +7, entre otros. Sistema estequiométrico Se utiliza para dar nombre principalmente a los compuestos formados entre no metales. Consiste en expresar, mediante el uso de los prefijos griegos correspondientes, el número de átomos de cada elemento presentes en el compuesto. Se menciona primero al elemento más electronegativo con las terminaciones que correspondan según los compuestos. Prefijos griegos por usar: mono ..................... 1 hexa .....................6 di ..................... 2 hepta....................7 tri ..................... 3 octa .....................8 tetra .....................4 nona.....................9 penta ..................... 5 deca .................. 10 El prefijo mono se omite si no hay posibilidad de confusión. Pág. 3 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Clasificación de los compuestos inorgánicos Dos aspectos se toman en cuenta para clasificar los compuestos inorgánicos: a) El número de elementos que los forman; b) La función química. a) Según el número de elementos, se clasifican en binarios, ternarios y cuaternarios. 1. Compuestos binarios: son todos los compuestos que contienen dos elementos diferentes. Ejemplo: Está formado por el elemento sodio y el elemento cloro. Está formado por los elementos plomo y oxígeno; no toma en cuenta la cantidad de átomos que forma parte del compuesto, sólo la clase de elementos. 2. Compuestos ternarios: son los compuestos formados por tres elementos diferentes. Encontramos en este ejemplo tres elementos diferentes: potasio (K), oxígeno (O) e hidrógeno (H). Este compuesto es ternario pues está formado por tres elementos diferentes: hidrógeno (H), azufre (S) y oxígeno (O). 3. Compuestos cuaternarios: son los compuestos formados por cuatro o más elementos diferentes. Cuatro elementos forman el carbonato de amonio: el nitrógeno (N), el hidrógeno (H), carbono (C) y el oxígeno (O). Los subíndices y los paréntesis no se toman en cuenta en esta clasificación. El bicarbonato de potasio (está formado por cuatro elementos diferentes: potasio (K), hidrógeno H, carbono (C) y oxígeno (O). Pág. 4 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Se resume esta clasificación en el siguiente esquema: b) Las sustancias inorgánicas, tomando en cuenta su función química, se clasifican en óxidos metálicos y no metálicos, hidruros, hidróxidos, ácidos hidrácidos y oxácidos, sales binarias y ternarias, sales básicas y acidas. NOMENCLATURA Y REPRESENTACIÓN En este tema, se estudia cómo nombrar los compuestos inorgánicos, siguiendo las reglas de la nomenclatura de Stoke y la Estequiométrica. También se representarán por medio de la fórmula molecular. En este nivel del curso de Ciencias debe tener memorizados los números de oxidación de los metales, no metales y radicales simples. Pág. 5 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Óxidos metálicos Son compuestos binarios formados por un metal y el oxígeno (no metal). Fórmula molecular Las cargas eléctricas no se colocan en la fórmula molecular del compuesto ya que son neutros. Se escribe primero el símbolo del metal y luego del oxígeno. Se intercambian los números de oxidación y se simplifican, si es el caso. Por ejemplo, el sodio y el oxígeno se combinan para formar un óxido metálico. Siguiendo los pasos anteriores la fórmula molecular es: Sodio y oxigeno Calcio y oxigeno Bismuto (V) y oxigeno El número uno como subíndice en química no se escribe, el símbolo ya representa un átomo del elemento; no se pueden simplificar los subíndices 2 y 1. En la fórmula molecular del óxido que se forma a partir del calcio y del oxígeno los subíndices se deben simplificar. Bismuto (V) y el oxígeno. Cuando el metal tiene dos o más números de oxidación se deben identificar con número romano dentro de un paréntesis el que se está utilizando. Nomenclatura de Stoke Se escribe el término óxido, seguido de la preposición "de" y luego el nombre ' del metal. Si el metal tiene solo un número de oxidación, como el sodio y el calcio, no se debe indicar. Si tiene dos o más números de oxidación como el Bismuto se debe indicar con número romano y entre paréntesis. Pág. 6 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Óxidos no metálicos Compuestos binarios formados por un no metal y el oxígeno (no metal). Fórmula molecular Se escribe primero el símbolo del no metal y luego el del oxígeno. Se intercambian los números de oxidación y se simplifican, si es el caso. Nomenclatura Estequiométrica Pág. 7 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Utiliza los prefijos griegos para indicar el número de átomos de cada elemente que forman el compuesto. Se escribe el prefijo correspondiente para el oxígeno y luego para el no metal, separados por la preposición "de". El prefijo 'mono' no se utiliza para el no metal, solo para el oxígeno. Hidruros Son compuestos formados por un elemento metálico y el hidrógeno. Nomenclatura de Stoke Se escribe el término hidruro, la preposición "de" y de último el nombre del metal. Si el metal tiene solo un número de oxidación, no se indica; si tiene dos o más se indica el que está utilizando con número romano y dentro de un paréntesis. Ácidos hidrácidos Son los compuestos formados por el hidrógeno, con número de oxidación +1 (electropositivo), y un radical simple (no metal). Se presentan en solución acuosa (ac). Fórmula molecular Se escribe el símbolo del hidrógeno y luego el del radical simple. Se intercambian los números de oxidación. Se indica como subíndice el estado: acuoso (ac) Pág. 8 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Nomenclatura de Stoke Todos los nombres de los radicales simples terminan en "uro". Se escribe el término ácido y luego el nombre del radical, cambiándole la terminación "uro" por "hídrico". Cuando los compuestos formados por el hidrógeno y un radical simple se presentan en estado gaseoso (g) y no acuoso (ac), como los anteriores, las propiedades acidas cambian y el nombre del compuesto también. Fórmula molecular Se escribe el símbolo del hidrógeno y luego el del radical simple. Se intercambian números de oxidación. Se indica como subíndice el estado gaseoso (g). Nomenclatura de Stoke Se escribe el nombre del radical simple, el prefijo "de" y de último el término hidrógeno. Sales binarias Antiguamente se llamaron sales simples. Se conocen con el nombre de sales binarias los compuestos formados por la reacción de los metales con los radicales simples. Fórmula molecular Primero se escribe el símbolo del elemento metálico, luego el del radical simple. Se intercambian números de oxidación y se simplifican si es necesario. Pág. 9 de 10 Colegio Superior de Señoritas Prof.: NVM Tema: Formación de Compuestos Químicos 8vo Nivel Septiembre 2010 Departamento de Ciencias Cuando el compuesto está formado por el cianuro (CN) se debe de encerrar entre paréntesis para colocar un número de oxidación mayor que uno. Nomenclatura de Stoke Se nombra primero el metal y luego el radical simple, separados con la preposición "de". Se indica con número romano dentro de un paréntesis el número de oxidación si el metal posee varios. Pág. 10 de 10

