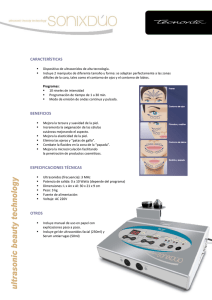
Nuevas metodologías y aplicaciones de las técnicas de
Anuncio

Nuevas metodologías y aplicaciones de las técnicas de microextracción líquido-líquido para la determinación de contaminantes orgánicos Carolina Cortada Cortés Universidad de Alicante Facultada de Ciencias Departamento de Química Analítica, Nutrición y Bromatología Nuevas metodologías y aplicaciones de las técnicas de microextracción líquido‐líquido para la determinación de contaminantes orgánicos TESIS DOCTORAL CAROL CORTADA CORTÉS Alicante, Junio de 2012 Universidad de Alicante Facultada de Ciencias Departamento de Química Analítica, Nutrición y Bromatología Nuevas metodologías y aplicaciones de las técnicas de microextracción líquido‐líquido para la determinación de contaminantes orgánicos Memoria presentada por CAROL CORTADA CORTÉS para la obtención del título de Doctora en Química Alicante, Junio de 2012 Departament de Química Analítica, Nutrició i Bromatologia Departamento de Química Analítica, Nutrición y Bromatología JUAN MORA PASTOR Director del Departamento de Química Analítica, Nutrición y Bromatología de la Facultad de Ciencias de la Universidad de Alicante, Certifica que, CAROLINA CORTADA CORTÉS ha realizado bajo la dirección de los profesores Dr. D. ANTONIO CANALS HERNÁNDEZ y Dra. Dña. LORENA VIDAL MARTÍNEZ, el trabajo bibliográfico y experimental correspondiente a la obtención del Grado de Doctor en Química sobre el tema: “Nuevas metodologías y aplicaciones de las técnicas de microextracción líquido‐líquido para la determinación de contaminantes orgánicos”. Alicante, Mayo de 2012 Fdo. Dr. Juan Mora Pastor Departament de Química Analítica, Nutrició i Bromatologia Departamento de Química Analítica, Nutrición y Bromatología Los profesores Dr. D. ANTONIO CANALS HERNÁNDEZ y Dra. Dña. LORENA VIDAL MARTÍNEZ del Departamento de Química Analítica, Nutrición y Bromatología de la Universidad de Alicante, en calidad de Directores de la Tesis Doctoral presentada por Dña. CAROLINA CORTADA CORTÉS, con el título “Nuevas metodologías y aplicaciones de las técnicas de microextracción líquido‐líquido para la determinación de contamiantes orgánicos”. Certifican que, la citada Tesis Doctoral se ha realizado en los laboratorios de Labaqua S.A. y del Departamento de Química Analítica, Nutrición y Bromatología de la Universidad de Alicante y que, a su juicio, reúne los requisitos necesarios exigidos en este tipo de trabajos. Alicante, Mayo de 2012 Fdo. D. Antonio Canals Hernández Fdo. Dña. Lorena Vidal Martínez Hay una fuerza motriz más poderosa que el vapor, la electricidad y la energía atómica: la voluntad (Albert Einstein) Cuando te planteas escribir los agradecimientos de un trabajo como éste, al que le has dedicado mucho tiempo y esfuerzo, te das cuenta que hay muchas personas a la que se los debes porque, algunas veces, pequeños detalles te han hecho seguir adelante y superar el desanimo que todos hemos sentido alguna vez. Y tienes la necesidad de agradecerlo. Mi primer agradecimiento es para mi padre, mi madre y mi abuela. Son las tres personas que han hecho posible que hoy esté escribiendo estos agradecimientos. Ellos me enseñaron que la meta la pongo yo y solamente yo y que, alcanzada una, la siguiente nos espera. Esta ha sido mi filosofía a lo largo de toda mi carrera. A mi hermana Montse porque cuando tenía 10 años me dijo, después de ver la película de Merlín el encantador, que debía estudiar químicas para ser como él (???). Mi siguiente agradecimiento es para la directora de mi colegio. Cuando todavía era una niña ella nos explicaba lo mucho que le costó estudiar químicas. Era mujer, huérfana y principios de los años 50. Era extraño que una mujer estudiara pero, además, que estudiara una carrera de ciencias era poco menos que impensable. Nos decía que era muy importante que estudiáramos lo que nos gustara. Nosotros teníamos la suerte de tener el apoyo de nuestras familias para hacerlo, debíamos aprovecharlo al máximo, era casi una obligación. He pensado muchas veces en ella cuando no tenía ganas de seguir estudiando y me la imaginaba de madrugada, con una vela en las escaleras de la casa de sus tíos para que nadie la viera estudiar. A Marie Curie, cuando ya estaba en el instituto y tenía 14 años cogí un libro de la biblioteca, este libro era la biografía de Madame Curie. Volví a ver en esta mujer lo que años antes había visto en la directora de mi colegio, una constancia ejemplar para conseguir lo que quería. Otra química que me impresionó por su trabajo y por la cantidad de dificultades que se encontró en su camino. No le importó el esfuerzo, fue la primera mujer en conseguir un premio Nobel en ciencia. A mi profesora de química del instituto que me abocó a no dudar en estudiar la carrera de químicas. Cuando ya estaba en la facultad y estudiaba química orgánica en tercero de carrera, un día se me ocurrió leer el prólogo del libro que estaba estudiando, “el Alinger”. Decía que, antes que nosotros, mucha gente había trabajado y había estudiado para darnos los conocimientos en esa etapa de nuestra vida. El que nos presentaran cosas ya estudiadas era una ventaja importante puesto que no partíamos de cero, cada uno de nuestros predecesores había puesto su granito de arena para que en ese momento me enseñaran muchas cosas que, años atrás, no habían sido tan evidentes. Este era el motivo de que nuestro deber como futuros químicos fuera el utilizar nuestro conocimiento con un respeto absoluto por el hombre y por el medio que nos circundaba, que no lo utilizáramos nunca para hacer daño a nadie ni a nada. Creo no haber decepcionado a este señor. He tardado muchos años desde que terminé la carrera hasta que empecé a preparar el doctorado y en este periodo vuelvo a tener que agradecer a mucha gente que me ha acompañado en estos años de trabajo. En primer lugar a mis directores de tesis. A Antonio que confió en mí sin conocerme. Me presenté en su despacho diciendo que quería hacer el doctorado con él. Y aquí estoy, con la tesis terminada. A Lorena que ha dedicado muchas horas a las revisiones y desde muy lejos en los últimos tiempos. En este periodo he aprendido muchísimo y de temas que me han abierto nuevos caminos, temas que me han gustado y me han impresionado por su potencial. A mis hermanas, siempre están ahí, siempre diciéndome lo orgullosas que están de lo que hago, sobre todo en momentos muy duros que hacen tambalear (momentáneamente) tu autoestima. A mis cuñados que también están siempre al lado. A mis sobrinos que confían en mí. A la gente del laboratorio por su inestimable ayuda a lo largo de todo el trabajo experimental y de redacción de la tesis. A la gente de la facultad que me han tratado como una más y eso que estaba poco tiempo con ellos. Y sobre todo a Salvador, Nuria y Marina. Creo que han sido los críticos más duros con los que nadie se haya encontrado. Me han aguantado mis malos momentos, se han alegrado con los buenos y siempre han estado a mi lado para apoyarme. Nuria ha hecho unos dibujos “preciosos”. ÍNDICES ÍNDICE GENERAL ÍNDICE GENERAL • ÍNDICES ................................................................................................................. XVII GLOSARIO DE TÉRMINOS Y ACRÓNIMOS .............................................................. XXIII • OBJETO ...................................................................................................................... 1 • PARTE TEÓRICA ....................................................................................................... 13 1.‐TECNICAS DE EXTRACCION CON DISOLVENTE ....................................................... 15 2.‐ MICROEXTRACCION LÍQUIDO‐LÍQUIDO ................................................................ 19 2.1.‐ EVOLUCIÓN HISTÓRICA DE LA TÉCNICA ........................................................ 21 2.2.‐ ESTADO DEL ARTE DE LAS TÉCNICAS DE MICROEXTRACCIÓN UTILIZADAS EN LA PRESENTE MEMORIA ................................................................................... 33 2.3.‐ ASPECTOS TEÓRICOS ...................................................................................... 37 2.4.‐ PARÁMETROS EXPERIMENTALES QUE AFECTAN A LA SME ....................... 49 3.‐ SONOQUÍMICA ........................................................................................................55 3.1. PRINCIPIOS GENERALES .................................................................................. 56 3.2. FENÓMENO DE CAVITACIÓN .......................................................................... 59 3.3.‐ PARÁMETROS QUE AFECTAN AL PROCESO DE CAVITACIÓN ...................... 61 3.4. PROCESO DE CAVITACIÓN EN SISTEMAS QUÍMICOS ................................... 65 3.5. INSTRUMENTACIÓN INVOLUCRADA EN LA TECNOLOGÍA DE LOS ULTRASONIDOS ..................................................................................................... 69 3.5. ALGUNAS DE LAS APLICACIONES DE LA ENERGÍA DE ULTRASONIDOS ...... 72 4.‐ DISEÑO DE EXPERIMENTOS ................................................................................... 77 4.1.‐ DISEÑO FACTORIAL ........................................................................................ 82 4.2. DISEÑO FACTORIAL FRACCIONADO .............................................................. 83 XVII ÍNDICE GENERAL 4.3. DISEÑO CENTRAL COMPUESTO ..................................................................... 87 5.‐ ANALITOS OBJETO DE ESTUDIO ........................................................................... 89 5.1.‐ PLAGUICIDAS ORGANOCLORADOS ............................................................... 89 5.2.‐ COMPUESTOS ODORÍFEROS ......................................................................... 92 5.3.‐ COMPUESTOS NITROAROMÁTICOS ............................................................. 93 REFERENCIAS .............................................................................................................. 95 • PARTE EXPERIMENTAL ......................................................................................... 103 1.‐ MICROEXTRACCIÓN EN GOTA .............................................................................. 105 2.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA .......................................... 131 3.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS ......................................................................................................... 149 4.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS ................................................................................ 181 • RESULTADOS Y DISCUSIÓN ................................................................................. 209 • CONCLUSIONES GENERALES .............................................................................. 229 • FUTURAS LINEAS DE INVESTIGACIÓN ................................................................. 233 • COMUNICACIONES A CONGRESOS ...................................................................... 237 • PUBLICACIONES .................................................................................................... 241 XVIII ÍNDICE GENERAL ÍNDICE DE FIGURAS (1) Figura 1. Esquema del proceso analítico total (TAP) ................................................................................. 9 Figura 2. Extracción líquido‐líquido mediante agitación en embudo de decantación ........................... 15 Figura 3. Esquema del dispositivo de microextracción en gota drop‐in‐drop ........................................ 22 Figura 4. Esquema del sistema de microextracción en gota empleado por Jeannot y Cantwell.......... 23 Figura 5. Esquema del sistema de microextracción en gota modificado por Jeannot y Cantwell ........ 24 Figura 6. Etapas de la microextracción en fase líquida dinámica ........................................................... 25 Figura 7. Diagrama esquemático del sistema de microextracción con disolvente con retroextracción .......................................................................................................................................... 26 Figura 8. Diagrama esquemático de HF‐LPME: (a) de dos fases y (b) de tres fases .............................. 28 Figura 9. Diagrama esquemático de SDME en flujo continuo ................................................................. 29 Figura 10. Diagrama esquemático de HS‐SDME ....................................................................................... 30 Figura 11. Diagrama esquemático de MASE ............................................................................................. 31 Figura 12. Diagrama esquemático de EME. .............................................................................................. 32 Figura 13. Tres pasos de la microextracción líquido‐líquido dispersiva. ................................................. 33 Figura 14. Intervalo de frecuencias del sonido......................................................................................... 55 Figura 15. Representaciones del movimiento del sonido ........................................................................ 57 Figura 16. Desarrollo y colapso de las burbujas de cavitación. .............................................................. 60 Figura 17. Colapso de las burbujas de cavitación en un medio homogéneo .......................................... 67 Figura 18. Colapso de burbujas de cavitación en un medio bifásico ...................................................... 68 Figura 19. Colapso de una burbuja de cavitación cerca de una superficie sólida. ................................. 69 Figura 20. Esquema de un baño de ultrasonidos ..................................................................................... 70 Figura 21. Esquema de un sistema de ultrasonidos provisto de sonda ................................................... 71 Figura 22. Esquema general de un proceso o sistema. ........................................................................... 78 Figura 23. Superficie de respuesta tridimensional. .................................................................................. 87 Figura 24. Estructura química de los dieciocho plaguicidas organoclorados estudiados. .................... 91 Figura 25. Estructura química de los dos compuestos odoríferos estudiados. ...................................... 92 Figura 26. Estructura química de los cinco explosivos nitroaromáticos estudiados. ............................ 93 (1) Excluyendo los artículos XIX ÍNDICE GENERAL ÍNDICE DE TABLAS (1) Tabla 1. Desarrollo histórico de la técnica de microextracción con disolvente. ..................................... 19 Tabla 2. Aplicaciones de la energía de ultrasonidos en la preparación de la muestra ........................... 74 Tabla 3. Comparación de la extracción Soxhlet convencional, asistida por ultrasonidos y una extracción convencional por ultrasonidos ............................................................................................... 76 Tabla 4. Diseño de Plackett‐Burman para N = 12 y k = 11. ......................................................................... 85 Tabla 5. Características representativas de los métodos desarrollados en la memoria ....................... 213 Tabla 6. Datos representativos de los métodos desarrollados en los trabajos 1 y 2 de la presente memoria. .................................................................................................................................................. 216 Tabla 7. Datos representativos de los métodos desarrollados en los trabajos 3 y 4 de la presente memoria ................................................................................................................................................... 219 Tabla 8. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 1 ............................... 220 Tabla 9. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 2 ............................... 221 Tabla 10. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 3 ............................. 223 Tabla 11. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 3.............................. 223 Tabla 12. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 4. ............................ 224 Tabla 13. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 4 con las muestras de agua de efluente residual mediante el método de adición de estándar. ........................................ 225 (1) Excluyendo los artículos XXI GLOSARIO DE TÉRMINOS Y ACRÓNIMOS GLOSARIO DE TÉRMINOS Y ACRÓNIMOS ABREVIATURA (Kd) ow DESCRIPCIÓN 2‐ADNT 2‐Amino‐4,6‐dinitrotolueno ANOVA Análisis de la varianza BTEXs Benceno, tolueno, etilbenceno y xileno CCCD Diseño central compuesto circunscrito CCD Diseño central compuesto CLSA Análisis de atrapamiento en circuito cerrado CV Coeficiente de variación DDSME Microextracción gota‐gota DLLME Microextracción líquido‐líquido dispersiva DOE Diseño de experimentos DSDME Microextracción en gota directamente sumergida DUSA‐DLLME Microextracción líquido‐líquido dispersiva directamente Coeficiente de distribución octanol‐agua asistida por ultrasonidos ECD Detector de captura de electrones EDAR Estación depuradora de aguas residuales EME Microextracción por electromembrana EPA Agencia de protección ambiental estadounidense ETAP Estación de tratamiento de agua potable GC Cromatografía de gases XXIII HCH Hexaclorociclohexano HF‐LPME Microextracción en fase líquida en fibra hueca HPLC Cromatografía de líquidos de alta resolución HS‐SDME Microextracción en gota de espacio en cabeza LDPE Polietileno de baja densidad LLE Extracción líquido‐líquido LLME Microextracción líquido‐líquido LOD Límite de detección LOQ Límite de cuantificación LPME Microextracción en fase líquida MASE Extracción con membrana microporosa MIB 2‐Metilisoborneol MIP Polímeros de impronta molecular MS Espectrometría de masas NE Explosivos nitroaromáticos NOOA Administración oceánica y atmosférica nacional OCPs Plaguicidas organoclorados OPPs Plaguicidas organofosforados OSPs Plaguicidas organosulfurados PAHs Hidrocarburos aromáticos policíclicos PCBs Bifenilos policlorados PEEK Polieteretercetona XXIV GLOSARIO DE TÉRMINOS Y ACRÓNIMOS PT Purga y atrapamiento PTFE Politetrafluoretileno (Teflón) r Coeficiente de correlación RSD Desviación estándar relativa S/N Relación señal/ ruido SBSE Extracción sobre barra agitadora SD Desviación estándar SDME Microextracción en gota SME Microextracción con disolvente SPE Extracción en fase sólida SPME Microextracción en fase sólida TAP Proceso analítico total TCA Antidepresivos tricíclicos THM Trihalometanos U Incertidumbre expandida USA‐DLLME Microextracción líquido‐líquido dispersiva asistida por ultrasonidos WHO Organización mundial de la salud WWTP Planta de tratamiento de aguas residuales XXV OBJETO OBJETO El desarrollo industrial conlleva una mejora sustancial en la calidad de vida de la población; comodidades insospechadas a principios del siglo XX son incuestionables en el siglo XXI. Pero este progreso lleva asociado un grave problema medioambiental; la población genera residuos en cantidades tan grandes y son tan diversos que su eliminación es difícil con lo que se plantea un problema de desarrollo sostenible a medio plazo. La sensibilización de la población hacia los problemas medioambientales empezó en la década de los setenta del siglo pasado. Esto se vio reflejado en la celebración del Primer Día de la Tierra en Estados Unidos. A través de los actos organizados en esta celebración, Nelson, senador americano, fue capaz de persuadir a la clase política estadounidense de la importancia de la legislación medioambiental y ese mismo año se aprobaron leyes tan importantes como el acta del aire limpio, de protección del agua potable y de los espacios naturales y los océanos. En julio de ese mismo año Richard Nixon propuso la creación de la Agencia de Protección Ambiental estadounidense (EPA) y la de la Administración Oceánica y Atmosférica Nacional (NOAA) entrando ambas en funcionamiento antes de que finalizara ese mismo año [1]. A partir de esa fecha, las estrategias empleadas para controlar la contaminación han pasado por diferentes etapas. Al principio era suficiente diluir los contaminantes presentes en efluentes o residuos para llegar a las concentraciones exigidas por la legislación. Sin embargo, cuando la cantidad y variedad de contaminantes aumentó, se hizo imprescindible tratar tanto los efluentes como los residuos. De esta manera surgieron los procesos de “end of pipe” diseñados para disminuir las concentraciones de éstos sin modificar el proceso que los generaba [2]. La finalidad de las leyes que se fueron aprobando desde el año 1970 hasta principios de la década de los 90 fue la de controlar el riesgo tratando los productos tóxicos y peligrosos generados. En 1990 se proclamó el Acta de Prevención de la Contaminación y es la única ley enfocada a prevenir la generación más que a tratar los 3 residuos con lo que, en parte, ha sido la que ha provocado un nuevo enfoque del problema y ha empezado a tomar cuerpo la idea de que la mejor forma de solucionar los problemas originados por los contaminantes es no generarlos. Este enfoque traslada los controles ambientales desde el final del proceso productivo hacia el proceso productivo en sí. Para lograrlo hay que cambiar la forma de pensar en la problemática medioambiental y evolucionar desde una planificación remediadora, es decir, pensar en que los residuos generados deben ser eliminados, hacia una preventiva, cuyo objetivo sea introducir en el proceso de producción las modificaciones necesarias para minimizar o incluso eliminar tanto la generación de efluentes y residuos como la utilización de sustancias tóxicas [2]. Como consecuencia de la promulgación de la ley de 1990, la Sociedad Química Americana desarrolló el concepto de Química Verde. La química verde o química beneficiosa para el medio ambiente se ocupa del diseño, desarrollo e implementación de productos o procesos químicos que reducen o eliminan el uso y generación de sustancias peligrosas para la salud humana o para el medio ambiente [2]. En este cambio se debe incluir al químico de control medioambiental y éste debe pasar de la monitorización del entorno para detectar contaminantes y buscar la forma de eliminarlos o minimizar sus efectos, a otra forma de afrontar el problema de la contaminación medioambiental para hablar de estrategias preventivas, así deberán ponerse en marcha mecanismos que permitan que su actividad resulte inocua para el medio ambiente. Partiendo de estas premisas generales, la presente memoria se ha centrado en el desarrollo de nuevos métodos de análisis basados en la extracción líquido‐líquido utilizando los principios y desarrollos de la miniaturización. Como resultado de ello, se han desarrollado nuevas metodologías de microextracción líquido‐líquido para la determinación de microcontaminantes orgánicos en muestras medioambientales o alimentarias de naturaleza líquida. 4 OBJETO El objetivo principal es aplicar los principios de la Química Verde a la preparación de la muestra con fines analíticos. Este objetivo se pretende conseguir: miniaturizando el proceso de extracción líquido‐líquido con lo que se eliminará o reducirá, en la medida de lo posible, la utilización de disolventes orgánicos y se reducirá la manipulación de la muestra en todo el proceso, utilizando herramientas quimiométricas para la optimización del método de preparación de la muestra ya que permiten realizarlo de forma más rápida y eficiente con un menor número de experimentos, empleando nuevos desarrollos instrumentales que no se han utilizado hasta la fecha en esta etapa del análisis. Con este objetivo general se ha intentado mejorar las metodologías analíticas existentes obteniendo los mismos o mejores límites de detección que en las técnicas de extracción líquido‐líquido clásicas, reduciendo los volúmenes empleados de sustancias tóxicas y optimizando el número de ensayos realizados en la puesta a punto del método a través del uso de herramientas estadísticas. El fin último es contribuir a la implantación de la química verde en el control medioambiental de la contaminación. Las técnicas de microextracción estudiadas han sido la microextracción en gota (SDME), la microextracción líquido‐líquido dispersiva (DLLME), la microextracción líquido‐líquido dispersiva asistida por ultrasonidos (USA‐DLLME) y la microextracción líquido‐líquido dispersiva directamente asistida por ultrasonidos (DUSA‐DLLME). La diferencia fundamental entre estas dos últimas técnicas es la forma de irradiar la muestra con energía de ultrasonidos. Mientras que en la primera se usa un baño de ultrasonidos, en la segunda se irradia directamente con un sonotrodo. La optimización de los métodos se ha llevado a cabo mediante la utilización del diseño de experimentos (DOE) como herramienta estadística. De esta manera se 5 reduce tanto el tiempo empleado en la optimización como el consumo de sustancias tóxicas. 6 INTRODUCCIÓN INTRODUC CCIÓN La Quím mica Analíticca se puede e definir com mo la parte e de la Quím mica que esstudia el conju unto de principios, p l leyes y téccnicas cuya finalidad d es la detterminación de la composición química de una muesstra naturaal o artificiial. Esta ciencia desaarrolla y mejo ora método os e instrum mentos paraa conseguirr dicho obje etivo [3]. La meto odología general utilizaada para taales fines se e denominaa Proceso A Analítico Total (TAP). El T TAP está fo ormado porr un conjun nto de procesos o etap pas realizad dos para soluccionar un determinad d do problem ma analítico o. En la sigu uiente figura se muesstran de form ma esquemáática las etaapas del TA AP [4]. Figura 1. Esquema del proceso a analítico totaal (TAP) [Fuen nte: Referenccia 4]. La definición del prroblema es la primeraa de las etap pas y en ellla se debe p plantear el tip po de análisis que se e necesita y y la escala de trabajo o. En la seg gunda etap pa debe realizzarse la ele ección del método an nalítico aco orde con la naturalezaa de las esp pecies a invesstigar y su concentracción; una vez elegido,, se proced de a su ejeccución en laa que se 9 realizará la optimización del mismo. Por último, se valoran los resultados obtenidos y se establece si se ha resuelto de forma satisfactoria el problema planteado. Si no es así, se debería reiniciar el proceso analítico total y replantear el problema. Como se puede ver en la Fig. 1, en el Proceso de Medida Químico la primera de las etapas consiste en la toma y preparación de la muestra, donde se incluyen las técnicas de separación. De una manera simplista, se puede afirmar que las técnicas de separación se utilizan en el proceso analítico para mejorar dos aspectos fundamentales del mismo: la selectividad y la sensibilidad. Cuando los métodos analíticos no poseen un nivel adecuado de estos parámetros para la resolución de problemas analíticos concretos, las técnicas de separación pueden paliar estas deficiencias. Las técnicas de separación se pueden dividir en dos grupos generales: i. El primer grupo lo formarían las técnicas que no comportan en sí la detección o determinación de las especies separadas; es decir, la medición de la señal analítica se efectúa de forma discontinua respecto a la separativa. ii. En el segundo grupo se encontrarían aquellas que implican la detección o determinación de las especies involucradas de manera continua después de ser separadas. Las técnicas más frecuentes de este grupo son la cromatografía de líquidos y de gases. Estas técnicas llevan integrados los sistemas de separación y de detección con lo que el cromatógrafo actúa globalmente como instrumento suministrando una información cualitativa y cuantitativa. Cuando la definición del problema es la búsqueda de microcontaminantes orgánicos es necesario utilizar los dos tipos de técnicas de separación acopladas; por un lado las separaciones que no comportan la determinación del analito y por otro la cromatografía ya sea de líquidos o de gases acoplada a un sistema de detección adecuado. 10 INTRODUCCIÓN Mientras que la cromatografía ha sufrido un desarrollo instrumental vertiginoso a partir de la segunda mitad del siglo XX, sigue existiendo una etapa de preparación de la muestra que es determinante de todo el proceso. Esto es debido a que los microcontaminantes orgánicos vienen acompañados de una matriz que puede presentar interferencias que es preciso eliminar ya que, en la mayoría de los casos, tienen características muy similares a los analitos buscados o simplemente perturban en la medición (efecto matriz). Por otro lado, cuando la concentración del analito es muy baja (análisis a niveles de trazas), es frecuente que la aplicación directa del método analítico bien no origine señal o ésta esté por debajo del límite de detección o determinación. En ambos casos es necesario un proceso de separación previo para eliminar interferentes y realizar una preconcentración del analito a identificar y cuantificar [5]. Esta etapa de extracción y concentración de la muestra ha sido objeto de numerosos estudios que persiguen conseguir la disminución del tiempo empleado, la disminución de los disolventes usados y la máxima automatización del proceso. Partiendo de las técnicas clásicas de extracción como son la extracción líquido‐ líquido (LLE) o la extracción en fase sólida (SPE), se han desarrollado nuevas técnicas de extracción que se podrían clasificar en dos grandes grupos; las técnicas de extracción en las que no se emplea disolventes como puede ser la microextracción en fase sólida (SPME) o la extracción sobre barra agitadora (SBSE) y las técnicas de extracción en las que sí se emplea disolvente y se estudia la miniaturización de la extracción líquido‐líquido (LPME). La miniaturización de la extracción con disolventes se puede enfocar desde dos puntos de vista diferentes, mediante la reducción de las dimensiones de un procedimiento ya existente o mediante el desarrollo de equipos y técnicas totalmente nuevas. En ambos casos el objetivo es maximizar la diferencia de volúmenes entre fase extractante (disolvente orgánico, líquido iónico o surfactante, entre otros) y la 11 muestra (normalmente fase acuosa), con el fin de mejorar el factor de enriquecimiento de los analitos y, de esta forma, eliminar o reducir la etapa posterior de concentración de la fase orgánica previa a la separación cromatográfica. 12 PARTE TEÓRICA TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 1.‐TECNICAS DE EXTRACCION CON DISOLVENTE La extracción líquido‐líquido es, junto con la destilación, la operación básica más importante para la separación de mezclas líquidas homogéneas. Consiste en separar una o varias sustancias disueltas en un disolvente mediante su transferencia a otro disolvente inmiscible, o parcialmente inmiscible. La especie del soluto A se distribuye entre una fase acuosa y otra orgánica. Esta distribución está gobernada por la Ley de Distribución [6,7] y se puede escribir como: Analito en la fase acuosa (Caq ) Analito en la fase orgánica (Cor ) En el equilibrio, la relación de concentraciones de A entre las fases acuosa y orgánica será constante e independiente de la cantidad total de A. Esto es: (1) donde Kd se denomina coeficiente de distribución y es constante cuando las sustancias no reaccionan químicamente en ninguna de las fases y la temperatura permanece constante. Esta técnica de separación se ha utilizado ampliamente para la extracción de analitos tanto orgánicos como inorgánicos contenidos en una muestra y su posterior determinación por técnicas cromatograficas o atómicas (Fig. 2). a) b) c) Figura 2. Extracción líquido‐líquido mediante agitación en embudo de decantación 15 El procedimiento consiste en añadir un disolvente orgánico inmiscible con el agua a la muestra acuosa (Fig. 2a), agitar vigorosamente (Fig. 2b) y dejar en reposo para separar ambas fases (Fig. 2c). Los distintos analitos presentes se distribuyen entre la fase acuosa y la orgánica de acuerdo con sus solubilidades relativas. De este modo, las sales inorgánicas que son prácticamente insolubles en los disolventes orgánicos más comunes, permanecerán en la fase acuosa, mientras que los compuestos orgánicos insolubles en agua, se encontrarán mayoritariamente en la fase orgánica. Como se ha descrito anteriormente, el equilibrio que se establece entre las dos fases para un determinado analito viene definido por el coeficiente de distribución Kd que se muestra en la ecuación (1). Cuanto mayor sea el valor de Kd más desplazado estará el equilibrio hacia el paso del analito a la fase orgánica por lo que aumentará la eficacia de la extracción. El coeficiente de distribución va a ser diferente para cada analito y para cada pareja de disolventes por lo que se tendrá que elegir qué tipo de disolvente se necesita para la extracción de un determinado analito. Para saber si la extracción va a ser eficaz, se dispone de valores tabulados de los coeficientes de distribución octanol‐agua ((Kd)ow) de una gran cantidad de compuestos orgánicos. Este coeficiente de distribución proporciona una medida de la hidrofobicidad de los compuestos. Las variables que influyen en la eficiencia del método de extracción líquido‐ líquido son: (i) El disolvente extractante. La selectividad se puede controlar mediante la correcta elección del disolvente extractante ya que existe una gran variedad de éstos con diferentes propiedades pudiéndose también utilizar mezclas para la modificación de las mismas. (ii) El pH de la muestra. Cuando el compuesto a extraer presenta diferentes formas más o menos polares dependiendo del pH, se puede modificar éste para conseguir la máxima extracción de la especie neutra. 16 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE (iii) La fuerza iónica. Esta propiedad hace que se desplace el equilibrio favoreciendo el paso del analito hacia la fase orgánica ya que disminuye la actividad del agua y se favorece la solvatación de los iones de la sal, es a lo que se denomina efecto de “salting‐out”. Por tanto, se suele utilizar una sal (NaCl, Na2SO4, etc.) para favorecer la extracción. (iv) La relación existente entre el volumen de disolvente extractante y el de muestra acuosa (relación de fases). Cuanto menor es la relación a un coeficiente de distribución dado, mayor será la concentración del analito en la fase orgánica. Se suele emplear un volumen de agua grande y un volumen pequeño de disolvente extractante. (v) El número de extracciones realizadas. Si se lleva a cabo una segunda y una tercera extracción, después de n extracciones la concentración final del analito en la fase acuosa disminuirá. La extracción es más eficiente si cada una de ellas se realiza con pequeñas porciones de disolvente como se ha visto en el apartado anterior. La extracción líquido‐líquido convencional es una técnica muy útil para la extracción de compuestos orgánicos de muy diferente naturaleza por la posibilidad de modificación de los parámetros anteriormente citados. Sin embargo existen una serie de inconvenientes en el uso de la misma, entre las que se encuentran: el tiempo de extracción es muy largo; se usa una gran cantidad de disolventes orgánicos. En muchos casos, estos disolventes son caros y presentan una alta toxicidad; se pueden formar emulsiones que provocan la pérdida del analito en estudio; las impurezas de los disolventes pueden aumentar su efecto en el proceso de concentración que se lleva a cabo antes de su análisis cromatográfico. pueden producirse pérdidas de compuestos debido al proceso de evaporación; 17 es muy difícil la automatización del proceso de extracción. Para solventar todos estos inconvenientes, o al menos parte de ellos, y aprovechar las ventajas de esta técnica de extracción se han aplicado los principios y metodologías de la miniaturización de la instrumentación analítica, resultando la microextracción líquido‐líquido (LLME). Desde la aparición de las primeras publicaciones se han desarrollado un gran número de variantes metodológicas así como de aplicaciones de las técnicas basadas en la miniaturización de la extracción líquido‐líquido ya que ofrece numerosas y grandes ventajas frente a otras técnicas de microextracción de compuestos orgánicos. 18 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 2.‐ MICROEXTRACCION LÍQUIDO‐LÍQUIDO La microextracción con disolvente (SME) se ha convertido en los últimos 10‐15 años en una de las formas más simples y fáciles de limpieza y preconcentración de microcontaminantes orgánicos a microescala [8]. En esta técnica de extracción se utilizan los principios de la extracción líquido‐ líquido y se aplica a volúmenes muy pequeños tanto de muestra como de disolvente extractante. En la tabla 1 se muestra un esquema del desarrollo histórico sufrido por la técnica de microextracción con disolvente: Tabla 1. Desarrollo histórico de la técnica de microextracción con disolvente. Año 1995 Autores Liu y Dasgupta Técnica desarrollada Desarrollan un método en el que un flujo de Ref. 9 gas pasa a través de una gota de líquido 1996 Liu y Dasgupta Desarrollan el sistema de extracción con 10 disolvente “drop‐in‐drop” 1996 Jeannot y Cantwell Introducen el término microextracción 11 líquido‐líquido 1997 Jeannot y Cantwell Utilizan una jeringa de cromatografía para 12 poner en contacto la gota con la muestra 1997 He y Lee Desarrollan la misma modalidad y definen, 13 además, el término LPME estática y dinámica 1998 Ma y Cantwell Utilizan tres fases usando un soporte de 14 membrana líquida y una gota acuosa de disolución aceptora 1999 Pedersen y Rasmussen Introducen la LPME introduciendo el 19 15 disolvente en una fibra hueca porosa 2000 Liu y Lee Desarrollan una técnica de microextracción 16 en flujo continuo 2001 Jeannot y col. Introducen simultáneamente la 17 2001 Vickackaite y col. microextracción en gota en el modo de 18 2002 Przyjazny y Kokosa espacio en cabeza 19 2002 Hauser y Popp Utilizan una membrana de polietileno de 20 baja densidad para separar la fase acuosa de la fase orgánica dentro de un vial 2006 Pedersen y Rasmussen Desarrollan la extracción con 21 electromembrana combinando la extracción en fibra hueca con los principios de la electroextracción 2006 Rezaee y col. Introducen la microextracción líquido‐líquido dispersiva Las ventajas que presenta este tipo de concentración e inyección en un sólo paso son: (i) no es necesario la concentración del disolvente al final del proceso de extracción con lo que no se introducen impurezas o pérdidas de compuestos de interés; (ii) el tiempo de extracción se reduce significativamente y; (iii) se reduce el volumen de disolventes tóxicos. Desde su introducción, la SME ha tenido un rápido desarrollo debido a que es barata, fácil de realizar, no se necesitan equipos especiales para llevarla a cabo, se puede considerar prácticamente libre de disolventes, existe una mejora en el enriquecimiento de los analitos, es relativamente fácil de automatizar y existe un amplio campo de aplicación [23]. 20 22 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE El volumen de disolvente extractante empleado en esta técnica oscila entre 1 y 5 µL con lo que la reducción frente a la extracción líquido‐líquido convencional se encuentra comprendida entre 100 y 1000 veces. Con la utilización de esta técnica de separación se cumple con el criterio ecológico de reducir el empleo de disolventes tóxicos. Por otro lado, el volumen de muestra utilizado está comprendido entre 1 y 10 mL; esto supone una reducción entre 50 y 500 veces frente a las técnicas convencionales de extracción líquido‐líquido. 2.1.‐ EVOLUCIÓN HISTÓRICA DE LA TÉCNICA 2.1.1.‐ Sistema de extracción con disolvente gota‐gota El grupo de investigación de Dasgupta desarrolló un nuevo método de microextracción con disolvente “drop‐in‐drop” [10] (Fig. 3). El dispositivo consistía en la formación de una gota de disolvente orgánico inmiscible en agua de aproximadamente 1,3 µL dentro de la gota de agua que contenía la muestra. La fase acuosa conteniendo el analito de interés se renovaba continuamente por un tubo situado en la parte superior y se aspiraba por un tubo conectado en la parte inferior. 21 Figura 3. Esquema del dispositivo de microextracción en gota “drop‐in‐drop” [Fuente: referencia 10] El sistema se utilizó para extraer pares iónicos formados por dodecilsulfato sódico y azul de metileno. La respuesta analítica del instrumento estaba linealmente relacionada con la concentración de dodecilsulfato sódico y se observó que la precisión se veía afectada por el volumen de la gota orgánica. Este dispositivo presentaba una serie de ventajas como puede ser la fácil automatización del proceso o el empleo de un volumen pequeño de disolvente orgánico. 2.1.2.‐ Microextracción en gota Jeannot y Cantwell [11] desarrollaron un primer sistema (Fig. 4) en el que se utilizaba una gota de 8 µL de un disolvente orgánico inmiscible con el agua conteniendo una cantidad fija de estándar interno. La gota se suspendía al final de una varilla de teflón sumergida en una disolución acuosa que contenía 4‐metilacetofenona como analito a investigar; la disolución acuosa estaba sometida a agitación. 22 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Figura 4. Esquema del sistema de microextracción en gota empleado por Jeannot y Cantwell [Fuente: Referencia 11] Después de un tiempo preestablecido, la varilla se retiraba de la disolución de la muestra y, con la ayuda de una microjeringa, se inyectaba 1 µL de la fase orgánica en un cromatógrafo de gases. Este sistema resulta interesante en términos de sensibilidad, precisión, tiempo de análisis, y su relativa simplicidad de manejo. Sin embargo, mantener la gota suspendida al final de la varilla de teflón resultaba un poco incómodo ya que requería llenar el hueco con el disolvente en el inicio del experimento para después recoger la gota al final del mismo con la microjeringa para poder inyectarla en el cromatógrafo de gases para su análisis. 2.1.3.‐ Utilización de una jeringa de GC como soporte de la gota de disolvente extractante Estos mismos autores [12] describieron un sistema en el que se utilizaba la misma jeringa con la que se inyecta la muestra en el cromatógrafo de gases para poner en contacto la gota de disolvente extractante con la muestra (Fig. 5). 23 Figura 5. Esquema del sistema de microextracción en gota modificado por Jeannot y Cantwell [Fuente: Referencia 12] La microextracción se realizó suspendiendo una gota de 1 µL de n‐octano como disolvente extractante en la punta de la aguja de una microjeringa. Ambas estaban sumergidas en una disolución acuosa agitada que contenía una mezcla de malation, 4‐ metilacetofenona, 4‐nitrotolueno y progesterona. Después de un tiempo preestablecido, la gota se retrotraía en la jeringa y se inyectaba directamente en el cromatógrafo de gases para su análisis. 2.1.4.‐ Microextracción en fase líquida (LPME) estática y dinámica Al mismo tiempo, He y Lee [13] propusieron dos modos de microextracción en fase líquida (LPME), definiendo la LPME estática y dinámica. Las dos modalidades implicaban el uso de una cantidad pequeña de disolvente (2 µL) contenido en una microjeringa convencional. La potencialidad de las dos modalidades de LPME se 24 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE demostró extrayendo 1,2,3‐triclorobenceno y pentaclorobenceno con una gota de tolueno. La modalidad de LPME estática utilizaba el mismo sistema que el utilizado por Jeannot y Cantwell [12]. La segunda modalidad, LPME dinámica, consistía en tomar el volumen de disolvente de extracción e ir cogiendo diferentes volúmenes de muestra e ir desechándolas tras un tiempo prefijado (Fig. 6). De esta forma se conseguía un aumento en la concentración de analito en el disolvente extractante. El problema que presentaba esta modalidad de extracción era la menor repetibilidad ya que resultaba difícil reproducir el movimiento de la jeringa con precisión. Figura 6. Etapas de la microextracción en fase líquida dinámica. (a) Introducción de la fase orgánica en la jeringa; (b) introducción de una porción de la fase acuosa en el interior de la jeringa; (c) expulsión de la fase acuosa [Fuente: referencia 13]. 25 2.1.5.‐ Microextracción líquido‐líquido‐líquido Ma y Cantwell [14] desarrollaron un sistema en el que la fase líquida orgánica se situaba sobre la fase acuosa que contenía los analitos de interés con la ayuda de un pequeño anillo de teflón. Sobre la fase orgánica se situaba una segunda fase acuosa aceptora (Fig. 7). Después de un tiempo de extracción predeterminado, una alícuota de la fase acuosa aceptora se inyectaba directamente en un cromatógrafo de líquidos de alta resolución para su cuantificación. La fase orgánica (o) consistía en 40 u 80 µL de n‐octano sobre 0,5 ó 1,0 mL de muestra acuosa (a1) a un pH de 13, contenidos en un vial de microextracción de 1 ó 2 mL de volumen y separados por un anillo pequeño de teflón; la muestra se agitaba a 2000 rpm. La fase aceptora (a2) consistía en 200 ó 100 µL de una disolución acuosa de NaH2PO4 (pH=2,1) y se situaba encima del anillo de teflón y la fase orgánica (o). Después de 30 min de extracción los compuestos utilizados como modelo (mefentermina y 2‐feniletilamina) se recogían en la fase aceptora (a2). Una alícuota de la fase a2 se inyectaba en un cromatógrafo líquido de alta resolución. Figura 7. Diagrama esquemático del sistema de microextracción con disolvente con retroextracción [Fuente: Referencia 14]. 26 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 2.1.6.‐ Microextracción en fase líquida en fibra hueca (HF‐LPME) En 1999 Pedersen y Rasmussen desarrollaron la microextracción en fase líquida en fibra hueca (HF‐LPME) [15]. Esta modalidad de microextracción consiste en impregnar los poros de una fibra hueca con un disolvente orgánico. HF‐LPME puede realizarse en la modalidad de dos o tres fases (Fig. 8). En HF‐LPME de dos fases los analitos se extraen desde la muestra acuosa a un disolvente orgánico inmiscible con el agua que está inmovilizado en los poros de la fibra hueca mientras que el interior de la fibra se llena con otra porción del mismo disolvente orgánico (disolución aceptora) (Fig. 8a). La extracción se basa en la difusión pasiva y forzada por las constantes de distribución de los analitos. Una porción del disolvente orgánico se inyectaba en un cromatógrafo de gases. Con la misma configuración se puede trabajar con la modalidad de HF‐LPME de tres fases. Los analitos extraídos desde la muestra acuosa pasan a través de una fina capa de disolvente orgánico inmiscible con el agua que se encuentra inmovilizado en los poros de la fibra hueca. Dentro del hueco de la fibra se introduce una segunda fase acuosa aceptora (Fig. 8b). Como en el caso anterior, los analitos se extraen por difusión pasiva basada en sus coeficientes de distribución. Para analitos básicos, la muestra debe ser alcalina y los analitos se recogen en una disolución acuosa ácida que se encuentra en el hueco de la fibra. En el caso de analitos ácidos la situación es la inversa, la muestra ha de tener un pH ácido y la disolución aceptora debe ser alcalina. Se inyecta en cromatografía líquida de alta resolución. 27 (a) (b) Figura 8. Diagrama esquemático de HF‐LPME: (a) de dos fases y (b) de tres fases 2.1.7.‐ Técnica de microextracción en flujo continuo Liu y Lee desarrollaron una técnica de microextracción líquido‐líquido en flujo continuo (Fig. 9) [16]. La extracción se llevó a cabo en una cámara de vidrio de 0,5 mL. Se usó un tubo de polieteretercetona (PEEK) para introducir una muestra acuosa a través de la cámara de extracción. Con la ayuda de una válvula de inyección de HPLC, se inyectaron 1‐5 µL de disolvente orgánico. Cuando el disolvente orgánico alcanzaba la salida del tubo de PEEK, la gota de disolvente orgánico se quedaba retenida en el tubo mientras que la muestra acuosa seguía fluyendo a través de la gota con lo que se favorecía la extracción. Una vez finalizada la extracción se usó una jeringa de cromatografía de gases para capturar e inyectar en el cromatógrafo de gases una alícuota de la gota de disolvente. 28 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Figura 9. Diagrama esquemático de SDME en flujo continuo [Fuente: Referencia 16] 2.1.8.‐ Microextracción en gota de espacio en cabeza (HS‐SDME) A principios de la década del 2000 se introdujo la microextracción en gota en la modalidad de espacio en cabeza independientemente por Theis, Waldack, Hansen y Jeannot [17], Tankeviciute, Kazlauskas y Vickaakaite [18] y Przyjazny y Kokosa [19]. Przyjazny y Kokosa y Theis y col. aplicaron la nueva modalidad de microextracción a la determinación de benceno, tolueno, etilbenceno y xileno (BTEXs) en agua mientras que Tankeviciute y col. lo aplicaron para la determinación de alcoholes en agua. En esta modalidad de microextracción, la microgota se mantiene en el espacio en cabeza existente sobre la muestra que puede ser líquida o sólida. Los analitos pasan en una primera etapa desde la matriz de la muestra hasta el espacio en cabeza, y de aquí, en una segunda etapa, a la gota (fase extractante) (Fig. 10). El procedimiento es idéntico al de microextracción en gota sumergida; la única variación es que la gota de extractante no entra en contacto directo con la muestra. Esto permite trabajar con matrices más complejas con un elevado número de interferentes, se puede aumentar la velocidad de agitación puesto que la estabilidad de la gota es mayor y, de esta manera, se aumenta la difusión de los compuestos a 29 analizar al espacio en cabeza consiguiendo mayor concentración en la fase extractante. Además, se puede utilizar tanto para la concentración de compuestos volátiles como semivolátiles. Figura 10. Diagrama esquemático de HS‐SDME [Fuente: Referencia 19] 2.1.8.‐ Extracción con disolvente asistida por membrana (MASE) En 2002 Hauser y col. propusieron la extracción con disolvente asistida por membrana (MASE) (Fig. 11) [20]. En esta modalidad la fase orgánica estaba separada de la fase acuosa por una membrana de polietileno de baja densidad (LDPE). La fase acuosa conteniendo los analitos de interés se introducía en un vial mientras que la fase orgánica se introducía dentro de la membrana. Después de agitar vigorosamente para favorecer el paso de los analitos a través de la membrana, se inyectó el disolvente extractante en un cromatógrafo de gases de grandes volúmenes. 30 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Figura 11. Diagrama esquemático de MASE [Fuente: Referencia 20] 2.1.9.‐ Extracción con electromembrana (EME) En 2006 Pedersen y Rasmussen desarrollaron la extracción con electromembrana [21]. Esta modalidad consistía en extraer sustancias cargadas de un volumen pequeño de muestra a través de una fina membrana de disolvente orgánico inmovilizado en la pared de una fibra hueca mediante la imposición de una diferencia de potencial entre la fase dadora (acuosa) y aceptora (orgánica). La imposición de una diferencia de potencial produce una migración electrocinética lo que favorece el transporte del analito (Fig. 12). 31 Figura 12. Diagrama esquemático de EME. [Fuente: Referencia 21] 2.1.10.‐ Microextracción líquido‐líquido dispersiva (DLLME) Rezaee y col. introdujeron en el 2006 la microextracción líquido‐líquido dispersiva [22] (Fig. 13). La técnica consistió en mezclar 8,0 µL de tetracloroeteno como disolvente extractante con 1,0 mL de acetona como disolvente dispersante. El dispersante posee una alta miscibilidad tanto con el disolvente extractante como con la fase acuosa. La mezcla se inyectó rápidamente con una jeringa en una muestra acuosa de 5,0 mL conteniendo los analitos de interés. En ese momento se formaba una nube en la que el disolvente extractante se encontraba en forma de una gran cantidad de gotas pequeñas disperso en la fase acuosa. Después de centrifugar la muestra, el disolvente extractante se depositó en un tubo con fondo cónico. Finalmente, una alícuota del disolvente extractante se inyectó en un cromatógrafo de gases. 32 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Figura 13. Tres pasos de la microextracción líquido‐líquido dispersiva. La utilización de un volumen grande de disolvente dispersante hace que exista competencia en la extracción de los analitos entre éste y el disolvente extractante. Una manera de eliminar el disolvente extractante es utilizar la energía de ultrasonidos para producir la rotura del disolvente extractante dentro de la muestra que contiene los analitos de interés. La microextracción líquido‐líquido dispersiva asistida por ultradonidos (USA‐ DLLME) se puede llevar a cabo utilizando un baño ultrasónico [24] o mediante la introducción de una sonda de ultrasonidos directamente en la muestra (DUSA‐DLLME) [25]. 2.2.‐ ESTADO DEL ARTE DE LAS TÉCNICAS DE MICROEXTRACCIÓN UTILIZADAS EN LA PRESENTE MEMORIA 2.2.1.‐ Microextracción en gota Una de las primeras modificaciones sufrida por este modo de microextracción líquido‐líquido ha sido la utilización de líquidos iónicos como extractantes en sustitución de los disolventes orgánicos convencionales. En 2003 Liu y col. [26] utilizaron líquidos iónicos en los modos de inmersión directa y espacio en cabeza para 33 extraer hidrocarburos policíclicos aromáticos de una muestra de agua y su posterior determinación por HPLC. En 2006 Yancheng y col. [27] introdujeron el término microextracción en gota directamente sumergida (DSDME). Esta modalidad consistía en utilizar una gota de disolvente orgánico inmiscible en agua y de menor densidad que ésta. La gota se depositaba libremente en la superficie de la muestra acuosa y se agitaba. Después de la extracción, la gota de extractante se recolectaba con una jeringa y se procedía a su análisis por cromatografía de gases. Otra forma descrita para recoger el extractante consiste en situar la muestra en un baño de hielo; el extracto orgánico se solidifica lo que premite recogerlo con unas pinzas. Seguidamente se situa en un vial donde al calentar vuelve al estado líquido. Finalmente se toma una alícuota y se realiza el análisis [28]. En el mismo año 2006, Wu y col. [29] publicaron la microextracción “drop‐to‐ drop” (DDSME). Ésta es una versión miniaturizada de la inmersión directa donde los volúmenes de disolvente extractante y de la muestra son muy pequeños. El tiempo de equilibrio es muy rápido debido a la pequeña relación de volúmenes lo que hace que no sea necesaria la agitación de la muestra. Otra variante de la microextracción en gota lo constituye la microextracción en gota coacervativa. López Jiménez y col. [30] han publicado esta modalidad de SDME en la que se forma una gota de coacervato que se pone en contacto con la muestra acuosa. Los coacervatos son líquidos ricos en coloides donde los analitos objeto de estudio quedan retenidos en las miscelas de un surfactante. Tienen una parte polar y otra parte apolar por lo que se pueden utilizar para la extracción de un amplio rango de compuestos. Una vez extraidos los compuestos, se recoge la gota de coacervato y se inyecta en un cromatógrafo líquido de alta resolución. 34 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 2.2.2.‐ Microextracción líquido‐líquido dispersiva Desde su introducción en 2006 por Rezaee y col. [22], la modalidad de microextracción líquido‐líquido dispersiva ha sufrido diversas modificaciones. En 2007 Farajzadeh y col. [31] publicaron la utilización de esta modalidad para extraer compuestos orgánicos y permitir su determinación por HPLC. En este artículo el disolvente empleado para la extracción se llevó a sequedad y se redisolvió con un disolvente apto para su inyección por HPLC, en este caso acetonitrilo. La ventaja de esta modalidad es el poder analizar compuestos polares. En el mismo año Wei y col. [32] presentaron la posibilidad de la inyección directa en HPLC sin necesidad del paso de evaporación y redisolución inyectando el extracto de tetracloroetano en fase reversa. Otras dos mejoras en DLLME las introdujeron Assadi y col. en 2007. La primera de ellas fue realizar una derivatización simultáneamente con la dispersión [33]. La segunda de ellas consistió en una derivatización simultánea combinada con SPE [34]. En 2010 se han publicado dos artículos combinando DLLME con SBSE [35] y con extracción con fluidos supercríticos [36] por Farajzadeh y col. y Rezaee y col. respectivamente. La búsqueda de disolventes menos tóxicos para el medio ambiente que los utilizados hasta el momento como fase extractante ha dado lugar a la utilización de alcoholes de cadena larga o hidrocarburos en lugar de disolventes clorados. Estos disolventes son menos densos que el agua con lo que se quedan en la superficie de la muestra acuosa después de la centrifugación. Se han publicado dos formas para recuperar el disolvente extractante. La primera de ellas consistió en congelar el disolvente extractante, recogerlo con una espátula y, después de licuarlo, inyectarlo en el cromatógrafo de gases [37]. El segundo consiste en utilizar tubos de centrífuga especiales. Se han descrito diferentes formas para estos tubos [38‐40]. 35 Otra manera de eliminar el uso de disolventes clorados es la utilización de líquidos iónicos que, debido a su baja presión de vapor, los hace relativamente seguros en los experimentos de laboratorio. La mayoría de los artículos emplean líquidos iónicos más densos que el agua ya que resultan más cómodos de manejar que los disolventes menos densos que ésta. Los líquidos iónicos se han inyectado directamente en HPLC [41,42] o bien se han diluido antes del análisis. Esta dilución del líquido iónico se ha llevado a cabo utilizando el constituyente orgánico de la fase móvil [43‐44] o diluyendo el extracto del líquido iónico con la fase móvil [45]. En este sentido, otra de las tendencias ha sido eliminar el dispersante utilizando la energía ultrasónica para producir la dispersión del líquido iónico en la muestra de agua [46]. Otra alternativa ha sido calentar y enfriar la muestra. En este procedimiento, la muestra con el líquido iónico añadido, se calienta hasta obtener un líquido homogéneo posteriormente se enfría y se centrifuga. Este procedimiento se denomina microextracción líquido‐líquido con temperatura controlada [47]. En 2009 Yao y Anderson [48] han publicado la formación del líquido iónico in situ produciendo una reacción de metatesis. Primero se disuelve un líquido iónico soluble en agua (en forma de cloruro) y posteriormente se añade una sal que intercambia el anión fomando un líquido iónico insoluble en agua, formando una disolución turbia. La extracción y reacción de metátesis en un solo paso hace que la transferencia de analitos en la fase extractante sea más rápida y eficiente. Papadopoulou y col. [49] han publicado la microextracción líquido‐líquido dispresiva sustituyendo la energía de ultrasonidos por la agitación con Vortex para producir la dispersión del disolvente exrtractante en la muestra acuosa. Se ha reportado la utilización de partículas suspendidas en polímeros de impronta molecular (MIP) para introducir mayor selectividad a la DLLME. El sorbente se eliminó de la muestra por filtración [50]. 36 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE También se ha descrito la utilización de nanopartículas magnéticas para mejorar el procedimiento de DLLME. Estas partículas se eliminaron de la muestra utilizando un campo magnético externo [51]. 2.3.‐ ASPECTOS TEÓRICOS El proceso de microextracción líquido‐líquido se basa en las diferencias de concentración del analito entre las dos fases inmiscibles acuosa y orgánica. El transporte de las moléculas de analito desde la disolución acuosa a la microgota viene limitado por la baja velocidad de difusión de éstas en las fases condensadas (acuosa y/u orgánica). Aunque la temperatura y la viscosidad juegan un papel importante en esta velocidad de difusión, la mejor manera de aumentarla es mediante la reducción de la distancia a la que se debe producir la difusión. Ésta es la razón por la que las muestras se deben agitar durante el proceso de microextracción. Esta agitación se puede llevar a cabo mediante agitación magnética, vibración mecánica o movimiento del émbolo de la jeringa para aumentar la cantidad de mezcla convectiva o el área interfacial de contacto. El tiempo requerido para alcanzar el equilibrio en la microextracción en gota puede ser desde segundos hasta horas dependiendo del grado de agitación, del volumen de las fases, del área interfacial de contacto y de la constante de distribución de los analitos. Por ello, y para evitar excesivos tiempos de equilibrio se puede llevar a cabo la microextracción bajo condiciones de no‐equilibrio (control cinético). Incluso en las situaciones en las que se llega al equilibrio, rara vez se puede considerar una técnica exhaustiva ya que una parte significativa del analito se queda en la disolución acuosa cuando se ha alcanzado el equilibrio. Esto se debe a la pequeña relación existente entre el volumen de la fase orgánica y la acuosa [8]. 37 Para explicar el proceso que tiene lugar en la microextracción en gota, Liu y Dasgupta propusieron un modelo radial de difusión donde la gota se asumía esférica y estanca [9]. Por otro lado, Jeannot y Cantwell propusieron un modelo general de equilibrio y de transferencia de masas en un sistema de microextracción líquido‐líquido en dos fases [11,12]. Éste es el modelo teórico que se desarrollará a continuación en el que se establecen consideraciones termodinámicas y cinéticas. Las consideraciones termodinámicas se utilizan para profundizar en los aspectos de equilibrio de la microextracción con disolvente (SME) en todas sus modalidades; y el tratamiento cinético detallado se emplea con el fin de comprender y controlar las características que determinan la velocidad del proceso de microextracción en el que, como se ha comentado anteriormente, se trabaja generalmente en condiciones de no‐equilibrio [52]. 2.3.1‐ Consideraciones termodinámicas La microextracción con disolvente se basa en la distribución del analito entre la fase que contiene la muestra, normalmente acuosa, y la fase extractante, normalmente orgánica. El balance de masas establece que en todo momento el analito presente en la fase acuosa y orgánica ha de ser igual a la cantidad inicial de analito en la muestra: C , V C V C V (2) donde: Caq,ini y Caq son la concentración inicial y en el equilibrio en la fase acuosa respectivamente, Cor es la concentración en el equilibrio en la fase orgánica, Vor es el volumen de la fase orgánica, Vaq es el volumen de la fase acuosa. 38 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Teniendo en cuenta la ecuación del coeficiente de distribución definida en la página 15 (ecuación (1)) y combinando ambas ecuaciones, se puede expresar la concentración de equilibrio en la fase orgánica como [12]: C , K C (3) / donde: Kd es el coeficiente de distribución definido en la ecuación (1) (ver página 15) De este modo, Kd y/o Caq,ini deben ser suficientemente grandes y la relación de fases Vor / Vaq debe ser razonablemente pequeña para que la concentración del analito en la fase orgánica cuando se alcance el equilibrio sea suficientemente grande [12]. El equilibrio en SME de espacio en cabeza se puede explicar incorporando dos coeficientes de distribución y en la ecuación del balance de masas las tres fases implicadas en el proceso [52]: (4) , , C , V (5) C V C V C V (6) donde: K g, aq es el coeficiente de distribución entre la fase gaseosa y la acuosa, K or,g es el coeficiente de distribución entre la fase orgánica y la gaseosa, y Cg y Vg son la concentración del analito en la fase gaseosa y el volumen de esta fase, respectivamente. El coeficiente de distribución total entre la fase orgánica‐fase acuosa se puede expresar como: 39 K K , , K (7) , Combinando las ecuaciones (6) y (7) tenemos: C , , ⁄ , , ⁄ (8) Si Vg es suficientemente pequeña, la ecuación (8) se reduce a la ecuación (3) para dos fases. Como en el sistema de dos fases, la Cor en el equilibrio será mayor cuando el volumen orgánico y del espacio en cabeza sean suficientemente pequeños y/o las constantes de distribución no sean muy altas. 2.3.2.‐Consideraciones cinéticas 2.3.2.1.‐ Transferencia de masa por difusión y leyes de Fick La velocidad de transporte de las moléculas de analito a través de las fases a nivel molecular está gobernada por el movimiento molecular aleatorio o difusión. Las moléculas en disolución están sometidas a un movimiento de traslación y la dirección y la velocidad de este movimiento está constantemente cambiando por las colisiones e interacciones que se producen con las moléculas de disolvente. Debido a la naturaleza aleatoria de este movimiento, la velocidad media de un conjunto de moléculas es cero. A pesar de esto, hay una varianza asociada con esta media por lo que una molécula determinada experimentará un movimiento de traslación neta en un período de tiempo determinado. Por lo tanto, un conjunto de moléculas inicialmente concentradas en un punto, en una línea o en un plano se extenderán o difundirán a lo largo del tiempo. En general, debido al movimiento molecular aleatorio, la concentración de moléculas tenderá a igualarse en el disolvente a lo largo del tiempo y se moverán de la región de mayor concentración a la de menor [52]. Hay dos leyes matemáticas que describen el proceso [12]: 40 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 1. La primera ley de difusión de Fick que describe el flujo de moléculas como una función del gradiente de concentración (dC/dx): D (9) donde: n es el número de moles, A es el área y t es el tiempo. La constante de proporcionalidad entre el gradiente de concentración y el flujo es el coeficiente de difusión D que tiene unidades de cm2 s‐1. El signo negativo significa que la difusión se produce desde la zona de concentración más alta a la más baja. Los coeficientes de difusión en la fase gas son relativamente altos (del orden de 0,1 cm2 s‐1) ya que existen pocos obstáculos al movimiento de traslación en esta fase, mientras que los coeficientes de difusión de las moléculas de soluto en la disolución líquida son mucho más pequeños (del orden de 10‐5 cm2 s‐1). Por este motivo comprender y controlar las velocidades de difusión en la fase líquida es muy importante. Los coeficientes de difusión en líquidos se pueden medir experimentalmente o estimarlos por uno de los numerosos modelos empíricos o teóricos existentes. En general, la mayoría de modelos establecen una función directa de D con la temperatura y una relación inversa con la viscosidad del disolvente y el tamaño de la molécula que difunde. Por tanto, con estos tres parámetros experimentales podemos controlar la velocidad de difusión aunque no se conozca la dependencia exacta. 2. La segunda ley de difusión de Fick es una ecuación diferencial que establece la variación de concentración con relación al tiempo y sólo se puede resolver exactamente para una serie de casos sencillos: 41 D (10) La segunda ley de difusión de Fick establece que para gradientes lineales de concentración (donde d2C/dx2 es cero) no hay cambio neto en la concentración, aunque sí pueda haber un transporte neto de moléculas de acuerdo a la primera ley de Fick. En otras palabras, con un gradiente de concentración lineal tenemos una situación de estado estacionario. Por otro lado, un gradiente de concentración no lineal da lugar a una acumulación o agotamiento de concentración (estado inestable) de acuerdo con la segunda ley de Fick [52]. 2.3.2.2.‐ Transferencia de masa convectivo‐difusivo Para facilitar la transferencia de masa de las moléculas de analito entre las fases es conveniente la agitación (convección) de una o de todas las fases líquidas en cada una de las modalidades de SME. De una manera simplista se puede pensar que la convección es una forma de reducir la distancia a la que deben darse los procesos de difusión. Este es el motivo por el que se han desarrollado modelos específicos para explicar las contribuciones combinadas de la convección y la difusión en la relación de transferencia de masa total en SME. Los dos métodos más comunes de agitación de la fase líquida son la agitación magnética y la vibración mecánica. En ambos casos, el flujo que se genera en el seno de la fase líquida se emplea para lograr la mezcla dentro de esta fase o renovar el área interfacial de contacto entre las dos fases. Es inviable una descripción exacta del comportamiento hidrodinámico de la fase líquida y su dependencia con las variables experimentales, como la velocidad de agitación o la geometría de la barra agitadora, pero sí se pueden construir modelos de fenómenos convectivo‐difusivo simples pero útiles y también modelos de agitación a los que se les puede tratar de manera similar a los modelos de transferencia de masa. 42 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Los postulados básicos planteados para enunciar la teoría de transferencia de masa son los siguientes: 1. La velocidad de transferencia de masa hacia o desde la interfase al seno de cualquier fase será proporcional a la diferencia de concentración entre el seno de la disolución y la concentración en la interfase. La constante de proporcionalidad se denomina coeficiente de transferencia de masa. 2. Suponemos que hay una adsorción insignificante de las moléculas de analito en la propia interfase. En otras palabras, no habrá acumulación o agotamiento del analito en la interfase. 3. Suponemos que no hay resistencia a la transferencia en la propia interfase; es decir, el equilibrio de distribución prevalecerá en todo momento en cada fase inmediatamente adyacente a la interfase. Con estos supuestos básicos se puede formular los modelos de transferencia de masa para sistemas de dos o tres fases y adaptarlos a las circunstancias específicas asociadas a los diferentes modos de SME [52]. 2.3.2.3.‐ Modelo de transferencia de masa cinética entre dos fases Los dos primeros postulados se pueden combinar y expresar matemáticamente como: β C C β , C , C (11) donde: Ai es el área interfacial agua‐disolvente orgánico, n el número de moles de analito, βaq y βor son los coeficientes de transferencia de masa en la fase acuosa y orgánica respectivamente, Caq y Cor son las concentraciones en el seno de la fase acuosa y orgánica respectivamente, y 43 Caq,i y Cor,i son las concentraciones en la fase acuosa y en la fase orgánica inmediatamente adyacentes a la interfase respectivamente. La igualdad de flujos hacia y desde la interfase satisface el segundo postulado. El tercer postulado puede enunciarse como: K , , (12) donde Kd es el coeficiente de distribución en el equilibrio. El cambio de concentración en la fase orgánica en función del tiempo se puede obtener combinando las ecuaciones (11) y (12), y la ecuación diferencial resultante será: k C El término β β ⁄ β K β C (13) es el coeficiente de transferencia de masa total: β (14) o lo que es lo mismo: (15) El coeficiente de transferencia de masa total se puede considerar como la constante de proporcionalidad entre el flujo de las moléculas de analito en la interfase y la diferencia entre la concentración en la fase orgánica en el equilibrio y la concentración en un instante t de la fase acuosa y la concentración real de la fase orgánica. Cuando el sistema está realmente en equilibrio, KdCaq= Cor y la ecuación (13) tiende a cero. Escribir la ecuación inversa es útil ya que permite visualizar que el proceso de transferencia de masa total es la suma de dos resistencias a transferir masa: la resistencia de la fase acuosa (Kd/βaq) y la resistencia de la fase orgánica (1/βor). Esto da 44 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE idea de la importancia relativa de la transferencia en ambas fases, dado que Kd es normalmente mucho más grande que la unidad para cualquier aplicación típica de SME, la resistencia de la transferencia de masa en la fase acuosa será más importante y será el paso determinante de la velocidad de transferencia de masa entre las fases. Por lo tanto, es más importante incrementar el coeficiente de transferencia de masa en la fase acuosa (mejorando la agitación de esta fase) que el de la fase orgánica. Por otro lado, podemos escribir Caq en términos de Cor por las consideraciones del balance de masas (Ecuación (3)) y sustituir en la ecuación (13), resultando una ecuación diferencial de primer orden. La solución general es: , C ⁄ (16) donde k es la constante de velocidad del proceso de extracción: k β K 1 (17) Por último, la constante de la ecuación (16) se puede evaluar mediante la sustitución de las condiciones iniciales de Cor=0 a t=0 y sabiendo que el primer término del lado derecho de la ecuación (16) es la concentración de equilibrio en la fase orgánica que llamaremos C∞or, de esta manera la ecuación (16) se convierte en: C C 1 e (18) Por lo tanto, la concentración en la fase orgánica es cero a tiempo cero y se aproxima a un valor constante ∞ con el tiempo. Los valores de la concentración frente al tiempo se ajustan experimentalmente muy bien a la ecuación (18) para varios de los sistemas de SME. 2.3.2.3.1.‐ Variables experimentales 1. Un incremento en el área de la interfase tiene un efecto directo sobre la constante de velocidad k (ecuación 17). 45 2. El efecto que producen los volúmenes de la fase acuosa y orgánica sobre la constante de velocidad es mucho más complejo. Consideremos primero el caso en que KdVor/Vaq es mucho menor que la unidad, en este caso el término KdVor/Vaq +1 de la ecuación (17) tiende a la unidad y k es independiente de Vaq. Esto tiene sentido ya que no está cambiando la composición de la fase acuosa por lo que su concentración se mantiene esencialmente sin cambios. También, en este caso, la constante de velocidad es inversamente proporcional a Vor. Esto vuelve a tener sentido ya que un volumen pequeño de fase orgánica se equilibrará más rápidamente con la fase acuosa. En el otro extremo, una extracción exhaustiva donde KdVor/Vaq es mucho más grande que la unidad, la velocidad de transferencia de masa se convierte en independiente de Vor pero es inversamente proporcional a Vaq. Sin embargo, el escenario más típico es cuando el valor de KdVor/Vaq se sitúa entre los dos extremos. En este caso la velocidad se mejora haciendo ambos volúmenes, Vor y Vaq, lo más pequeños posible. 3. El coeficiente de transferencia de masa total tiene un efecto directo sobre k. Aumentando β se produce un aumento de k. Esto se logra incrementando la velocidad de convección a través de la agitación o la vibración mecánica. Los factores que aumentan el coeficiente de distribución, como puede ser la temperatura, también pueden usarse para aumentar el coeficiente de transferencia de masa total. Como se mencionó anteriormente, el impacto de la transferencia de masa en el medio acuoso frente a la transferencia de masa en el medio orgánico depende de la magnitud de Kd. 4. La velocidad de extracción es semi‐independiente de Kd, como se puede ver examinando las ecuaciones (14) y (17) a menos que KdVor/Vaq<<1 en cuyo caso la constante de velocidad se aproxima a una relación inversa con Kd (aumenta la velocidad al disminuir Kd). Por otro lado, la cantidad extraida en el equilibrio obviamente aumenta al aumentar Kd. 46 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 2.3.2.3.2‐ Modelo cinético para técnicas de microextracción en gota Para la modalidad de gota en SME, donde el disolvente extractante se presenta en forma de una gota suspendida y existe una agitación de la disolución acuosa, hay evidencias de la existencia de convección inducida en la gota orgánica como resultado de la transferencia de energía a través de la interfase. Por lo tanto, tenemos transferencia de masa convectivo‐difusiva en las dos fases. Existen, al menos, dos modelos específicos convectivo‐disfusivo que describen la velocidad de transferencia de masa: la teoría de la doble capa de Whitman y la teoría de penetración de Higbie. Teoría de la doble capa de Whitman Esta teoría, propuesta inicialmente por Nernst [53] y posteriormente desarrollada por Lewis y Whitman [54], asume la mezcla completa entre la fase acuosa y orgánica a una distancia δaq y δor respectivamente. Entre estas películas de espesor δaq y δor la disolución se asume estanca y la transferencia de masa es por difusión molecular. La disminución de la película se logra en este modelo aumentando la agitación y se asume que los gradientes de concentración se encuentran en estado estacionario en ambos lados de la interfase. Combinando la primera ley de Fick (9) con la ecuación (11) en el caso de gradientes de concentración lineal se definen los coeficientes de transferencia de masa acuoso y orgánico: β β (19) donde Daq y Dor representan los coeficientes de difusión en las fases acuosa y orgánica respectivamente. De acuerdo con estas ecuaciones (19) existe una proporcionalidad lineal entre β y δ. Teoría de penetración de Higbie Esta teoría fue propuesta por Higbie [55] y más tarde modificada por Danckwerts [56]. En la misma se postula que la convección del flujo tiene lugar hasta en el interior de la interfase, por lo que la película no es estanca. En la interfase, un 47 pequeño volumen de flujo de una de las fases está momentáneamente en contacto con la otra fase por un tiempo de exposición determinado te. Transcurrido ese tiempo el volumen se mezcla de nuevo en el seno de la disolución. La transferencia de masa del soluto se produce a través del estado estacionario de difusión lineal para el incremento de tiempo te. La expresión resultante para el coeficiente de transferencia de masa de las dos fases es: β 2 (20) donde te es constante para una velocidad constante de agitación. A mayores velocidades de agitación, el valor de te es más pequeño. En contraste con la dependencia lineal que predice la teoría de la doble capa, esta teoría establece la dependencia de β con la raíz cuadrada de D. Se puede obtener experimentalmente la relación funcional entre βaq y Daq ya que se pueden medir cada uno de ellos independientemente. Jeannot y Cantwell [12] demostraron experimentalmente que la teoría de la doble capa predice mejor los valores de Daq . 2.3.2.3.3.‐ Modelo para SME dispersiva Los métodos de SME dispersiva implican la dispersión de un disolvente orgánico en muchas gotas muy finas suspendidas en la fase acuosa. El área interfacial, por lo tanto, es muy grande y la pequeña relación Vor/Vaq hace que el equilibrio se alcance rápidamente, por lo que SME dispersiva se considera una técnica de extracción de equilibrio. Para ilustrarlo, se considera la raíz cuadrada de la distancia media (d) atravesada por una molécula con coeficiente de difusión (D) en un corto periodo de tiempo (t). Esta distancia viene dada por la relación de Einstein‐Smoluchowski [57]: d 48 √2Dt (21) TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE Para un coeficiente de difusión de 5*10 ‐6 cm2 s‐1 y un periodo de tiempo corto de 10 s, esta distancia es de 0,01 cm. Existen tratamientos rigurosos sobre la difusión desde la fase acuosa a las pequeñas gotas de disolvente pero tales modelos de transferencia de masa no tienen prácticamente importancia en tiempos tan cortos como los de SME dispersiva [52]. 2.4.‐ PARÁMETROS EXPERIMENTALES QUE AFECTAN A LA SME La microextracción con disolvente es una técnica relativamente nueva aunque ha experimentado un desarrollo muy rápido. Las condiciones experimentales se deben optimizar para cada analito específico y en cada matriz determinada, pero el gran número de artículos publicados recientemente facilitan esta labor y se pueden encontrar recomendaciones que sirvan como punto de partida para el desarrollo de nuevos métodos. Como punto de partida los parámetros que se deben tener en cuenta son: 1. Propiedades del analito 2. Propiedades del disolvente de extracción 3. Volumen del disolvente extractante 4. Agitación 5. Fuerza iónica 6. Temperatura 7. Volumen de muestra y de espacio en cabeza 8. pH 9. Tiempo de extracción 2.4.1.‐ Propiedades del analito Para determinar qué tipo de técnica de microextracción utilizar se debe tener en cuenta la volatilidad (punto de ebullición), ionización (para ácidos y bases) y la 49 polaridad tanto de la matriz como del analito. Estas propiedades afectan a dos parámetros importantes, el coeficiente de distribución de la fase extractante/agua (Kd) y el coeficiente de distribución gas/agua (Kg,aq) [8]. 2.4.2.‐ Propiedades del disolvente de extracción Elegir el disolvente de extracción más adecuado es una de las labores más importantes para obtener unos buenos resultados. Éste debe cumplir una serie de condiciones mínimas para su utilización como extractante en las diferentes técnicas de SME: Buena selectividad para los analitos objeto de estudio. Alta eficiencia de extracción de los analitos. El coeficiente de distribución del analito entre la fase extractante y la muestra debe ser grande, es decir, la polaridad del disolvente debe coincidir con la del analito. Inmiscible o parcialmente inmiscible con la muestra. El disolvente debe ser inmiscible en la muestra o al menos tener una baja solubilidad. En el caso de la modalidad de espacio en cabeza este requisito no es necesario ya que el disolvente no entra en contacto con la muestra acuosa. Compatible con la técnica analitica de determinación. Se debe tener en cuenta si la determinación se va a realizar por cromatografía de líquidos o de gases, con detectores específicos o universales, etc. Buen comportamiento cromatográfico. El pico de disolvente no debe interferir con los picos de los analitos objeto de estudio. Baja volatilidad para minimizar la pérdida de disolvente durante la extracción. Bajo coste y buena disponibilidad. Alta pureza. Ausencia de contaminantes que interfieran con la determinación. Baja toxicidad. 50 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE 2.4.3.‐ Volumen del disolvente de extracción La selección del volumen de extractante dependerá de tres factores: la cantidad de analito que se debe extraer para conseguir un análisis cuantitativo (sensibilidad), los requisitos de la técnica de SME empleada y el volumen de extractante que se puede introducir en el instrumento de medida. El uso de gotas grandes de disolvente lleva asociado un incremento en la respuesta analítica del equipo para todas las técnicas de SME. Sin embargo, para la técnica de SDME, tanto en su modo de inmersión directa como de espacio en cabeza, las gotas grandes además de ser difíciles de manejar en el proceso de extracción presentan problemas en la detección cromatográfica. En el caso de la DLLME los volúmenes de disolvente orgánico empleados van desde 10 a 200 µL. Por otro lado, volúmenes grandes de inyección pueden provocar un ensanchamiento de los picos en cromatografía de gases de alta resolución. 2.4.4.‐ Agitación La agitación incrementa la transferencia de masa de los analitos sobre todo en sistemas de dos fases. En el caso de DLLME no es necesaria la agitación ya que el equilibrio entre fases es prácticamente instantáneo ya sea con la utilización de un agente dispersante o mediante cualquier otro medio (e.g. sonicación). Como se ha visto en los aspectos teóricos de la microextracción en gota un aumento en la velocidad de agitación produce una disminución de la película de difusión de Nernst. Esto hace que aumente la transferencia de masa. La limitación a la velocidad de agitación la impone la inestabilidad de la gota ya que se puede desprender de la punta de la jeringa o, en el caso del espacio en cabeza, se pueden producir salpicaduras. Se pueden emplear tres métodos de agitación: agitación magnética, vibración y vortex. Estos dos últimos se suelen utilizar con sistemas automáticos. 51 2.4.5.‐ Fuerza iónica La adición de sales a las muestras acuosas (NaCl, KCl, Na2SO4) provoca un aumento de la fuerza iónica de la disolución, las moléculas de agua solvatan a los iones presentes y no a las moléculas neutras de los analitos a investigar. La reducción de la solubilidad por el incremento de la fuerza iónica se conoce con el nombre de “salting‐ out”. Este fenómeno hace que se modifique el coeficiente de distribución de muchas sustancias y, por tanto, facilita la extracción de los analitos no polares por la fase orgánica. Sin embargo, cuando sumergimos la gota dentro de la muestra que contiene los analitos de interés se puede producir un segundo efecto debido a la presencia de sales disueltas. Este efecto es debido a un cambio en las propiedades físicas de la fase acuosa que hace que se reduzca la velocidad de difusión del analito hacia la gota. Como consecuencia de este fenómeno, un aumento de la concentración de sal en la muestra produce una disminución de la extracción de los analitos en la gota. 2.4.6.‐ Temperatura La temperatura tiene múltiples efectos sobre la microextracción con disolvente. Afecta tanto a la cinética como a la termodinámica del proceso de absorción y, por tanto, a la sensibilidad y selectividad. El aumento de la temperatura durante la extracción aumenta la difusión de los analitos hacia la fase extractante, pero, por otro lado, como la etapa de absorción es un proceso exotérmico, el aumento de temperatura hace disminuir la constante de distribución de los analitos con lo que se produce una disminución de la absorción del analito en la fase extractante. 2.4.7.‐ Volumen de muestra y de espacio en cabeza La teoría de SME predice claramente que es contraproducente utilizar un volumen grande de muestra o de espacio en cabeza. La cantidad máxima de analito extraido depende de kd, y una mayor cantidad de muestra requiere mayores tiempos de equilibrio. Generalmente volúmenes de muestra entre 1‐4 mL son óptimos para 52 TÉCNICAS DE EXTRACCIÓN CON DISOLVENTE analitos con kd por debajo de 1000. Para analitos con valores altos, superiores a 1000, como los plaguicidas halogenados y PAHs se incrementa el volumen a 30‐40 mL pero lleva asociado un aumento en el tiempo de equilibrio. El espacio en cabeza pequeño hace que la extracción del analito sea mayor. 2.4.8.‐ pH El pH de la muestra afecta al equilibrio de disociación de algunos analitos en medio acuoso. Se ha comentado en el punto 2.4.5 que los analitos se extraen mejor si se encuentran sin disociar. Si asumimos que solo se extraerán en la gota orgánica las formas no disociadas de los analitos, ya sean ácidos o básicos, el ajuste de pH debe favorecer la forma neutra de éstos. De esta manera mejora el coeficiente de distribución de las especies disociables, incrementando la transferencia de masa hacia la gota y, por tanto, favorece la extracción de dichos analitos. Como regla general, es conveniente trabajar a valores de pH dos unidades por debajo para las especies ácidas o dos unidades por arriba para las especies básicas, del correspondiente pKa. En la práctica, en las extracciones afectadas por el pH, las muestras deben tamponarse para conseguir una buena reproducibilidad. 2.4.9.‐ Tiempo de extracción El objetivo de todo proceso de extracción es alcanzar el equilibrio de distribución del sistema ya que en este momento se extraerá la cantidad máxima de analito. Definimos el tiempo de equilibrio como el tiempo después del cual la cantidad de analito en cada fase permanece constante y corresponderá, en ausencia de error experimental, a la cantidad extraída a tiempo infinito. La agitación de la muestra reduce el tiempo necesario para alcanzar el equilibrio ya que favorece la difusión de los analitos hacia la fase extractante. 53 Los compuestos con coeficientes de distribución bajos poseen tiempos de equilibrio mayores. Desde el punto de vista práctico, puede trabajarse con un tiempo de extracción menor sin llegar a alcanzar el equilibrio. Para ello es necesario tener un control riguroso del mismo para no deteriorar la reproducibilidad en la extracción. La microextracción en gota no es una técnica exhaustiva. Aunque la sensibilidad máxima se alcanza en el equilibrio, alcanzarlo no es necesario para obtener buenas figuras de calidad analítica. 54 SONOQUÍMICA 3.‐ SONOQUÍMICA El sonido se transmite a través de un medio material mediante inducción de un movimiento de vibración de las moléculas del medio por el que viaja [58,59]. Todavía no está totalmente claro el efecto químico de los ultrasonidos en las disoluciones, pero su acción en el avance de las reacciones se debe, al menos en parte, a los efectos térmicos originados por dichas ondas. Durante la acción de los ultrasonidos se llegan a alcanzar temperaturas de hasta 5.000 ºC y presiones de hasta 2.000 atmósferas, condiciones que explicarían el efecto beneficioso producido por este tipo de energía [58,59]. Los ultrasonidos se definen como un sonido de frecuencia mayor a la que es capaz de percibir el oído humano, por ejemplo 18 kHz, comprendiendo la región de frecuencias entre 20 kHz y 10 MHz (Fig. 14). Las frecuencias de ultrasonidos pueden dividirse en dos intervalos; la zona denominada de alta frecuencia, entre 5 y 10 MHz, en la cual no se produce el fenómeno de cavitación y es la zona de frecuencias utilizadas con fines médicos. La zona denominada de baja frecuencia, comprendida entre 20 kHz y 2 MHz, ha sido utilizada para limpieza y para favorecer la reactividad química [58‐60]. Figura 14. Intervalo de frecuencias del sonido [Fuente: Referencia 58] Los ultrasonidos de alta frecuencia fueron empleados por primera vez tras el hundimiento del Titanic, al idearse un sistema para localizar icebergs. Se vio que podía detectarse la distancia hasta ellos por el tiempo transcurrido entre la emisión del 55 sonido por el barco y la recepción de un eco proveniente del iceberg. Otra aplicación de los ultrasonidos de alta frecuencia que presenta un mayor interés para los químicos es el seguimiento de una reacción mediante los cambios en el tiempo invertido por el sonido en recorrer una distancia dada, tiempo que varía debido a la formación de algún producto en el medio [58]. Por su parte, los ultrasonidos de baja frecuencia influyen sobre la reactividad química mediante el fenómeno de cavitación. Este efecto fue descubierto en 1895 por John Thornycroft y Sydney Barby. Los ultrasonidos de baja frecuencia se han utilizado en una gran variedad de reacciones químicas, por ejemplo, de oxidación. La influencia de este tipo de ondas mecánicas en las reacciones de oxidación será comentada posteriormente. Los ultrasonidos, tanto los comprendidos en la zona de alta frecuencia como los de baja frecuencia, presentan una gran diversidad de aplicaciones industriales. Entre ellas se encuentran la esterilización de materiales, limpieza, homogeneización, oxidación, soldadura de materiales plásticos, etc. En todos los casos en los que los ultrasonidos han sido empleados, se han desarrollado métodos de trabajo sencillos y baratos, constituyendo por tanto un avance importante en dichas aplicaciones. 3.1. PRINCIPIOS GENERALES Las ondas sonoras se pueden representar como una serie de líneas verticales o zonas sombreadas con diferente intensidad en las cuales la separación entre ellas o la intensidad del sombreado está relacionada con la intensidad de la onda. Debido a su naturaleza ondulatoria, también se puede representar como una onda seno cuya intensidad está relacionada con la amplitud de la misma (Fig. 15). 56 SONOQUÍMICA Figura 15. Representaciones del movimiento del sonido [Fuente: Referencia 60] Por tanto, existirán zonas en las que la onda provocará una compresión y otras en las que producirá una rarefacción (Fig. 15). La presión acústica en un instante dado (Pa) es una función del tiempo (t) de la forma: sen 2 (22) donde f es la frecuencia de la onda sonora, que será siempre superior a 16 kHz por referirse a ondas de ultrasonidos, y PA es la máxima presión de la onda sonora. La intensidad de la onda sonora puede definirse como la energía transmitida a la disolución por unidad de tiempo y por unidad de área, y se relaciona con PA del siguiente modo: 2 (23) donde c es la velocidad del sonido en el medio por el que circula la onda y ρ la densidad de dicho medio. Durante la propagación de una onda sonora a través de un medio, la intensidad de la onda disminuye a medida que aumenta la distancia desde la fuente de radiación. La intensidad (I) a la distancia desde la fuente (L) viene dada por la siguiente ecuación [58]: 57 (24) donde α es el coeficiente de atenuación y Io representa la intensidad inicial emitida. La atenuación surge como resultado de la reflexión, refracción y difracción de la onda sonora, además de la conversión de parte de la energía mecánica (cinética) de la onda en calor. En las aplicaciones químicas en las cuales normalmente interviene un líquido, el proceso de calentamiento es el más importante. Sin embargo, dicho calentamiento es muy pequeño ya que el calentamiento se genera en unos puntos (burbujas de cavitación) contenidos en un gran volumen líquido. A medida que aumenta la distancia respecto al generador de ultrasonidos, la intensidad de la onda recibida será menor al perderse su energía acústica en la vibración molecular, siendo su posible efecto térmico inferior. Por tanto, se producirá una menor aceleración de las reacciones químicas en aquellas porciones de la mezcla de reacción que se encuentren más alejadas del emisor. Esta es la razón de que no sea conveniente emplear recipientes con un diseño que requiera un espesor excesivo de la mezcla de reacción. La frecuencia de los ultrasonidos es una variable que también afecta a los fenómenos producidos por los mismos. Esta variable puede relacionarse con la intensidad de la onda emitida a través del coeficiente de atenuación (α). El coeficiente de atenuación presenta la forma: 2 / 4 /3 1 / (25) donde ŋs es la viscosidad del medio, γ es la relación entre las capacidades caloríficas a presión y a volumen constantes, K es la conductividad térmica del medio y Cp es la capacidad calorífica molar a presión constante. El coeficiente de atenuación (α) tiene dos contribuciones. La primera de ellas representa la conversión en energía térmica por la resistencia de las fuerzas viscosas o de fricción al movimiento de las ondas. La segunda contribución es debida a la diferencia de temperaturas entre zonas bajo compresión y rarefacción. Esta diferencia 58 SONOQUÍMICA de temperaturas modifica la energía necesaria para invertir los procesos de compresión – rarefacción [58]. Reordenando la ecuación (25), tenemos: 2 4 /3 1 / (26) Para un medio y una temperatura determinados, todos los parámetros del lado derecho son constantes, por lo que la relación α/f2 también lo es. Por tanto, las mayores frecuencias son atenuadas con mayor intensidad que las bajas. Según se observa en la ecuación (24), la intensidad recibida (I) en un punto dado disminuye si aumenta el coeficiente de atenuación. Por tanto, la ecuación (24) permite calcular la intensidad inicial (Io) necesaria para que una determinada intensidad sónica (I) alcance un punto dado de la disolución. Se ha comprobado que de 20 a 50 kHz, la atenuación sufrida por los ultrasonidos es mínima, por lo que los sistemas sonoquímicos suelen utilizar ondas de esas frecuencias [58]. 3.2. FENÓMENO DE CAVITACIÓN Las especiales e interesantes características que poseen las ondas de ultrasonidos surgen del fenómeno denominado cavitación. Puesto que la onda sónica cuenta con ciclos de compresión y rarefacción, deben considerarse dos situaciones. Por un lado, la presión en un líquido durante un ciclo de compresión (Pm) puede expresarse como suma de la presión acústica (Pa) suministrada por la onda y la hidrostática (Ph) existente en el medio: (27) Por su parte, en un ciclo de rarefacción donde Pa es negativa, Pm se obtiene como diferencia de ambas presiones: (28) 59 La presión de dicha onda sonora provoca una oscilación de las moléculas presentes en la disolución alrededor de su posición de equilibrio. Cuando la presión que se ejerce durante un ciclo de rarefacción es suficientemente grande, la distancia entre las moléculas vecinas puede alcanzar una distancia crítica (R) para la cual las fuerzas intermoleculares que mantienen unidas las moléculas del líquido son superadas, rompiéndose el líquido. En esas condiciones se forman unas burbujas denominadas burbujas de cavitación. A su vez, estas burbujas están sujetas a las presiones inducidas por las ondas sonoras emitidas [58‐60]. Figura 16. Desarrollo y colapso de las burbujas de cavitación. [Fuente: Referencia 60]. En los sucesivos ciclos, las burbujas de cavitación tenderán a crecer durante el ciclo de rarefacción y a contraerse en el ciclo de compresión (Fig. 16). Durante los ciclos de compresión, las microburbujas cavitacionales podrían colapsar provocando una implosión que libera una gran cantidad de energía, llegándose a alcanzar dentro de las burbujas colapsadas temperaturas de hasta 5.000 °C y presiones de hasta 2.000 atm [60]. Estas condiciones energéticas tan drásticas son las responsables de los efectos tanto químicos como mecánicos producidos por la onda de ultrasonidos. Se conocen dos modos de cavitación: Estable 60 SONOQUÍMICA Transitoria La cavitación estable hace referencia a aquellas burbujas de cavitación que oscilan alrededor de su posición de equilibrio (Ro) creciendo y comprimiéndose durante algunos ciclos de compresión y descompresión. Por su parte, la cavitación transitoria consiste en que las burbujas crecen constantemente durante unos pocos ciclos acústicos, llegando a alcanzar al menos el doble de su tamaño inicial durante un ciclo acústico y, finalmente, colapsan de forma violenta por medio de una implosión durante un ciclo de compresión. El tiempo necesario para que estas burbujas colapsen es corto en comparación con el tiempo que dura la onda acústica. Considerando constante la presión existente en el líquido en el momento del colapso, este tiempo viene dado por la expresión siguiente: 0,915 (29) donde Rm es el radio de la burbuja en el momento del colapso, ρ es la densidad del medio y Pm la presión, considerada constante en el momento de la implosión y que se puede obtener mediante la ecuación (27) al referirse al ciclo de compresión en el cual se produce la implosión de las burbujas. Estas implosiones representan la parte más importante de la sonoquímica, es decir, de la química asistida o favorecida por ondas de ultrasonidos [58‐60]. 3.3.‐ PARÁMETROS QUE AFECTAN AL PROCESO DE CAVITACIÓN Los procesos que ocurren durante la cavitación, como el crecimiento de las burbujas y su correspondiente colapso, pueden verse afectados por diversos parámetros experimentales como son, entre otros, la frecuencia de la onda sonora, su intensidad, la presión hidrostática, la temperatura, las propiedades físicas del disolvente y la presión de gas [58,60]. 61 La formación de las burbujas de cavitación desciende a medida que la frecuencia de ultrasonidos aumenta. De este modo, cuando se alcanza la región de frecuencias de ultrasonidos del orden de los MHz, la cavitación se reduce considerablemente. La forma más sencilla de entender este hecho consiste en considerar que cuando la frecuencia es muy elevada los ciclos de rarefacción y compresión son muy cortos. La producción de burbujas de cavitación requiere un tiempo finito, por tanto, cuando los ciclos de rarefacción involucran un tiempo menor a ese tiempo finito, la cavitación se dificulta. Esta es la razón por la que generalmente en sonoquímica se emplean frecuencias comprendidas entre 20 y 40 kHz [58,60]. Otra variable que afecta a la cavitación es la presencia de un gas en el medio de reacción [58,60]. Dicho gas podría facilitar la cavitación puesto que introduce en el medio burbujas que servirán de núcleo para la formación de las burbujas de cavitación. Burbujeando la disolución se asegura la presencia de dichos núcleos, pese a la inevitable desgasificación que los ultrasonidos realizan de la mezcla de reacción. Por ello, suele gasificarse la disolución antes o durante la irradiación con el fin de mantener una cavitación uniforme [58‐60]. Se ha observado que gases monoatómicos (He, Ar, Ne) provocan mayores mejoras en el efecto de cavitación que los diatómicos (N2, O2, aire) [59,60]. Entre las propiedades físicas del medio conviene considerar la viscosidad y la tensión superficial. La formación de microburbujas en un líquido requiere que la presión negativa durante el ciclo de rarefacción venza las fuerzas cohesivas que actúan en el líquido. Por lo tanto, será más difícil de generar cavitación en líquidos viscosos o de gran tensión superficial. Por esta última razón, se recomienda utilizar un tensioactivo que reduzca la tensión superficial para obtener un mayor efecto debido a los ultrasonidos [58,60]. La temperatura también afecta a la cavitación [58‐61]. En términos generales, un aumento en la temperatura disminuye el nivel de energía necesario para producir la 62 SONOQUÍMICA cavitación. Sin embargo, suele ser bastante común observar comportamientos de máximo en las gráficas que muestra la influencia de la temperatura sobre los efectos sonoquímicos. Dichos máximos aparecen a unos valores de temperatura que dependen, entre otros factores, de la reacción involucrada. La razón de estos máximos es debida a las disminuciones simultáneas en la viscosidad y/o tensión superficial y al aumento en la presión de vapor con la temperatura. Cuando nos acercamos al punto de ebullición del disolvente, se forma al mismo tiempo un gran número de burbujas de cavitación las cuales actúan como una barrera para la transmisión del sonido y, por tanto, amortiguan los efectos de la onda sonora incidente [60]. Por esta razón, hay autores que indican un aumento de velocidad de reacción con el aumento de la temperatura [61], mientras que otros autores afirman el comportamiento de máximo [58‐60]. Un parámetro que afecta de forma significativa al fenómeno de cavitación es la presión externa (Ph). Esto puede explicarse utilizando la ecuación 28 y considerando la condición necesaria para que se generen burbujas. Esta condición establece que un líquido es capaz de hervir, es decir, de producir burbujas, cuando la presión sobre el líquido (Pm) es menor que la presión de vapor (Pv) del mismo (Pm < Pv). En el caso de una disolución sometida a ultrasonidos y durante un ciclo de rarefacción, Pm será la resta de la presión propia del líquido o presión hidrostática (Ph) y la presión generada por el paso de la onda acústica a través del medio o presión acústica (Pa) (ecuación 28). Así, para que un líquido hierva, tenemos que: (30) A partir de la ecuación 30, se puede observar que a mayores valores de Ph es necesario aplicar mayores presiones acústicas (Pa) para producir la cavitación. En estos comentarios sólo se ha considerado la fase de rarefacción de la onda sonora, dado que es en ella cuando se genera y crece la burbuja. 63 Por otro lado, una vez iniciado el proceso de cavitación, si se aumenta la presión exterior, más violento será el colapso cavitacional y, por tanto, los efectos sonoquímicos aumentarán. Existe una presión externa a la cual los efectos sonoquímicos alcanzados son máximos, presión que depende de la frecuencia utilizada [58]. Si se considera la ecuación (27), se puede ver que a medida que Ph aumenta, mayor será el valor de Pm. Evaluando la ecuación (29), que permite obtener el tiempo necesario para que se produzca una implosión, puede comprobarse que si Pm aumenta, dicho tiempo será menor, produciéndose implosiones rápidas y violentas. El mismo efecto se observaría si aumentara Pa por efecto de un aumento de la intensidad acústica. Según la ecuación (23), si la intensidad (I) se ve incrementada, PA sufrirá el mismo efecto al igual que Pa. Todo esto conduce a un aumento en Pm y, según la ecuación (29), a implosiones más violentas y cortas. Como hemos visto anteriormente, un parámetro que afecta al fenómeno de cavitación y, por tanto, a los efectos sonoquímicos, es la intensidad de la onda emitida [60]. En términos generales, un aumento en la intensidad produce un aumento en los efectos sonoquímicos. Sin embargo, existen ciertas limitaciones para la intensidad de los ultrasonidos entre las que se encuentran: Se necesita un mínimo de intensidad para iniciar la cavitación, y este mínimo depende de la frecuencia. Cuando se suministra al sistema una gran cantidad de energía acústica, se forman una gran cantidad de burbujas de cavitación. Algunas de estas burbujas podrían unirse con otras formando burbujas de mayor tamaño y de mayor tiempo de vida. Estas nuevas burbujas generadas por unión de varias pueden actuar como una barrera al paso de la onda acústica por la disolución. Cuando se suministran al medio de reacción amplitudes elevadas, la fuente de ultrasonidos no es capaz de mantener un contacto físico continuado con el 64 SONOQUÍMICA medio durante el ciclo acústico completo. Este fenómeno se conoce como desacoplamiento, y es más importante cuanto mayor es el número de burbujas de cavitación que se encuentra sobre o cerca de la superficie del transductor. El resultado de este fenómeno es una disminución de la eficacia en la transferencia de energía acústica desde el transductor hasta el medio. Debido a los cambios bruscos en sus dimensiones, el transductor se deteriora, pudiendo llegar a fracturarse. 3.4. PROCESO DE CAVITACIÓN EN SISTEMAS QUÍMICOS La sonoquímica está fundamentalmente enfocada hacia reacciones en las cuales al menos interviene un componente líquido, en el cual tiene lugar el fenómeno de cavitación. El gran número de aplicaciones existentes se podrían clasificar en alguno de los siguientes grupos [60]: 3.4.1.‐ Reacciones homogéneas: Debido a las condiciones tan drásticas producidas por las implosiones de las burbujas, en un periodo de tiempo breve, los gases que puedan quedar retenidos en el interior de las burbujas que sufren los colapsos se encuentran por encima de su punto crítico. Esto conduce a una serie de reacciones, dentro de la burbuja, en la interfase burbuja‐líquido y en el líquido próximo a la burbuja, que provocarán la creación de especies radicales altamente reactivas. Estas especies, posteriormente, entran en la fase líquida para producir los efectos químicos deseados. En el caso de que dicho proceso se produzca en disolución acuosa, las especies radicales que se forman son: ))) (31) H2O → Hy + OHy Estas especies radicales creadas en fase gaseosa son, junto con las condiciones extremas de presión y temperatura alcanzadas durante las implosiones de 65 las burbujas de cavitación, las responsables de provocar un aumento en la velocidad de la reacción química involucrada en el proceso. Tras esta primera reacción, los radicales OHy y Hy generados pueden reaccionar formando H2O2, entre otros productos, según el esquema de equilibrios siguiente: H2O → Hy+ OHy (32) Hy + OHy → H2O (33) Hy + Hy → H2 (34) OHy + OHy →H2O2 (35) Hy + O2 →HO2y (36) Hy + H2Oy → H2O2 (37) HO2y + HO2y →H2O2 + O2 (38) H2O + OHy → H2O2 + Hy (39) OHy + OHy → H2 + O2 (40) Tanto el radical OHy como el H2O2 que se forma por varias vías son especies fuertemente oxidantes, por lo que pueden reaccionar con otras especies existentes en el seno de la propia burbuja o de la misma disolución; por ejemplo, el contenido en materia orgánica existente en un agua residual (demanda química de oxigeno) puede ser determinada mediante la oxidación asistida por ultrasonidos [62]. Un sistema constituido por un líquido en el cual se están formando burbujas no es estrictamente hablando un medio homogéneo. Sin embargo, en sonoquímica, un sistema de estas características es considerado homogéneo. Como se ha indicado anteriormente, los efectos mecánicos y químicos de una burbuja que colapsa se pueden estudiar considerando tres zonas [60] (Figura 17): Reacciones dentro de la burbuja. El interior de la burbuja puede ser considerado como un microreactor que contiene una gran cantidad de energía. Si el disolvente es agua, al aplicar 66 SONOQUÍMICA energía sónica dentro de la burbuja, se forman pequeñas cantidades de radicales Hy y OHy, los cuales, posteriormente, experimentan una serie de reacciones en las cuales se forma H2O2 (ecuación (32) a (40)). Los OHy son especies altamente oxidantes y pueden reaccionar con otras especies o migrar hacia la disolución donde sólo tienen una existencia transitoria, pero pueden ser detectadas químicamente. Por ello, algunas especies disueltas en el agua podrían sufrir reacción química con el H2O2 generado ultrasónicamente. Reacciones en la interfase. Podría pensarse que la sonoquímica no tiene efecto en materiales que no pueden formar parte de las burbujas. Sin embargo, como se ha comentado anteriormente, los radicales formados dentro de la burbuja pueden migrar a la disolución donde podrían reaccionar con especies no volátiles presentes en el medio de reacción. De este modo, aquellas especies que no sean capaces de formar parte de las burbujas también pueden verse afectadas por los efectos sonoquímicos. Reacciones en el líquido próximo a la burbuja. El colapso de las burbujas también produce grandes fuerzas en el líquido próximo a las mismas. Estas fuerzas pueden producir importantes fenómenos mecánicos como son la rotura de los enlaces químicos de los materiales poliméricos disueltos en el líquido, entre otros [60]. Figura 17. Colapso de las burbujas de cavitación en un medio homogéneo. [Fuente: Referencia 60] 67 3.4.2.‐ Reacciones heterogéneas En las cuales intervienen líquidos inmiscibles (por ejemplo, en extracción líquido‐líquido, síntesis orgánica, etc.): Normalmente los reactivos se encuentran disueltos en fases diferentes. Por tanto, únicamente podrán reaccionar en la interfase, y esto es un proceso muy lento. Sin embargo, la irradiación con ultrasonidos permite formar emulsiones de ambos líquidos como resultado del colapso de las burbujas de cavitación que se encuentran en o cerca de la interfase. Durante el colapso de las mismas, se producen chorros de un líquido dentro del otro, lo cual favorece la formación de emulsiones (Fig. 18). Figura 18. Colapso de burbujas de cavitación en un medio bifásico. [Fuente: Referencia 60]. En las cuales interviene un sólido y un líquido: Existen dos tipos principales de reacciones que involucran la interfase sólido‐líquido. En la primera, la cavitación tiene lugar en un área de una superficie sólida grande, mientras que en la segunda, la cavitación tiene lugar en presencia de un sólido granulado en suspensión. En el primer caso, la burbuja que colapsa no es simétrica. En este caso la implosión es asimétrica y se forma un chorro de líquido que se aproxima e impacta a la superficie sólida a gran velocidad (Fig. 19). Como resultado de ello, el chorro líquido puede provocar variaciones en la superficie del sólido o limpiarlo. El proceso de limpieza permite aumentar la superficie efectiva y mostrar una superficie nueva a los reactivos. 68 SONOQUÍMICA Cuando el sólido se encuentra en forma de partículas en suspensión, la cavitación puede producir una variedad de fenómenos que dependen del tamaño y tipo de material. En principio se puede producir una disgregación mecánica, limpieza de la superficie e incluso un proceso de fusión de las partículas. Figura 19. Colapso de una burbuja de cavitación cerca de una superficie sólida. [Fuente: Referencia 60] 3.5. INSTRUMENTACIÓN INVOLUCRADA EN LA TECNOLOGÍA DE LOS ULTRASONIDOS Los sistemas de ultrasonidos más utilizados en el laboratorio químico son los baños de ultrasonidos y la sonda ultrasónica. Estos sistemas están basados en transductores electromagnéticos capaces de convertir energía mecánica o eléctrica en ondas sónicas de alta frecuencia. El baño de ultrasonidos es el sistema más barato para irradiar con ultrasonidos. En el baño de ultrasonidos, el transductor se ubica debajo del tanque de acero inoxidable que constituye el baño (Fig. 20). 69 Figura 20. Esquema de un baño de ultrasonidos [Fuente: Referencia 59]. Algunos tanques están provistos de un controlador de temperatura. Algunas ventajas de este sistema de irradiación son: (i) bajo coste, (ii) distribución bastante uniforme de la energía dentro del recipiente y (iii) no se requiere ninguna adaptación especial del recipiente de reacción [58‐60]. Las aplicaciones más comunes de los baños de ultrasonidos suelen ser la limpieza, desgasificación de disolventes y extracción de metales adsorbidos, siendo poco útil para la extracción de analitos enlazados químicamente con la matriz. En este caso, la potencia ha de ser suficiente para poder producir cavitación dentro del recipiente de extracción situado, a su vez, dentro del baño, cosa que no siempre es fácil con los sistemas comerciales [59]. Anteriormente se ha discutido la importancia que presenta la tensión superficial sobre el fenómeno de cavitación. Para tal fin, se ha modificado la tensión superficial del líquido contenido en el baño [58‐60]. Un inconveniente general inherente a todos los baños de ultrasonidos es el posicionamiento en el interior del mismo, del recipiente que contiene a la mezcla de reacción, ya que el efecto de las ondas de ultrasonidos en la reacción estudiada varía en función de dicha posición [58, 59, 63, 64]. Otro aspecto importante a considerar es la falta de un control adecuado de la temperatura del baño, lo cual impide tener un control riguroso de los procesos que ocurren en la mezcla de reacción [58,64]. Otra 70 SONOQUÍMICA limitación importante de estos sistemas es la falta de un control adecuado de la potencia, además, como se ha dicho anteriormente, de una falta de eficacia en la transferencia energética dentro del recipiente que contiene la mezcla de reacción. Con la finalidad de aumentar la eficacia de la energía de ultrasonidos, se puede irradiar directamente en el medio de reacción. Este es el objetivo de los llamados sistemas de sonda (Fig. 21). Estos sistemas son unas 100 veces más eficientes en la irradiación del medio de reacción que un baño ultrasónico, lo cual favorece los efectos sonoquímicos. Figura 21. Esquema de un sistema de ultrasonidos provisto de sonda [Fuente: Referencia 59] Estos sistemas están constituidos por una serie de componentes generales que son: Un generador de la frecuencia deseada (típicamente es de 20 kHz). El generador de ultrasonidos puede ser usado en modo de pulsos [60]. El transductor. Una sonda constituida en general por una pieza desmontable normalmente de titanio, o con menos frecuencia de vidrio, la cual permite que la vibración sea 71 transmitida directamente al sistema químico estudiado. La punta del generador de ultrasonidos puede sufrir una erosión como resultado de la cavitación [59]. 3.5. ALGUNAS DE LAS APLICACIONES DE LA ENERGÍA DE ULTRASONIDOS 3.5.1. Aplicaciones médicas Una de las áreas donde mayor número de aplicaciones se ha encontrado a las ondas de ultrasonidos es en la medicina. El diagnóstico por ultrasonidos está basado en el hecho de que la onda sonora, a diferencia de una onda electromagnética, constituye una perturbación mecánica del medio por el que se propaga, perturbación que permite el transporte de la energía del sonido. El diagnóstico depende del medio físico en el que el sonido se propaga y de cómo las ondas ultrasónicas interaccionan con los materiales biológicos que atraviesan. La detección de los ecos que provienen del interior del organismo constituye el fundamento del diagnóstico. Una dificultad que presenta esta forma de diagnóstico consiste en la atenuación que sufren los ultrasonidos. Dicha atenuación es debida, bien a un cambio en la trayectoria de la onda emitida o bien a la pérdida de su energía por absorción de la misma. En ambos casos, conduce a una disminución de la amplitud de los ecos generados en las estructuras más profundas, hecho que dificulta su detección y el posterior diagnóstico. Las frecuencias empleadas en este tipo de aplicaciones son del orden de MHz, empleando en su generación los mismos materiales piezoeléctricos utilizados en otros sistemas de emisión de ultrasonidos. Lo más novedoso en este tipo de aplicaciones es la creación de ecografías tridimensionales, que se caracterizan por ser imágenes con una calidad realmente impresionante y en color. Este tipo de ecografías ayudan a la detección precoz de malformaciones y defectos genéticos. 72 SONOQUÍMICA 3.5.2. Tratamiento de productos alimenticios Desde hace unos años se han venido desarrollando numerosas técnicas para el tratamiento de los alimentos. Frente a los métodos tradicionales, como la refrigeración, el ahumado o la pasteurización, se están imponiendo otros nuevos como las altas presiones o los ultrasonidos. La energía ultrasónica ha sido utilizada en procesos de secado (deshidratación de alimentos) en combinación con aire caliente, permitiendo la utilización de temperaturas más bajas. La radiación ultrasónica a través del aire introduce variaciones de presión en la interfase gas/líquido aumentando la tasa de evaporación. Se ha desarrollado un nuevo procedimiento de deshidratación ultrasónica basado en la aplicación de la vibración ultrasónica en contacto directo con las muestras y en combinación con una presión estática. Los resultados obtenidos con esta nueva técnica han sido extraordinariamente positivos: el efecto del secado no sólo es de dos a tres veces más rápido que con el aire caliente, sino que además es más potente. Por otra parte, la calidad del producto se mantiene intacta [65]. Últimamente se está investigando también sobre la aplicación de ultrasonidos a la purificación del agua, concretamente para la limpieza de filtros. La clave está en el fenómeno de la cavitación; si logramos que se produzcan burbujas y que éstas colisionen limpiando la suciedad de los filtros, tendremos un excelente método para depurar el agua. 3.5.3. Aplicaciones químicas Los ultrasonidos también han encontrado sus aplicaciones en el campo de la química. El área científica que se dedica a la utilización de la energía de los ultrasonidos, en el campo de la química, se denomina sonoquímica y su finalidad es producir cambios químicos o físicos en un medio mediante cavitación. En la mayoría de los casos, se utiliza para acelerar procesos lentos o difíciles por otros medios y, en otros casos, para obtener productos nuevos. La sonoquímica se ha utilizado 73 ampliamente en el campo de la química apareciendo en los últimos años nuevos campos de aplicaciones, entre ellos la síntesis de nuevos productos orgánicos [66‐68], entre otras. Sin embargo, la preparación de la muestra, y más concretamente la digestión de las mismas, sigue siendo una de las áreas en las que ha encontrado mayor utilidad la energía de ultrasonidos. En sus aplicaciones químicas se ha utilizado tanto la sonda como el baño, requiriéndose en este segundo caso tiempos significativamente más prolongados para lograr la digestión completa. Por ejemplo, Kazi et al. [69] ha extraído los metales pesados en lodos de depuradora con un baño de ultrasonidos utilizando una secuencia de extracción en tres etapas, necesitando un tiempo total de 90 minutos, mientras que Collasiol et al. [70] realizaron en dos minutos la digestión de suelos y sedimentos de ríos y marinos mediante una sonda de ultrasonidos. En la Tabla 2, se muestra algunas aplicaciones recientes de la energía de ultrasonidos a la preparación de la muestra. Tabla 2. Aplicaciones de la energía de ultrasonidos en la preparación de la muestra Analitos Muestra Dispositivo usado Recuperación Tiempo de (%) sonicación (min) Ref. Metales Plantas/especias Sonda 79 ‐ 122 3 71 Ca‐Mg‐Mn y Zn Vegetales Baño 96 ‐ 102 10 64 Especiación de Lodos y suelos Sonda 94 ‐ 104 10 72 Suelos Baño 92 ‐ 101 9 73 Metales trazas Suelos y lodos Baño 59 ‐ 99 9 74 Cu, Cd, Cr, Pb, Ni Lodos Baño 95 ‐ 106 90 70 As y Zn As, Cd, Cu, Pb y Ag y Zn 74 SONOQUÍMICA Se Mariscos Sonda 99 ‐ 103 3 75 Cu, Pb, Zn Suelos Baño 96 ‐ 122 4 (horas) 76 Cd, Zn, Cu, Ni, Suelos y sedimentos Baño 80 ‐ 100 30 77 Pb, Cu, Ni, Zn Material particulado Baño 99 ‐ 105 25 78 Cr (VI) Suelo Sonda 85 ‐ 101 16 79 Cd, Pb Plantas Sonda 98 ‐ 100 5 80 Se Tejido mamario Sonda 98 ‐ 101 3 81 Cd, Cu y Zn. Pescado Baño 92‐114 30 82 Pb, Cr Mariscos 88‐103 Polifenoles Aceite de oliva Sonda 97 ‐ 100 1,5 83 Cd Sedimentos de Baño/Sonda > 90 5 84 Comida de animales Sonda 100 18 85 Marisco Baño 66 ‐ 101 0,5 86 estuarios Cu, Fe, Zn, Ca, Mg Mn Debido al hecho de que en determinados tipos de muestra cada analito se puede encontrar enlazado a la matriz de diferente manera, la optimización de la extracción ha de ser realizada individualmente para cada uno de ellos, ya que en caso contrario podían obtenerse recuperaciones muy diferentes según el analito. La aplicación de la extracción sólido‐líquido asistida por ultrasonidos produce una extracción de parte de la matriz al medio líquido. Este efecto es mayor en la aplicación de ultrasonidos con sonda que en la aplicación de ultrasonidos con baño. Las ventajas que ofrecen los ultrasonidos en la extracción son las siguientes: Disminución de la cantidad de los reactivos químicos utilizados 75 Disminución de la cantidad de muestra utilizada en las extracciones Disminución en los tiempos de tratamientos de muestras Estas ventajas se resumen en la Tabla 3. Tabla 3. Comparación de la extracción Soxhlet convencional, asistida por ultrasonidos y una extracción convencional por ultrasonidos Soxhlet Soxhlet‐ Ultrasonidos[88] Ultrasonidos[87] Cantidad de muestra (g) 10 10 5 Cantidad de disolvente (mL) 300 100 100 Tiempo (horas) 16 ‐24 4 1 Disolventes Acetona ‐ hexano Hexano Etanol 50% (v/v) 76 DISEÑO DE EXPERIMENTOS 4.‐ DISEÑO DE EXPERIMENTOS El diseño estadístico de experimentos, también denominado como diseño experimental, es el proceso de planificar un experimento para obtener datos apropiados que pueden ser analizados mediante métodos estadísticos con objeto de obtener conclusiones válidas y objetivas [89]. La metodología estadística es el único enfoque objetivo para analizar un problema que involucre datos sujetos a errores experimentales. Por tanto, siempre hay dos aspectos fundamentales en cualquier problema experimental: (i) el diseño del experimento y; (ii) el análisis estadístico de los datos. Ambos aspectos están estrechamente relacionados ya que el método de análisis depende directamente del diseño empleado. El diseño experimental ayuda al experimentador a seleccionar la estrategia experimental óptima que permita obtener la información buscada con el mínimo coste y evaluar los resultados experimentales obtenidos, garantizando la máxima fiabilidad en las conclusiones que se obtengan. Las situaciones en las que se puede aplicar el diseño experimental son muy numerosas. De forma general se aplica a sistemas como el mostrado esquemáticamente en la Fig. 22. En todos ellos se observa una o más variables experimentales dependientes o respuestas (y) cuyo valor depende de los valores de una o más variables independientes controlables llamadas también factores (x). Las respuestas también pueden estar influidas por otras variables que no son controladas por el experimentador (z). 77 Figura 222. Esquema ge eneral de un proceso o sisstema. [Fuentte: referenciaa 89]. L optimizzación me La ediante diseño expe erimental se presen nta como una alternattiva muy in nteresante a la optimiización clássica (paso a a paso). El método clásico de optiimización es e clasificado como un u método o secuenciaal, y es tam mbién cono ocido como m método clássico de inve estigación, método de el factor ún nico o de estrategia d de un‐ factor‐ccada‐vez. En el método clásico se e fijan, a un n determinaado nivel o valor, todo os los factores que están siendo in nvestigadoss menos un no de elloss. Entoncess, éste últim mo es variado o hasta que e se encue entre la me ejor respue esta. Despu ués de eso, este factor es fijado e en su valor ó óptimo y un n nuevo facctor es variiado dentro o de un inte ervalo prefiijado. Al finalizar el pro oceso comp pleto se ob btiene un conjunto c d valores formado por de p el óptimo de cada faactor estudiiado; pero e el proceso es largo, te edioso y pre esenta una serie de inco onvenientess. El elevad do coste económico de la expe erimentació ón junto co on las limitacio ones de tie empo recom miendan ejecutar sólo o los experiimentos im mprescindib bles, y el méto odo tradicio onal de varriar un facttor cada ve ez no suele e ser la mejjor opción.. Esta estrateg gia de expe erimentació ón puede im mplicar más experime entos de loss necesario os y, a pesar d de ello, prop porcionar s sólo inform mación parcial, por ejem mplo no mostrará si e existe interaccción entre factores. LLas interaccciones suelen ser muyy frecuente es y a veces son 78 DISEÑO DE EXPERIMENTOS los efectos más importantes sobre la respuesta de un sistema, por lo que conocerlas es imprescindible para comprender el comportamiento de muchos sistemas. La solución, por lo tanto, puede consistir en variar más de un factor simultáneamente al realizar un nuevo experimento. Ello permite mejorar la eficiencia en el esfuerzo del experimentador y obtener información sobre las interacciones entre factores. La dificultad principal de esta metodología consiste en diseñar una experimentación reducida en la cual estos cambios simultáneos se complementen entre si y permitan obtener la información buscada al combinar los resultados de todos los experimentos. El diseño experimental proporciona el marco matemático para cambiar todos los factores simultáneamente y obtener la información buscada con un número reducido de experimentos, es decir, con la máxima eficiencia. El diseño experimental conduce a una planificación con menos experimentos que el método de optimización paso a paso proporcionando un conocimiento mayor del sistema o proceso en estudio. La aplicación del diseño experimental requiere tener una idea clara de qué es exactamente lo que se va a estudiar, cómo se van a recopilar los datos y, al menos, una idea cualitativa de cómo se van a analizar. Por ello, se requiere considerar las etapas que se enumeran y describen brevemente a continuación. 1. Comprender el problema y definir claramente el objetivo El diseño experimental es una herramienta para encontrar respuestas a problemas perfectamente identificados y definidos. Cuanto más claramente se plantea el problema y se identifica el propósito o información que se desea conseguir con los experimentos, mayor será la ayuda del diseño. Para obtener una comprensión profunda del sistema y del problema es necesario recopilar toda la información disponible sobre el sistema en estudio que pueda ser relevante para la experimentación que se realizará. 79 2. Identificar los factores y niveles Es muy importante identificar todos los factores (las variables independientes) que se cree que pueden influir sobre el proceso y la respuesta, aunque se crea que pueden tener poca importancia. Los factores no controlados pueden introducir variaciones en la respuesta que dificulten el análisis de los resultados experimentales. El experimentador debe elegir los factores que variará en el experimento, los intervalos de dicha variación y los valores (niveles) específicos a los cuales se hará el experimento. Esta decisión requiere un conocimiento previo del sistema, obtenido de referencias bibliográficas, de la experiencia previa en el laboratorio, etc. Cuando el objetivo es el escrutinio de factores o la caracterización del proceso suele ser mejor mantener bajo el número de niveles de los factores (lo más común es usar dos niveles). 3. Selección de la variable respuesta Al seleccionar la respuesta o variable dependiente, el experimentador debe estar seguro de que la respuesta que se va a medir realmente proporciona información útil acerca del proceso en estudio. Con mayor frecuencia, el promedio o la desviación estándar (o ambos) de la característica medida serán la variable respuesta. 4. Elección del diseño experimental Es fundamental tener presente el objetivo del diseño experimental al seleccionar el diseño. Además, si los tres pasos anteriores se han realizado de manera correcta, este cuarto paso es relativamente fácil. 5. Realización de la experimentación El diseño seleccionado suele estar descrito mediante variables codificadas. Éstas se particularizan para los factores en estudio, se comprueba si los experimentos son posibles y, si es así, se realiza la experimentación en orden aleatorio respecto al orden en el cual están listados. La ejecución en orden aleatorio es necesaria para asegurar que los factores no contemplados introduzcan confusión y/o sesgo en los 80 DISEÑO DE EXPERIMENTOS resultados. Además, es vital vigilar el proceso cuidadosamente para asegurar que todo se haga conforme a lo planeado. Los errores cometidos durante el procedimiento serán detectados en el análisis de datos posterior. 6. Análisis de datos Deben emplearse métodos estadísticos para analizar los datos con la finalidad de que los resultados y conclusiones sean objetivos más que apreciativos. Si el experimento se diseñó correctamente y se ha realizado conforme al diseño previsto, los métodos estadísticos que se requieren no son complicados. Existen muchos paquetes de software excelentes para el análisis de datos y los métodos gráficos sencillos son importantes en la interpretación de tales datos. Conviene enfatizar que los métodos estadísticos no pueden probar que un factor (o varios factores) tiene un efecto particular; sólo proporcionan directrices para la veracidad y validez de los resultados. Los métodos estadísticos, aplicados adecuadamente, no permiten probar algo experimental, sólo hacen posible obtener el error probable de una conclusión o asignar un nivel de fiabilidad a los resultados. La principal ventaja de los métodos estadísticos es que agregan objetividad al proceso de toma de decisiones. Las técnicas estadísticas, junto a un buen conocimiento técnico del proceso y al sentido común, suelen llevar a conclusiones razonables. 7. Conclusiones y recomendaciones Una vez que se han analizado los datos, el experimentador debe extraer conclusiones prácticas de los resultados y recomendar un tipo de acción. También debe realizarse un seguimiento y pruebas de confirmación para validar las conclusiones del diseño. Existen numerosos tipos de diseños dependiendo de las aplicaciones. Los que seguidamente se presentan son únicamente los diseños utilizados en la presente memoria. 81 4.1.‐ DISEÑO FACTORIAL Por diseño factorial se entiende el diseño experimental en el que se investigan todas las posibles combinaciones de los niveles de los factores estudiados en cada ensayo [89]. Los diseños factoriales son los más eficientes para estudiar los efectos producidos por dos o más factores los cuales tienen dos o más niveles (la notación más habitual para los factores, por lo general, es el valor ‐1 para el nivel inferior y el valor +1 para el nivel superior del experimento). El efecto de un factor se define como el cambio en la variable respuesta producido por un cambio en el nivel del factor. Existen varios casos especiales del diseño factorial general que resultan importantes porque son utilizados ampliamente en el trabajo de investigación y, además, éstos constituyen la base para otros diseños de gran valor práctico. El caso más importante es el diseño factorial completo 2k, en el cual se tienen k factores con dos niveles cada uno (superior e inferior), aunque también es posible realizar diseños a 3 y 5 niveles, 3k y 5k respectivamente. Debido a que en el diseño 2k sólo hay dos niveles para cada factor, se debe suponer que la respuesta es aproximadamente lineal en el intervalo de los niveles elegidos de los factores. El modelo estadístico del diseño 2k describe los experimentos más adecuados para conocer simultáneamente qué efecto tienen los k factores sobre una respuesta y descubrir si interaccionan entre ellos. Sin embargo, incluso para un número pequeño de factores, el número de combinaciones o tratamientos en un diseño 2k es grande. Muchas veces no se cuenta con los recursos necesarios para llevar a cabo el experimento más de una vez, o no se dispone de tiempo para llevarlo a cabo una segunda vez, por lo que el investigador se ve en la necesidad de realizar el experimento una sola vez. A este tipo de diseño factorial 2k se le llama factorial no replicado. Los diseños factoriales presentan varias ventajas. Son más eficaces que los métodos de optimización en los cuales se varía solo un factor ya que permiten obtener 82 DISEÑO DE EXPERIMENTOS más información con el menor número de experimentos posible. Además, un diseño factorial es necesario cuando hay presentes interacciones para evitar conclusiones erróneas. Finalmente, estos diseños permiten estimar los efectos de un factor a varios niveles de los otros factores, así como interacciones entre dichos factores, aportando conclusiones que son válidas en el intervalo de condiciones experimentales estudiadas. 4.2. DISEÑO FACTORIAL FRACCIONADO A medida que el número de factores en un diseño factorial 2k aumenta, el número de ensayos necesarios para obtener un diseño completo sobrepasa rápidamente los recursos de la mayoría de los experimentadores. Un diseño 26 requiere 64 ensayos. En este caso sólo 6 de los 63 grados de libertad (nº de ensayos menos 1) corresponden a los efectos principales y únicamente 15 corresponden a las interacciones de dos factores. Los 42 restantes corresponden a las interacciones de tres o más factores. Si el experimentador puede razonablemente suponer que algunas interacciones de orden superior son despreciables, la información sobre los efectos principales y las interacciones de menor orden puede obtenerse realizando sólo una fracción del diseño factorial completo. Estos diseños factoriales fraccionados [89] se encuentran entre los tipos más ampliamente utilizados en el diseño de productos y procesos así como en la detección y solución de problemas. Un uso importante de este tipo de diseño se da en los experimentos de escrutinio, también llamados de tamizado, cribado o “screening”. Éstos son diseños en los cuales se consideran muchos factores con el fin de identificar aquellos que presentan efectos importantes. Los experimentos de escrutinio suelen realizarse en las primeras fases de un proyecto o proceso de optimización, cuando es probable que muchos de los factores inicialmente considerados tengan poco o ningún efecto sobre la respuesta. Los factores que se identifican como importantes en esta primera etapa son investigados entonces con mayor detalle en diseños posteriores. 83 El empleo exitoso de los diseños factoriales fraccionados se basa en tres ideas fundamentales: 1‐ Principio de dispersidad de efectos. Cuando existen varias variables es probable que el sistema o proceso se vea influido principalmente por algunos de los efectos principales e interacciones de orden superior. 2‐ La propiedad de proyección. Los diseños factoriales fraccionados pueden ser extendidos a diseños factoriales más grandes. 3‐ Experimentación secuencial. Es posible combinar los ensayos de dos o más diseños factoriales fraccionados para conformar de manera secuencial un diseño más grande y estimar los efectos de los factores y las interacciones de interés. El diseño factorial fraccionado más utilizado es el conocido como Plackett‐ Burman, que es un diseño saturado que se utiliza principalmente para identificar las variables significativas del proceso. 4.2.1. ‐Diseño de Plackett‐Burman Este diseño factorial fraccionado fue propuesto en 1946 por Plackett y Burman [89,90]. Es un diseño de dos niveles (± 1) y es utilizado para estudiar k factores con N ensayos, siendo N múltiplo de 4. Este tipo de diseño es útil cuando N = 12, 20, 24, 28 y 36. La Tabla 2 presenta la matriz del diseño para 11 factores (k) con 12 ensayos (N), uno de los más utilizados. 84 DISEÑO DE EXPERIMENTOS Tabla 4. Diseño de Plackett‐Burman para N = 12 y k = 11. Ensayo A B C D E F G H I J K 1 + ‐ + ‐ ‐ ‐ + + + ‐ + 2 + + ‐ + ‐ ‐ ‐ + + + 3 ‐ + + ‐ + ‐ ‐ ‐ + + 4 + ‐ + + ‐ + ‐ ‐ ‐ + 5 + + ‐ + + ‐ + ‐ ‐ ‐ 6 + + + ‐ + + ‐ + ‐ ‐ 7 ‐ + + + ‐ + + ‐ + ‐ 8 ‐ ‐ + + + ‐ + + ‐ + 9 ‐ ‐ ‐ + + + ‐ + + ‐ 10 + ‐ ‐ ‐ + + + ‐ + + 11 ‐ + ‐ ‐ ‐ + + + ‐ + + 12 ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ ‐ + + ‐ + Este diseño asume que las interacciones pueden ser ignoradas y que únicamente los efectos principales son calculados con un número reducido de experimentos. Se emplea cuando se quiere conocer los factores que son significativos en el proceso y cuáles afectan en menor grado y, por lo tanto, pueden ser fijados. Posteriormente los factores que afectan significativamente al proceso son optimizados mediante un diseño factorial completo u otro tipo de diseño, como el diseño central compuesto. En la última década se ha introducido el uso de factores ficticios o factores fantasma (“dummy”) en este tipo de diseño [91,92]. El objetivo de la utilización de estos factores fantasma es la estimación del error experimental utilizado en la 85 interpretación estadística. De este modo, al aplicar un diseño Plackett‐Burman, tenemos un número de factores reales y el resto hasta N‐1 de factores fantasmas. Por ejemplo, si utilizamos la matriz de 12 ensayos, tenemos 6 factores reales y 5 factores fantasma. 4.2.2.‐ Diseños óptimos En algunos casos no es posible aplicar estos diseños clásicos debido a limitaciones en el dominio de experimentos (coste de ciertos reactivos, seguridad o incompatibilidad en las condiciones experimentales, etc.) o en el número de experimentos (análisis demasiado largos, precio, materiales, falta de linealidad de algunas variables, etc.). Estas limitaciones obligan a reducir la experimentación pero se debe mantener, a pesar de estas restricciones forzadas, la mayor calidad del diseño, la fiabilidad de las estimaciones y, por lo tanto, la calidad de las conclusiones derivadas de él [93]. A finales de la década de los cincuenta Kieffer y Wolfowitz sentaron las bases de la teoría de los diseños experimentales óptimos. En estos diseños se buscan n puntos de la región de experimentación que permitan la mejor estimación de los parámetros del modelo lineal considerado. Con el diseño óptimo se pretende encontrar la matriz de diseño X que cumpla con un criterio específico de optimización. La mayoría de las veces el criterio está en función de la matriz de información (XtX) o de la matriz de covarianzas del estimador mínimo cuadrático de β. Los criterios de diseño óptimo se denotan con nombres alfabéticos, el más conocido es el diseño D‐óptimo que maximiza el determinante de la matriz de información. La interpretación estadística que tiene este hecho es la de minimizar el volumen de la región de confianza para β [94]. El diseño D‐óptimo tiene la propiedad de que las estimaciones derivadas del modelo matemático postulado son las más precisas. Por lo tanto, a partir del análisis 86 DISEÑO D DE EXPERIME ENTOS de lo os coeficien ntes del mo odelo se pueden obten ner las condiciones exxperimentaales para maximizar la prrecisión. 4.3. D DISEÑO CENTRAL COM MPUESTO El diseño o central co ompuesto (CCD) es un n diseño cuya superficcie de respu uesta se ajustta a un polinomio de s segundo orrden. Este t tipo de dise eño se utilizza para opttimizar y evalu uar los facttores principales, las in nteraccione es y los efe ectos cuadráticos. Si se e realiza la op ptimización n de tres factores, com mo es el caaso utilizado en la pre esente mem moria, el diseñ ño viene de efinido por el siguiente e modelo p polinomial d de segundo o orden: y = βo + β1x1 + β2 x2 + β3 x3 + β12x1x2 + β13x1x3 + β23x2 x3 + β11x12 + β22x22 + β33x23 (41) dond de y es la variable v resspuesta, x1, , x2 y x3 so on las variables indepe endientes, βo es la orde enada en el origen y β1‐β33 son loss coeficienttes de regre esión. Dado o que no ess posible repre esentar en n este caso o la respue esta del sisstema en función f sim multáneamente de todaas las variab bles en esttudio, la resspuesta vie ene represe entada porr una superrficie en un espacio e trid dimensional que muestra el efecto que eje erce un paar de variab bles por sepaarado sobre e la función n objetivo. E En la Fig. 233 se muestrra una supe erficie de re espuesta obte enida para d dos de los t tres factore es estudiados. Figura 23. Superficcie de respuessta tridimenssional. 87 Este tipo de diseño fue introducido por Box y Wilson en el año 1951 y es el más utilizado de los diseños de segundo orden. Por ello, este diseño también toma el nombre de diseño Box‐Wilson. El diseño CCD está construido por la superposición de varios diseños. Consiste en un diseño factorial (2k) aumentado con puntos estrella (2k) y con un punto central, el cual puede ser replicado n veces [90]. Los puntos correspondientes al diseño factorial representan el modelo de primer orden junto con las interacciones entre dos factores. Los puntos centrales proporcionan información sobre la existencia de una posible curvatura en el sistema, y si existe curvatura, los puntos estrella permiten estimar los términos cuadráticos. En la presente memoria el tipo de diseño CCD utilizado es el conocido como diseño central compuesto circunscrito (CCCD), en el que los puntos estrella se encuentran localizados a una distancia ± α (| α |> 1) del centro del diseño, el cual es situado en el punto 0. El valor de α depende de las propiedades deseadas del diseño y del número de factores. Para establecer la ortogonalidad y rotabilidad del diseño, las réplicas del punto central (n) se fijan en 9 y α = 4 2k = 1,682 [90]. En el diseño CCCD utilizado en este trabajo se estudian tres factores o variables a 5 niveles, siendo éstos el punto estrella inferior (‐ α ), el nivel bajo (‐1), el nivel central (0), el nivel superior (+1) y el punto estrella superior (+ α ). El número total de ensayos que conlleva la realización del CCCD con las condiciones fijadas se establece en 23 (8 puntos del diseño factorial + 6 puntos estrella + 9 réplicas centrales). 88 ANALITOS OBJETO DE ESTUDIO 5.‐ ANALITOS OBJETO DE ESTUDIO En la presente memoria se han seleccionado diferentes analitos para llevar a cabo la puesta a punto de los distintos métodos de microextracción propuestos. Los analitos estudiados han sido: (i) dieciocho plaguicidas organoclorados (OCPs): alfa‐hexaclorociclohexano (HCH), beta‐HCH, gamma‐HCH, delta‐HCH, heptaclor, aldrín, heptaclor epoxido, alfa‐endosulfan, p,p’‐DDE, dieldrín, endrín, beta‐ endosulfan, p,p’‐DDD, endrín aldehido, endosulfan sulfato, p,p’‐DDT, endrín cetona y metoxiclor; (ii) dos compuestos odoríferos: geosmina y 2‐metilisoborneol (MIB); (iii) y cinco explosivos nitroaromáticos: nitrobenceno, 2‐nitrotolueno, 2,6‐ dinitrotolueno, 2,4,6‐trinitrotolueno y 2‐amino‐4,6‐dinitrotolueno (2‐ADNT). A continuación se presenta una breve descripción de estos analitos, sus principales usos así como los problemas toxicológicos a que dan lugar los mismos. 5.1.‐ PLAGUICIDAS ORGANOCLORADOS Según la organización mundial de la salud (WHO), un pesticida o plaguicida es cualquier sustancia o mezcla de sustancias, de carácter orgánico o inorgánico, que está destinada a combatir insectos, ácaros, roedores y otras especies indeseables de plantas y animales que son perjudiciales para el hombre o que interfieren de cualquier otra forma en la producción, elaboración, almacenamiento, transporte o comercialización de alimentos, producción de alimentos, productos agrícolas, madera y productos de madera. También aquellos que pueden administrarse a los animales para combatir insectos arácnidos u otras plagas en o sobre sus cuerpos [95]. Los plaguicidas organoclorados (OCPs) (Fig. 24) se han utilizado durante las dos últimas décadas para combatir plagas en la agricultura, en la industria e incluso para hacer frente a enfermedades como la malaria. Sus propiedades físico‐químicas hacen que tengan una resistencia muy alta a la degradación biológica por lo que son 89 muy persistentes. Debido a esta persistencia se encuentran ampliamente distribuidos en el medio ambiente lo que hace que sean una amenaza para la salud pública y para muchas formas de vida. Estos compuestos se comportan como pseudohormonas, interfiriendo en el sistema endocrino de animales, humanos o en la biota acuática. Se han asociado muchos problemas de salud a estos disruptores endocrinos como son daños neurológicos, enfermedad de Parkinson, defectos de nacimiento, enfermedades respiratorias, desarrollos sexuales precoces, cambios de comportamiento, cáncer de mama, disminución de la cantidad de esperma o disfunciones en el sistema inmunitario [96,97]. Estos compuestos llegan al medio acuático principalmente por la agricultura ya sea a través de precipitaciones atmosféricas o por transporte, por arrastre, infiltraciones y erosiones del suelo. También se pueden dispersar concentraciones traza de plaguicidas tras la aplicación en los campos de cultivo, por derrames accidentales o por la aplicación directa en los campos situados cerca de sistemas acuáticos. 90 Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Alfa‐HCH Cl Cl Cl Cl Cl Lindano Beta‐HCH Cl Cl delta‐HCH Cl Cl Cl Cl Cl Cl Cl Cl Cl H Cl2 ClCl O H Cl Cl Cl Cl Cl Cl Cl alfa‐Endosulfan Heptaclor epóxido Cl Cl Cl Cl Cl Cl Cl Cl O Cl Cl O O S Cl Cl O Cl Cl Cl Cl Dieldrin beta‐Endosulfan p,p'‐DDE Cl Cl O O Cl Cl Cl Cl Endrin aldehido Endrin Cl Cl S Cl O O Cl O Cl Cl Cl Cl Cl p,p'‐DDD Cl Cl Cl O O Aldrin Cl Cl Heptaclor Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Cl Endosulfan sulfato Cl Cl Cl Cl Cl Cl Cl Cl Cl p,p'‐DDT O O O Cl Endrin cetona Metoxiclor Figura 24. Estructura química de los dieciocho plaguicidas organoclorados estudiados. 91 5.2.‐ COMPUESTOS ODORÍFEROS Los metabolitos producidos en la degradación de las algas verde‐azuladas como consecuencia de procesos de eutrofización son los responsables del olor a moho y tierra mojada en las aguas de grifo [98]. También ciertas bacterias de la clase Actinomices producen este tipo de olor [99]. Estos metabolitos son la geosmina y el 2‐metilisoborneol (MIB) (Fig. 25) entre otros, y su olor es perceptible a niveles muy bajos de concentración, entre 4 y 10 ng L‐1 para la geosmina, y entre 9 y 42 ng L‐1 para el MIB [100]. Además, la geosmina y el MIB son los responsables de aromas no deseados en el vino. Cuando las uvas son atacadas por ciertos hongos filamentosos producen geosmina y MIB. El vino puede tener un sabor característico a tierra debido a la presencia de estas moléculas y los olores son perceptibles a valores de concentración entre 50‐55 ng L‐1. Estos compuestos no presentan peligro para la salud pero cuando los valores de concentración se sitúan por encima de estos niveles umbral se produce el rechazo del consumidor. H3C CH3 CH3 OH CH3 Geosmina MIB Figura 25. Estructura química de los dos compuestos odoríferos estudiados en el presente trabajo. 92 5.3.‐ COMPUESTOS NITROAROMÁTICOS Los compuestos nitroaromáticos se utilizan principalmente como explosivos o como disolventes. Su mayor consumo corresponde a la reducción de estos compuestos a derivados de la anilina para la fabricación de pigmentos, colorantes, insecticidas, plásticos, resinas, elastómeros, productos farmacéuticos, reguladores del crecimiento de las plantas, aditivos para combustibles, aceleradores del caucho y antioxidantes [101]. El riesgo agudo más importante para la salud es la cianosis, y la manifestación crónica es la anemia. Estos compuestos llegan al medio ambiente principalmente por las actividades militares y como consecuencia del recrudecimiento de la actividad terrorista. Los cinco compuestos nitroaromáticos determinados en esta memoria se muestran en la Fig. 26. Figura 26. Estructura química de los cinco explosivos nitroaromáticos estudiados. 93 REFERENCIAS REFERENCIAS 1. M.C. Cann. ”Greening Across the Chemistry Curriculum”. Chemistry Department, University of Scranton. http://academic.scranton.edu/faculty/CANNM1/dreyfusmodules.html 2. A.I. Varsavsky. ”Química verde y prevención de la contaminación”. Fundación Nexos, Buenos Aires. http://www.aqa.org.ar/iyq1.htm 3. F. Burriel, F. Lucena, J. Arribas, J. Hernández, “Química Analítica Cuantitativa”. Editorial Paraninfo, Madrid, 1985. 4. J.J. Baeza. “La Química Analítica y su metodología”. http://www.uv.es/baeza/metodo.html 5. M. Valcárcel, A. Gómez. “Técnicas analíticas de separación”. Editorial Reverté, Barcelona, 1990. 6. L.M.L. Nollet. “Handbook of Water Analysis”. Editorial Marcel Dekker, New York, 2000. 7. L.M.L. Nollet. “Chromatographic analysis of the environment”. Editorial CRC/Taylor & Francis, New York, 2006. 8. M.A. Jeannot, A. Przyjazny, J.M. Kokosa. Journal of Chromatography A 1217 (2010) 2326‐2336. 9. S.Liu, P.K. Dasgupta. Analytical Chemistry 67 (1995) 2042‐2049. 10. H. Liu, P.K. Dasgupta. Analytical Chemistry 68 (1996) 1817‐1821. 11. M.A. Jeannot, F.F. Cantwell. Analytical Chemistry 68 (1996) 2236‐2240. 12. M.A. Jeannot, F.F. Cantwell. Analytical Chemistry 69 (1997) 235‐239. 13. Y. He, H.K. Lee. Analytical Chemistry 69 (1997) 4634‐4640. 14. M. Ma, F.F. Cantwell. Analytical Chemistry 70 (1998) 3912‐3919. 15. S. Pedersen‐Bjergaard, K.E. Rasmussen. Analytical Chemistry 71 (1999) 2650‐2656. 16. W. Liu, H.K. Lee. Analytical Chemistry 72 (2000) 4462‐4467. 95 17. A. Theis, A.J. Waldack, S.M. Hansen, M. A. Jeannot. Analytical Chemistry 73 (2001) 5651‐5654. 18. A.Tankeviciute, R. Kazlauskas, V. Vickackaite. Analyst 126 (2001) 1674‐1677. 19. A. Przyjazny, J.M. Kokosa. Journal of Chromatography A 977 (2002) 143‐ 153. 20. B. Hauser, P. Popp, E. Kleine‐Benne. Journal of Chromatography A 963 (2002) 27‐36. 21. S. Pedersen‐Bjergaard, K.E. Rasmussen. Journal of Chromatography A 1109 (2006) 183‐190. 22. M. Rezaee, Y. Assadi, M.R. Milani Hosseini, E. Aghaee, F. Ahmadi, S. Berijani. Journal of Chromatography A 1116 (2006) 1‐9. 23. H. Lord, J. Pawliszyn. Journal of Chromatography A 902 (2000) 17‐63. 24. C. Cortada, L. Vidal, A. Canals. Journal of Chromatography A 1218 (2011) 17‐ 22. 25. C. Cortada, L. Vidal, A. Canals. Talanta 85 (2011) 2546‐2552. 26. J. Liu, G. Jiang, Y. Chi, Y. Cai, Q. Zhou, J.T. Hu. Analytical Chemistry 75 (2003) 5870‐5876. 27. L. Yangcheng, L. Quan, L. Guangsheng, D. Youyuan. Analytica Chimica Acta 566 (2006) 259‐264. 28. A. Sarafraz‐Yazdi, S Raouf‐Yazdinejad, Z. Es’haghi. Chromatographia 66 (2007) 613‐617. 29. H.F. Wu, J.H. Yen, C.C. Chin. Analytical Chemistry 78 (2006) 1707‐1712. 30. F.J. López‐Jiménez, S. Rubio, D‐ Pérez‐Bendito. Journal of Chromatography A 1195 (2008) 25‐33. 31. M.A. Farajzadeh, M. Bahram, J.A. Jonsson. Analytica Chimica Acta 591 (2007) 69‐79. 32. Wei, Y. Li, X. Wang. Journal of Separation Science 30 (2007) 3262‐3267. 96 REFERENCIAS 33. N. Fattahi, Y. Assadi, MRM Hosseini, E.Z. Jahromi. Journal of Chromatography A 1157 (2007) 23‐29. 34. N. Fattahi, S. Samadi, Y. Assadi, MRM Hosseini. Journal of Chromatography A 1169 (2007) 63‐69. 35. M.A. Farajzadeh, D. Djozan, N. Nouri, M. Bamorowat, M.S. Shalamzari. Journal of Separation Science 33 (2010) 1816‐1828. 36. M. Rezaee, Y. Yamini, M. Moradi, A. Saleh, M. Faraji, M.H. Naeeni. The Journal of Supercritical Fluids 55 (2010) 161‐168. 37. V. Vickackaite, E. Pusvaskiene. Journal of Separation Science 32 (2009) 3512‐3520. 38. M.A. Farajzadeh, S.E. Seyedi, M.S. Shalamzari M. Bamorowat. Journal of Separation Science 32 (2009) 3191‐3200. 39. P. Hashemi, S. Beyranvand, R.S. Mansur, A.R. Ghiasvand. Analytica Chimica Acta 655 (2009) 60‐65. 40. X.Z Hu, J.H. Wu, Y.Q. Feng. Journal of Chromatography A 1217 (2010) 7010‐ 7016. 41. L. He, X. Luo, H. Xie, Ch. Wang, X. Jiang, K.Lu. Analytica Chimica Acta 655 (2009) 52‐59. 42. L. He, X. Luo, X. Jiang, L. Qu. Journal of Chromatography A 1217 (2010) 5013‐ 5020. 43. Y. Liu, E. Zhao, W.Zhu, H. Gao, Z. Zhou. Journal of Chromatography A 1216 (2009) 885‐891. 44. L.M. Ravelo‐Pérez, J. Hernández‐Borjes, M. Asensio‐Ramos, M.A. Rodríguez‐Delgado. Journal of Chromatography A 1216 (2009) 7336‐7345. 45. M. Cruz‐Vera, R. Lucena, S. Cárdenas, M. Valcárcel. Journal of Chromatography A 1216 (2009) 6459‐6465. 46. E. Molaakbari, A. Mostafavi, D. Afzali, Journal of Hazardous Materials 185 (2011) 647‐682. 97 47. C. Yao, J.L. Anderson. Analytical & Bioanalytical Chemistry 395 (2009) 1491–1502. 48. A.Papadopoulou, I.P. Roman, A. Canals, K. Tyrolova, E. Psillakis. Analytica Chimica Acta 691 (2011) 56‐61. 49. Q. Zhou, H.Bai, G. Xie, J. Xiao. Journal of Chromatography A 1188 (2008) 148‐153. 50. H. Ebrahimzadeh, H. Abedi, Y. Yamini, L. Adlnasab. Journal of Separation Science 33 (2010) 3759‐3766. 51. Z.G‐ Shi, H.K. Lee. Analytical Chemistry 82 (2010) 1540‐1545. 52. J. M. Kokosa, A. Pryjazny, M. A. Jeannot. “Solvent microextraction. Theory and practice”. Editorial John Wiley & Sons, New Jersey, 2009. 53. W.Z. Nernst. Physical Chemistry 47 (1904) 52‐58. 54. W.K. Lewis, W.G. Whithman. Industrial Engineering Chemitry 16 (1924) 1215‐ 1220. 55. R. Higbie. Transactions of the American Institute of Chemical Engineers 31 (1935) 365‐389. 56. P.V. Danckwerts. Industrial Engineering Chemistry 43 (1951) 1460‐1467. 57. R.P. Schwarzenbach, P.M. Gschwend, D.M. Imboden. “Environmental Organic Chemistry”, 2‐nd ed., Editorial Wiley‐Interscience, Hoboken, New Jersey, 2003. 58. T. J. Mason. “Sonochemistry: The uses of ultrasound in chemistry”. Editorial Royal Society of Chemistry, Cambridge, 1990. 59. C. Biendicho, I. Lavilla. “Ultrasound extractions. Encyclopedia of Separation Science”, Editorial Academic Press, London. 2000. 60. T. J. Mason. “Sonochemistry”. Editorial Oxford University Press, Nueva York, 1999. 98 REFERENCIAS 61. N. Haider, S. Karlsson. Analyst 124 (1999) 797‐800. 62. A. Canals, A. Cuesta, L. Gras, M.R. Hernández. Ultrasonics Sonochemistry 9 (2009) 143‐149. 63. C.C. Nascentes, M. Korn, C.S. Sousa, M.A.Z. Arruda. Journal of the Brazilian Chemical Society 12 (2001) 57‐63. 64. C.C. Nascentes, M. Korn, C.S. Sousa, M.A.Z. Arruda. Microchemical Journal 69 (2001) 37‐43. 65. J.A. Gallego, G. Rodríguez, E. Riera, F. Montoya, F. Vázquez, L. Elvira, E. Andrés, M. Navajas, J.C. Gálvez, G. Nájera, V. Acosta, A. Blanco. Revista de acústica XXXI (2000) 1. 66. G. Cravotto, P. Cintas. Chemical Society Reviews 35 (2006) 180‐196. 67. A. Gedanken. Ultrasonics Sonochemistry 11 (2004) 47‐55. 68. P.R. Birkin, D. G. Offin, P.F. Joseph, T.G. Leighton. Journal of Physical Chemistry B 109 (2005) 16997‐17005. 69. T.G. Kazi, M.K. Jamali, A. Siddiqui, G.H. Kazi, M.B. Arain, H.I, Afridi. Chemosphere 60 (2006) 411‐420. 70. Collasiol, D. Pozebon, S.M. Maia. Analytical Chimica Acta 518 (2004) 157‐ 164. 71. A.V. Filgueiras, I. Lavilla, C. Bendicho. Fressenius’ Journal of Analytical Chemistry 369 (2001) 451‐456. 72. A. Marín, A. López‐Gonzálvez, C. Barbas. Analytica Chimica Acta 442 (2001) 305‐318. 73. A. Vaisanen, R. Suontamo, J. Silvonen, J. Rintala. Analytical and Bioanalytical Chemistry 373 (2002) 93‐97. 74. A. Vaisanen, A. Ilander. Analytica Chimica Acta 570 (2006) 93‐100. 99 75. H. Méndez, F. Alava, I. Lavilla, C. Bendicho. Analytica Chimica Acta 452 (2002) 217‐222. 76. R. Al‐Merey, M.S. Al‐Masri, R. Bozou. Analytica Chimica Acta 452 (2002) 143‐ 148. 77. S. Canepari, E. Cardarelli, S. Ghighi, L. Scimonelli. Talanta 66 (2005) 1122‐ 1130. 78. A. Elik. Talanta 66 (2005) 882‐888. 79. J.L. Luque‐García, M.D. Luque de Castro. Analyst 127 (2002) 1115‐1120. 80. J. Ruiz‐Jiménez, J.L. Luque‐García, M.D. Luque de Castro. Analytica Chimica Acta 480 (2003) 231‐237. 81. A. Peña, F. Ruano, M.D. Mingorance. Analytical and Bioanalytical Chemistry 385 (2006) 918‐925. 82. I. Lavilla, A. Mosquera, J. Millos, J. Cameselle, C. Bendicho. Analytica Chimica Acta 566 (2006) 29‐36. 83. N. Manutsewee, W. Aeungmaitrepirom, P. Varanusupakul, A. Imyim. Food Chemistry 101 (2007) 817‐824. 84. J. Ruiz‐Jiménez, M.D. Luque de Castro. Analytica Chimica Acta 489 (2003) 1‐11. 85. R. Agapito, S. Alves, J.L. Capelo, M.L. Gonçalve, A.M. Mota. Marine Chemistry 98 (2006) 286‐294. 86. M.C. Yebra, A. Moreno‐Cid. Analytica Chimica Acta 477 (2003) 149‐155. 87. J.L. Luque‐García, M.D. Luque de Castro. Journal of Chromatography A 1034 (2004) 237‐242. 88. E. Martino, I. Ramaiola, M. Urbano, F. Bracco, S. Collina. Journal of Chromatography A 1125 (2006) 147‐151. 100 REFERENCIAS 89. D.C. Montgomery. “Diseño y análisis de experimentos”. Editorial N. Grepe. Grupo Editorial Iberoamerica S.A. de C.V., 1991. 90. R.H. Myers, D.C. Montgomery. “Response surface methodology”. P. Bloomfield y N. Cressie. Editorial Jonh Willey & Son, Inc, 2002. 91. Y Heyden, C. Hartmann, D. Massart, L. Michel, P. Kiechle, F. Emi. Analytica Chimica Acta 316 (1995) 15‐26. 92. H. Fabre, N. Mesplet. Journal of Chromatography A, 897 (2000) 329‐338. 93. I. Garcia, L. Sarabia, M.C. Ortiz, J.M. Aldama. Journal of Chromatography A, 1085 (2005) 190‐198. 94. A. Atkinson, A.N. Donev, “Optimum experimental designs”. Editorial Oxford Clarendon Press, 1992. 95. World Health Organitation. “Guidelines for Drinking‐water Quality, 3‐th ed., Geneva, 2008. 96. W.J. Hayes in: W. Hayes, E.R. Lawes (Eds), Handbook of Pesticides Toxicology Academic Press, San Diego, 1991. 97. S.M. Snedecker, Environmental Health Perspectives 119 (2001) 35‐40. 98. G. Izaguirre, R.I. Wolfe, E.G. Means. Applied Environmental Microbiology 54 (1988) 2424‐2431. 99. N.N. Gerber, H.A. Lechevalier. Applied Microbiology 13 (1965) 935‐938. 100. A. Salemi, S. Lacorte, H. Bagheri, D. Barceló, Journal of Chromatography A 1136 (2006) 170‐175. 101. Instituto Nacional de Seguridad e Higiene en el Trabajo. Ministerio de trabajo e investigación. “Propiedades de los nitrocompuestos aromáticos”, Vol. 4, pp‐104.346‐104.348. 101 PARTE EXPERIMENTAL MICROEXTRACCIÓN EN GOTA 1.‐ MICROEXTRACCIÓN EN GOTA En este trabajo se utilizó la microextracción con disolvente en su modalidad de extracción en gota directamente sumergida. Se estudió su aplicación en la determinación de plaguicidas en muestras de agua con una matriz compleja. En este tipo de matrices tanto las técnicas clásicas como son la extracción líquido‐líquido o la extracción en fase sólida, como las técnicas más recientes como pueden ser la microextracción en fase sólida o la extracción sobre barra agitadora presentan problemas que en numerosas ocasiones impiden su determinación y, en la mayoría de los casos, es necesaria una limpieza previa de la muestra mediante un tratamiento de extracción con Soxhlet u otros similares. Se eligieron los plaguicidas organoclorados debido a su persistencia en el medio ambiente y su toxicidad provada. Estos compuestos se utilizaron en grandes cantidades en la década de los cincuenta por su eficacia en el control de plagas en la agricultura. De hecho, algunos de estos compuestos como el DDT se han utilizado para combatir epidemias como la malaria. Aunque la mayoría de estos compuestos están prohibidos sigue teniendo una presencia importante en el agua tanto en manantiales, embalses o pozos de agua potable como en las aguas procedentes del deshecho de industrias, agricultura, etc. La técnica de microextracción en gota directamente sumergida se utilizó para extraer 18 plaguicidas organoclorados de muestras de agua procedentes de cinco efluentes diferentes urbanos e industriales y su posterior determinación por cromatografía de gases y detección por espectrometría de masas. Para llevar a cabo la optimización del método se utilizó el diseño de experimentos como herramienta estadística para minimizar el número de pruebas a realizar. 105 MICROEXTRACCIÓN EN GOTA Abstract A rapid and simple single‐drop microextraction method (SDME) has been used to preconcentrate eighteen organochlorine pesticides (OCPs) from water samples with a complex matrix. Exposing two microlitre toluene drop to an aqueous sample contaminated with OCPs proved an excellent preconcentration method prior to analysis by gas chromatography‐mass spectrometry (GC‐MS). A Plackett‐Burman design was used for screening and a central composite design for optimizing the significant variables in order to evaluate several possibly influential and/or interacting factors. The studied variables were drop volume, aqueous sample volume, agitation speed, ionic strength and extraction time. The optimum experimental conditions of the proposed SDME method were: 2 μL toluene microdrop exposed for 37 min to 10 mL of the aqueous sample containing 0% w/v NaCl and stirred at 380 rpm. The calculated calibration curves gave high‐level linearity for all target analytes with correlation coefficients ranging between 0.9991 and 0.9999. The repeatability of the proposed method, expressed as relative standard deviation, varied between 5.9 and 9.9 % (n = 8). The detection limits were in the range of 0.022‐ 0.101 μg L−1 using GC‐MS with selective ion monitoring. The LOD values obtained are able to detect these OCPs in aqueous matrices as required by EPA Method 625. 107 Analysis of spiked effluent wastewater samples revealed that the matrix had no effect on extraction for eleven of the analytes but exerted notable effect for the other analytes. Keywords: Organochlorine pesticides; single‐drop experimental design; complex matrix; sample preparation. 108 microextraction; MICROEXTRACCIÓN EN GOTA 1. Introduction The use of pesticides in food production affords numerous benefits in terms of increasing production and quality; however, it is harmful to human health if applied inappropriately. Organochlorine pesticides (OCPs) are associated with many chronic diseases. Moreover, these compounds may behave as pseudohormones, disrupting the endocrine system in wildlife, humans, as well as aquatic biota. Many problems have been linked to these endocrine disrupters, such as neurological damage, Parkinson’s disease, birth defects, respiratory illness, early sexual development, behavioural changes, breasts cancer, lowered sperm counts and immune system dysfunction [1,2]. Although the use of OCPs has been banned by the Stockholm Convention of Certain Persistent Organic Pollutants, previous widespread use of these pesticides caused significant environmental contamination. Therefore, monitoring trace levels of OCPs in food and waters is still imperative for health protection and environmental control because OCPs are of difficult degradation, easy accumulation and high toxicity [3]. Recently, researchers have paid more attention to developing analytical approaches to OCPs detection, including gas chromatography (GC‐ECD) [4‐6] and gas chromatography‐mass spectrometry (GC‐MS) [7,8]. Most OCPs determinations require a preparative processes, such as liquid‐liquid extraction (LLE) [9], solid‐ phase extraction (SPE) [10,11], solid‐phase microextraction (SPME) [12‐14] and hollow fiber‐liquid phase microextraction (HF‐LPME) [15,16]. Liquid‐liquid extraction (LLE) is one of the oldest pretreatment procedures and is commonly used because of its simplicity and low cost. However, conventional LLE requires relatively large volumes of organic solvents, is time‐consuming, labor‐intensive and hazardous to health and environment. SPE demands a large volume of organic solvents, analytes may be adsorbed and complex matrices can cause settling in cartridges. SPME, a 109 robust, sensitive and accurate method, has achieved tremendous success and is widely used for testing foods and environmental pollutants; however, its application has been hindered by its relatively high price and fragile coating layer. Fibers tend to degrade with use and the partial loss of stationary phase leads to peaks that may coelute with the analytes, thus affecting precision. In addition, when SPME is used, carryover of the fiber between extractions may occur and is hard to eliminate even at high desorption temperatures. Single‐drop microextration (SDME), developed in 1996 by Jeannot and Cantwell [17], provides an alternative technique, which integrates sampling, extracting and concentrating into a single step. The advantages of simple processes using fewer organic solvents in SDME are attractive. Other advantages of SDME include low cost, since it requires only common laboratory equipment, as well as simplicity, speed and the potential for easy automation. In recent years, SDME has become highly developed and is used for OCPs extraction [18‐22]. De Jager and Andrews [18] reported a preliminary work using SDME for the extraction of 11 kinds of OCPs from river water. Qian and He [20] introduced a funnel‐form single‐drop microextraction to extract 11 organochlorine and two pyrethroid pesticides for the analysis of tea samples by gas chromatography‐electron‐capture detection (GC‐ECD). Zhang et al. [22] investigated the extraction of 9 kinds of OCPs from vegetable samples by suspending a 1.00 µL mixed drop of p‐xylene and acetone (8:2). Other applications of SDME for the extraction of OCPs from fish [21] and, natural and tap water [19] have also been developed. Chemometrics have been employed to optimize analytical methods, whose advantages include the need for fewer resources (i.e., time, reagents and experimental work). Chemometrics offer a sound theoretical basis to optimize chemical systems and processes. Moreover, chemometric tools, which employ 110 MICROEXTRACCIÓN EN GOTA mathematical models, can assess the statistical significance of the effects of the independent variables under study as well as evaluating the effects of their interaction. Multivariate optimization employs designs in which the levels of all variables can be changed simultaneously. Some applications make use of the microextraction and chemometric aspects with SDME simultaneously [23‐25]. To our knowledge, no studies have been reported using multivariate analysis to optimize the SDME of organochlorine pesticides. In this work, SDME was used to extract eighteen OCPs, some of which have not been considered previously, from complex aqueous matrices, and then, determinations were carried out on GC‐MS. SDME extraction parameters (i.e., drop volume, aqueous sample volume, agitation speed, ionic strength and extraction time) were optimized by the experimental design. The procedure was then applied to the determination of organochlorine pesticides in water samples. 2. Experimental 2.1. Chemicals and “real‐world” water samples Eighteen organochlorine pesticides were used in the present study, namely: alpha‐hexachlorocyclohexane (HCH), beta‐HCH, gamma‐HCH, delta‐HCH, Heptachlor, Aldrin, Heptachlor epoxide, alpha‐Endosulfan, p,p’‐DDE, Dieldrin, Endrin, beta‐Endosulfan, p,p’‐DDD, Endrin aldehyde, Endosulfan sulfate, p,p’‐DDT, Endrin ketone and Methoxychlor, all obtained from Dr. Ehrenstorfer (Agsburg, Germany). Methanol, toluene, isooctane and hexane were pesticide‐grade and were obtained from Sigma‐Aldrich (St. Louis, MO, USA). Deionised water was prepared in a water purification system (Gradient A10) supplied by Millipore (Billerica, MA, USA). Sodium chloride from Merck (Darmstadt, Germany) was used to adjust the ionic strength of the aqueous samples. Stock standard solution of 10 mg L‐1 of target compounds was prepared in methanol. Working solutions were prepared by dilution of standard stock solution. All solutions were stored in the dark at 4°C. 111 The recovery studies were carried out using effluent wastewater (Torrevieja, Spain) from a municipal and industrial wastewater treatment plant (WWTP). Samples were stored in the dark at 4°C and were analyzed after being filtered through common lab filter paper. Initial analysis confirmed that they were free of all target analytes. 2.2. Single‐drop microextraction (SDME) For SDME, 10 mL of the sample solution was placed in a 15 mL crimp top glass vial containing a stirring bar and fitted with a Mininert Valve from Supelco (Bellefonte, PA, USA). In order to eliminate volatilization losses, all aqueous samples were freshly prepared before each SDME experiment. A 10 μL SGE syringe (Melbourne, Australia) with a bevel‐needle tip (length: 5.0 cm, i.d.: 0.047 cm, bevel 26º) typically containing 2 μL of toluene was clamped above the vial containing the water sample. The microsyringe was then lowered and its needle passed through the Mininert valve until the tip of the needle was immersed in the sample. The plunger was depressed and the 2‐μL drop of the extractant phase was exposed to the sample with magnetic stirring at 380 rpm. The analytes were then allowed to partition between the aqueous sample and toluene droplet at room temperature for 37 min (unless otherwise stated in the text). After extraction, the microdrop was retracted into the microsyringe and then injected into the GC‐MS system for analysis. 2.3. GC‐MS determination All analyses were carried‐out on a Varian 3800‐Saturn 2000 Gas Chromatography/Mass Spectrometer system (Walnut Creek, CA, USA) equipped with a VF‐5‐Ms Factor‐four Varian column (30 m × 0.25 mm, 0.25 μm). The mass spectrometer employed was an ion trap (20 µA) with 0.82 seconds of scan time. The injector was maintained at 250 °C and operated in the splitless mode with the split closed for 0.75 min. Helium (> 99.999 % pure) was used as the carrier gas at a flow 112 MICROEXTRACCIÓN EN GOTA rate of 1.0 mL min‐1. The column oven was initially set at 70 °C for 2 min, programmed to 160 °C at a 15 °C min‐1 rate for 5 min, and finally to 240 °C at 3.5 °C min‐1 rate, where it was held for 5 min. The interface temperature was set at 200 °C and the detector voltage at 4 V. A 10‐min solvent cut time was allowed for all analyses. The base peak ion and two other significant ions of each analyte were chosen as the quantifying ions. The base peak ions (m/z) for the target analytes were: alpha, beta, gamma and delta‐HCH: 183, Heptachlor: 272, Aldrin: 263, Heptachlor epoxide: 289, alpha‐Endosulfan: 241, p,p’‐DDE: 318, Dieldrin: 79, Endrin: 281, beta‐Endosulfan: 195, p,p’‐DDD: 235, Endrin aldehyde: 345, Endosulfan sulfate: 272, p,p’‐DDT: 235, Endrin ketone: 317 and Methoxychlor: 227. Prior to quantification, the identification of all target compounds was based on their mass spectra and GC retention times. Fig. 1 shows a typical chromatogram of a real spiked aqueous sample containing 10 µg L‐1 of all the target analytes. Fig. 1. Typical chromatogram of organochlorine pesticides studied. (1) α‐HCH; (2) β‐HCH; (3) γ‐HCH; (4) δ‐HCH; (5) Heptachlor; (6) Aldrin; (7) Heptachlor epoxide; (8) α‐Endosulfan; (9) p,p’‐DDE; (10) 113 Dieldrin ; (11) Endrin; (12) β‐Endosulfan; (13) p,p’‐DDD; (14) Endrin aldehyde; (15) Endosulfan sulphate; (16) p,p’‐DDT; (17) Endrin ketone; (18) Methoxychlor. 2.4. Data handling and processing According to previous works, the response of the instrument used in the screening study was based on each area of the individual peaks eluted during GC‐MS analysis (see section 3.1.1. for explanation) [26]. By contrast, the optimization study was based on the sum of all the areas of the individual peaks [23,27‐29], in order to obtain one unique set of optimum conditions for the extraction of all the organochlorine pesticides. Experimental design matrices were constructed and results were evaluated using the Statgraphics Statistical Computer Package “Statgraphics Plus 5.1”. 3. Results and Discussion 3.1. Study of experimental variables involved in SDME The first step in the optimization procedure was to select an appropriate extraction solvent. Toluene, n‐hexane and isooctane were tested as potential acceptor phases. Solvent selectivity was evaluated after exposing 2 µL of organic solvent drop immersed in a 10 mL de‐ionized water sample, spiked at 100 µg L‐1 with all target analytes and stirred at 300 rpm for 10 min. Enrichment factors were calculated for each solvent and are shown in Table 1. Of the three solvents tested toluene gave the best results, as can be seen in Table 1; contrarily, hexane presented drop‐stability problems. Therefore, toluene was chosen for the next optimization procedure for the extractant phase. 114 MICROEXTRACCIÓN EN GOTA Table 1. Enrichment factor of various organic solventsa Enrichment (‐fold) Analyte Toluene n‐Hexane Alpha‐HCH 68 29 Beta‐HCH 61 24 Gamma‐HCH 107 44 Delta‐HCH 110 32 Heptachlor 25 11 Aldrin 5 3 Heptachlor epoxide 23 11 Alpha‐Endosulfan 28 14 p,p’‐DDE 3 2 Dieldrin 20 10 Endrin 23 8 Beta‐Endosulfan 51 19 p,p’‐DDD 13 6 Endrin aldehyde 50 11 Endosulfan sulfate 93 28 p,p’‐DDT 12 5 Endrin ketone 100 30 Methoxychlor 232 61 Isooctane 35 30 54 39 12 4 14 17 2 13 13 27 7 13 34 8 43 97 ‐1 a Water samples spiked at a concentration of 100 µgL of each compounds. Different variables can affect the extraction yield in the SDME procedure and in most cases they are correlated. Therefore, a multivariate approach is recommended for their optimization. However, some of them might not have a significant effect and they can, thus, be obviated. In this respect, a screening study, prior to optimization, is helpful in order to assess the significant variables involved in the analytical system under study. In this case, based on the literature and previous experience of our group [23,24,26], the influence of five variables, namely drop volume, sample volume, ionic strength, agitation speed and extraction time, were studied in order to maximize the extraction yield of the SDME procedure. 115 3.1. 1. Screening design Screening is the first step in the efficient assessment of the variables involved in the analytical system under study. If a large number of variables are involved, reduced factorial designs are employed. One particular type of those designs is the Plackett‐Burman design [30], which assumes that the interactions can be completely ignored and so the main effects are calculated with a reduced number of experiments. A saturated Plackett‐Burman matrix was employed because many parameters were to be tested. A matrix with 11 variables (five real variables and six dummy variables) was used. The effects of dummy variables are used to estimate the experimental error used in the statistical interpretation [31,32]. For each variable, shown in Table 2, two levels were considered. The matrix of the Plackett‐Burman design comprised 12 experiments. The experiments were carried out at random in order to nullify the effect of extraneous or nuisance variables, by using aqueous solutions of 100 µg L‐1 and evaluating the GC peak area for each experiment and for each analyte. The screening study was done with each area because there were many variables and many analytes. Therefore, it is possible that confusion could arise when the sum of the area is used, because of the different effects exerted by the variables on the different analytes. The aim of this preliminary study was to choose the significant variables in common for all the analytes rather than the optimum conditions, therefore, the use of individual peak area is the best option, and the significant variables for all the analytes should be compared. 116 MICROEXTRACCIÓN EN GOTA Table 2. Experimental variables and levels of the Plackett‐Burman design. Variables Level Low (‐1) High (+1) Drop Volume (µL) 1 2 Sample volume (mL) 8 10 Ionic strength (NaCl concentration; %, w/v) 0 3 Agitation speed (rpm) 0 300 Extraction time (min) 10 30 An ANOVA test was used to evaluate the data and statistically significant effects were determined using a t‐test with 95% probability [31,32] and visualized by using main effects Pareto charts (Fig. 2). The Pareto charts, shown in Fig. 2, belong to alpha, beta, delta‐HCH and Endrin aldehyde. The charts for the rest of the analytes are not shown as they are similar. 117 Fig. 2. Pareto charts of the main effects obtained from a Plackett‐Burman design for alpha‐HCH, beta‐HCH, delta‐HCH and Endrin aldehyde. According to the results, agitation speed was the most significant variable having a positive effect for almost all target analytes. The next most significant variables were ionic strength followed by extraction time, exerting a negative and a positive effect, respectively. Pareto charts also reveals that drop volume appeared as a non‐significant effect showing a negative effect for all the analytes except for the Endrin aldehyde. In general, an increase in the signal is expected on increasing droplet volume; however, larger organic solvent drops sometimes require extended equilibration times because mass transfer inside the drop is by diffusion alone [33]. However, in this study 2 µL of organic solvent drop was chosen to keep at least 1 µL of the droplet needed for the injection after extraction, due to problems of dissolution and instability. 118 MICROEXTRACCIÓN EN GOTA Sample volume appeared to have a positive non‐significant effect upon extraction. This positive effect agrees with the fact that increasing the aqueous sample volume also led to an increase in the total amount of analytes present in the solution, given that all samples were spiked at the same concentration level. Consequently, a greater amount of target pollutants was transferred to the droplet. Overall, the results of this first screening study revealed that two variables could be fixed, i.e., sample volume at 10 mL and drop volume at 2 µL, for the following optimization. 3.1.2. Optimization design The second study was concerned with optimizing the values of the significant variables in order to obtain the best response (in our case the sum of all peak areas). Different experimental designs can be found in the literature, many of which are based on the so‐called response surface designs. Box‐Wilson or central composite design (CCD) is one of the most commonly used response surface designs, and is constructed by several superimposed designs. It consists of a factorial design (2k) augmented with (2k) star points, where k is the number of variables to be optimized, and with a central point, which can be run n times [30]. A circumscribed central composite design (CCCD) was employed, where the star points were located at ±α from the centre of the experimental domain, which was located at 0. In order to establish the rotatability of the experimental design, n was set at 2 and α = 4√2k = 1.682 [30]. Therefore, the overall matrix of CCCD design involved 16 experiments. In this study, the three variables considered were: extraction time, agitation speed and sodium chloride concentration (ionic strength). The low (‐1), central (0), and high (+1) levels of these variables, as well as the location of their star points, are also given in Table 3. 119 Table 3. Experiemental variables and levels of the circumscribed central composite design (CCCD) Variables Level Star points (α = 1.682) Low (‐1) Central (0) High (+1) ‐α +α Agitation speed (rpm) 300 400 500 230 570 Extraction time (min) 10 20 30 3 37 Ionic strength (NaCl concent.; %, w/v) 2 3 4 1 5 The data obtained were evaluated by ANOVA test, and the effects were visualized by using a Pareto chart (Fig. 3). As can be seen, extraction time and agitation speed proved significant showing a positive effect, whilst ionic strength showed a non‐significant negative effect upon extraction. Fig. 3. Pareto chart of the three main factors obtained from the circumscribed central composite design. The effects exerted by pairs of variables were considered separately as it is not possible to plot the instrumental response as a function of all the variables controlling the extraction process simultaneously. Accordingly, the plots shown in Fig. 4 are useful to interpret the variation of the instrumental response as a function of each pair of independent variables graphically. Accordingly, Fig. 4a shows the response surface obtained by plotting extraction time versus ionic strength with the agitation speed fixed at 400 rpm, Fig. 4b shows the response surface developed for extraction time and agitation speed, whilst keeping a sodium chloride 120 MICROEXTRACCIÓN EN GOTA concentration of 3% (w/v) and finally, Fig. 4c shows the response surface obtained as a function of agitation speed and ionic strength, for an extraction time of 20 minutes. As can be seen, extraction time shows a positive effect upon extraction (Fig. 4a and 4b). Indeed, increasing extraction time augments the total amount of analyte extracted, reaching a maximum at 37 min (+1.682). As expected, agitation speed also shows a positive effect (Fig. 4b and 4c), reaching a maximum at 380 rpm (+0.956), and becoming stable afterwards. Increasing the speed of sample agitation is expected to enhance the extraction rate of the analyte, since mass transference is increased; however, higher values cause drop instability. On the other hand, ionic strength exerts a negative effect (Fig. 4a and 4c), reaching a maximum at 2.6% (w/v) (‐0.35). Apart from the salting‐out effect, the presence of salt was assumed to cause a secondary effect and change the physical properties of the extraction film, thus reducing the diffusion rates of the analytes toward the drop [34]. Since this variable had a non‐significant effect and the presence of salt also caused drop instability, the following extractions were done without NaCl. 121 Fig. 4. Response surfaces for total chromatographic peak area using the circumscribed central composite design obtained by plotting: (a) extraction time vs. ionic strength (agitation speed: 400 rpm); (b) agitation speed vs. extraction time (NaCl: 3%, w/v); and (c) agitation speed vs. ionic strength (extraction time: 20 min). According to this optimization study, the GC sum peak area for target analytes is expected to be maximized for sodium chloride concentration, reaching a value of 0% (w/v), extraction time reaching a value of 37 min and agitation speed reaching a value of 380 rpm. Overall, summarizing the results of both screening and optimization studies yield the following optimum experimental conditions: sodium 122 MICROEXTRACCIÓN EN GOTA chloride concentration, 0%; extraction time, 37 min; agitation speed, 380 rpm; drop volume, 2 µL; and sample volume, 10 mL. 3.2. Analytical figures of merit The optimum SDME conditions were used to test the applicability of the proposed method for quantitative determination of target analytes. A calibration study was performed by spiking pure water with analytes over the concentration range of 0.5 to 16 μg L‐1. The calculated calibration curves gave a high level of linearity for all target analytes with correlation coefficients (r) ranging between 0.9991 and 0.9999 as shown in Table 4. The repeatability of the proposed method, expressed as relative standard deviation (RSD), was evaluated by extracting eight consecutive aqueous samples (spiked at 10 μg L‐1 with each target analyte) and was found to vary between 5.9 and 9.9% (Table 4). The limits of detection (LODs) for all target analytes were determined according to the signal‐to‐noise‐ratio (S/N) of three and the limits of quantification (LOQs) as ten times the above mentioned ratio. As shown in Table 4, the LOD and LOQ values were found to be in the low μg L‐1 level, ranging from 0.022 to 0.101 μg L‐1 and between 0.074 and 0.337 µg L‐1, respectively. As we can see in Table 4, limits of detection values obtained in this work are much lower than the LOD values obtained with the EPA method 625 [35]. Furthermore, in comparison with previously reported works on the same topic, analyzing clean waters [18,19], we obtained higher or similar LOD values for more OCPs. Moreover, the LODs obtained by the method proposed here are similar to, or lower than, those obtained in other previous works on organochlorine pesticide determination using other microextraction methods (solvent cooling assisted dynamic hollow‐fiber‐supported headspace liquid‐phase microextraction) [36]. 123 Table 4. Main method parameters for extraction of organochlorine pesticides from water samples using the optimized SDME method. Analyte Slope ± SD Intercept ± SD Correlation RSD (%)b LOD (µg L‐1)c a coefficient (r) LOQ (µg L‐1)d LOD EPA 625 (µg L‐1)e Alpha‐HCH 8600±300 ‐4000±2000 0.9993 6.7 0.087 0.290 NAf Beta‐HCH 3800±100 4000±1000 0.9993 6.5 0.093 0.311 4.2 Gamma‐HCH 8000±100 ‐3000±1000 0.9998 6.5 0.045 0.149 NA Delta‐HCH 8200±200 ‐900±1000 0.9996 8.2 0.066 0.221 3.1 Heptachlor 800±10 300±100 0.9998 7.6 0.049 0.163 1.9 Aldrin 510±10 260±70 0.9997 9.9 0.053 0.177 1.9 Heptachlor epoxide 1290±20 ‐500±200 0.9997 6.8 0.054 0.178 Alpha‐Endosulfan 1070±20 0±200 0.9996 7.6 0.064 0.213 NA p,p’‐DDE 2040±20 800±100 0.9999 9.0 0.025 0.083 5.6 Dieldrin 2840±20 0±200 0.9999 6.3 0.022 0.074 2.5 Endrin 1450±30 0±300 0.9996 9.8 0.068 0.227 NA Beta‐Endosulfan 1180±30 400±200 0.9996 7.9 0.071 0.237 NA p,p’‐DDD 4700±30 6200±300 0.9999 6.9 0.022 0.074 2.8 Endrin aldehyde 2260±50 ‐700±400 0.9999 5.9 0.069 0.230 NA Endosulfan sulfate 1860±50 300±400 0.9993 9.3 0.087 0.290 5.6 p,p’‐DDT 740±20 900±200 0.9991 7.8 0.101 0.337 4.7 Endrin ketone 4050±90 ‐2400±700 0.9996 9.1 0.060 0.200 NA Methoxychlor 4390±80 ‐200±600 0.9999 7.4 0.050 0.167 NA Linear range: 0.5‐16 µg L‐1 (number of calibration points = 4). Relative standard deviation (RSD); mean value for eight replicate analyzes; spiking level 10 µg L‐1. c Limits of detection (LODs) were calculated for a three signal‐to‐noise‐ratio(S/N = 3). d Limits of cuantification (LOQs) were calculated for a ten signal‐to‐noise‐ratio (S/N = 10). e Data taken for Ref. [35]; EPA 625 (GC‐MS). f Not available. a b 124 2.2 MICROEXTRACCIÓN EN GOTA 3.3 “Real‐world” water analysis Different effluent wastewater samples from urban and industrial wastewater treatment plants were extracted using the SDME method developed here, and the extracts were analyzed by GC‐MS. The preliminary results showed that they were free of organochlorine pesticide contamination. In order to investigate the effects of sample matrix upon the SDME procedure three replicate analyses were carried out of the effluent wastewater samples, spiked at 10 μg L‐1 with each target contaminant, filtrated with common lab filter paper and analyzed under optimized experimental conditions. Relative recoveries were determined as the ratio of the concentrations found in real and deionised water samples, spiked at the same contamination level. The results for each set of experiments are summarized in Table 5. As shown in the table, eleven out of the eighteen organochlorine pesticides did not exert matrix effects, considering 70% as the acceptable lower limit and 120% as the upper limit. However, the other seven organochlorine pesticides, mainly Heptachlor, alpha‐Endosulfan, p,p’‐DDE, beta‐Endosulfan, p,p’‐DDD, p,p’‐DDT, and Methoxychlor, exerted a notable matrix effect. The decrease in relative recoveries observed could be attributed to three different phenomena [37]: (i) the possible competitive adsorption of target analytes by suspended particulate matter; (ii) adsorption by the containers and; (iii) losses during sample prefiltration. This phenomena could also be related with the structure of the analyte, where Endosulfans (alpha and beta) and Heptachlor have a similar structure, and on the other hand p,p’‐DDE, p,p’‐DDT, p,p’‐DDD and Metoxychlor are also similar in structure. This effect can be observed in Table 5. The mean recovery values could be used to quantify these analytes in real water samples. 125 Table 5. Relative and mean recoveries of the eighteen organochlorine pesticides in effluent wastewater samples. Relative recoveries (%) and RSD values (%) in parenthesesa Analyte Urban WWTP‐1 Wastewater raft Urban WWTP‐2 Mean recoveries ± SD Sanitary Urban and Urban Urban sewage industrial WWTP‐3 WWTP‐4 WWTP Alpha‐HCH 101 (3) 94 (5) 98 (11) 117 (9) 98 (8) 106 (2) 110 (5) 103 ± 8 Beta‐HCH 103 (4) 104 (9) 87 (7) 113 (4) 97 (7) 98 (5) 101 (7) 100 ± 8 Gamma‐HCH 95 (1) 101 (7) 92 (11) 118 (10) 99 (8) 105 (3) 104 (4) 102 ± 8 Delta‐HCH 101 (8) 90 (6) 101 (6) 115 (7) 98 (10) 99 (8) 105 (5) 101 ± 8 Heptachlor 66 (8) 63 (1) 55 (13) 45 (10) 51 (5) 57 (5) 47 (8) 55 ± 8 Aldrin 75 (6) 90 (10) 107 (11) 97 (13) 96 (5) 100 (8) 79 (2) 90 ± 10 Heptachlor epoxide 74 (1) 90 (7) 91 (7) 74 (5) 87 (7) 77 (7) 78 (4) 82 ± 8 Alpha‐Endosulfan 46 (8) 59 (6) 43 (10) 41 (6) 48 (9) 49 (8) 46 (11) 47 ± 6 p,p’‐DDE 34 (15) 48 (11) 49 (10) 44 (8) 43 (8) 39 (3) 43 (4) 43 ± 5 Dieldrin 94 (5) 71 (6) 79 (12) 73 (9) 80 (9) 73 (5) 73 (11) 78 ± 8 Endrin 83 (7) 75 (6) 84 (11) 74 (10) 68 (10) 79 (6) 80 (9) 78 ± 6 Beta‐Endosulfan 46 (9) 56 (9) 59 (9) 53 (2) 51 (9) 45 (9) 54 (10) 52 ± 5 p,p’‐DDD 43 (9) 54 (7) 55 (8) 47 (2) 34 (3) 51 (6) 45 (6) 47 ± 7 Endrin aldehyde 92 (10) 76 (9) 92 (9) 93 (6) 86 (4) 84 (1) 75 (9) 85 ± 8 Endosulfan sulfate 79 (3) 81 (7) 88 (4) 96 (10) 84 (10) 91 (2) 94 (6) 88 ± 7 p,p’‐DDT 34 (6) 71 (11) 46 (4) 52 (2) 42 (5) 45 (7) 43 (5) 50 ± 10 Endrin ketone 84 (5) 72 (11) 69 (4) 87 (11) 70 (10) 76 (5) 83 (10) 77 ± 7 Methoxychlor 57 (3) 64 (7) 64 (2) 58 (9) 58 (8) 61 (3) 66 (7) 61 ± 4 a Three replicate analyzes at a 10 µgL‐1 spiking level. 126 MICROEXTRACCIÓN EN GOTA 4. Conclusions A sensitive analytical method comprising SDME coupled with GC‐MS has been developed to quantify trace levels of eighteen organochlorine pesticides in complex water samples. The SDME method has been optimized by experimental design, which significantly reduces the resources used (time, reagents and experimental work). Sample preparation time, as well as consumption of toxic organic solvents, were minimized without reducing method sensitivity. This easy‐to‐ handle and cost‐effective method represents an attractive alternative to both traditional and more recently proposed sample preparation methods, as it affords better results. Acknowledgements The authors would like to thank the Spanish Government (projects n. CTQ2005‐09079‐C03‐01/BQU) and the Generalitat Valenciana (project n. ACOMP07/053) and LABAQUA S.A (Alicante, Spain) for the financial support. This work is part of the Doctoral Thesis of Carol Cortada. 127 REFERENCES [1] W.J. Hayes, in: W. Hayes, E.R. Lawes, (Eds.), “Handbook of Pesticides Toxicology”, Academic Press, San Diego 1991, pp 215‐244. [2] S.M. Snedeker, Environ. Health Perspect. 109 (2001) 35. [3] H.Z. Xu, N. Jia, R. Ren, Environ. Sci. Manage. 30 (2005) 83. [4] M. Gonzalez, K.S.B. Miglioranza, J.E. Aizpun de Moreno, V.J. Moreno, J. Agric. Food Chem. 51 (2003) 1353. [5] J. Ji, C.H. Deng, H.Q. Zhang, Y.Y. Wu, X.M. Zhang, Talanta 71 (2007) 1068. [6] R.Q. Yang, A.H. Lv, J.B. Shi, G.B. Jiang, Chemosphere 61 (2005) 347. [7] E.N. Papadakis, Z. Vryzas, E. Papadopoulou‐Mourkidou, J. Chromatogr. A 1127 (2006) 6. [8] A. Garrido Frenich, J.L. Martínez Vidal, A.D. Cruz Sicilia, M.J. González Rodríguez, P. Plaza Bolaños, Anal. Chim. Acta 558 (2006) 42. [9] O.S. Fatoki, R.O. Awofolu, J. Chromatogr. A 983 (2003) 225. [10] K. Conka, B. Drobná, A. Kocan, J. Petrik, J. Chromatogr. A 1084 (2005) 33. [11] M. Barriada‐Pereira, M.J. González‐Castro, S. Muniategui‐Lorenzo, P. López‐ Mahía, D. Prada‐Rodríguez, E. Fernández‐Fernández, J. Chromatogr. A 1061 (2004) 133. [12] B.D. Page, G. Lacroix, J. Chromatogr. A 757 (1997) 173. [13] H.P. Li, G.C. Li, J.F. Jen, J. Chromatogr. A 1012 (2003) 129. [14] B.A. Tomkins, A.R. Barnard, J. Chromatogr. A 964 (2002) 21. [15] C. Basheer, H.K. Lee, J.P. Obbard, J. Chromatogr. A 968 (2002) 191. [16] C.H. Yan, H.F. Wu, Rapid Commun. Mass Spectrom. 18 (2004) 3015. [17] M.A. Jeannot, F.F. Cantwell, Anal. Chem. 68 (1996) 2236. [18] L.S. de Jager, A.R.J. Andrews, Analyst 125 (2000) 1943. [19] L. Zhao, H.K. Lee, J. Chromatogr. A 919 (2001) 381. [20] L.L. Qian, Y.Z. He, J. Chromatogr. A 1134 (2006) 32. [21] K. Shrivas, H.F. Wu, J. Sep. Sci. 31 (2008) 380. 128 MICROEXTRACCIÓN EN GOTA [22] M. Zhang, J. Huang, Ch. Wei, B. Yu, X. Yang, X. Chen, Talanta 74 (2008) 599. [23] L. Vidal, C.E. Domini, N. Grané, E. Psillakis, A. Canals, Anal. Chim. Acta 592 (2007) 9. [24] L. Vidal, A. Chisvert, A. Canals, A. Salvador, J. Chromatogr. A 1174 (2007) 95. [25] E. Martendal, D. Budziak, E. Carasek, J. Chromatogr. A 1148 (2007) 131. [26] L. Vidal, E. Psillakis, C. Domini, N. Grané, F. Marken, A. Canals, Anal. Chim. Acta 584 (2007) 189. [27] F. Pellati, S. Benvenuti, F. Yoshizaki, D. Bertelli, M. Rossi, J. Chromatogr. A 1087 (2005) 265. [28] R. Castro, R. Natera, M. García, C. García, J. Chromatogr. A 953 (2002) 7. [29] P. Díaz, F.J. Señoráns, G. Reglero, E. Ibáñez, J. Agric. Food Chem. 50 (2002) 6468. [30] R.H. Myers, D.C. Montgomery. Response surface methodology, Wiley, New York, 2002. [31] H. Fabre, N. Mesplet, J. Chromatogr. A 897 (2000) 329. [32] Y.V. Heyden, C. Hartmann, D.L. Massart, L. Michel, P. Kiechle, F. Erni, Anal. Chim. Acta 316 (1995) 15. [33] A.L. Theis, A.J. Waldack, S.M. Hansen, M.A. Jeannot, Anal. Chem. 73 (2001) 5651. [34] E. Psillakis, N. Kalogerakis, J. Chromatogr. A 907 (2001) 211. [35] Method 625. “Organic chemical analysis of municipal and industrial wastewater” U.S. Environmental Protection Agency (U.S.EPA). [36] S.‐P. Huang, S.‐D. Huang, J. Chromatogr. A 1176 (2007) 19. [37] E. Concha‐Graña, M. I. Turnes‐Carou, S. Muniategui‐Lorenzo, P. López‐Mahía, E. Fernández‐Fernández, D. Prada‐Rodríguez, Chromatographia 54 (2001) 501‐507. 129 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA 2.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA En este trabajo se analizaron los mismos 18 plaguicidas que los estudiados en el trabajo anterior pero utilizando la técnica de microextracción líquido‐líquido dispersiva. La ventaja de esta técnica frente a la anteriormente citada es que la superficie de contacto entre la fase acuosa que contiene los analitos de interés y la fase orgánica es infinitamente larga con lo que se pueden obtener límites de detección inferiores y además, se evita el problema de la inestabilidad de la gota. Los resultados obtenidos con esta novedosa técnica deberían mejorarse con relación a los buenos resultados obtenidos con la técnica anterior de microextracción en gota siendo el manejo de esta técnica mucho más sencillo. Se determinaron los dieciocho plaguicidas organoclorados extrayéndolos con la técnica de microextracción líquido‐líquido dispersiva y posterior separación por cromatografía de gases y detección por espectrometría de masas en una muestra de agua superficial procedente de un río, de un embalse, de un agua potable y de un efluente de una planta de tratamiento de aguas residual urbana. 131 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA Abstract A rapid and simple dispersive liquid‐liquid microextraction (DLLME) has been developed to preconcentrate eighteen organochlorine pesticides (OCPs) from water samples prior to analysis by gas chromatography‐mass spectrometry (GC‐ MS). The studied variables were extraction solvent type and volume, disperser solvent type and volume, aqueous sample volume and temperature. The optimum experimental conditions of the proposed DLLME method were: a mixture of 10 µL tetrachloroethylene (extraction solvent) and 1 mL acetone (disperser solvent) exposed for 30 s to 10 mL of the aqueous sample at room temperature (20ºC). Centrifugation of cloudy solution was carried out at 2300 rpm for 3 min to allow phases separation. Finally, 2 µL of extractant was recovered and injected into the GC‐MS instrument. Under the optimum conditions, the enrichment factors ranged between 46 and 316. The calculated calibration curves gave a high‐level linearity for all target analytes with correlation coefficients ranging between 0.9967 and 0.9999. The repeatability of the proposed method, expressed as relative standard deviation, varied between 5 and 15% (n=8), and the detection limits were in the range of 1‐25 ng L‐1. The LOD values obtained are able to detect these OCPs in aqueous matrices as 133 required by EPA methods 525.2 and 625. Analysis of spiked real water samples revealed that the matrix had no effect on extraction for river, surface and tap waters; however, urban wastewater sample shown a little effect for five out of eighteen analytes. Keywords: Organochlorine pesticides; dispersive microextraction; sample preparation; water samples analysis. 134 liquid‐liquid MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA 1. Introduction Pesticides are classified according to their chemical structure in organochlorine, organophosphorous, carbamates, herbicides, triazines, etc. Organochlorine pesticides (OCPs) have been used extensively in the past two decades to combat pests in agriculture, industry and even to counter diseases such as malaria. Their physicochemical properties make them highly resistant to biological degradation and therefore they are highly persistent. Due to its wide spectrum of distribution and its biodegradation difficult, these compounds pose a serious threat to public health and most forms of life, since OCPs may behave as pseudohormones, disrupting the endocrine system in wildlife, humans, as well as aquatic biota. Many problems have been linked to these endocrine disrupters, such as neurological damage, Parkinson’s disease, birth defects, respiratory illness, early sexual development, behavioural changes, breasts cancer, lowered sperm counts and immune system dysfunction [1,2]. These compounds may reach the aquatic environment primarily from agricultural through atmospheric precipitation or transport, dredging, infiltration and soil erosion, also traces of pesticides are dispersed after spraying, accidental spills, and their direct application in fields situated near aquatic systems or when applied to rivers or ponds to kill fish. Therefore, monitoring trace levels of OCPs in food and waters is still imperative for health protection and environmental control because of their difficult degradation, easy accumulation and high toxicity [3]. Researchers have developed methods to determined (ultra)trace concentrations of OCPs, and most of them require a preparative process such as liquid‐liquid extraction (LLE) [4], solid‐phase extraction (SPE) [5] and solid‐phase microextraction (SPME) [6], which presents some disadvantages. SPE and SPME use expensive materials, are time‐consuming, usually have carry over effects and long‐time sorbent conditioning. On the other hand, in the case of LLE the main 135 disadvantages are the use of large amounts of potentially toxic and normally expensive organic solvents, time‐consuming and the high manipulation of the sample. For this reason, the miniaturization of the liquid‐liquid extraction (LPME) [7,8] has made the effort of eliminating or minimizing all these disadvantages. As a result, hollow‐fiber liquid‐phase microextraction (HF‐LPME) [9,10] and single drop microextraction (SDME) [11,12] have been widely applied for the extraction of OCPs from different matrices. SDME extracts the compounds in a droplet of organic solvent which hangs from the tip of a chromatographic syringe. SDME has centred a remarkable number of investigations during the last decade [8], and it has been proven and consolidated as an interesting and alternative to other (micro)extraction techniques. SDME stands out because it is simple to operate and use, fast, inexpensive, precise, sensitive, virtually solventless and environmentally friendly. In addition, it is characterized by its affordability, due to its independence of a commercial source. However, fast stirring speed and air bubbles cause drop instability and tend to break up the organic drop, and equilibrium could not be attained after a long time in most cases. For this reason, dispersive liquid‐liquid microextraction (DLLME) [13,14] appears as an alternative technique that eliminates all the problems described above. This microextraction technique eliminates the use of the syringe being the organic droplet with a disperser organic solvent, which is used as disperser of the droplet, directly suspended in the sample. Thereby, instant mixing of three components forms a cloudy solution that enables the equilibrium in few seconds, because the interphase is infinitely large between fine drops of organic solvent and water sample. The transference of the analytes from the water sample to organic phase is very fast if we compare the equilibrium time in SPE (60‐ 120 min) or SDME (40‐60 min). A short centrifugation of 3 min, force the drops to be deposited at the bottom of the tube and a portion is collected for analysis. On the 136 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA whole, DLLME not only keeps all the advantages of SDME, but also reduces the extraction time, increases the enrichment factors, and avoids the drop instability. DLLME methods coupled with GC have been successfully employed for the extraction and determination of polycyclic aromatic hydrocarbons (PAHs) [13], organophosphorus pesticides (OPPs) [14,15], chlorobenzenes [16], chlorophenols [17], trihalomethanes (THMs) [18], volatile phenols [19], triazine herbicides [20], phthalate esters [21], organophosphorus flame retardants and plasticizers [22], antidepressant drugs (TCAs) [23], polychlorinated biphenyls (PCBs) [24], organosulfur pesticides (OSPs) [25], amide herbicides [26] and captan, folpet and captafol [27]. During the preparation of this manuscript an interesting modification of DLLME has been published, where 13 µL of mixed organic solvent (tetrachloroethylene:tert‐butyl methyl ether = 4:6) have been used to extract five OCPs in clean waters employing 6.5 minutes for extraction [28]. In this work we present the use of DLLME to extract eighteen OCP’s from water samples, some of which have not been considered previously and are considered difficult to be extracted. The suggested method reduces the extraction time and the limits of detection values obtained are adequate for trace analysis of these OCPs in aqueous samples. Determinations were carried out on gas chromatography‐mass spectrometry (GC‐MS). DLLME extraction parameters (i.e. disperser solvent type and volume, aqueous sample volume, temperature, extraction solvent type and volume) were systematically optimized and the procedure was then applied to the determination of organochlorine pesticides in clean and dirty spiked real water samples. 137 2. Experimental 2.1. Chemicals and “real‐world” water samples Eighteen organochlorine pesticides were used in the present studies, namely: alpha‐hexachlorocyclohexane (HCH), beta‐HCH, gamma‐HCH, delta‐HCH, Heptachlor, Aldrin, Heptachlor epoxide, alpha‐Endosulfan, p,p’‐DDE, Dieldrin, Endrin, beta‐Endosulfan, p,p’‐DDD, Endrin aldehyde, Endosulfan sulfate, p,p’‐DDT, Endrin ketone and Methoxychlor, all obtained from Dr. Ehrenstorfer (Agsburg, Germany). Tetrachloroethylene, carbon tetrachloride, acetone and methanol were pesticide‐grade and were obtained from Sigma‐Aldrich (St. Louis, MO, USA). De‐ ionised water was prepared in a water purification system (Gradient A10) supplied by Millipore (Billerica, MA, USA). Stock standard solution of 10 mg L‐1 of target compounds was prepared in methanol. Working solutions were prepared by dilution of standard stock solution. All solutions were stored in the dark at 4°C. The recovery studies were carried out using river water from Ebro (Zaragoza, Spain), surface water of reservoir (Murcia, Spain), tap water (Alicante, Spain) and effluent wastewater (Torrevieja, Spain) from a municipal wastewater treatment plant (WWTP). Samples were stored in the dark at 4°C and were analysed without a previous filtration, except effluent wastewater that was filtered with common lab filter paper. Initial analysis confirmed that they were free of all target analytes. 2.2. DLLME and GC analysis For DLLME, 10 mL of the sample solution was placed in a 15 mL glass test tube with conic bottom and spiked with each pesticide at concentrations of 10 µg L‐1. In order to avoid volatilisation losses, all aqueous samples were freshly prepared before each extraction experiment. 1010 µL of organic solvents mixture, containing 10 µL of tetrachloroethylene, as extraction solvent, and 1000 µL of acetone, as disperser solvent, were dropped into the sample solution, and then the mixture was gently shaken for 30 seconds. A cloudy solution was formed in the test 138 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA tube and the cloudy state was stable for a long time. The mixture was then centrifuged for 3 min at 2300 rpm in a refrigerated GS‐6R Beckman centrifuge (Fullerton, CA, USA), causing the dispersed fine droplets of the extractant phase to settle down to the bottom of the conical test tube. Finally, 2 µL of extractant phase were collected using a 10 μL Hamilton syringe (Bonaduz, Switzerland) with a bevel needle tip (length: 5.0 cm, i.d.: 0.047 cm, bevel 26º) and injected into the GC‐MS system for analysis. All analyses were carried out on a Varian 3800‐Saturn 2000 Gas Chromatography‐Mass Spectrometer system (Walnut Creek, CA, USA) equipped with a VF‐5‐Ms Factor‐four Varian column (30 m × 0.25 mm, 0.25 μm). The mass spectrometer employed was an ion trap (20 µA) with 0.82 s of scan time. The conditions employed and the base peaks ion (m/z) of the selected analytes were described in our previous work [12]. A typical GC‐MS chromatogram is shown in Fig. 1 on Ref. [12]. 3. Results and Discussion 3.1. Optimization of extraction conditions In order to optimize the different variables, de‐ionized water samples were spiked with each pesticide. The first step in the optimization procedure was to select an appropriate extraction solvent. The solvents were selected on the basis of higher density rather than water, extraction capability of target compounds and good gas chromatography behaviour. Tetrachloroethylene and carbon tetrachloride were tested as potential acceptor phases. Solvent selectivity was evaluated with 1.7 mL of acetone which contained 10 µL of extraction solvent, 5 mL of de‐ionized water sample spiked at 100 µg L‐1 with all target analytes. Tetrachloroethylene and carbon tetrachloride gave enrichment factors ranging from 46 to 316 and from 14 to 75, respectively. Therefore, tetrachloroethylene was chosen as extraction solvent. 139 In order to study the effect of extraction solvent volume 1.7 mL of acetone containing four different volumes of tetrachloroethylene, 5, 10, 15 and 20 µL, were dropped into 5 mL de‐ionized water spiked at 10 µg L‐1. Most of the analytes presented the highest response for 10 µL of tetrachloroethylene, and it was the optimum volume chosen. In a separate set of experiments, the effect of temperature was investigated. Different values of temperature were studied, namely 20, 30, 40 and 50 ºC. The responses obtained for the target analytes were similar at the different temperatures studied. There is a slight decrease at 50ºC. This may be because when the temperature rises pesticides are more soluble in water and its extraction is more difficult. For this reason, room temperature (20ºC) was chosen as optimum. The main point of selection of disperser solvent is its miscibility in organic phase (extraction solvent) and aqueous phase. Acetone, acetonitrile and methanol have this property and could have been selected for this purpose. However, based on literature, it has been studied that the type of disperser does not affect the response [13,14,19,20]. For this reason, acetone was selected as disperser solvent because of its low toxicity. The volumes selected to study the effect of disperser solvent were 500, 1000, 1500 and 1700 µL, which contained 10 µL of tetrachloroethylene. The organic mixture was dropped into 5 mL of de‐ionized water sample spiked at 10 µg L‐1 with all target analytes. The best response was obtained for a disperser volume of 1000 µL. Finally, four sample volumes (5, 8, 10 and 12 mL) were extracted maintaining the other variables fixed at the optimum studied. The organic mixture was dropped into de‐ionized water sample spiked at 10 µg L‐1 with all target analytes. According to the results, it is clear that by increasing the sample volume there is also an improvement in the signal due to the higher analyte amount available in the sample. 140 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA However, 10 mL sample volume was selected as a compromise between sensitivity and sample consumption. Therefore, the optimized extraction conditions found in the present studies were: tetrachloroethylene volume, 10 µL; acetone volume, 1mL; sample volume, 10 mL and extraction temperature, 20 ºC. 3.2. Analytical characteristics and analysis of real samples The optimum DLLME experimental conditions were used to assess the applicability of the proposed method for quantitative determination of target analytes by GC‐MS. A calibration study was performed by spiking de‐ionized water with analytes over the concentration range of 0.5‐16 μg L‐1 (N=5). The calculated calibration curves gave a high level of linearity for all target analytes with correlation coefficients (r) ranging between 0.9967 and 0.9999 (Table 1). The repeatability of the proposed method, expressed as relative standard deviation (RSD), was evaluated by extracting eight consecutive aqueous samples (spiked at 10 μg L‐1 with each target analyte) and was found to vary between 5 and 15% (Table 1). The limits of detection (LODs) for all target analytes were determined according to the signal‐to‐noise‐ratio (S/N) of three. As shown in Table 1, limits of detection values obtained in this work are much lower than the LOD values obtained with the EPA methods 525.2 and 625 [29,30]. Furthermore, in comparison with previously reported works on the same topic, analyzing clean [11,28,31] and wastewater waters [12], we obtained equal or superior LOD values for all OCPs. 141 Table 1. Main method parameters for the estraction of organochlorine pesticides from water samples using the optimized DLLME method Analyte Slope ± SD Intercept (x1000) ±SD (x1000) Correlation coefficient (r)a RSD (%)b LOD LOD LOD EPA DLLME SDME 525.2 (ng L‐1)e (ng L‐1)c (ng L‐1)d LOD EPA 625 (ng L‐1)g Alpha‐HCH 170 ± 1 30 ± 10 0.9999 7 3 87 110 NA Beta‐HCH 130 ± 3 20 ± 30 0.9994 5 5 93 85 4200 Gamma‐HCH 164 ± 2 30 ± 10 0.9998 5 8 45 84 NA Delta‐HCH 141 ± 4 50 ± 30 0.9992 5 6 66 49 3100 Heptachlor 93 ± 4 20 ± 30 0.9982 8 7 49 61 1900 Aldrin 510 ± 1 5 ± 1 0.9995 7 9 53 45 1900 Heptachlor epoxide 51 ± 2 20 ± 20 0.9983 7 2 54 130 2200 Alfa‐ Endosulfan 14 ± 1 7 ± 3 0.9991 6 5 64 110 NA p,p’‐DDE 272 ± 8 5 ± 7 0.9992 7 2 25 70 5600 Dieldrin 151 ± 7 70 ± 50 0.9983 9 4 22 150 2500 Endrin 56 ± 2 20 ± 20 0.9985 8 4 68 340 NA Beta‐ Endosulfan 19 ± 1 14 ± 8 0.9977 15 25 71 74 NA p,p’‐DDD 500 ± 30 200 ± 200 0.9967 8 4 22 55 2800 Endrin aldehyde 48 ± 2 20 ± 10 0.9984 10 1 69 150 NA Endosulfan sulfate 85 ± 2 50 ± 20 0.9992 8 3 87 93 5600 350 ± 20 1 ± 1 0.9982 11 4 101 39 4700 Endrin ketone 154 ± 6 60 ± 50 0.9988 10 4 60 NAf NA Methoxychlor 960 ± 40 30 ± 30 0.9985 10 1 50 130 NA p,p’‐DDT a Linear range: 0.5‐16 µg L‐1 (number of calibration points = 5). b Relative standard deviation (RSD); mean value for eigth replicate analyses; spiking level 10 µg L‐1. c Limits of detection (LODs) were calculated foor a three signal to noise ratio (S/N = 3). d Data taken from Ref. [12] (SDME‐GC‐MS). e Data values taken from reference [29]; EPA 525.2 (SPE cartridge‐GC‐ion trap MS). f Not available. g Data taken from reference [29]; EPA 625 (GC‐MS). 142 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA During the present investigations, matrix effects upon extraction were also evaluated by investigating the applicability of the proposed method to determine OCPs in water samples. Different real water samples from river, surface, tap water and urban wastewater spiked at 10 μg L‐1 with each target analyte were extracted using the DLLME method developed here, and the extracts were analyzed by GC‐MS. Filtration with common lab filter paper before the extraction was needed in the case of previously spiked urban wastewater in order to eliminate the particulate material. Relative recoveries were determined as the ratio of the concentrations found in real and de‐ionised water samples, both spiked at the same contamination level. The results for each set of experiments are summarized in Table 2. Table 2. Relative recoveries of eighteen organochlorine pesticides in water samples Relative recoveries (%) and RSD values (%) in parenthesesa Analyte River water Surface water Tap water Urban WWTP‐1b 113 (3) 101(7) 106 (5) 77 (3) 112 (3) 96 (2) 98 (5) 94 (4) Gamma‐HCH 111 (7) 97 (6) 106 (7) 81 (1) Delta‐HCH 109 (2) 86 (9) 99 (6) 81 (8) Heptachlor 98 (8) 85 (6) 88 (3) 63 (3) Aldrin 93 (4) 81 (9) 97 (8) 56 (7) Heptachlor epoxide 89 (5) 79 (10) 99 (8) 65 (5) Alpha‐Endosulfan 95 (8) 83 (6) 93 (6) 73 (12) p,p’‐DDE 88 (8) 81 (5) 99 (8) 66 (7) Dieldrin 97 (9) 82 (4) 100 (8) 70 (2) Endrin 92 (9) 81 (9) 102 (3) 63 (12) Beta‐Endosulfan 93 (9) 85 (3) 103 (6) 120 (5) Alpha‐HCH Beta‐HCH 143 p,p’‐DDD 90 (10) 84 (6) 96 (7) 70 (5) Endrin aldehyde 97 (5) 86 (3) 104 (5) 97 (4) Endosulfan sulfate 100 (10) 82 (4) 97 (7) 93 (3) p,p’‐DDT 93 (8) 75 (7) 87 (11) 85 (8) Endrin ketone 95 (8) 82 (5) 97 (7) 107 (9) Methoxychlor 88 (10) 75 (4) 96 (10) 113 (12) a Three replicate analyses at a 10 µgL‐1 spiking level. b Wastewater sample studied on Ref. [12] (SDME‐CG‐MS) As shown in the table and considering 70% and 120% as the acceptable lower and upper limit respectively [12], the eighteen organochlorine pesticides did not exert significant matrix effects for river, surface and tap water. On the other hand, urban wastewater sample shown a little matrix effect for five out of the eighteen OPCs, mainly Heptachlor, Aldrin, Heptachlor epoxide, p,p’‐DDE and Endrin. The decrease in relative recoveries observed could be attributed to different phenomena [12,32]: (i) the possible competitive adsorption of target analytes by suspended particulate matter; (ii) adsorption by the containers and; (iii) losses during sample prefiltration. However, comparing these matrix effects to our previous work [12] based on SDME, a fewer number of analytes present matrix effects and, on the whole, recoveries have been improved, being the lowest value 56% for DLLME and 34% for SDME. 4. Conclusions A sensitive analytical method comprising DLLME coupled with GC‐MS has been developed to quantify ultratrace levels of eighteen organochlorine pesticides, some of which have not been considered previously, in clean and dirty water samples. The optimized DLLME method minimizes sample preparation time, as well as, consumption of toxic organic solvents, without reducing method sensitivity and 144 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA reaching the equilibrium in a few seconds. This easy‐to‐handle and cost‐effective method represents an attractive alternative to both traditional and more recently proposed sample preparation methods, as it affords better extraction conditions for a wider range of analytes and samples matrices. Acknowledgements The authors would like to thank the Spanish Government (projects n. CTQ2005‐09079‐C03‐01/BQU and CTQ2008‐06730‐C02‐01), the Generalitat Valenciana (project n. ACOMP07/053) and LABAQUA S.A (Alicante, Spain) for the financial support. This work is part of the Doctoral Thesis of Carol Cortada. 145 REFERENCIAS REFERENCES [1] W.J. Hayes, in: W. Hayes, E.R. Lawes (Eds.), Handbook of Pesticides Toxicology, Academic Press, San Diego 1991, pp. 215‐244. [2] S.M. Snedeker, Environ. Health Perspect. 109 (2001) 35‐40. [3] H.Z. Xu, N. Jia, R. Ren, Environ. Sci. Manage. 30 (2005) 83‐85. [4] O.S. Fatoki, R.O. Awofolu, J. Chromatogr. A 983 (2003) 225‐236. [5] M. Barriada‐Pereira, M.J. González‐Castro, S. Muniategui‐Lorenzo, P. López‐ Mahía, D. Prada‐Rodríguez, E. Fernández‐Fernández, J. Chromatogr. A 1061 (2004) 133‐139. [6] B.D. Page, G. Lacroix, J. Chromatogr. A 757 (1997) 173‐182. [7] E. Psillakis, N. Kalogerakis, Trends Anal. Chem. 22 (2003) 565‐574. [8] L. Xu, C. Basheer, H. Lee, J. Chromatogr. A 1152 (2007) 184‐192. [9] C. Basheer, H.K. Lee, J.P. Obbard, J. Chromatogr. A 968 (2002) 191‐199. [10] C.H. Yan, H.F. Wu, Rapid Commun. Mass Spectrom. 18 (2004) 3015‐3018. [11] L.S. de Jager, A.R.J. Andrews, Analyst 125 (2000) 1943‐1948. [12] C. Cortada, L. Vidal, S. Tejada, A. Romo, A. Canals, Anal. Chim. Acta 638 (2009) 29‐35. [13] M. Rezaee, Y. Assadi, M.R. Milani, E. Aghaee, F. Ahmadi, S. Berijani, J. Chromatogr. A 1116 (2006) 1‐9. [14] S. Berijani, Y. Assadi, M. Anbia, M.‐R. Milani, E. Aghaee, J. Chromatogr. A 1123 (2006) 1‐9. [15] E. Zhao, W. Zhao, L. Han, S. Jiang, Z. Zhou, J. Chromatogr. A 1175 (2007) 137‐ 140. [16] R.R. Kozani, Y. Assadi, F. Shemirani, M.R. Milani, M.R. Jamali, Talanta 72 (2007) 387‐393. [17] N. Fattahi, Y. Assadi, M.R. Milani, E.Z. Jahromi, J. Chromatogr. A 1157 (2007) 23‐29. 146 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA [18] R.R. Kozani, Y. Assadi, F. Shemirani, M.R. Milani, M.R. Jamali, Chromatographia 66 (2007) 81‐89. [19] L. Fariña, E. Boido, F. Carrau, E. Dellacassa, J. Chromatogr. A 1157 (2007) 46‐ 50. [20] D. Nagaraju, S‐D. Huang, J. Chromatogr. A 1161 (2007) 89‐87. [21] H. Farahani, P. Norouzi, R. Dinarvand, M.R. Ganjali, J. Chromatogr. A 1172 (2007) 105‐112. [22] M. García‐López, I. Rodríguez, R. Cela. J. Chromatogr. A 1166 (2007) 9‐15. [23] A.S. Yazdi, N. Razavi, S.R. Yazdinejad, Talanta 75 (2008) 1293‐1299. [24] F. Rezaei, A. Bidari, A.P. Birjandi, M.R. Milani, Y. Assadi, J. Hazard. Mater. 158 (2008) 621‐627. [25] J. Xiong, B. Hu, J. Chromatogr. A 1193 (2008) 7‐18. [26] R‐S. Zhao, C‐P. Diao, X. Wang, T. Jiang, J‐P. Yuan, Anal. Bioanal. Chem. 391 (2008) 2915‐2921. [27] X. Zang, J. Wang, O. Wang, M. Wang, J. Ma, G. Xi, Z. Wang, Anal. Bioanal. Chem. 392 (2008) 749‐754. [28] W.‐C Tsai, S.‐D. Huang, J. Chromatogr. A 1216 (2009) 5171‐5175. [29] Method 525.2. “Determination of organic compounds in drinking water by liquid‐solid extraction and capillary column gas chromatography/mass spectrometry”. U.S. Environmental Protection Agency (U.S.EPA). [30] Method 625. “Organic chemical analysis of municipal and industrial wastewater”. U.S. Environmental Protection Agency (U.S.EPA). [31] L. Zhao, H.K. Lee, J. Chromatogr. A 919 (2001) 381‐388. [32] E. Concha‐Graña, M.I. Turnes‐Carou, S. Muniategui‐Lorenzo, P. Lopez‐ Mahia, E. Fernandez‐Ferandez, D. Prada‐Rodriguez, Chromaotographia 54 (2001) 501‐506. 147 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS 3.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS En el presente trabajo se utilizó la microextracción líquido‐líquido dispersiva sustituyendo el disolvente dispersante por la energía ultrasónica para producir el punto de niebla entre el disolvente extractante y la muestra. Los analitos estudiados en el presente trabajo fueron la geosmina y el 2‐metilisoborneol. Estos compuestos confieren al agua un olor a tierra mojada a concentraciones de ng L‐1. También están presentes en el vino cuando las uvas son atacadas por ciertos hongos filamentosos produciéndose, en ambos casos, el rechazo del consumidor por lo que es necesaria su determinación a niveles de ultratraza. En este trabajo la energía ultrasónica se generó utilizando un baño ultrasónico y eliminando totalmente el disolvente dispersante. En otros trabajos publicados con anterioridad a éste se utilizaba la energía ultrasónica acompañada de un volumen muy pequeño de disolvente dispersante. La ventaja de la eliminación del disolvente dispersante es que el coeficiente de reparto entre los analitos y el disolvente extractante aumenta ya que no existe competencia entre los dos disolventes. Las muestras reales analizadas fueron aguas prepotables y tres tipos diferentes de vinos (tinto, rosado y blanco). La separación se llevó a cabo utilizando cromatografía de gases y posterior detección por espectrometría de masas. Se utilizó el diseño de experimentos para la optimización del método y se calculó la incertidumbre expandida de los resultados para mejorar la fiabilidad de la medición, poder comparar los estudios entre diferentes laboratorios y ayudar a evaluar la significación estadística de la diferencia entre la medida y un valor de referencia. 149 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS ABSTRACT A fast, simple and environmentally friendly ultrasound‐assisted dispersive liquid‐liquid microextraction (USADLLME) procedure has been developed to preconcentrate geosmin and 2‐methylisoborneol (MIB) from water and wine samples prior to quantification by gas chromatography‐mass spectrometry (GC‐MS). A two‐stage multivariate optimization approach was developed by means of a Plackett‐Burman design for screening and selecting the significant variables involved in the USADLLME procedure, which was later optimized by means of a circumscribed central composite design. The optimum conditions were: solvent volume, 8 µL; solvent type: tetrachloroethylene; sample volume, 12 mL; centrifugation speed, 2300 rpm; extraction temperature 20 ºC; extraction time, 3 min; and centrifugation time, 3 min. Under the optimized experimental conditions the method gave good levels of repeatability with coefficient of variation under 11% (n=10). Limits of detection were 2 and 9 ng L‐1 for geosmin and MIB, respectively. Calculated calibration curves gave high levels of linearity with correlation coefficient values of 0.9988 and 0.9994 for geosmin and MIB, respectively. Finally, the proposed method was applied to the analysis of two water (reservoir and tap) 151 samples and three wine (red, rose and white) samples. The samples were previously analyzed and confirmed free of target analytes. Recovery values ranged between 70 and 113% at two spiking levels (0.25 µg L‐1 and 30 ng L‐1) showing that the matrix had a negligible effect upon extraction. Only red wine showed a noticeable matrix effect (70‐72% recovery). Similar conclusions have been obtained from an uncertainty budget evaluation study. Keywords: Geosmin; 2‐methylisoborneol (MIB); ultrasound‐assisted dispersive liquid‐liquid microextraction (USADLLME); experimental design; expanded uncertainty; wine; water. 152 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS 1. Introduction The flowering of green‐blue algae occurs in surface waters by eutrophication processes. Metabolites are produced in the degradation of these algae which are responsible for musty and earthy odours in tap water [1]. It has also been found that certain bacteria of the Actinomyces kind produces this typical smell [2]. These metabolites are geosmin and 2‐methylisoborneol (MIB), among others, and their odours are perceptible at low levels, between 4 and 10 ng L‐1 for geosmin, and between 9 and 42 ng L‐1 for MIB [3]. In addition, geosmin and MIB are also responsible for some unwanted aromas in wine. When grapes have been attacked by one of the filamentous fungi producing geosmin or MIB, wine can also submit earthy aromas characteristic of these molecules, and their odours are perceptible from 50‐55 ng L‐1 levels [4]. Although, these compounds present an unknown health hazard, their concentration beyond the threshold levels produce the rejection of the consumer. A rapid, selective, and sensitive analytical method for monitoring residues of these odorant compounds is therefore required. However, a preconcentration step is usually necessary in order to meet these demands. Among the extraction/enrichment techniques, closed loop‐stripping analysis (CLSA) and some of its modified versions have been the most frequently used method for geosmin and MIB analysis [5,6]. Also, liquid‐liquid extraction (LLE) [7‐9], solid phase extraction (SPE) [7], solid phase microextraction (SPME) [4,10‐13], purge and trap (PT) [3], stir bar sorptive extraction (SBSE) [14], and recently headspace single drop microextraction (SDME) [15] have been developed. All of the above mentioned techniques present some drawbacks. CLSA, PT, SPME and SBSE use expensive materials, are time‐consuming and usually have carryover effects. Furthermore, SPME and SBSE have long‐time sorbent conditioning. On the other hand, LLE and SPE use large amounts of potentially toxic 153 and normally expensive organic solvents, are time‐consuming and the high manipulation of the sample can lead to undesirable contaminations. In the case of SDME fast stirring speed and air bubbles cause a drop instability and tend to break up the organic drop, and equilibrium could not be attained after a long time in most cases. For these reasons, other new extraction techniques need to be developed. Dispersive liquid‐liquid microextraction (DLLME) is a recent extraction technique [16], which eliminates all the problems described above, whereby a small droplet of extractant is disrupted on many microdroplets by the action of a disperser solvent. The increase of surface favours the exchange of analyte between phases, and hence speed up the extraction process. However, a large disperser volume is used, which decreases the partition coefficient of analytes in the extractant solvent. Recently, ultrasound energy has been used to assist the dispersion [17‐25]. The use of ultrasound energy to disrupt the extractant phase reduces the consumption of organic solvent because the disperser solvent is not needed, being ultrasound‐assisted dispersive liquid‐liquid microextraction (USADLLME) a more environmentally friendly technique. However, this fact led most of the published works to use a higher volume of extractant phase (40‐100 µL) than with DLLME or SDME (5‐10 µL). The aim of this paper is to develop a fast, inexpensive and environmentally friendly sample preparation method based on ultrasound energy to assist the dispersion of a few microlitres of extractant solvent used for the preconcentration of geosmin and MIB in water and wine samples before the quantification by GC‐MS. The optimization of the extraction conditions has been done using experimental design and uncertainty budget has been used for establishing confidence as a more realistic approach to the regulatory environment [26]. Good figures of merit have been obtained and the analytical method has been validated and applied to water and wine samples. 154 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS 2. Experimental 2.1. Chemicals and samples Geosmin and MIB were obtained from Dr. Ehrenstorfer (Agsburg, Germany). Tetrachloroethylene, bromoform and methanol were pesticide‐grade and were obtained from Sigma‐Aldrich (St. Louis, MO, USA). De‐ionized water was prepared on a water purification system (Gradient A10) supplied by Millipore (Billerica, MA, USA). Stock standard solutions of 1 mg L‐1 and 10 µg L‐1 of target compounds were prepared in methanol. Working solutions were prepared by dilution of standard stock solution in water. In order to eliminate volatilisation losses, all aqueous working solutions were freshly prepared before each extraction. All solutions were stored in the dark at 4°C. The recovery studies were carried out using reservoir water (Seville, Spain), tap water (Murcia, Spain), red wine (Eroski, Spain), and rose and white wine (Casón Histórico, Ciudad Real, Spain). Samples were also stored in the dark at 4°C. Initial analysis confirmed that they were free of target analytes. 2.2. Ultrasound‐assisted dispersive liquid‐liquid microextraction (USADLLME) 12 mL of sample were placed in a 20 mL glass test tube with a conical bottom and 8 µL of tetrachloroethylene as extraction solvent was dropped into the sample solution. The mixture was sonicated in an ultrasonic bath (Ultrasons‐H, Selecta, Spain) for 3 min and subsequently centrifugated for 3 min at 2300 rpm in a centrifuge table (GS‐6R of Bekman, Fullerton, CA, USA). Finally, 2 µL of the extractant phase deposited at the bottom of the test tube was manually injected into the GC‐MS system for analysis. 2.3. GC‐MS determination All analyses were carried‐out on a Varian 3800‐Saturn 2000 Gas Chromatography/Mass Spectrometer system (Walnut Creek, CA, USA) equipped 155 with a Meta.X5 Tecknokroma column (30 m × 0.25 mm, 1.0 μm) (Barcelona, Spain). The mass spectrometer employed was an ion trap (20 µA) with 0.82 seconds of scan time. The injector was maintained at 250 °C and operated in the splitless mode with the split closed for 0.75 min. Helium (> 99.999 % pure) was used as the carrier gas at a flow rate of 1.0 mL min‐1. The column oven was initially set at 50 °C for 1 min, then programmed at 10 °C min‐1 to 180 °C where it was held for 2 min, followed by a 4°C min‐1 ramp to 200 °C and held for 4 min. The interface temperature was set at 200 °C and the detector voltage at 4 V. A 10 min solvent cut time was allowed for all analyses. The base peak ion and two other significant ions of each analyte were chosen as the quantifying ions. The base peaks ion (m/z) for the target analytes were 112 and 95 for geosmin and MIB, respectively. Prior to quantification, the identification of target compounds was based on their mass spectra and GC retention times. Fig. 1 shows a typical chromatogram of a standard solution spiked at 10 µg L‐1 of both target analytes after USADLLME. 156 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS RIC Merged 5ppb-rep.sms 2000 CENTROID RAW MCounts 3.5 3.0 2.5 2.0 1.5 1.0 0.5 2 1 2 0.0 10.0 12.5 15.0 17.5 20.0 22.5 minutes Fig. 1. Typical chromatogram of a standard solution (10 µg L‐1) subject to the USADLLME‐GC‐MS procedure. (1) MIB; (2) geosmin. 2.4. Data handling and processing Experimental design matrices were constructed and the results were evaluated using the Statgraphics Statistical Computer Package “Statgraphics Plus 5.1”. 3. Results and Discussion 3.1. Study of experimental factors involved in USADLLME 3.1.1. Solvent extraction study The selection of an appropriate extraction solvent is very critical for developing an efficient dispersive liquid‐liquid microextraction. Generally, extraction solvent used in USADLLME procedures must fulfill the following requirements: it should have a higher density than water, a low solubility in water, high extraction capability of the target analytes, and additionally it should be easily dispersed in water during sonication. Based on these facts, two solvents including bromoform 157 and tetrachloroethylene were tested as potential acceptor phases. The extraction solvent should also have good chromatographic behaviour during the course of chromatographic separation. Bromoform presented problems overlapping the peak of geosmin, and areas of MIB were less than those obtained with tetrachloroethylene. Hence, tetrachloroethylene was chosen for the next optimization procedure as the extractant phase. 3.1.2. Study of other experimental factors by multivariate optimization Different factors can affect the extraction yield in the USADLLME procedure and in most cases they are correlated. Therefore, their optimization through a multivariate approach is recommended. However, some of them might not have a significant effect and they can, thus, be obviated. In this respect, a screening study, prior to the optimization, is helpful in order to assess the significant factors involved in the analytical system under study. In this case, based on the literature and the previous experience of our group [27,28], the influence of six factors, namely sample volume, solvent volume, extraction temperature, extraction time, centrifugation speed and centrifugation time were studied in order to maximize the extraction yield in the USADLLME procedure. If a large number of factors are involved, reduced factorial designs are employed for screening. A particular type of those designs is the Plackett‐Burman design [29] which assumes that the interactions can be completely ignored and so the main effects are only calculated with a reduced number of experiments. A saturated Plackett‐Burman matrix was employed because of the large number of factors to be tested. A matrix with 11 factors (six real factors and five dummy factors) was used. The effects of dummy factors were used for the estimation of the experimental error used in the statistical interpretation [30, 31]. 158 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS For each factor two levels were considered (Table 1). The matrix of the Plackett‐Burman design was composed of 12 experiments. The experiments were randomly carried out in order to nullify the effect of extraneous or nuisance factors using standard solutions of 10 µg L‐1 and evaluating the GC peak area of both analytes on each experiment. Table 1. Experimental factors and levels studied on the Plackett‐Burman design. Factors Level Low (‐1) High (+1) Sample volume (mL) 5 10 Solvent volume (µL) 20 50 Extraction temperature (ºC) 20 50 Extraction time (min) 1 3 Centrifugation speed (rpm) 1500 2300 Centrifugation time (min) 3 6 An ANOVA test was used to evaluate the data and statistically significant effects were determined using a t‐test with a 95% probability [30, 31] and visualized by using main effects Pareto charts (Fig. 2). Geosmin Solvent volume Sample volume Dummy 5 Centrifugation speed Extraction temperature Extraction time Dummy 4 Centrifugation time Dummy 3 Dummy 2 Dummy 1 + - 0 1 2 3 Standarized effect 4 (X 10000) 159 2-Methylisoborneol Solvent volume Sample volume Dummy 5 Extraction temperature Dummy 2 Centrifugation speed Dummy 4 Centrifugation time Dummy 1 Extraction time Dummy 3 + - 0 3 6 9 Standarized effect 12 15 (X 1000) Fig. 2. Pareto charts of the main effects obtained from the Plackett‐Burman design. According to the results, sample and solvent volume were the most significant factors for both target analytes showing a positive and negative effect, respectively. Pareto charts also reveals that centrifugation speed appeared as a non‐ significant effect showing a negative sign for both analytes. Despite this value, in this study 2300 rpm was used because sometimes the sedimentation with 1500 rpm was poor. Extraction temperature appeared to have a positive non‐significant effect upon extraction. This result is according to an increased temperature enhancing the diffusion transference. Despite this value, room temperature was chosen because it is easier to control and handle with the ultrasonic bath used. Extraction time appeared to have a negative non‐significant effect for geosmin and a positive non‐ significant effect for MIB, therefore, 3 min were chosen as a compromise value for both analytes. Finally, centrifugation time appeared to have a non‐significant negative effect for both analytes and 3 min were chosen. 160 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS Overall, the results of this first screening study revealed that four factors could be established, centrifugation speed at 2300 rpm, extraction temperature at 20ºC, extraction time at 3 min and centrifugation time at 3 min for the following optimization. The second study was concerned with optimizing the significant factors in order to obtain the best response. Different experimental designs can be found in the literature, many of them are based on the so‐called response surface designs. Box‐Wilson or central composite design (CCD) is one of the most used response surface designs, which is constructed by several superimposed designs. It consists of a factorial design (2k) augmented with (2k) star points, where k is the number of factors to be optimized, and with a central point, which can be run n times [29]. A circumscribed central composite design (CCCD) was employed, where the star points were located at ±α from the centre of the experimental domain, which was situated at 0. In order to establish the rotatability of the experimental design, n was set at 2 and α = 4√2k [29]. Therefore, the overall matrix of CCCD design involved 16 experiments. In this study, the two factors considered were: sample volume and solvent volume. The low (‐1), central (0), and high (+1) levels of these factors, as well as the location of their star points (± 1.414), are given in Table 2. Table 2. Experimental factors and levels studied on the circumscribed central composite design (CCCD). Factors Level Star points (α =1.414) Low (‐1) Central (0) High (+1) ‐α +α Sample volume (mL) 5.0 8.0 11.0 3.8 12 Solvent volume (µL) 15 20 25 8 32 161 The data obtained were evaluated by ANOVA test, and the effects were visualized by using Pareto charts (Fig. 3). As can be seen, sample volume is significant showing a positive effect, whilst solvent volume shows a non‐significant negative effect upon extraction. Indeed, increasing the sample volume results in an increase in the total amount of analyte extracted, reaching a maximum at 12 mL (+1.414). Solvent volume shows a negative effect, reaching a maximum at 8 µL (‐ 1.414). This negative effect could be attributed to a dilution effect. Geosmin + - A:Sample volume B:Solvent volume AA AB BB 0 0.5 1 1.5 2 2.5 Standardized effect 2-Methylisoborneol + - A:Sample volume B:Solvent volume AA BB AB 0 0.5 1 1.5 2 2.5 Standardized effect 3 Fig.3. Pareto charts of the main effects obtained from the circumscribed central composite design. 162 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS Overall, summarizing the results of screening and optimization studies yield the following optimum experimental conditions: sample volume, 12 mL; solvent volume, 8 µL; extraction temperature, 20ºC; extraction time, 3 min; centrifugation speed, 2300 rpm; and centrifugation time, 3 min. 3.2. Analytical figures of merit A calibration study was performed by spiking pure aqueous samples with analytes over the concentration range of 0.01‐1 μg L‐1 and 0.05‐1 μg L‐1 for geosmin and MIB, respectively. The calculated calibration curves gave a high level of linearity for both target analytes with correlation coefficients (r) 0.9988 and 0.9994 for geosmin and MIB, respectively, as shown in Table 3. The repeatability of the proposed method, expressed as coefficient of variation (CV), evaluated by extracting and analyzing ten consecutive aqueous samples spiked at 1 μg L‐1 with each target analyte, was found to be lower than 11%. The limits of detection (LODs) for both target analytes were determined according to a signal‐to‐noise‐ratio (S/N) of three and the limits of quantification (LOQs) as ten times the above mentioned ratio. As can be seen in Table 3 the LODs and LOQs values were found to be 2 and 7 ng L‐1 for geosmin and 9 and 30 ng L‐1 for MIB, respectively. Comparison of the USADLLME method developed in this work with other methods of analysis is shown in Table 4. As a compromise between LOD values, extraction time and sample volume USADLLME‐GC‐MS seems the best option for the analysis of geosmin and MIB. SBSE and PT show lower detection limits but these sample preparation methodologies are more expensive, time consuming and show carry‐over problems. In addition, the odour threshold is higher than the LOD values obtained by USADLLME‐GC‐MS. 163 Table 3. Main method parameters for the determination of geosmin and MIB in water samples using the optimized USADLLME‐GC‐MS Analyte Correlation CV (%)b coefficient (r)a LOD (ng L‐1)c LOQ (ng L‐1)d Geosmin 0.9988 10.4 2 7 MIB 0.9994 10.1 9 30 a Working range: Geosmin: 0.01‐1 µg L‐1 (number of standards = 5; number of repetitions = 3 for each level); MIB: 0.05‐1 µg L‐1 (number of standards = 4, number of repetitions = 3 for each level). b Coefficients of variation (CVs); were calculated for ten replicate analyses at 1 µg L‐1 spiking level. c Limits of detection (LODs) were calculated for a three signal to noise ratio (S/N = 3). d Limits of quantification (LOQs) were calculated for a ten signal to noise ratio (S/N = 10). 164 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS Table 4. Comparison of different methods of analysis for the determination of geosmin and MIB Preconcen‐ tration methoda Linear range (ng L‐1) LOD (ng L‐1) Geosmin Geosmin MIB CV (%) MIB Geosmin MIB Solvent extraction (volume) Extraction time (min) Sample volume (mL) Ref. PT 10‐200 10‐200 2 1 7.9 6.4 ‐ 30 25 [3] LLE 1‐500 1‐500 0.1 0.1 6.3 6.9 Pentane (1 mL) 30 250 [9] SPME 10‐30,000 10‐30,000 10 10 7.8 11.9 ‐ 15 6 [10] SBSE 0.5‐100 0.5‐100 0.15 0.33 3.7 9.2 ‐ 20 5 [14] SDME 5‐900 ‐ 0.8‐3.3 ‐ <5 ‐ 1‐Octanol (2 µL) 15 5 [15] 10‐1000 50‐1000 2 9 10.4 10.1 Tetrachloroethylene (8 µL) 3 12 This work USADLLME In all cases GC‐MS has been used for separation and quantification. a 165 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS 3.3. Samples analysis Water (reservoir and tap) and wine (red, rose and white) samples were extracted using the ultrasound‐assisted dispersive liquid‐liquid microextraction developed method and the extracts were analyzed by GC‐MS. Four replicate of water and wine samples were spiked at 0.25 and 0.03 µg L‐1 with both target analytes and were extracted under the optimized experimental conditions. The preliminary analysis showed that samples were free of geosmin and MIB. The results for each set of experiments are summarized in Tables 5 and 6. Recovery values range between 72 and 113% at 0.25 µg L‐1, and between 70 and 87% at 0.03 µg L‐1, being the lowest for red wine (70‐72%). Table 5. Recovery study of geosmin and MIB in different water and wine samples using the proposed USADLLME‐GC‐MS method at 0.25 µg L‐1 spiking level. Found concentration ± U (k=2)a µg L‐1 (recovery ± CV, %)b Analyte Red wine Rose wine White wine Reservoir water Tap water Geosmin 0.18±0.03 (72±7) 0.28 ±0.05 (112±7) 0.24±0.06 (96±11) 0.20±0.04 (80±7) 0.22±0.06 (88±11) MIB 0.18±0.04 (72±7) 0.23±0.05 (92±9) 0.19±0.06 (76±14) 0.23±0.03 (92±2) 0.28±0.05 (113±8) a U = expanded uncertainty with a coverage factor k = 2, corresponding to a level of confidence of 95%. b Four replicates analyses. 167 Table 6. Recovery study of geosmin and MIB in different water and wine samples using the proposed USADLLME‐GC‐MS method at 30 ng L‐1 spiking level. Found concentration ± U (k=2)a ng L‐1 (recovery ± CV, %)b Analyte Red wine Rose wine White wine Reservoir water Tap water Geosmin 21±9 (71±18) 22 ±8 (73±14) 26±9 (87±16) 22±9 (73±18) 23±8 (78±16) MIB 21±19 (70±12) 22±19 (73±11) 25±20(85±15) 28±21 (85±20) 25±20 (73±18) a U = expanded uncertainty with a coverage factor k = 2, corresponding to a level of confidence of 95%. b Four replicates analyses. Expanded uncertainty values were also calculated based on Ref. [32]. Uncertainty of measurement is a component of uncertainty in all individual steps of an analytical procedure. Hence it is necessary to determinate the sources and types of uncertainty for all these steps. Estimation of uncertainty leads to better measurement reliability, renders data from inter‐laboratory studies comparable, and helps to assess the statistical significance of the difference between the measurement and a relevant reference value [26,32]. Expanded uncertainty is also included in Tables 5 and 6 (see supplementary content). From the expanded uncertainty values obtained, at 0.25 µg L‐1 spiking level, a systematic error is concluded for geosmin and MIB on a red wine sample, and for geosmin on a reservoir water sample since reference (spiked) value is not included into the found concentration ± expanded uncertainty intervals. For samples spiked at 0.03 µg L‐1, no systematic error is concluded for geosmin. Nevertheless, conclusions for MIB 168 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS cannot be obtained from the expanded uncertainty values obtained since the spiking level is the LOQ value for this analyte. 5. Conclusions A new sample preparation methodology has been developed, based on the use of ultrasound energy to assist the dispersion of organic extractant on a liquid‐ liquid microextraction, to preconcentrate geosmin and MIB from water and wine samples before the quantification by GC‐MS. Microextraction methodology proposed is environmentally friendly, faster, cheaper and easier to handle than those previously studied for the same purpose. LOD values obtained satisfy the consumer requirements for these analytes on water and wine samples. Therefore, the suggested analytical method (USADLLME‐GC‐MS) can be an excellent alternative for laboratories which perform routine analysis of these compounds in these kinds of samples. Acknowledgements The authors would like to thank the Spanish Government (project n. CTQ2008‐06730‐C02‐01), the Regional Government of Valencia (Spain) (projects n. ACOMP/2009/144 and A‐04/09) and LABAQUA S.A (Alicante, Spain) for the financial support. This work is part of the Doctoral Thesis of Carol Cortada. The authors would like to thank Prof. Konieczka and Prof. Mamiesnik for their valuable help during uncertainty budget evaluation. Appendix A. Suplementary data Suplementary data associated with this article can be found, in the online version, at doi:10.1016/j.chroma.2010.11.007. 169 REFERENCES [1] G. Izaguirre, R.L. Wolfe, E.G. Means, Appl. Environ. Microbiol. 54 (1988) 2424. [2] N.N. Gebber, H.A. Lechevalier, Appl. Microbiol. 13 (1965) 935. [3] A. Salemi, S. Lacorte, H. Bagheri, D. Barceló. J. Chromatogr. A 1136 (2006) 170. [4] S. Boutou, P. Chatonnet, J. Chromatogr. A 1141 (2007) 1. [5] A.J. Hassett, E.R. Rohwer, J. Chromatogr. A 849 (1999) 521. [6] A.K. Zander, P. Pingert, Water Res. 31 (1997) 301. [7] M. Xiaoyan, G. Niyun, C. Beibei, L. Qingsong, Z. Qiaoli, G. Guofen, Front. Environ. Sci. Engin. China 1 (2007) 286. [8] N.F. Wood, V.L. Snoeyink, J. Chromatogr. A 132 (1977) 405. [9] H.‐S. Shin, H.‐S. Ahn, Chromatographia 59 (2004) 1073. [10] S.W. Lloyd, J.M. Lea, P.V. Zimba, C.C. Grimm, Water Res. 32 (1998) 2140. [11] S.B. Watson, B. Brownlee, T. Satchwill, E.E. Hargesheimer, Water Res. 34 (2000) 2818. [12] Y.‐H. Sung, T.‐Y. Li, S.‐D. Huang, Talanta 65 (2005) 518. [13] S. Nakamura, S. Daishima, Anal. Chim. Acta 548 (2005) 79. [14] S. Nakamura, N. Nakamura, S. Ito, J. Sep. Sci. 24 (2001) 674. [15] H. Bagheri, A. Salemi, J. Sep. Sci. 29 (2006) 57. [16] M. Rezaee, Y. Assadi, M.‐R. Milani, E. Aghaee, F. Ahmadi, S. Berijani, J. Chromatogr. A 1116 (2006) 1. [17] M.D. Luque de Castro, F. Priego‐Capote, Talanta 72 (2007) 321. [18] J. Regueiro, M. Llompart, C. Garcia‐Jares, J.C. Garcia‐Monteagudo, R. Cela, J. Chromatogr. A 1190 (2008) 27. [19] A.R. Fontana, R.G. Wuilloud, L.D. Martinez, J.C. Altamirano, J. Chromatogr. A 1216 (2009) 147. [20] S. Ozcan, A. Tor, M.E. Aydin, Anal. Chim. Acta 647 (2009) 182. [21] J. Wu, B. Xiang, J. Xia, Microchim. Acta 166 (2009) 157. 170 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA ASISTIDA POR ULTRASONIDOS [22] J. Regueiro, M. Llompart, E. Psillakis, J.C. Garcia‐Monteagudo, C. Garcia‐Jares, Talanta 79 (2009) 1387. [23] S. Ozcan, A. Tor, M.E. Aydin, Water Res. 43 (2009) 4269. [24] A. Saleh, Y. Yamini, M. Faraji, M. Rezaee, M. Ghambarian, J. Chromatogr. A 1216 (2009) 6673. [25] S. Ozcan, A. Tor, M.E. Aydin, Anal. Chim. Acta 665 (2010) 193. [26] C.F. Poole, J. Chromatogr. A 1217 (2010) 881. [27] L. Vidal, E. Psillakis, C.E. Domini, N. Grané, F. Marken, A. Canals, Anal. Chim. Acta 584 (2007) 189. [28] C. Cortada, L. Vidal, S. Tejada, A. Romo, A. Canals, Anal. Chim. Acta 638 (2009) 29. [29] R.H. Myers, D.C. Montgomery. Response surface methodology, Wiley, New York, 2002. [30] Y.V. Heyden, K. Luypaert, C. Hartmann, D.L. Massart, J. Hoogmartens, J.D. Beer, Anal. Chim. Acta 312 (1995) 245. [31] Y.V. Heyden, C. Hartmann, D.L. Massart, L. Michel, P. Kiechle, F. Erni, Anal. Chim. Acta 316 (1995) 15. [32] P. Konieczka, J. Namiesnik, J. Chromatogr. A 1217 (2010) 882. 171 ANEXO A. DATOS COMPLEMENTARIOS SUPPLEMENTARY CONTENT Determination of Geosmin and 2‐Methylisoborneol in Water and Wine Samples by Ultrasound‐Assisted Dispersive Liquid‐Liquid Microextraction Coupled to Gas Chromatography Mass Spectrometry Carol Cortadaa, Lorena Vidalb and Antonio Canalsb a Labaqua S.A., C/ Dracma 16‐18. Pol. Ind. Las Atalayas, 03114 Alicante, Spain. b Departamento de Química Analítica, Nutrición y Bromatología e Instituto Universitario de Materiales, Universidad de Alicante, Apdo. 99, 03080, Alicante, Spain. Corresponding author: Tel.: +345909790; fax: +34965909790. E‐mail addresses: lorena.vidal@ua.es (L. Vidal); a.canals@ua.es (A. Canals) 173 UNCERTAINTY BUDGET FOR USADLLME‐GC‐MS. Example: Geosmin in red wine I. Definition of relative combined uncertainty [1, 2] (1) where: ur(sample) is the uncertainty associated with the amount of sample used for a determination ur(true) is the uncertainty associated with recovery (trueness) ur(cal) is the uncertainty associated with calibration ur(rep) is the uncertainty associated with repeatability ur(LOD) is the uncertainty associated with analyte concentration Uncertainty of the sample I.i • Preparation of the red wine solution spiked at 0.25 µg L‐1 from stock standard solution of 10 µg L‐1. (2) where: Cf is the spiked concentration of the red wine solution Vi is the volume of the stock standard solution (0.25 mL) Ci is the concentration of the stock standard solution (10 µg L‐1) Vf is the volume of the spiked red wine sample (10 mL) 174 • ANEXO A. DATOS COMPLEMENTARIOS Uncertainty of the sample is defined by [3]: (3) where: uvi is the uncertainty of the pipet used to measure the stock standard solution volume (0.00052 mL) uci is the uncertainty of the concentration of the stock standard solution (0.0047 µg L‐1) uvf is the uncertainty of the volumetric flask (0.0014 mL) • Substituting the values in equation (3) we obtained the following result: ur(sample) = 0.0021 Uncertainty of the recovery I.ii • Recovery is defined by [4]: (4) where: C is the determined concentration (0.18 µg L‐1) Ci is the initial concentration of geosmin (initial analysis confirmed that was free) Cf is the spiked concentration of the red wine solution (0.25 µg L‐1) 175 • Uncertainty of the recovery is defined by [3]: (5) where: uc is the uncertainty of the determined concentration (0.013 µg L‐1) ucf is the uncertainty of the spiked concentration (0.00053 µg L‐1) • Substituting the values in equation (5) we obtained the following result: ur(true) = 0.072 I.iii Uncertainty of the calibration • Uncertainty of the calibration is defined by [1]: , ∑ (6) where: SDxy is the residual standard deviation [3] ∑ (7) b is the slope of the calibration curve p is the number of the measurements (repetitions) of the sample (p = 4) n is the number of standards of the calibration curve (n = 5) 176 ANEXO A. DATOS COMPLEMENTARIOS Xo is the concentration to be determined (0.18 µg L‐1) Xm is the mean of the x‐values (analyte concentration) Xi is the standards concentration of the calibration curve Yi is the measured value of dependent variable Ŷi is the predicted value for the model • Substituting the corresponding values in equation (6) and (7) and dividing by 0.18 µg L‐1, we obtained the relative uncertainty of the calibration: u , 0.18 . I.iv Uncertainty of the repeatability • Uncertainty of the repeatability is defined by [1]: √ (8) where: SDresult is the repeatability of measurements as standard deviation (0.057 µg L‐1) n is the number of replicates (n= 10) • Substituting the values in equation (8) we obtained the following result: ur(rep) = 0.018 177 Uncertainty of the analyte concentration I.v • Uncertainty of the analyte concentration is defined by [1]: (9) where: LOD is the limit of detection (0.002 µg L‐1) C is the determined concentration (0.18 µg L‐1) • Substituting the values in equation (9) we obtained the following result: ur(LOD) = 0.011 I.vi Calculation of relative combined uncertainty Table 1. Summary of the results. ur(sample) ur(true) ur(cal) ur(rep) ur(LOD) 0.0021 0.072 0.061 0.018 0.011 Relative uncertainty • Substituting these values in equation (1), the following value is obtained: 0.0021 0.072 0.061 0.018 ur = 0.097 II. Calculation of expanded uncertainty [1, 2] (10) 178 0.011 ANEXO A. DATOS COMPLEMENTARIOS where: k is the coverage factor (k=2, 95% confidence) C is the determined concentration (0.18 µg L‐1) ur is the relative combined uncertainty (0.097) • Substituting the values in equation (10), we obtained the following result: U= 0.03 µg L‐1 (k=2) Concentration of the sample = (0.18 ± 0.03) µg L‐1 (k=2) 179 References: [1] P. Konieczka, J. Naemiesnik, J. Chromatogr. A 1217 (2010) 882. [2] Eurachem Guide, Quantifying Uncertainty in Analytical Measurement, English Edition, 1995. [3] J.C. Miller, J.M. Miller, Statistics for Analytical Chemistry, Ellis Horwood Limited, 2nd ed., 1988. [4] Eurachem Guide, The Fitness for Purpose of Analytical Methods: A Laboratory Guide to Method Validation and Related Topics, English Edition 1.0, 1998. 180 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS 4.‐ MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS En este trabajo se utilizó la técnica de microextracción líquido‐líquido dispersiva asistida por ultrasonidos sustituyendo el baño ultrasónico para producir el punto de niebla entre el disolvente y la muestra conteniendo los analitos, por una sonda ultrasónica. La ventaja frente al trabajo anterior es que la sonda produce una energía ultrasónica 100 veces superior al baño de ultrasonidos y, además se produce directamente sobre la disolución con lo que la formación del punto de niebla es mucho más rápida. Los analitos utilizados en el presente estudio fueron cinco explosivos. Estos compuestos llegan al agua debido, no sólo a las actividades militares si no también por el recrudecimiento de la actividad terrorista lo que ha hecho que en los últimos años haya aumentado el interés por su determinación. Se utilizaron dos tipos diferentes de agua: un agua procedente de un embalse y un agua residual. De esta manera se estudió el efecto de la matriz en la técnica. Como en los trabajos anteriores, se usó el diseño de experimentos para la optimización del método y los resultados se presentaron con el cálculo de incertidumbre expandida. En este trabajo se comprobó que las aguas procedentes del efluente residual presentaban un importante efecto matriz. Para soslayar este problema se utilizó la calibración por adición de estándar obteniendo unos muy buenos resultados. La separación y posterior detección se realizó con un sistema de cromatografía de gases acoplado a un espectrómetro de masas. 181 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS ABSTRACT A fast, simple, inexpensive, sensitive, efficient and environmental friendly direct ultrasound‐assisted dispersive liquid‐liquid microextraction (DUSA‐DLLME) procedure has been developed to concentrate five nitroaromatic explosives from water samples prior to quantification by gas chromatography‐mass spectrometry (GC‐MS). An efficient ultrasonic probe has been used to radiate directly the samples producing very fine emulsions from immiscible liquids. A D‐optimal design was used for optimizing the factors and to evaluate their influential upon extraction. The optimum experimental conditions were: Sample volume, 10 mL; extraction time, 60 s; cycles, 0.6 s(s‐1); power of ultrasound energy, 40% (70W); and, extractant solvent (chlorobenzene) volume, 20 µL. Under the optimized experimental conditions the method presents good level of repeatability with coefficients of variation under 6% (n=8; spiking level 10 µg L‐1). Calculated calibration curves gave high level of linearity with correlation coefficient values between 0.9949 and 0.9992. Limits of detection were ranged between 0.03 and 0.91 µg L‐1. Finally, the proposed method was applied to the analysis of two types of water samples, reservoir and effluent wastewater. The samples were previously analysed and confirmed free of target analytes. At 5 µg L‐1 spiking level recovery values ranged between 75 and 96% for 183 reservoir water sample showing that the matrix had a negligible effect upon extraction. However, a noticeable matrix effect (around 50% recovery) was observed for effluent wastewater sample. In order to alleviate this matrix effect, the standard addition calibration method was used for quantitative determination. This calibration method supplied recovery values ranged between 71 and 79%. The same conclusions have been obtained from an uncertainty budget evaluation study. Keywords: Nitroaromatic explosives; direct ultrasound‐assisted dispersive liquid‐liquid microextraction; gas chromatography‐mass spectrometry; D‐optimal design; expanded uncertainty; water. 184 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS 1. Introduction Over the past few years the interest in nitroaromatic explosives (NE) analysis has increased due to military activities, but especially for the continuous upsurge in terrorist activity. This has generated tremendous demand for innovative analytical tools capable of detecting these compounds. Real samples are usually complicated matrices and these compounds are at low concentration, therefore, extraction is often recommended before detection. Conventional liquid‐liquid extraction (LLE) and solid phase extraction (SPE) are the most commonly used methods of sample pretreatment for isolation and/or enrichment of nitroaromatic explosives [1]. However, they present many disadvantages as they are tedious, labor‐intensive and time‐consuming. In addition, LLE requires large amounts of organic solvents that are potentially toxic, and is difficult to automate. SPE uses much less solvent than LLE but can be relatively expensive. Besides, prior to chromatographic analysis LLE and SPE often require solvent evaporation in order to preconcentrate the samples. During this evaporation step, loss and/or deterioration of target analytes have been reported [2]. Efforts have been placed on the miniaturization of the SPE and LLE procedures to remove these disadvantages. Solid‐phase microextraction (SPME) is a solvent‐free extraction technique that incorporates sample pretreatment, concentration and sample introduction into a single procedure. However, the extraction fiber is expensive, fragile, requires conditioning and it has a limited lifetime, and in addition, sample carry‐over between runs can be a problem [3]. Liquid‐liquid microextraction (LLME) is a single‐step extraction with a very high sample‐to‐solvent ratio which leads to high enrichment factor of analytes. In comparison to the traditional LLE and SPE, LLME has many advantages including wide selection of available solvents, low cost, simplicity and ease of use, short preconcentration time, virtually solventless and possibility of automation. In 185 addition, it is characterized by its affordability, due to its independence of a commercial source. One of the LLME approach is based on analyte partitioning between a droplet of organic solvent (extractant phase) and the aqueous sample matrix, named single‐drop microextraction (SDME) [4]. However, in SDME fast stirring speed and air bubbles cause drop instability and tend to break down the organic droplet, and relative low precision were often reported. Other configurations of LLME have been recently developed [5,6] with the aim of solving these problems. One of this novel liquid‐liquid microextraction techniques is the dispersive liquid‐liquid microextraction (DLLME), which was introduced by Assadi et al. [7,8]. DLLME is based on the formation of tiny droplets of extractant in the sample solution using water‐immiscible organic solvent (extractant) dissolved in a water‐miscible organic dispersive solvent. This novel technique has the advantages of simplicity, rapidity, low sample volume, low cost, high recovery, and a high enrichment factor. Both microextraction techniques (i.e., SPME and LLME) have been used for the determination of NE in soil and water samples [9‐13]. Sonochemistry is a growing topic in science and technology [14]. The effects of ultrasound on chemical and physical transformations are through the phenomenon of cavitation. Cavitation is the production of microbubbles in a liquid when a large negative pressure is applied to it [14]. Sonication can be used to produce very fine emulsions from immiscible liquids, which result in very large interfacial contact areas between the liquids and a corresponding dramatic increase in the mass transfer between two immiscible phases. This leads to an increment in the extraction efficiency of the procedure in a minimum time [15,16]. For this reason, sonochemistry has been combined with dispersive liquid‐liquid microextraction and the result has been a new technique called ultrasound‐assisted emulsification‐microextraction (USAEME) or ultrasound‐assisted dispersive liquid‐ liquid microextraction (USA‐DLLME). The use of ultrasound energy to disrupt the extractant phase reduces the consumption of organic solvent, because the 186 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS necessity of using a third component (disperser solvent) is not needed. Moreover, the use of disperser solvent usually decreases the partition coefficient of analytes into the extractant solvent. Therefore, these drawbacks are eliminated when sonochemistry is introduced. This technique was for the first time applied to the determination of synthetic musk fragrances, phthalate esters and lindane in water samples [17]. Fontana et al. [18] reported the extraction and preconcentration of polybrominated diphenyl ethers from environmental waters. Ozcan et al. [19,20] extrated some selected polychlorinated biphenyls and organochlorine pesticides from water samples, and Cortada et. al [21] extracted geosmin and 2‐ methylisoborneol in water and wine samples. Simultaneous USAEME and derivatization have been combined to extract parabens, triclosan and related phenols in water samples [22]. More recently Li et al. [23] have introduced an ionic liquid‐based ultrasound‐assisted dispersive liquid‐liquid microextraction method (IL‐ based USA‐DLLME) for cadmium determination in water samples. In most of the published papers cited above [17‐23] an ultrasonic bath has been used to irradiate the liquids. Nevertheless, it is well known that ultrasonic bath is less efficient in energy transmission than ultrasonic probe [14], and hence, the former produces a lower rate of emulsification [24]. Therefore, the main aim of this work was to develop a new, simple, rapid, inexpensive, sensitive, and efficient direct ultrasound‐assisted dispersive liquid‐ liquid microextraction (DUSA‐DLLME) method for extraction of NEs from aqueous samples. In this method the ultrasonic probe (i.e., sonotrode) was directly introduced into the sample increasing the efficiency of energy transmission. DUSA‐ DLLME extraction parameters (i.e., sample volume, extraction time, cycles, power of ultrasound energy, extractant solvent type and volume) were optimized and the procedure was then applied to the determination of five nitroaromatic explosives in real reservoir water and effluent wastewater samples. Determinations were carried out by gas chromatography‐mass spectrometry (GC‐MS). The optimization of the 187 microextraction conditions has been done using experimental design [25], and uncertainty budget [26] has been used for establishing confidence as a more realistic approach to the regulatory environment. 2. Experimental 2.1. Chemicals, “real‐world” water samples and apparatus Nitrobenzene, 2‐nitrotoluene, 2,6‐dinitrotoluene, 2,4,6‐trinitrotoluene and 2‐ amino‐4,6‐dinitrotoluene (2‐ADNT) were obtained from Sigma‐Aldrich (St Louis, MO, USA). Chlorobenzene, carbon tetrachloride, tetrachloroethylene and methanol pesticide‐grade were also obtained from Sigma‐Aldrich. De‐ionised water was prepared on a water purification system (Gradient A10) supplied by Millipore (Billerica, MA, USA). Stock standard solution of 2 mg L‐1 of target compounds was prepared in methanol. Working solutions were prepared by proper dilution of stock standard solution in water. All solutions were stored in the dark at 4°C. The recovery studies were carried out using reservoir water (Seville, Spain) and effluent wastewater (Ourense, Spain) samples, which were also stored in the dark at 4°C. Initial analysis confirmed that they were free of all target analytes. An ultrasonic processor (175 W, 24 kHz) with a titanium cylindrical sonotrode (7 mm o.d.; 110 mm long, reference S7) from Dr. Hielscher (Teltow, Germany) was used as the sonic probe. The instrument can be used in pulsed mode to enable rhythmic processing of media. With a pulse setting of “1” the reaction mixture is sonicated without interruption whereas with a pulse setting, for example, of “0.5” the reaction mixture is sonicated for 0.5 s and then sonication stops for 0.5 s. Hence, in pulse mode the ratio of sound‐emission time to cyclic pause time can be adjusted continuously from 0 to 100% per second. Centrifuge table GS‐6R model of Beckman (Fullerton, CA, USA) was used for centrifugation of the samples. 188 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS 2.2. Direct ultrasound‐assisted dispersive liquid‐liquid microextraction (DUSA‐DLLME) 10 mL of sample were placed into a 20 mL glass test tube with conical bottom. 20 µL of chlorobenzene as extractant solvent (Caution: be aware with the hazardous for the environment. Especially precaution should be taken for waste management and residues after extraction) were dropped into the sample solution and then the mixture was homogenized to avoid that the solvent remains in the cone inhibiting dispersion. 75 mm of the titanium cylindrical sonotrode was directly introduced into the reaction mixture for 60 s. Once the extraction was finished the mixture was centrifugated for 4 min at 2300 rpm in the centrifuge table. Finally, 2 µL of the extractant phase located at the bottom of the tube were manually injected into the GC‐MS system for analysis. 2.3. GC‐MS determination All analyses were carried‐out on a Varian 3900‐Saturn 2100T Gas Chromatography/Mass Spectrometer system (Walnut Creek, CA, USA) equipped with a Meta.X5 Tecknokroma column (30 m × 0.25 mm, 1.0 μm) (Barcelona, Spain). The mass spectrometer employed was an ion trap (20 µA) with 0.82 s of scan time. The injector was maintained at 220 °C and operated in the splitless mode with the split closed for 0.75 min. Helium (> 99.999 % pure) was used as the carrier gas at a flow rate of 1.0 mL min‐1. The column oven was initially set at 60 °C for 2 min, then programmed at 5 °C min‐1 to 150 °C where it was held for 2 min, and finally to 250 °C at 20°C min‐1 rate, where it was held for 10 min. The interface temperature was set at 200 °C and the detector voltage at 4 V. A 15 min solvent cut time was allowed for all analyses. The base peak ion and two other significant ions of each analyte were isolated during the whole chromatogram and were chosen as the quantifying ions. The base peaks ion (m/z) for the target analytes were: Nitrobenzene: 77; 2‐ nitrotoluene: 65; 2,6‐dinitrotoluene: 165; 2,4,6‐trinitrotoluene: 210 and 2‐amino‐4,6‐ dinitrotoluene: 180. Prior to quantification, the identification of all target 189 compounds was based on their mass spectra and GC retention times. Fig. 1 shows a typical chromatogram obtained after extraction of a spiked de‐ionised sample containing 10 µg L‐1 of each target analyte. 300 2 k counts 200 3 1 4 5 100 0 5 10 15 20 25 30 Time (min) Figure 1. Typical chromatogram of a de‐ionized water sample (10 µg L‐1) extracted by the DUSA‐ DLLME‐GC‐MS method. (1) Nitrobenzene; (2) 2‐nitrotoluene; (3) 2,6‐dinitrotoluene; (4) 2,4,6‐ trinitrotoluene; (5) 2‐ADNT. Conditions: extractant (chlorobenzene) volume, 20 µL; sample volumen, 10 mL; extraction time, 60 s; cycles, 0.6 s(s‐1); and power, 40% (70W). 2.4. Data handling and processing According to a previous work, the response of the instrument used in the design of experiments study was based on each area of the peaks individually obtained during GC‐MS analysis [27]. 190 35 minute MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS Experimental design matrices were constructed and the results were evaluated using the Statgraphics Statistical Computer Package “Statgraphics Plus 5.1” (Warrenton, VA, USA). 3. Results and discussion 3.1. Study of experimental factors involved in DUSA‐DLLME 3.1.1. Solvent study The first step in the optimization procedure was to select an appropriate extraction solvent. The solvents were selected on the basis of higher density than water, extraction capability of target compounds and good gas chromatography behaviour. Carbon tetrachloride, chlorobenzene and tetrachloroethylene were tested as potential acceptor phases. Solvent selectivity was evaluated with 20 µL of each extractant solvent into a 10 mL of de‐ionized water sample spiked at 100 µg L‐1 with all target analytes. From the three tested solvents chlorobenzene gave the best results, as can be seen in Fig. 2. Polarity of the solvents is similar, where values in terms of LogP are 2.91, 2.84 and 3.07 for carbon tetrachloride, chlorobenzene and tetrachloroethylene, respectively. However, chlorobenzene has an aromatic ring which allows π‐π interaction with the NEs, and therefore, higher extraction. 191 Figure 2. Response of the three organic solvents tested. De‐ionised water samples spiked at concentration of 100 µg L‐1 . Conditions: extractant volume, 20 µL; sample volumen, 10 mL; extraction time, 5 min; cycles, 0.5 s(s‐1); and power, 55% (96 W). 3.1.2. Study of others experimental factors Different factors can affect the extraction yield in the direct ultrasound‐ assisted dispersive liquid‐liquid microextraction procedure and in most cases they are correlated. Therefore, their optimization through a multivariate approach is recommended. The methodology based on the design of experiments (DOEs) is a useful tool that can be used to find the best experimental conditions. Various types of designs can be applied as factorial designs [20] that are appropriate for assessing main effects and interactions between factors; fractional designs [28] that only concerned with the main effects, and central composite, Doehlert designs and those designs based on the simplex method that are used for optimizing the experimental conditions when dealing with continuous factors [29,30]. In many cases, it is not possible to apply these classical experimental designs due to constraints either on the experimental domain (cost of certain reagents, safety or 192 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS incompatibility in the experimental conditions, etc.) or on the number of experiments (time‐consuming analysis, cost, material, etc.). These limitations obliged to reduce experimentation by selecting those experiments that, complying with the constraints enforced, keep the highest quality of the design, the reliability of the estimations and therefore the conclusions derived from it. In the present work, in order to reduce resources (time, reagents and sample) invested, and that two out of the five factors under study were not expected to have a linear behaviour, the experiments to be performed were selected according to the D‐ optimality criterion [31]. D‐optimal designs have the property that the estimations of the coefficients of the model are the most precise possible [31]. More detailed information of D‐optimal design can be found in Ref. [31]. The first step of the experimental design methodology was the selection of the factors, experimental domain and the response function. Three of these factors named extractant volume, sample volume and extraction time were chosen at two levels, low (‐1) and high (+1), and the other two factors, namely cycles and power of ultrasound energy were chosen at three, low (‐1), central (0) and high (+1). The selected values chosen for each factor are given in Table 1. Three levels must be chosen for cycles and power of ultrasound energy in order to avoid the problem associated to lack of linearity. It should be emphasized that the number of experiments needed using a full factorial design is 72. However, using D‐optimal design the number of experiments selected by the program is only 21 (see supplementary material for more information). As it has been described above, the peak area of each analyte has been used as a response of the proposed model. 193 Table 1. Experimental factors and level‐studied on the D‐optimal design Factors Level Low (‐1) Central (0) High (+1) Extractant volume (µL) 20 ‐ 40 Sample volume (mL) 5 ‐ 10 Extraction time (s) 30 ‐ 60 0.4 0.7 1.0 40 (70) 70 (123) 100 (175) ‐1 Cycles (s(s )) Power (%)a a Numbers in parentheses are absolute ultrasound power values in W The second step was the selection of the mathematical model which represents the phenomenon studied, and a second‐order linear model was proposed: y = b0 + b1x1 + b2x2 + b3x3 + b4x4 + b5x5 + b6x1x2 + b7x1x3 + b8x1x4 + b9x1x5 + b10x2x3 + b11x2x4 + b12x2x5 + b13x3x4 + b14x3x5 + b15x4x5 + b16x42 + b17x52 where y is the response function (peak area), b0 is the intercept, b1‐17 are the regression coefficients that estimate the effect of each factor (b1‐5), interactions (b6‐15) and quadratic effects of two factors (b16‐17), and xi are the independent factors, where x1 is extractant volume, x2 is sample volume, x3 is extraction time, x4 is cycles and x5 is power of ultrasound energy. From the analysis of the 21 experiments results, the R‐square and p‐values from Durbin‐Watson statistical test [32] are shown in Table 2. As can be seen, values of R‐square are between 97.2 and 99.9% and these values indicate that the model chosen explains the variability of the factors with the response (y). The Durbin‐ Watson statistic is a test to determine if there is any residual autocorrelation. The significance level was settled at 0.05. All p‐values shown in Table 2 are greater than 0.05, therefore the null hypothesis is accepted, which considers that there is no autocorrelation in the residuals, and therefore the model proposed for this study was valid. 194 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS Table 2. Parameters of the evaluation of significance of the proposed model. Analyte Nitrobenzene 2‐Nitrotoluene 2,6‐Dinitrotoluene 2,4,6‐Trinitrotoluene 2‐ADNT p‐Valuea 0.0915 0.1151 0.3140 0.2690 0.4016 R‐square (%) 99.9 99.6 97.2 98.3 98.8 a Significance level: 0.05. The data obtained were evaluated by ANOVA test, and the coefficients of the factors are listed in Table 3. Only coefficients of main factors are presented in Table 3, due to only few interactions for three out of the five analytes were significant, and the results were also according to those of the main factors. Therefore, to select the optimum conditions of the extraction procedure only the effects of main factors were considered. In order to determine if a coefficient is significant and consequently, if the corresponding factor affects the extraction procedure, the significance level was also settled at 0.05. Therefore, those coefficients, whose p‐ value is smaller than 0.05, will be considered statistically significant. 195 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS Table 3. Estimated effects, p‐values and levels of the coefficients of factors of the model Coefficient Nitrobenzene a 2‐Nitrotoluene Level Estimation p‐value a 2,6‐Dinitrotoluene Level Estimation p‐value a 2,4,6‐Trinitrotoluene 2‐ADNT p‐valuea Level ‐68,693.0 0.0178 ‐ + 9,727.5 0.4008 + 0.0738 + 29,785.8 0.0683 + ‐43,426.6 0.6117 ‐ ‐23,740.9 0.1445 ‐ 7,696.4 0.9054 + ‐13,769.1 0.2266 ‐ Level Estimation Estimation p‐value b1 ‐106,691.0 0.0023 ‐ ‐357,101.0 0.0053 ‐ ‐388,579.0 0.0382 ‐ ‐482,200.0 0.0186 ‐ b2 26,942.9 0.0333 + 114,989.0 0.0468 + 200,871.0 0.1220 + 41,371.0 0.5944 b3 24,860.6 0.0313 + 101,961.0 0.0475 + 84,568.5 0.3463 + 204,764.0 b4 ‐24,265.4 0.0489 ‐ ‐44,926.1 0.2559 ‐ 53,330.1 0.5969 + b5 ‐31,1846.6 0.0184 ‐ ‐75,051.9 0.0787 ‐ ‐16,694.4 0.8271 ‐ a Significance level.: 0.05. 197 p‐value a Level Estimation MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS As can be seen, extractant volume shows a negative significant effect upon extraction for all target analytes. Indeed, decreasing extractant volume increases the concentration of analyte extracted and therefore the signal increased. Sample volume and extraction time show a positive effect upon extraction for all target analytes but only for nitrobenzene and 2‐nitrotoluene have significant effect. Indeed, increasing the sample volume results in an increase of in the total amount of analyte extracted. In case of extraction time, the amount of analytes extracted is also increased when time is increased. Nevertheless, extraction time is not significant for three of the five compounds, and this could be due to equilibrium is reached in few seconds once the solvent is fully dispersed. Cycles shows a negative non‐significant effect for all targets except a negative significant effect for nitrobenzene and a positive non‐significant effect for 2,6‐dinitrotoluene. Decreasing the cycles the amount of analyte extracted increases. This effect could be explained because an increase in cycles results in a temperature increase at a microscale level that will raise the vapour pressure of a medium, and so lead to easier cavitation but less violent collapse. This large number of cavitation bubbles will act as a barrier to sound transmission and dampen the effective ultrasonic energy from the source which enters the liquid medium. Power shows a non‐significant negative effect for all the compounds except for 2,4,6‐ trinitrotoluene where the effect is positive and for nitrobenzene that shows a negative significant effect. A minimum of ultrasound energy is required to reach the cavitation threshold, but when a large amount of ultrasonic power enters a system, a great number of cavitation bubbles are generated in the solution. These will certainly act as a barrier to sound transmission as in the cycles effect [14]. Optimum extraction conditions for each target compound are shown in Table 4. However, compromise values chosen as optimum for the simultaneous extraction of all NE compounds with this method were: Extractant volume, 20 µL; sample volume, 10 mL; extraction time, 60 s; cycles, 0.6 s(s‐1); and power, 40% (70W). 199 Table 4. Optimum extraction‐condicions for each analyte. Extractant volume (µL) Analyte Sample volume (mL) Extraction time (s) Cycles (s(s‐1)) Power (%)a Nitrobenzene 20 10.0 58.3 0.65 40 (70) 2‐Nitrotoluene 20 10.0 59.3 0.67 41 (72) 2,6‐Dinitrotoluene 20 10.0 54.0 0.88 40 (70) 2,4,6‐Trinitrotoluene 20 10.0 60.0 0.65 68 (119) 2‐ADNT 20 9.2 60.0 0.61 40 (70) a Numbers in parentheses are absolute ultrasound power values in W. 3.2 Analytical figures of merit The optimum conditions of direct ultrasound‐assisted dispersive liquid‐liquid microextraction were used to assess the applicability of the proposed method for quantitative determination of target analytes by GC‐MS. A calibration study was performed by spiking de‐ionized water with analytes over the concentration range of 1‐10 μg L‐1. The calculated calibration curves gave a high level of linearity for all target analytes with correlation coefficients (r) between 0.9949 and 0.9992 (Table 5). The repeatability of the proposed method, expressed as coefficient of variation (CV), was evaluated by extracting and analyzing eight consecutive aqueous samples spiked at 10 μg L‐1 with each target analyte, and the CV values were ranged between 3.9 and 5.1% (Table 5). The limits of detection (LODs) for all target analytes were determined according to a signal‐to‐noise‐ratio (S/N) of three and the limits of quantification (LOQs) as ten times the above mentioned ratio. As can be seen in Table 5 the LODs and LOQs values were found to be in the low µg L‐1 level. 200 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS Table 5. Main method (DUSA‐DLLME‐GC‐MS) parameters for NEs determination in water samples. Correlation coefficient (r)a CV (%)b LOD (µg L‐1)c LOQ (µg L‐1)d Nitrobenzene 0.9992 4.1 0.10 0.3 2‐Nitrotoluene 0.9989 4.6 0.03 0.1 2,6‐Dinitrotoluene 0.9949 4.3 0.06 0.2 2,4,6‐Trinitrotoluene 0.9957 3.9 0.17 0.6 2‐ADNT 0.9981 5.1 0.91 3.0 Analyte Linear range: 1‐10 µg L‐1 (number of calibration points =5, replicates=3 for level). Coefficient of variation (CV): mean value for 8 replicate analyses, spiking level 10 µg L‐1. c Limits of detection (LODs): calculated for a three signal to noise ratio (S/N=3). d Limits of quantification (LOQs): calculated for a ten signal to noise ratio (S/N=10). a b Limit of detection, extraction time, extractant solvent, solvent and sample volume and linear range of different methods are shown in Table 6 [1,9‐11,13]. The LODs of the proposed method are of the same order or lower for some of the analytes than those obtained in previous works. However, DLLME and DUSA‐DLLME are faster (1‐2 min) and easier‐handle methods. On the other hand, LODs obtained in the present work for 2‐nitrotoluene and 2,6‐dinitrotoluene are three times lower and almost one order of magnitude lower, respectively, than LODs obtained with DLLME method [13]. 201 Tabla 6. Comparison of DUSA‐DLLME‐GC‐MS method with other analytical methods for determination of NEs. Preconcentration method Separation/detecition Linear range LOD (µg L‐1) Solvent (volume) ‐1 Extraction Sample time (min) volume (mL) RReferences technique (μg L ) HPLC‐UV 1‐50 0.04‐0.31 Acetonitrile (165 mL) 100 770 [1] SPMEb GC‐MS 20‐1000 0.03‐0.29 ‐ 15 5 [9] SDMEc GC‐MS 20‐1000 0.11‐0.80 Toluene (1 µL) 15 5 [10] HF‐LPMEd GC‐MS 10‐500 0.3‐0.64 Toluene (3 µL) 20 5 [11] DLLMEe GC‐FID 0.5‐300 0.09‐0.4 Carbon tetrachloride 2 9 [13] 1 10 This work SOEa /methanol (20/750 µL) DUSA‐DLLME GC‐MS 1‐10 0.03‐0.91 Chlorobenzene (20 µL) a Salting‐out extraction. Solid‐phase microextraction. c Single‐drop microextraction. d Hollow fiber liquid‐phase microextraction. e Dispersive liquid‐liquid microextraction. b 3.3 Analysis of “real‐world” samples. Two different types of water samples were extracted using the DUSA‐DLLME method and the extracts were quantified by GC‐MS. Five aliquots of the reservoir water and effluent wastewater samples were spiked at 5 µg L‐1 with all target contaminants and analysed under the optimized experimental conditions. Preliminary analysis showed that samples were free of all studied compounds. The results for each set of experiments are summarized in Table 7. The amount of the extracted analytes is presented as found concentration and recovery values. The latter, ranged between 75 and 96% for reservoir water, and therefore no noticeable matrix effects were observed. However, effluent wastewater shows recoveries between 49 and 88%, where 2,4,6‐trinitrotoluene and 2‐ADNT shows 202 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS values around 50%. This implies that there is a significant matrix effect. The found concentration was accompanied by expanded uncertainty (Table 7), which values were calculated based on Refs. [21,26]. Uncertainty of measurement is a component of uncertainty in all individual steps of an analytical procedure. Hence, it is necessary to determinate the sources and types of uncertainty for all these steps. Estimation of uncertainty leads to better measurement reliability, renders data from inter‐ laboratory studies comparable, and helps to assess the statistical significance of the difference between the measurement and a relevant reference value [26]. As can be seen, for reservoir water no systematic error is concluded since reference value (spiked value) is included into the found concentration ± expanded uncertainty intervals. In the case of effluent wastewater sample a systematic error is concluded for nitrobenzene, 2,4,6‐trinitrotoluene and 2‐ADNT, which was confirmed with the low recovery values. Tabla 7. Found concentration and mean recoveries of NEs in water samples. Analyte Found concentration ± U(k=2)a µg L‐1 (recovery ± CV, %)b Reservoir water Effluent wastewater Nitrobenzene 4.8 ± 1.8 (96± 13) 3.6 ± 1.3 (72± 16) 2‐Nitrotoluene 4.6 ± 2.0 (93± 13) 3.6 ± 1.5 (72± 15) 2,6‐Dinitrotoluene 3.8 ± 1.7 (75± 14) 4.4 ± 1.6 (88± 12) 2,4,6‐Trinitrotoluene 4.0 ± 1.6 (80± 14) 2.6 ± 1.6 (52± 13) 2‐ADNT 4.1 ± 2.4 (81± 11) 2.5 ± 2.0 (49± 10) a U = expanded uncertainty. b Five replicate analyses at 5 µg L‐1 spiking level. For this reason, the standard addition calibration method was used for quantitative determination of the NEs in effluent wastewater due to the matrix 203 effects observed. The standard addition calibration curve was performed with effluent wastewater until 6 μg L‐1 and gave a high level of linearity for all target analytes with correlation coefficients (r) between 0.9924 and 0.9967. The three aliquots of effluent wastewater samples were spiked at 4 µg L‐1 with all target compounds. The results obtained are summarized in Table 8. Recovery values are ranged between 71 and 79% and it can be seen now that reference value is included into the found concentration ± expanded uncertainty intervals, and therefore no systematic error is presented. Table 8. Found concentration of NEs in effluent wastewater samples with standard addition calibration method. Analyte Correlation coefficient (r)a Found concentración ± U(k=2)b µg L‐1 (recovery ± CV, %)c Nitrobenzene 0.9940 3.1 ± 1.3 (77± 14) 2‐Nitrotoluene 0.9967 2.9 ± 1.1 (71± 8) 2,6‐Dinitrotoluene 0.9965 3.0 ± 1.2 (74± 9) 2,4,6‐Trinitrotoluene 0.9924 3.2 ± 1.2 (79± 10) 2‐ADNT 0.9963 3.1 ± 1.9 (78± 12) a Linear range: 0‐6 µg L‐1 (number of calibration points = 4). b U = expanded uncertainty. c Three replicate analyses at 4 µg L‐1 spiking simple. 5. Conclusions A new, simple, rapid, inexpensive, sensitive and efficient DUSA‐DLLME method has been introduced for extraction of five NEs from aqueous samples. Ultrasonic probe is directly introduced into the sample increasing the efficiency of energy transmission. 204 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS The new sample preparation method has been optimized with a non‐ common DOE approach (D‐optimal design). This optimization approach significantly reduces the number of experiments and introduces experimental conditions that are not able to study with classical experimental designs. Acknowledgements The authors would like to thank the Spanish Government (project n. CTQ2008‐06730‐C02‐01), the Regional Government of Valencia (Spain) (projects n. ACOMP/2010/047 and A‐04/09) and LABAQUA S.A. (Alicante, Spain) for the financial support. The authors would like to thank Prof. Ortiz for her valuable help during the design and evaluation of optimization experiments. This work is part of the Doctoral Thesis of Carol Cortada. Appendix A. Supplementary data. Supplementary data associates with this article can be found, in the online version, at doi:10.1016/j.talanta.2011.08.011. 205 REFERENCES [1]. USEPA, SW‐846, Method 8330, Nitroaromatic and nitramines by high performance liquid chromatography (HPLC), US Environmental Protection Agency, Washington, DC, 1994. [2]. M.R. Darrach, A. Chutjian, G.A. Plett, Environ. Sci. Technol. 32 (1998) 1354‐ 1358. [3]. P. Helena, Z.K. Lucija, Trends Anal. Chem. 18 (1999) 272‐282. [4]. M.A. Jeannot, F.F. Cantwell, Anal. Chem. 68 (1996) 2236‐2240. [5]. A. Sarafraz‐Yazdi, A. Amiri, Trends Anal. Chem. 29 (2010) 1‐14. [6]. E. Psillakis, N. Kalogerakis, Trends Anal. Chem. 22 (2003) 565‐574. [7]. M. Rezae, Y. Assadi, M.R. Milani Hosseini, E. Aghaee, F. Ahmadi, S. Berijani, J. Chromatogr. A 1116 (2006) 1‐9. [8]. S. Berijani, Y. Assadi, M. Anbia, M.R. Milani Hosseini, E. Aghaee, J. Chromatogr. A 1123 (2006) 1‐9. [9]. E. Psillakis, N. Kalogerakis, J. Chromatogr. A 938 (2001) 113‐120. [10]. E. Psillakis, N. Kalogerakis, J. Chromatogr. A 907 (2001) 211‐219. [11]. E. Psillakis, D. Mantzavinos, N. Kalogerakis, Anal. Chim. Acta 501 (2004) 3‐10. [12]. H. Halasz, C. Groom, E. Zhou, L. Paquet, C. Beaulieu, S. Deschamps, A. Corriveau, S. Thiboutot, G. Ampleman, C. Dubois, J. Hawari, J. Chromatogr. A 963 (2002) 411‐418. [13]. H. Ebrahimzadeh, Y. Yamini, F. Kamerei, Talanta 79 (2009) 1472‐1477. [14]. T.J. Mason “Sonochemistry”, Oxford University Press, New York, 1999. [15]. M.D. Luque de Castro, F. Priego‐Capote, Talanta 72 (2007) 321‐334. [16]. F. Priego‐Capote, M.D. Luque de Castro, Anal. Chem. 23 (2004) 544‐653. [17]. J. Regueiro, M. Llompart, C. Garcia‐Jares, J.C. Garcia‐Monteagudo, R. Cela, J. Chromatogr. A 1190 (2008) 27‐38. [18]. A.R. Fontana, R.G. Wuilloud, L.D. Martinez, J.C. Altamirano, J. Chromatogr. A 1216 (2009) 147‐153. 206 MICROEXTRACCIÓN LÍQUIDO‐LÍQUIDO DISPERSIVA DIRECTAMENTE ASISTIDA POR ULTRASONIDOS [19]. S. Ozcan, A. Tor, M.E. Aydin, Anal. Chim. Acta 647 (2009) 182‐188. [20]. S. Ozcan, A. Tor, M.E. Aydin, Water Res. 43 (2009) 4 269‐4277. [21]. C. Cortada, L. Vidal, A. Canals, J. Chromatogr. A 1218 (2011) 17‐22. [22]. J. Regueiro, M. Llompart, E. Psillakis, J.C. Garcia‐Monteagudo, C. Garcia‐Jares, Talanta 79 (2009) 1387‐1397. [23]. S. Li, S. Cai, W. Hu, H. Chen, H. Liu, Spectrochim. Acta Part B 64 (2009) 666‐671. [24]. A.J. Wain, N.S. Lawrence, J. Davis, R.G. Compton, Analyst 127 (2002) 8‐10. [25]. D. C. Montgomery, “Design and analysis of experiments”, John Wiley &Sons, Arizona, 2000. [26]. P. Konieczka, J. Namiesnik, J. Chromatogr. A 1217 (2010) 882‐891. [27]. L. Vidal, E. Psillakis, C. Domini, N. Grané, F. Marken, A. Canals, Anal. Chim. Acta 584 (2007) 189‐195. [28]. R. Mabilia, C. Scipioni, F. Veglio, M.C. Tomasi Sciano, Atmos. Environ. 44 (2010) 3942‐3951. [29]. C. Cortada, L. Vidal, S. Tejada, A. Romo, A. Canals. Anal. Chim. Acta 638 (2009) 29‐35. [30]. L. Sarabia, M.C. Ortiz. Chem. Biochem. Data Anal. 1 (2009) 345‐390. [31]. I. Garcia, L. Sarabia, M.C. Ortiz, J.M. Aldama. J. Chromatogr. A 1085 (2005) 190‐ 198. [32]. J. Durbin, G.S. Watson, Biometrika 37 (1950) 409‐428. 207 RESULTADOS Y DISCUSIÓN RESULTADOS Y DISCUSIÓN En esta memoria se han desarrollado diferentes métodos de análisis utilizando la técnica de microextracción con disolvente para la determinación de microcontaminantes orgánicos en muestras de naturaleza líquida. El objetivo ha sido desarrollar metodologías de análisis respetuosas con el medio ambiente que se puedan utilizar en los laboratorios de control medioambiental. Para ello se ha reducido la cantidad de compuestos tóxicos utilizados y el número de pruebas para la optimización de los métodos. El estudio se ha centrado en la puesta a punto de nuevas técnicas de extracción basándonos en la miniaturización de las técnicas clásicas. En los cuatro trabajos presentados en esta memoria se ha miniaturizado la extracción líquido‐ líquido. La metodología de trabajo seguida se ha desarrollado en tres etapas; la primera de ellas consiste en la optimización de las variables que pueden influir en la microextracción, en la segunda etapa se evalúa el método obteniendo los parámetros analíticos de calidad del mismo y en la tercera etapa se aplica el método de análisis a muestras reales para comprobar la existencia de efectos de matriz y, en el caso de que exista, proponer la forma de eliminarlos. En este apartado se pretende ofrecer una visión global de los resultados más relevantes obtenidos en el desarrollo de la presente memoria. En primer lugar los métodos de microextracción desarrollados comparten los mismos principios generales, cuyas características comunes son: Sencillos, ya que la instrumentación utilizada es muy simple y no se utiliza pretratamiento de la muestra. Económicos, debido a la gran reducción en el consumo de los reactivos utilizados y a la simplicidad del material usado, común de cualquier laboratorio de análisis. 211 Rápidos, en cada uno de los trabajos realizados se ha ido reduciendo el tiempo dedicado a la etapa de extracción. Esto ha sido posible porque la metodología propuesta es simple y de fácil manejo. Sensibles, alcanzando en todos ellos los límites de detección obtenidos en otras técnicas utilizadas hasta la fecha para los mismos fines y, en la mayoría de los casos, mejorándolos. Precisos, consiguiendo precisiones comparables a otras técnicas utilizadas para los mismos propósitos y, en algunos casos, superándolas. En la Tabla 5 se muestran, a modo de resumen, las características más representativas de los métodos desarrollados en la presente memoria. 212 RESULTADOS Y DISCUSIÓN Tabla 5. Características representativas de los métodos desarrollados en la memoria Analitos Plaguicidas Volumen de muestra (mL) 10 Tiempo de extracción (min) 37 LOD (µg L‐1) SDME/GC‐MS Volumen de extractante (µL) 2 Agua DLLME/GC‐MS 10/1000 10 0,5 0,001‐0,025 Agua/vino USA‐DLLME/ 8 12 3 0,002 y 0,009 20 10 1 0,03‐0,91 Fase extractante Muestra Modo de SME/detección Tolueno Agua Tetracloroeteno/ 0,022‐0,101 organoclorados Plaguicidas organoclorados Acetona1 Gesomina y MIB Tetracloroeteno GC‐MS Explosivos Clorobenceno Agua nitroaromáticos DUSA‐ DLLME/GC‐MS 1 Se ha utilizado tetracloroeteno como disolvente extractante y acetona como disolvente dispersante. 213 RESULTADOS Y DISCUSIÓN Como se puede observar en la Tabla 5, en los sucesivos trabajos se ha ido reduciendo el tiempo de extracción y se ha simplificado la metodología. En el primero de ellos se utilizó la microextracción en gota. Esta técnica de miniaturización de la extracción líquido‐líquido reduce drásticamente el uso de disolventes orgánicos, el volumen de muestra y el tiempo de extracción. En el segundo trabajo se utilizó la microextracción líquido‐líquido dispersiva. La mejora consistió en la eliminación de la gota en suspensión sobre la disolución. La modalidad convencional de SDME puede presentar problemas de inestabilidad de la gota debido a la agitación necesaria para alcanzar el equilibrio en un periodo de tiempo corto, evaporación parcial de la gota de disolvente si el tiempo de extracción es elevado y formación de burbujas de aire que hacen que la gota disminuya la superficie de contacto. Todo esto hace que haya que llegar a un compromiso entre la velocidad de agitación, tiempo de extracción y volumen de la gota de disolvente. Cuando se utiliza la microextracción líquido‐líquido dispersiva estos problemas desaparecen ya que la gota se dispersa en la muestra que contiene los analitos objeto de estudio y hace que la superficie de contacto aumente enormemente. Este aumento en la superficie de contacto entre el disolvente extractante y la muestra acuosa lleva asociado un aumento en la eficiencia de extracción de los compuestos desde la fase acuosa a la fase orgánica. Por lo tanto, cabe esperar la mejora de los límites de detección y la reducción en el tiempo de equilibrio frente a la técnica de microextracción en gota. En el tercer trabajo se sustituyó el disolvente dispersante por la energía ultrasónica para producir la dispersión del disolvente extractante en la muestra. En este primer trabajo dedicado a la utilización de este tipo de energía como agente dispersante se usó un baño ultrasónico para producir la rotura del disolvente. Se produjo una mejora en los LODs debido a que, con la eliminación del disolvente 215 extractante, se elimina la competencia entre los dos disolventes orgánicos y, aunque los analitos estudiados son más afines por el disolvente extractante, se produce una disminución del coeficiente de reparto debido a la existencia en la disolución de otro disolvente orgánico (disolvente dispersante). En el cuarto trabajo se sustituyó el baño ultrasónico por una sonda de ultrasonidos que permitió irradiar directamente la mezcla extractante/muestra. Esto hace que la eficacia de la energía ultrasónica sea 100 veces superior. En este cuarto trabajo se redujo el tiempo de procesamiento a 1 min. En la primera etapa de la metodología general de trabajo empleado en el presente trabajo, la elección de los valores óptimos para las diferentes variables se llevó a cabo utilizando el diseño de experimentos (DOE) como herramienta estadística para los trabajos 1, 3 y 4. Para el trabajo 2 se utilizó el método clásico de variación de una de las variables cada vez manteniendo el resto fijas. En la segunda etapa se estudiaron los parámetros analíticos. En las Tablas 6 y 7 se muestran los resultados obtenidos para los cuatro métodos desarrollados. Tabla 6. Datos representativos de los métodos desarrollados en los trabajos 1 y 2 de la presente memoria. α‐HCH Coeficiente de correlación (r) (SDME/DLLME)a 0,9993/0,9999 RSD (%) (SDME/DLLME) 6,7/7 LOD (ng L‐1 ) (SDME/DLLME) 87/3 β‐HCH 0,9993/0,9994 6,5/5 93/5 γ‐HCH 0,9998/0,9998 6,5/5 45/8 δ‐HCH 0,9996/0,9992 8,2/5 66/6 Heptaclor 0,9998/0,9982 7,6/8 49/7 Aldrin 0,9997/0,9995 9,9/7 53/9 Heptaclor epóxido 0,9997/0,9983 6,8/7 54/2 Analito 216 RESULTADOS Y DISCUSIÓN α‐Endosulfan 0,9996/0,9991 7,6/6 64/5 p,p’‐DDE 0,9999/0,9992 9,0/7 25/2 Diendrin 0,9999/0,9983 6,3/9 22/4 Endrin 0,9996/0,9985 9,8/8 68/4 β‐Endosulfan 0,9996/0,9977 7,9/15 71/25 p,p’‐DDD 0,9999/0,9967 6,9/8 22/4 Endrin aldehido 0,9999/0,9984 5,9/10 69/1 Endosulfan sulfato 0,9993/0,9992 9,3/8 87/3 p,p´‐DDT 0,9991/0,9982 7,8/11 101/4 Endrin cetona 0,9996/0,9988 9,1/10 60/4 Metoxiclor 0,9999/0,9985 7,4/10 50/1 a Se muestran los valores obtenidos en el trabajo realizado con microextracción en gota (SDME) y en el trabajo realizado con microextracción líquido‐líquido dispersiva (DLLME) para el mismo grupo de analitos. En la Tabla 6 se puede observar cómo se han mejorado los LODs obtenidos utilizando la microextracción líquido‐líquido dispersiva para la extracción y concentración de plaguicidas organoclorados frente a la microextracción en gota. Estas reducciones han sido desde 3 veces en el caso del β‐endosulfan hasta 69 veces en el caso del endrín aldehído. Para la mayoría de los analitos se ha mejorado la repetibilidad del método mientras que en el resto es prácticamente igual para las dos metodologías. Esto lo podemos comprobar por los valores de RSD obtenidos para ambos métodos con valores inferiores a 10 para el caso de la SDME y similares valores para DLLME excepto para el β‐endosulfan y el p,p’‐DDT siendo del 15 y del 11%, respectivamente. 217 Otro aspecto a destacar de la presente memoria es la importante reducción en el tiempo de extracción ya que se ha pasado de 37 min. a 0,5 min. al realizar la microextracción en los modos SDME y DLLME respectivamente. En el tercer y cuarto trabajo se sustituyó el disolvente dispersante por energía ultrasónica para realizar la dispersión de muchas gotas pequeñas del extractante en la muestra. En el tercer trabajo se utilizó un baño ultrasónico como generador de ultrasonidos (USA‐DLLME). Los valores del coeficiente de variación estuvieron entorno al 10% tanto para la geosmina como para el MIB (10,4 y 10,1% respectivamente) (Tabla 7). Los límites de detección calculados para la geosmina y el MIB están por debajo de la concentración perceptible para ambos analitos tanto en aguas como en vinos. Estos valores, descritos en la literatura, son de 4 y 12 ng L‐1 para geosmina y MIB en aguas [1] y de 50 y 55 ng L‐1 en el caso de los vinos [2]. En el cuarto trabajo se sustituyó el baño de ultrasonidos por una sonda ultrasónica (DUSA‐DLLME) obteniendo coeficientes de variación por debajo del 5%, es decir, mejoró la repetibilidad del método frente a la utilización del baño ultrasónico. Los LODs son del orden de unos pocos µg L‐1, valores inferiores a los obtenidos con los métodos clásicos de determinación de estos compuestos (ver Tabla 6 del artículo dedicado a la determinación de los compuestos nitroaromáticos). 218 RESULTADOS Y DISCUSIÓN Tabla 7. Datos representativos de los métodos desarrollados en los trabajos 3 y 4 de la presente memoria CV (%) LOD (ng L‐1 ) Geosmina Coeficiente de correlación (r) 0,9988 10,4 2 2‐Metilisoborneol 0,9994 10,1 9 Nitrobenceno 0,9992 4,1 100 2‐Nitrotolueno 0,9989 4,6 30 2,6‐Dinitrotolueno 0,9949 4,3 60 2,4,6‐Trinitrotolueno 0,9957 3,9 170 2‐ADNT 0,9981 5,1 910 Analito En la tercera y última etapa de todos los trabajos realizados se estudió la aplicabilidad de las diferentes metodologías desarrolladas al análisis de muestras reales para analizar los efectos de matriz. En el caso de los trabajos 1, 2 y 4 se utilizaron muestras de agua de diferentes procedencias. En el trabajo 3, además de las muestras de agua, se estudió también los efectos de matriz en muestras de vinos. En las Tablas 8, 9, 10, 11 y 12 se reflejan los resultados obtenidos en los cuatro trabajos. 219 Tabla 8. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 1 Recuperaciones relativas (%) y valores de RSD(%) entre paréntesisa Analito Recuperaciones medias ± SD EDAR‐1 Urbana Balsa residual EDAR‐2 Urbana Residual sanitaria EDAR industrial y urbana EDAR‐ 3 urbana EDAR‐4 urbana α‐HCH 101 (3) 94 (5) 98 (11) 117 (9) 98 (8) 106 (2) 110 (5) 103 ± 8 β‐HCH 103 (4) 104 (9) 87 (7) 113 (4) 97 (7) 98 (5) 101 (7) 100 ± 8 γ‐HCH 95 (1) 101 (7) 92 (11) 118 (10) 99 (8) 105 (3) 104 (4) 102 ± 8 δ‐HCH 101 (8) 90 (6) 101 (6) 115 (7) 98 (10) 99 (8) 105 (5) 101 ± 8 Heptaclor 66 (8) 63 (1) 55 (13) 45 (10) 51 (5) 57 (5) 47 (8) 55 ± 8 Aldrín 75 (6) 90 (10) 107 (11) 97 (13) 96 (5) 100 (8) 79 (2) 92 ± 11 Heptaclor epóxido 74 (1) 90 (7) 91 (7) 74 (5) 87 (7) 77 (7) 78 (4) 82 ± 8 α‐Endosulfan 46 (8) 59 (6) 43 (10) 41 (6) 48 (9) 49 (8) 46 (11) 47 ± 6 p,p’‐DDE 34 (15) 48 (11) 49 (10) 44 (8) 43 (8) 39 (3) 43 (4) 43 ± 5 Dieldrín 94 (5) 71 (6) 79 (12) 73 (9) 80 (9) 73 (5) 73 (11) 78 ± 8 Endrín 83 (7) 75 (6) 84 (11) 74 (10) 68 (10) 79 (6) 80 (9) 78 ± 6 β‐Endosulfan 46 (9) 56 (9) 59 (9) 53 (2) 51 (9) 45 (9) 54 (10) 52 ± 5 p,p’‐DDD 43 (9) 54 (7) 55 (8) 47 (2) 34 (3) 51 (6) 45 (6) 47 ± 7 Endrín aldehido 92 (10) 76 (9) 92 (9) 93 (6) 86 (4) 84 (1) 75 (9) 85 ± 8 Endosulfan sulfato 79 (3) 81 (7) 88 (4) 96 (10) 84 (10) 91 (2) 94 (6) 88 ± 7 p,p’‐DDT 34 (6) 71 (11) 46 (4) 52 (2) 42 (5) 45 (7) 43 (5) 48 ± 12 Endrín cetona 84 (5) 72 (11) 69 (4) 87 (11) 70 (10) 76 (5) 83 (10) 77 ± 7 Metoxiclor 57 (3) 64 (7) 64 (2) 58 (9) 58 (8) 61 (3) 66 (7) 61 ± 4 a Análisis de tres repeticiones a una concentración de 10 µg L‐1 220 RESULTADOS Y DISCUSIÓN En la Tabla 8 podemos ver que, en el primer trabajo, once de los dieciocho compuestos no presentan efectos de matriz. Sin embargo, los otros siete plaguicidas organoclorados (Heptaclor, α‐Endosulfan, p,p’‐DDE, β‐Endosulfan, p,p’‐ DDD, p,p’‐DDT y Metoxiclor) presentan un notable efecto de la matriz. La disminución en las recuperaciones relativas se puede deber a tres fenómenos [3]: (i) la posible adsorción de los analitos en la materia orgánica; (ii) adsorción en el recipiente y; (iii) pérdidas durante la filtración. Este fenómeno también podría estar relacionado con la estructura de la sustancias analizadas. Los endosulfanes (alfa y beta) y heptaclor tienen una estructura similar, y por otro lado, p,p’‐DDE, p,p'‐DDT, p,p'‐DDD y Metoxiclor también son similares en estructura. Sin embargo, no hemos sido capaces de encontrar una explicación razonable a la posible relación entre estructura química y reducción en la recuperación. Tabla 9. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 2 Analito Recuperaciones relativas (%) y valores de RSD (%) entre parentesisa Agua de río Agua superficial Agua de grifo EDAR urbana α‐HCH 113 (3) 101(7) 106 (5) 77 (3) β‐HCH 112 (3) 96 (2) 98 (5) 94 (4) γ‐HCH 111 (7) 97 (6) 106 (7) 81 (1) δ‐HCH 109 (2) 86 (9) 99 (6) 81 (8) Heptaclor 98 (8) 85 (6) 88 (3) 63 (3) Aldrin 93 (4) 81 (9) 97 (8) 56 (7) Heptaclor epoxido 89 (5) 79 (10) 99 (8) 65 (5) α‐Endosulfan 95 (8) 83 (6) 93 (6) 73 (12) p,p’‐DDE 88 (8) 81 (5) 99 (8) 66 (7) Diendrin 97 (9) 82 (4) 100 (8) 70 (2) Endrin 92 (9) 81 (9) 102 (3) 63 (12) 221 β‐Endosulfan 93 (9) 85 (3) 103 (6) 120 (5) p,p’‐DDD 90 (10) 84 (6) 96 (7) 70 (5) Endrin aldehido 97 (5) 86 (3) 104 (5) 97 (4) 100 (10) 82 (4) 97 (7) 93 (3) p,p´‐DDT 93 (8) 75 (7) 87 (11) 85 (8) Endrin cetona 95 (8) 82 (5) 97 (7) 107 (9) Metoxiclor 88 (10) 75 (4) 96 (10) 113 (12) Endosulfan sulfato a Análisis de tres repeticiones de una concentración de 10 µg L‐1 En la Tabla 9 se muestran los valores obtenidos en el análisis de muestras reales en el segundo trabajo. De los dieciocho plaguicidas organoclorados estudiados ninguno de ellos presentó un efecto de matriz significativo para las muestras de agua de río, superficial y del grifo ya que los valores de recuperación estuvieron en el intervalo comprendido entre 75 y 113%. Sin embargo, en el caso de la muestra de agua residual de origen urbano se puede ver un pequeño efecto debido a la matriz para cinco de los dieciocho POCs, es decir, para el heptaclor, aldrin, heptaclor epoxido, p,p’‐DDE y endrin. En este caso el número de compuestos que presentan efecto de matriz ha bajado con relación al trabajo 2 y los valores de recuperación son mayores que en el trabajo anterior, es decir, los efectos de matriz se muestran con menor intensidad. 222 RESULTADOS Y DISCUSIÓN Tabla 10. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 3 Analito Concentración encontrada ± U (k=2)a µg L‐1 (recuperación ± CV) b Vino tinto Vino rosado Vino blanco Agua de embalse Agua de grifo Geosmina 0,18±0,03 (72±7) 0,28 ±0,05 (112±7) 0,24±0,06 (96±11) 0,20±0,04 (80±7) 0,22±0,06 (88±11) MIB 0,18±0,04 (72±7) 0,23±0,05 (92±9) 0,19±0,06(76±14) 0,23±0,03 (92±2) 0,28±0,05 (113±8) a U = Incertidumbre expandida con un factor de cobertura de k = 2, correspondiente a un nivel de confianza del 95%. b Análisis de cuatro réplicas a una concentración de 0.25 µg L‐1. Tabla 11. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 3. Concentración encontrada ± U (k=2)a ng L‐1 (recuperación ± CV) b Analito Vino tinto Vino rosado Vino blanco Geosmina 21±9 (71±18) 22 ±8 (73±14) 26±9 (87±16) 22±9 (73±18) 23±8 (78±16) MIB 21±19 (70±12) 22±19 (73±11) 25±20 (85±15) 28±21 (85±20) 25±20 (73±18) a Agua de embalse Agua de grifo U = Incertidumbre expandida con un factor de covertura de k = 2, correspondiente a un nivel de confianza del 95%. b Análisis de cuatro réplicas a una concentración de 30 ng L‐1. En las Tablas 10 y 11 se recogen los valores de recuperación obtenidos con muestras reales de agua y vino del trabajo 3. En este trabajo se realizó el estudio de recuperación a dos concentraciones diferentes. Los intervalos de los valores de recuperación se sitúan entre el 72 y 113% para una concentración de 0,25 µg L‐1, y para una concentración próxima al límite de cuantificación de 0,03 µg L‐1 se 223 obtuvieron valores de recuperación entre el 70 y 87%, encontrándose en ambos casos los valores más bajos de recuperación para las muestras de vino tinto (70‐ 72%). Por tanto, se puede decir que no se ha observado efectos de matriz significativos en este método. Se calcularon también los valores de la incertidumbre expandida [4]. Como queda reflejado en dichas Tablas, para el nivel de concentrración de 0,25 µg L‐1 para geosmina y MIB en la muestra de vino tinto y para geosmina en la muestra de agua de embalse existe un error sistemático ya que el valor de referencia (dopado de la muestra) no se encuentra dentro de los intervalos de concentración ± incertidumbre expandida. Para las muestras dopadas con una concentración de 0,03 µg L‐1, no se observa un error sistemático para la geosmina, pero no se pueden sacar conclusiones de la incertidumbre expandida para el caso de MIB ya que la concentración adicionada coincide con el valor del LOQ para este analito. Tabla 12. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 4. Nitrobenceno Concentración encontrada ± U(k=2)a µg L‐1 (recuperación ± CV, %)b Agua de embalse Efluente residual 4,8 ± 1,8 (96± 13) 3,6 ± 1,3 (72± 16) 2‐Nitrotolueno 4,6 ± 2,0 (93± 13) 3,6 ± 1,5 (72± 15) 2,6‐Dinitrotolueno 3,8 ± 1,7 (75± 14) 4,4 ± 1,6 (88± 12) 2,4,6‐Trinitrotolueno 4,0 ± 1,6 (80± 14) 2,6 ± 1,6 (52± 13) 2‐ADNT 4,1 ± 2,4 (81± 11) 2,5 ± 2,0 (49± 10) Compuesto a U= incertidumbre expandida. b Análisis de cinco replicados a una concentración de 5 µg L‐1 224 RESULTADOS Y DISCUSIÓN En la Tabla 12 se muestran los valores de la concentración y de la recuperación obtenidos en el trabajo 4. Los valores de recuperación obtenidos para la muestra de agua de embalse se encuentran entre 75‐96% por lo que no se observan efectos de matriz significativos. Sin embargo, los valores de recuperación en el efluente residual se encuentran entre 49% y 88%, siendo los valores para el 2,4,6‐trinitrotolueno y 2‐ADNT próximos al 50%. Esto implica que existe un efecto de matriz significativo. En cuanto a la incertidumbre expandida, para la muestra de agua de embalse no se observa un error sistemático ya que el valor de referencia (valor añadido) se encuentra para todos los analitos dentro de los intervalos de la concentración encontrada ± la incertidumbre expandida. En el caso del efluente residual se concluye que existe un error experimental para el nitrobenceno, 2,4,6‐ trinitrotolueno y 2‐ADNT, lo que coincide con las conclusiones obtenidas a partir de los valores de recuperación del párrafo anterior. Para eliminar, o al menos minimizar, los efectos de matriz observados en las aguas de efluentes residuales, se usó el método de la adición de estándar (Tabla 13). Tabla 13. Valores obtenidos en el estudio de los efectos de matriz en el trabajo 4 con las muestras de agua de efluente residual mediante el método de adición de estándar. Nitrobenceno 0,9940 Concentración encontrada ± U(k=2)b µg L‐ 1 (recuperación ± CV, %)c 3,1 ± 1,3 (77± 14) 2‐Nitrotolueno 0,9967 2,9 ± 1,1 (71± 8) 2,6‐Dinitrotolueno 0,9965 3,0 ± 1,2 (74± 9) 2,4,6‐Trinitrotolueno 0,9924 3,2 ± 1,2 (79± 10) 2‐ADNT 0,9963 3,1 ± 1,9 (78± 12) Compuesto a Coeficiente de correlación (r)a Intervalo lineal: 0‐6 µg L‐1 (número de patrones de calibración = 4). bU = incertidumbre expandida. c Análisis de tres replicados a una concentración de 4 µg L‐1 225 Los valores de recuperación obtenidos con esta metodología de calibración se encontraron entre 71‐79% y se puede observar que ahora el valor de referencia está incluido en el intervalo de la concentración encontrada ± la incertidumbre expandida; por lo tanto, no existe error sistemático. El método de separación, detección y cuantificación en todos los trabajos desarrollados en la presente memoria fue la cromatografía de gases de alta resolución acoplada a un espectrometro de masas (GC‐MS). Debido a la naturaleza de los disolventes extractantes y a los analitos estudiados, esta técnica de detección y cuantificación es más sensible y específica para la determinación de compuestos orgánicos. En los diferentes trabajos se ha utilizado un detector de masas del tipo “ion‐trap” y se han comparado los espectros obtenidos con la espectroteca Nist 98 (V. 2) incorporada al instrumento. 226 REFERENCIAS Referencias 1. S. Boutou, P. Chatonnet, Journal of Chromatography A 1141 (2007) 1‐9. 2. A.J. Hassett, E.R. Rohwer, Journal of Chromatography A 849 (1999) 521‐528. 3. E. Concha‐Graña, M. I. Turnes‐Carou, S. Muniategui‐Lorenzo, P. López‐Mahía, E. Fernández‐Fernández, D. Prada‐Rodríguez, Chromatographia 54 (2001) 501‐507. 4. P. Konieczka, J. Namiesnik, J. Chromatogr. A 1217 (2010) 882‐891. 227 CONCLUSIONES GENERALES CONCLUSIONES GENERALES A lo largo de esta memoria se han presentado una serie de nuevas metodologías analíticas para la determinación de microcontaminantes orgánicos en muestras líquidas. La investigación se ha centrado en el desarrollo y mejora de las técnicas de pretratamiento de la muestra siguiendo lo establecido en los objetivos de la misma: miniaturización, rapidez, simplicidad, precisión, bajo coste y respeto medioambiental. A continuación se exponen las conclusiones más significativas obtenidas durante la realización del trabajo experimental incluido en la presente memoria. Éstas son: 1. La microextracción con disolvente se presenta como una alternativa clara a las técnicas de extracción existentes hasta la fecha. A lo largo de los trabajos realizados en esta memoria se ha conseguido ir reduciendo el consumo de disolventes orgánicos y de compuestos tóxicos para el medio ambiente y el ser humano. 2. Las metodologías desarrolladas se han utilizado para la determinación de un amplio grupo de analitos en matrices complejas sin preparación previa a la extracción. 3. Se ha reducido la manipulación de la muestra debido a la miniaturización del proceso. Se consigue la extracción, preconcentración e inyección en un solo paso eliminando la evaporación del disolvente. 4. Se ha utilizado la energía ultrasónica para la dispersión del disolvente extractante eliminando totalmente el disolvente dispersante con lo que se ha mejorado el tiempo de procesamiento llegando a reducir en el último trabajo hasta 1 min la preparación de la muestra. Además, se ha conseguido 231 más eficacia de la extracción, primero con la utilización del baño ultrasónico y posteriormente con la sonda ultrasónica. 5. Se ha optimizado la puesta a punto de los métodos mediante el uso del diseño de experimentos utilizando tipos de diseño poco comunes como el diseño D‐óptimo en el que se reduce significativamente el número de experimentos e introduce condiciones experimentales que no se pueden introducir con los diseños clásicos. Esta optimización de métodos analíticos encaja perfectamente dentro de los principios de la Química Analítica ecológica. 6. Se han solucionado problemas de efecto de matriz con la utilización de la metodología de calibración de adición de estándar. 7. Se ha manejado la incertidumbre expandida con la finalidad de evaluar tanto la precisión como la exactitud de dos de los métodos desarrollados. 232 FUTURAS LINEAS DE INVESTIGACIÓN FUTURAS LINEAS DE INVESTIGACIÓN El trabajo experimental descrito en la presente memoria de investigación no se puede considerar un punto y final. Como en todo trabajo experimental extenso se han realizado aportaciones significativas, pero durante el desarrollo del mismo también se han planteado nuevas preguntas o retos que es necesario abordar. Entre ellos se encuentran: Utilización de líquidos iónicos magnéticos en la microextracción líquido‐ líquido dispersiva para poder ampliar el número de analitos susceptibles de extracción por esta técnica. Desarrollo de nuevos modos de microextracción líquido‐líquido para la determinación de analitos polares. Utilización de la energía magnética como extractante de compuestos orgánicos paramagnéticos. Automatización de la microextracción líquido‐líquido dispersiva en sus diferentes modalidades. Desarrollo de nuevos instrumentos de detección miniaturizados que, junto con los métodos de microextracción, permitan realizar medidas en tiempo real (in situ). Y en definitiva, seguir trabajando en el desarrollo de métodos sencillos, rápidos, sensibles, precisos, exactos, pero sobre todo ecológicos y económicos, que no requieran la utilización de una instrumentación cara y costosa y, por tanto, de difícil acceso para la mayoría de los laboratorios analíticos. 235 COMUNICACIONES A CONGRESOS Anexo 35th Internacional Symposium on Environmental Analytical Chemistry, Gdansk (Polonia), junio 2008 Póster: Determination of Organocholrine Pesticides in Water Samples using Dispersive Liquid‐Liquid Microextraction prior to Gas Chromatography‐Mass Spectrometry. C. Cortada, L. Vidal, R. Pastor, N. Santiago, A. Canals. 12th Jornadas de Análisis Instrumental, Barcelona (España), octubre 2008 Póster: Determination of Organocholrine Pesticides by Single Drop Microextraction (SDME) in Complex Matrices. C. Cortada, L. Vidal, S. Tejada, A. Romo, A. Canals. 5th Conference by Nordic separation science society, Tallin (Estonia), Agosto 2009 Póster: Determination of geosmin and 2‐methylisoborneol in water samples based on silicone tubes extraction coupled to gas chromatography‐mass spectrometry. C. Cortada, L. Vidal, R. Pastor, N. Santiago, A. Canals. 11th Internacional Symposium on Hyphenate Techniques in Chromatography and Hyphenated Chromatographic Analyzers, Brujas (Bélgica), eEnero 2010 Póster: Determination of geosmin and 2‐methylisoborneol in water and wine samples based on ultrasound‐assisted dispersive liquid‐liquid microextraction followed by Gas Chromatography‐Mass Spectrometry. C. Cortada, L. Vidal, S. Tejada, A. Romo, A. Canals. 12th Internacional Symposium on Advances in Extraction Technologies (ExTech 2010), Poznan (Polonia), septiembre 2010 Comunicación oral: Determination of explosives in water samples by direct ultrasound‐assisted dispersive liquid‐liquid microextraction followed by Gas Chromatography‐Mass Spectrometry. C. Cortada, L. Vidal, A. Canals. 9th Chemistry Conference, Plodiv (Bulgaria), octubre 2011 Póster: Determination of nitroaromatic explosives in water samples by direct ultrasound‐assisted dispersive liquid‐liquid microextraction followed by Gas Chromatography‐Mass Spectrometry. C. Cortada, L. Vidal, A. Canals. 240 PUBLICACIONES Articulos en revistas CORTADA, C.; VIDAL, L.; TEJADA, S.; ROMO, A.; CANALS, A. “Determiantion of Organochlorine Pesticides in Complex Matrices by Single‐Drop Microextraction Coupled to Gas Chromatography Mass Spectrometry”. Analytica Chimica Acta, 638 (2009) 29‐35. CORTADA, C.; VIDAL, L.; PASTOR, R.; SANTIAGO, N.; CANALS, A. “Determination of organochlorine pesticides in water samples by dispersive liquid‐liquid microextraction coupled to gas chromatography‐mass spectrometry. Analytica Chimica Acta.649 (2009) 218‐221. C.CORTADA, L. VIDAL, A. CANALS. “Determination of geosmin and 2‐ methylisoborneol in water and wine samples by ultrasound‐assisted dispersive liquid‐liquid microextraction coupled to gas chromatography‐mass spectrometry”. Journal of Chromatography A 1218 (2011) 17‐22. C.CORTADA, L. VIDAL, A. CANALS. “Determination of nitroaromatic explosives in water samples by direct ultrasound‐assisted dispersive liquid‐ liquid microextraction followed by gas chromatography‐mass spectrometry”. Talanta 85 (2011) 2546‐2552. 243