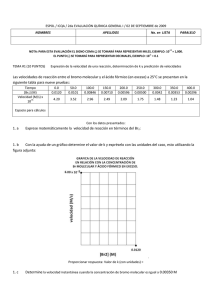
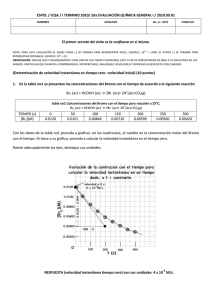
a) 2 Br - IES Dolmen de Soto
Anuncio

Ejercicio 8 - (1997-1998). El ácido sulfúrico concentrado reacciona con el bromuro de potasio para dar sulfato de potasio, bromo, dióxido de azufre y agua: a) Iguale la reacción por el método del ion electrón. b) Calcule el volumen de bromo líquido (densidad = 2’91 g/cm3) que se obtendrá al tratar 59’5 g de bromuro de potasio con suficiente cantidad de ácido sulfúrico. Masas atómicas: K= 39; Br = 80. a) • Se escribe la ecuación sin ajustar: → Br2 + SO2 + H2O + K2SO4 H2SO4 + KBr • Se escribe la ecuación en forma iónica y se identifican las especies que se oxidan y las que se reducen: se reduce –1 +6 0 +4 H+ + SO42– + K+ + Br– → Br2 + SO2 + K+ + SO42– + H2O se oxida • Se ajustan las dos semirreacciones: 2 Br– – 2 e- → Semirreacción de oxidación: SO42– + 4 H+ + 2 e- Semirreacción de reducción: • → SO2 + 2 H2O Se obtiene la reacción iónica global sumando las dos semirreacciones, el número de electrones ya está igualado: Semirreacción de oxidación: Semirreacción de reducción: Reacción iónica ajustada: • Br2 2– SO4 2 Br– – 2 e+ 4 H+ + 2 e- → Br2 → SO2 + 2 H2O 2 Br– + SO42– + 4 H+ → Br2 + SO2 + 2 H2O Se obtiene la ecuación molecular, añadiendo las especies químicas que no intervienen directamente en el proceso de intercambio electrónico, pero que aparecen en la ecuación global: 2 KBr + 2 H2SO4 – El Br va con K+: – Como hay 2 Br , se 2+ añaden 2 Na Los H+ van con SO42–: Como hay 4 H+ y 1 SO42–, se pueden formar 2 H2SO4, añadiendo 1 SO42– → Br2 + SO2 + 2 H2O + K2SO4 Balance de iones: 1er miembro 2º miembro 2 K+ 1 SO42– 2 K+ 1 SO42– En el 2º miembro de la ecuación iónica ajustada no faltan especies iónicas; pero se observa que faltan por colocar 2 K+ y 1 SO42–, estos corresponden al K2SO4 que se indica en el enunciado. Estos iones se combinan y se forma 1 K2SO4 b) 2 KBr + 2 H2SO4 → Br2 + SO2 + 2 H2O + K2SO4 Como Mm(KBr) = 119 g/mol; Mm(Br2)= 160 g/mol y densidad del Br2 = 2’91 g/cm3 59'5 g KBr ⋅ 1 mol KBr 1 mol Br2 160 g Br2 1 cm 3 ⋅ ⋅ ⋅ = 13'7 cm3 Br2 119 g NaBr 2 mol KBr 1 mol Br2 2'91 g Br2 0’500 mol de KBr 0’250 mol de Br2 40’0 g de Br2