Los compuestos de coordinación desempeñan funciones
Anuncio

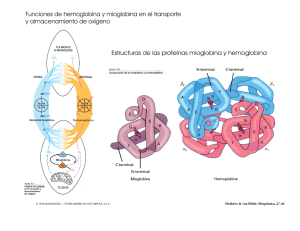
Los compuestos de coordinación desempeñan funciones importantes en animales y plantas. Son esenciales para el almacenamiento y transporte de oxígeno, como agentes que transfieren electrones, como catalizadores y para la fotosíntesis. Aquí se estudiarán los compuestos de coordinación que contienen hierro y magnesio.La hemoglobina es, quzá, la proteína más estudiada de todas por su función primordial como acarreadora de oxígeno para los procesos metabólicos. La molécula de hemoglobina está formada por cuatro cadenas largas plegadas llamadas subunidades. La hemoglobina transporta el oxígeno en la sangre desde los pulmones hacia los tejidos, donde lo transfiere a la mioglobina. Esta proteína está constituida por una sola subunidad y almacena el oxígeno necesario para los procesos metabólicos en el músculo. La molécula de porfirina es una parte importante de la estructura de la hemoglobina. Al coordinarse con un metal, se desplazan los iones H+ que están unidos a dos de los cuatro átomos de nitrógeno de la porfirina. Los complejos derivados de la porfirina se conocen como porfirinas, y a la combinación de hierro y porfirina se le denomina grupo hemo. El hierro del grupo hemo tiene un número de oxidación de +2; está coordinado con los cuatro átomos de nitrógeno del grupo porfina y con un átomo de nitrógeno donador que forma parte de un ligando unido a la proteína. El sexto ligando es una molécula de agua, que se une al ión Fe2+ del otro lado del anillo para completar el complejo octaédrikco. A esta molécula de hemoglobina se le llama desoxihemoglobina, e imparte un tinte azul a la sangre venosa. El ligando agua puede reemplazarse con facilidad por el oxígeno molecular para formar la oxihemoglobina roja que se encuentra en la sangre arterial. Cada subunidad de la hemoglobina contiene un grupo hemo, de modo que cada molécula se puede unir con cuatro moléculas de O2. Existen tres estructuras posibles para la oxihemoglobina. Por muchos años, no estuvo claro cuál era la disposición exacta de la molécula de oxígeno con respecto al grupo porfirina. Gran parte de la evidencia experimental sugiere que el enlace entre los átomos de O y Fe está doblado con respecto al grupo hemo. PORFIRINA GRUPO HEMO DEL CITOCROMO C PORFIRINA DE LA CLOROFILA El grupo porfirina es un agente quelante muy eficaz, asi que no es de sorprender que se encuentre en varios sistemas biológicos. El complejo hierro-hemo está presente en otro tipo de proteínas conocidas como citocromos, donde el hierro forma un complejo octaédrico. Sin embargo, como los grupos histidina y metionina están fuertemente unidos al ión metálico, el oxígeno u otros ligandos no pueden desplazarlos. Por esta razón, los citrocromos funcionan como acarreadores de electrones, esenciales para los procesos metabólicos. En los citocromos, el hierro experimenta rápidas reacciones redox reversibles: Fe+3 + e→ Fe2+ que se acoplan a la oxidación de moléculas orgánicas como los carbohidratos. La molécula de clorofila, esencial para la fotosíntesis en las plantas, también contiene el anillo porfirina, pero en este caso el ión metálico es el Mg2+ en lugar del Fe2+.