POSTULADOS DEL MODELO ATÓMICO DE BOHR (1913
Anuncio

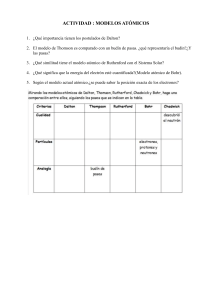
ESTRUCTURA DE LA MATERIA POSTULADOS DEL MODELO ATÓMICO DE BOHR (1913) 1. El átomo de Hidrógeno sólo tiene algunos estados permitidos de energía (estados estacionarios) en los cuales el electrón se mueve en una órbita circular. ESTRUCTURA DE LA MATERIA La estabilidad del electrón en una órbita circular se debe a que la fuerza con que es atraído hacia el núcleo es compensada por la fuerza centrífuga que tiende a alejarlo. 2. El átomo no emite ni absorbe energía cuando está en un estado estacionario. 3. El átomo puede cambiar a otro estado estacionario con el movimiento del electrón de una órbita a otra por absorción o emisión de un fotón de energía igual a la diferencia de energía entre las órbitas. 4. Las órbitas permitidas son aquellas en las que el momento angular del electrón toma ciertos valores ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 1 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 2 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 3 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 4 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA MODELO ATÓMICO DE BOHR Explica el espectro atómico del H Explica el espectro atómico de especies hidrogenoides (He+, Li2+,…) LIMITACIONES DEL MODELO DE BOHR No explica el espectro atómico del H en campos eléctricos o magnéticos No explica el espectro atómico de átomos plurielectrónicos 5 ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA ESTRUCTURA DE LA MATERIA 6