Práctica 5 ESTUDIO DE LOS PUENTES DE HIDRÓGENO POR
Anuncio

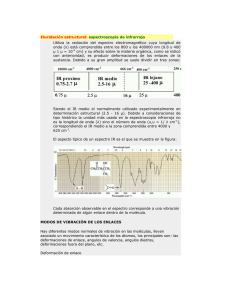
Físico-Química de Biomoléculas Licenciatura en Biotecnología Práctica 5 ESTUDIO DE LOS PUENTES DE HIDRÓGENO POR ESPECTROSCOPÍA INFRARROJA 1. Objetivo Estudiar los puentes de hidrógeno que se forman en (1) alcohol bencílico y (2) fenol en función de la concentración de alcohol en un disolvente inerte. 2. Introducción y Fundamento 2.1 Absorción de luz Los fundamentos de la absorción de luz por las moléculas se presentaron en el guión de la práctica 1. La absorción de luz por un analito de una muestra se describe por las expresiones usuales de la ley de Lambert-Beer: If = 10 −ε (λ )⋅[B]⋅L I0 I A ≡ log10 0 = ε(λ) ⋅ [B] ⋅ L = log10 (1/T) If T≡ (1) (2) donde T es la transmitancia, A es la absorbancia (ambas magnitudes adimensionales), I0 e If son las intensidades de radiación incidente y transmitida a una longitud de onda λ, [B] es la concentración molar del analito, L es el camino óptico de la célula (m) y ε(λ) es la absortividad molar o coeficiente de extinción molar. El coeficiente de extinción molar que se ha escrito como una función de la longitud de onda podría, igualmente, expresarse en función de la frecuencia (s–1) ν = c/λ ó el número de ondas (cm–1) ~ ν = 1/λ, siendo la velocidad de la luz c = 299,792,458 m⋅s–1. En cualquier caso, ε(λ) = ε(ν) = ε(~ ν). 2.2 Interés químico Los alcoholes son moléculas susceptibles de formar puentes de hidrógeno intermoleculares en fase condensada. Los puentes de hidrógeno son los responsables de muchos fenómenos interesantes como los anormalmente altos puntos de ebulición y de fusión del agua, comparados con los del sulfuro de hidrógeno. También, los puentes de hidrógeno son los causantes de que el ácido oxálico cristaliza en dos estructuras distintas, y , según cuales son los puentes formados. A pesar de su baja energía de enlace, la gran importancia del puente de hidrógeno proviene de su papel en moléculas de interés biológico. Por ejemplo, estabiliza la doble hélice del ADN y es el motivo de la baja solubilidad de la bilirubina, un producto de degradación de la hemoglobina. Por espectroscopía infrarroja (IR), se observan las frecuencias correspondientes a vibraciones de modos normales de vibración de la molécula. En particular, para alcoholes, la vibración que corresponde a la elongación del OH es una vibración de frecuencia característica entorno a 3600 cm-1 cuando la molécula no participa en puentes de hidrógeno. Esta situación se da en 1 Físico-Química de Biomoléculas Licenciatura en Biotecnología disoluciones muy diluidas. Si la concentración aumenta, es más probable que se asocien varias moléculas de alcohol mediante puente de hidrógeno. En función del número de moléculas involucradas serán dimeros, trimeros, tetrameros, ... Cuando se forma un puente de hidrógeno, la vibración del enlace OH se debilita y su frecuencia de vibración esta entorno a 3500 cm-1. ¡La banda observada a 3500 cm-1 no corresponde a la vibración del puente de hidrógeno! Aunque no se trata de enlaces covalentes, se puede escribir formalmente la reacción: n C6H5CH2OH (C6H5CH2OH)n (1) En ausencia de la reacción mencionada arriba, se cumpliría la ley de Lambert-Beer a las concentraciones bajas estudiadas. Es el caso entre otros de los hidrógenos del metilo o del arilo sobre todo el rango de concentraciones estudiado. En cambio, para los picos del OH del alcohol bencílico, se pueden distinguir dos regiones: Una de muy bajas concentraciones (<0.02M), en la que la reacción esta muy desplazada a la izquierda, solo se forman monómeros y se cumple Lambert-Beer. A concentraciones crecientes, desaparece parte de los monómeros y se produce una desviación sistemática de la ley de Lambert-Beer. Para determinar la constante de equilibrio de (1), se asume que el grado de asociación n es constante para el intervalo de concentraciones estudiado, es decir, se asume que solo se forma un tipo de agregado (dimero, trimero o tetramero). Con esta asunción se obtiene clibre = c − x donde clibre es la concentración de alcohol, c es la concentración nominal de alcohol y x es una cantidad específica pero desconocida. Así, la concentración de polímero es igual a: casoc = x n Por tanto la constante de equilibrio es: H O R O H O R Fig. 1: Evolución de las bandas de vibración a medida que aumenta la concentración de un alcohol en tetraclorometano. La banda fina de alta frecuencia corresponde al alcohol libre, la bande ancha al alcohol asociado mediante puentes de hidrógeno. 2 Físico-Química de Biomoléculas K= Licenciatura en Biotecnología x , (2) n (c − x ) n En la siguiente ecuación se reemplaza las concentraciones en el equilibrio por las correspondientes absorbancias ci = Ai εL donde L es el camino óptico y la absortividad molar. Por tanto la ec. (2) se puede escribir como sigue: Aasoc (ε libre ) n Ln −1 K= ε asoc ( Alibre ) n donde K, n , asoc y libre (3) son desconocidos. Si la asunción de la ec. 2 es correcta, la constante de equilibrio K debe ser realmente una constante cuando varía la concentración nominal de alcohol. Uniendo los términos constantes e introduciendo la dependencia de la concentración se obtiene la siguiente ec. a partir de la ec. (3). (4) (Aasoc(c))1/n=C Alibre(c) donde C es una constante. Es posible verificar la hipótesis representando las absorbancias medidas a distintas concentraciones (Aasoc1/n frente a Alibre). Los datos se representa probando con distintos valores de n (n=2, 3, 4 y 5). Al hacer estas representaciones, aquella cuya linea pase por el origen será el grado de asociación correcto. Una vez que se determina el grado de asociación, la ley de Lambert Beer para el "polímero", Aasoc = ε asoc Lcasoc se puede reordenar usando casoc = x 1 A 1 = (c − clibre ) = c − libre n n n ε libre L (5) para dar: Aasoc = ε asoc L A 1 c − libre n ε libre L Para libre se tomará 61 dm3mol-1cm-1 para el alcohol bencílico y 190 dm3mol-1cm-1 para el fenol. 3. Aparatos y material Espectrofotómetro IR y celda de líquidos 1 micropipeta de 100 L 1 micropipeta de 1000 L Para cada grupo de 4 alumnos: 10 viales pipeta pasteur y chupón 4. Reactivos 3 Físico-Química de Biomoléculas Licenciatura en Biotecnología *Disolución patrón de fenol en CCl4, 0.5 M. *Disolución patrón de alcohol bencílico en CCl4, 0.5 M. 5. Procedimiento experimental a) Se prepararán disoluciones de 1 mL de concentraciones 0.02 M, 0.04 M, 0.06 M, 0.1 M y 0.2 M de uno los analitos, fenol o alcohol bencílico (el profesor de prácticas le indicará cual de los dos compuestos) que se colocarán en el b) En el espectrofotómetro de IR se medirán las absorbancias máximas de la vibración del OH libre ( 3600 cm-1), del OH con puente de hidrógeno ( 3500 cm-1), y de una vibración de elongación C-H a seleccionar. c) Representar los datos de absorbancia frente a concentración para comprobar la ley de Beer Lambert o sus desviaciones. d) Representar los datos de Aasoc1/n frente a Alibre para determinar el valor de n. e) Representar los datos de Aasoc frente a A 1 c − libre para el valor de n determinado en n ε libre L el punto anterior. 6. Interpretación de espectros de IR El compuesto representado es el DDE (p-diclorodifenildicloroeteno). Se trata de un producto de metabolización del DDT, un insecticida muy usado en los años 50 en los paises desarrollados y que en ciertas regiones subdesarrolladas se sigue usando. Cl Cl C C Cl Cl Identificar los picos con la ayuda de la Tabla en anexo. 4 Físico-Química de Biomoléculas Licenciatura en Biotecnología Figura 2: IR del compuesto nº 1 (DDE) El compuesto nº 2 es el 1,1,2-tricloroetano. A temperatura ambiente, es un líquido no inflamable que se usa en la industria química como disolvente o producto intermedio de reacción. Es tóxico para el riñon y el higado y tiene efectos narcóticos. Es posiblemente cancerígeno. Identificar los picos con la ayuda de la Tabla en anexo. Figura 3: IR del compuesto nº 2 5 Físico-Química de Biomoléculas Licenciatura en Biotecnología El compuesto nº3 es un intermedio de la reacción siguiente con el que se pueden sintetizar toda una clase de insecticidas. Proponer una estructura posible del compuesto. Reacción de formación del compuesto 3: Cl2 Compuesto 3 + otros productos El espectro que se presenta en las Figura es del Compuesto 3 purificado. Figura 4: IR del compuesto nº3 6 Físico-Química de Biomoléculas Licenciatura en Biotecnología Apéndice Tabla A1: Números de ondas de vibraciones típicas de algunos grupos funcionales Grupo -O-H /cm-1 36001 Grupo -N-H C-H 35002 3300 S=O P=O C-F H =C-H 3000-2840 O=C-H 1500-14003 (C-C) 1310 1295 1400-1000 3080-3030 3095-3010 -C-H /cm-1 C H 2800 -S-H 2600-2540 -C N 2100 -C C-C=O 2050 1750-1650 1100 H F 1250-1100 Cl 1095-1035 Br 1075-1030 H C H H C-C 1000 900 900-675 C=N C=C N C H H H 1700-1500 1650-1550 (H fuera del plano) C-Cl C-Br 850-550 690-515 1650-1550 1450 H 1 se reduce hasta valores entorno a 3300 cm-1 si participa en puentes de hidrógeno y se ensancha 2 se reduce hasta valores entorno a 3200 cm-1 si participa en puentes de hidrógeno y se ensancha 3 aparece frecuentemente como doblete 7